은편모류(Cryptophyceae)는 2개의 편모를 가지며 세포는 2-40 µm까지 다양한 크기를 가진다. 전 세계적으로 약 200여 종이 담수와 해수, 기수역 등 모든 수계에서 서식하고(Klaveness, 1988; Metfies and Medlin, 2007), 때로는 적조를 일으키기도 한다(Novarino, 2003). 최근 해양 일차생산자 중 매우 작은 크기의 미세플랑크톤에 주목하면서 한국 연안에서도 은편모류가 시기적으로 우점하는 분류군으로 확인되고 있다(국립수산과학원 적조속보).
은편모류의 먹이 가치에 대해서는 최근 연구가 활발히 진행되고 있는데, 수산양식용 먹이로 활용하기 위해 일반 영양성분을 포함한 아미노산 및 지방산 조성에 관한 연구(Volkman et al., 1989; Brown, 1991; Zhukova et al., 1995; Brown et al., 1997)에서 종주에 따라 단백질 53-64%, 지질 18-28%, 탄수화물 9-24%를 함유하는 것으로 분석되었고, 특히 해산동물에 필요한 고도불포화지방산 함량이 높은 것으로 보고되었다. 또한 은편모류를 굴 치패(Brown et al., 1998; McCausland et al., 1999)과 가리비 부유유생(Tremblay et al., 2007)에 공급한 결과, 기존의 미세조류 먹이보다 성장률이 좋거나 타 광생물 먹이와 혼합할 경우 지질함량을 향상시켰다.
또한 은편모류를 동물플랑크톤인 요각류의 먹이로 공급하여 성장 및 알 생산력을 증가시켰고(Stottrup et al., 1999; McKinnon et al., 2003; Knuckey et al., 2005; Dahl et al., 2009), 어류 및 갑각류 종묘생산 시 동물먹이로 이용되는
그러나 지금까지 먹이생물로써 사용된 은편모류는 대부분
본 연구는 한국 연안에서 채집된 은편모류를 대상으로 먹이생물로서의 가능성을 검증하기 위해 다양한 은편모류 종주를 사용하여 동물성 먹이생물인 윤충류의 성장 및 포란율을 기준으로 우수 종주를 선발한 후, 이들 우수 종주와 기존의 먹이생물로 활용되고 있는 미세조류를 윤충류 및 이매패류 유생(바지락, 굴)에 공급하여 성장 또는 생존율을 비교하였다
>
은편모류 Teleaulax amphioxeia 종주의 순수 분리
은편모류 종주를 순수 분리하기 위해 우리나라 서해 및 남해와 제주해역에서 해수를 채수하여 실험실에서 은편모류를 미세관 피펫을 이용하여 광학현미경(Olympus BX-50) 하에서 1세포씩 분리하였다. 그 후 분리된 세포를 30 psu로 조절되고 규소 성분을 제외시킨 f/2 (f/2-Si) 배지가 담긴 24-well culture plate에 넣고, 20℃, 50 μE m−2s−1에서 배양하였다. Culture Plate에서 타 well에 비해 성장이 우수한 것으로 확인된 종주는 실험실 배양시스템[20℃, 연속광(L:D=24:0), 50 μE m−2s−1]에서 연안해수를 30psu로 조절한 후, f/2-Si 배지를 사용하여 계대배양을 통해 종주를 유지시키면서 실험에 사용하였다.
본 연구를 위해 확보된 신규 먹이생물 종주는 18S rDNA 유전자 분석을 통해 은편모강(Cryptophyceae)에 속하는
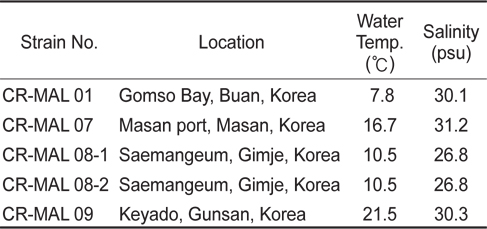
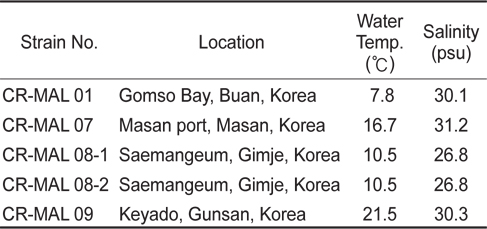
Temperature and salinity at the localities where cryptophyte Teleaulax amphioxeia strains used in the present study were collected
>
윤충류에 대한 먹이생물 Teleaulax amphioxeia 기능성 검증
윤충류의 초식률
어류 및 갑각류 종묘생산 시 이용되고 있는 동물 먹이생물인 윤충류
V : 부피(mL) C0와 Ct : 각각 초기 및 최종 먹이농도(cells mL−1) N : 윤충류의 개체수 t: 배양시간 (h)
윤충류의 성장 및 포란율
윤충류의 성장 및 포란율을 측정하기 위해 은편모류 5개 종주(CR-MAL 01, 07, 08-1, 08-2, 09)를 이용하여 2.0×105 cells mL−1의 농도로 공급하였으며, 수온(25℃)과 염분(30 psu)을 설정한 후 윤충류를 5 inds. mL−1를 접종하여 7일 동안 연속광(L:D=24:0)에서 배양하였다. 윤충류의 개체수와 포란 개체의 계수는 매일 1 mL씩 추출하여 해부 현미경 하에서 이루어졌으며, 계수된 개체들은 시험관에 재수용하였다. 윤충류의 성장은 순간성장률(Instantaneous growth rate, r 또는 증식률)로써 Rico-Martinez and Dodson (1992)에 따라 계산되었다.
r=(1/t) ln(Nt /N0)
Nt: 시간 t에서 윤충류의 개체수 N0 : 윤충류의 초기 개체수 t : 배양시간 (days)
윤충류의 성장 및 포란율 비교
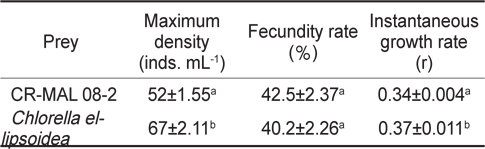
윤충류의 성장 및 포란율을 비교하기 위해 신규 은편모류 종주 CR-MAL 08-2와 기존의 해산 클로렐라
바지락 부유유생
바지락
굴 부유유생
굴
바지락과 참굴 부유유생에 공급되는 식물 먹이생물은 후기 지수성장기의 세포를 수확한 후 원심분리하여 공급하였다.
모든 실험은 SPSS program (ver. 12.0)을 이용하여 One-way ANOVA test를 실행한 후 Duncan's multiple range test (Duncan, 1955)로 평균 간의 유의성(
은편모류(
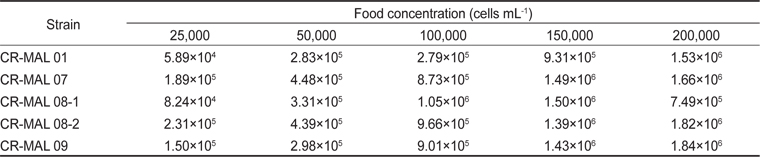
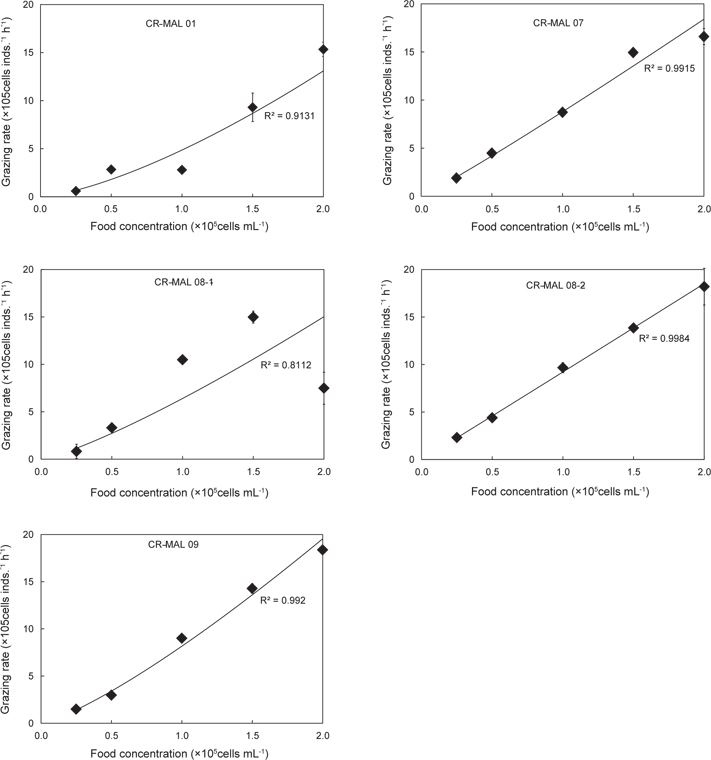
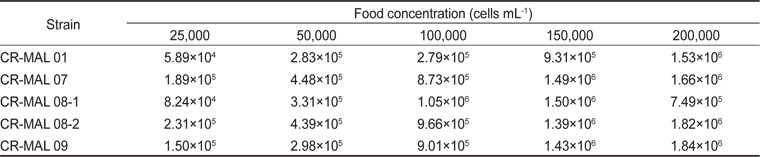
Grazing rate of the rotifer Brachionus plicatilis fed the different strains of the cryptophyte Teleaulax amphioxeia at different cell densities after 24 h
실험에 사용한 은편모류 5개 종주 중 1개의 종주 만을 제외하고는 먹이농도 2.5×104−2.0×105 cells mL−1에서 윤충류의 초식률이 감소하지 않고 계속 증가하였다. 그러나 종주 CR-MAL 08-1에 대해서는 최대 농도인 2.0×105 cells mL-1에서 감소하였다. .
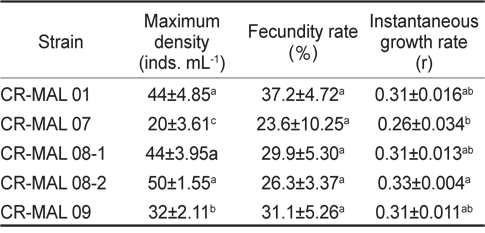
은편모류 먹이 종주에 따른 윤충류 성장과 관련하여 최대 밀도, 포란율, 비성장률의 결과를 Table 3에 나타내었다. 윤충류의 밀도는 모든 실험구에서 배양시간이 경과함에 따라 증가하는 경향을 보였으며, 상대적으로 높은 밀도를 보인 실험구는 CR-MAL 01과 08-1, 08-2로 배양 7일 째 평균 44-50 inds.mL-1이었고, 그 외 실험구의 평균 20-32 inds. mL−1보다 유의적으로 더 높은 성장을 나타냈다(
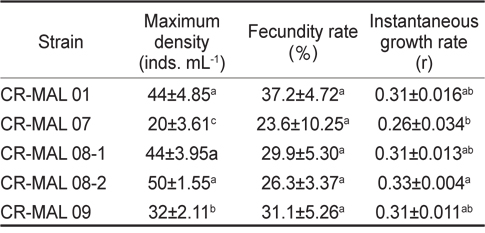
Maximum density, fecundity rate and instantaneous growth rate (means±s.d.) of the rotifer Brachionus plicatilis fed the different strains of the cryptophyte for seven days
최고 밀도에서의 포란율은 CR-MAL 07에서 평균 23.6%로 최저이었고, CR-MAL 01에서 평균 37.2%로 가장 높았으나(Table 3), 각 종주 간에는 유의적인 차이를 보이지 않았다(
성장률로써 최고 밀도에서의 순간성장률(Instantaneous growth rate, r 또는 증식률)은 CR-MAL 07에서 평균 0.26으로 가장 낮았고, CR-MAL 08-2에서 평균 0.33으로 가장 높았으며, 이들 두 종주 간에는 유의적인 차이가 있었으나(
>
해산 클로렐라 및 은편모류에 대한 윤충류의 성장 및 포란율 비교
본 연구에서 성장이 좋았던 은편모류 종주 CR-MAL 08-2와

Comparison of Maximum density, fecundity rate and instantaneous growth rate (mean±s.d.) of the rotifer Brachionus plicatilis fed each of the two different diets, the cryptophyte Teleaulax amphioxeia CR-MAL 08-2 and Chlorella ellipsoidea
>
은편모류에 의한 이매패류 부유유생의 성장 및 생존율
은편모류
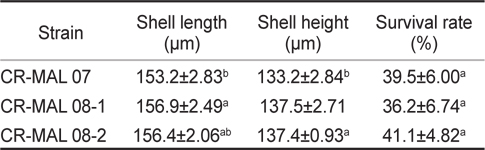
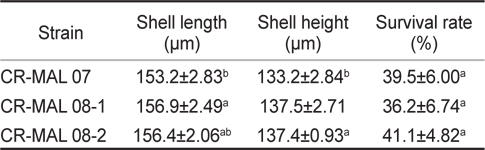
Shell length, shell height and survival rate (mean±s.d.) of the manila clam Ruditapes philippinarum larvae cultured with different strains of the cryptophyte Teleaulax amphioxeia (CR-MAL 07, 08-1, 08-2)
바지락 부유유생의 최종 생존율을 비교해 본 결과, 각 실험구 별로 유의한 차이는 없었으나, CR-MAL 07과 08-2 실험구에서 평균 약 40% 전후의 높은 생존율을 보였다. 비교적 좋은 성장을 보였던 CR-MAL 08-1 실험구에서는 약 36%의 생존율을 나타냈다.
은편모류 2개 종주(CR-MAL 07, 08-2)와
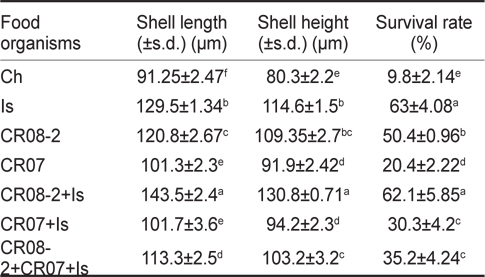
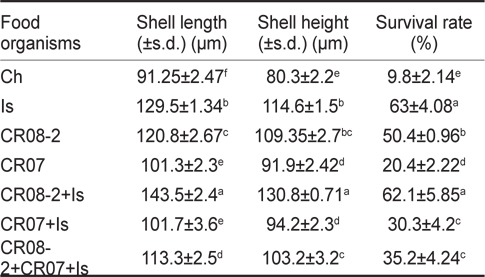
Growth and survival rate of the Pacific oyster Crassostrea gigas larvae fed on different diets
각장에 대한 성장 결과를 살펴보면, CR-MAL 08-2+
굴 부유유생의 생존율은
실험에 사용한 은편모류(
윤충류
Bae and Hur (2011)는 3속의 미세조류를 윤충류
앞에서 언급한 성장률(r) 값은 각 연구자마다 실험조건이 다르기 때문에 각각의 성장률(r) 값을 직접적으로 서로 비교하기에는 다소 문제가 있다. Hirayama et al. (1979)는 동일한 실험 조건에서 한 종의 미세조류, 예를 들면, 대조구로서 해산 클로렐라에 대해 임의의 먹이 종의 성장률(r) 값을, 비교하는 성장률(r) 상대치와 순생산속도(R0)를 이용하여 우수, 보통, 부족의 3등급으로 상대적으로 먹이의 질을 평가하였다. 성장률(r) 값에 대해서만 보면, 본 연구에서 해산 클로렐라
이매패류 유생의 먹이로써 미세조류가 갖추어야 할 조건은 형태, 크기, 운동성, 섭식의 용이성, 소화 및 동화, 독성 등 여러 가지가 있다(Marshall et al., 2010). 이러한 조건들이 충족되면 될수록 유생의 성장과 생존율은 좋아질 것이다. 그 중에서도 크기에 관해서는 일반적으로 2-10 µm가 적합한 것으로 알려져 있다(Palmer and Williams, 1980). 본 연구에 사용된 은편모류
본 연구에서 은편모류를 바지락 유생의 먹이로 12일간 공급한 후의 생존율이 평균 36.2-41.1%였다. 또 굴 유생의 먹이로 10일간 공급한 후의 생존율은 은편모류 종주 각각을 단독으로 공급하였을 때 20.4-50.4%로 나타나 종주에 따라 차이가 컸으며,
미세조류가 이매패류 부유유생의 먹이 가치는 주로 지방, 탄수화물, 단백질과 같은 생화학적 조성에 의해 결정되며, 먹이의 영양은 부유유생의 성장과 생존율에 매우 큰 영향을 미친다(Helm et al., 1973; Marshall et al., 2010). 예를 들면, 단백질 함량은 부유유생의 생존율과 양의 상관관계에 있는 것으로 나타났다(Aranda-Burgos et al., 2014). 또 단백질과 지방은 생물체내의 생합성을 위해 사용되지만, 탄수화물은 에너지원으로도 중요하다(Whyte et al., 1989). 향후 은편모류의 지방산을 포함한 영양가를 측정하여 이매패류 부유유생의 성장 및 생존율과의 관계를 분석함과 동시에 타 미세조류와도 비교함으로써 은편모류