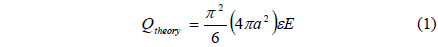Ionic liquid (IL) is a salt presents in a liquid form at room temperature. Recently, it attracts huge attention due to its possibilities as a clean solvent, electrolyte, and catalyst. In the present work, the charging behavior of six different ILs were investigated using droplet contact charging phenomenon in a dielectric medium. Basically, the charging of an IL droplet can be explained by a perfect conductor theory. However, there were several different features depending on the species of ions of ILs, which requires rigorous molecular level modeling of charge transport through electrochemical reaction of IL. We hope the present results contribute to build up fundamental understanding of electrochemical charge transport of IL.
이온성 액체(ionic liquid, IL)는 유기성 양이온과 무기성 음이온으로 이루어진 상온에서 액체로 존재하는 이온성염이다. 특히 이온성 액체의 끓는점은 물보다 높은 약 300 도씨로 매우 높기 때문에 물이나 암모니아 등 기존 용매 대비 용매로써 그 활용 범위가 매우 넓다. 또한 증기압이 매우 낮아 비휘발성을 나타내며 독성이 거의 없고 불에 잘 타지 않으면서도 높은 극성에 기인한 높은 용해도로 다양한 물질들을 효율적으로 녹일 수 있기 때문에 친환경 청정공정 용매로써 매우 적합한 물질이라 할 수 있다[1-5]. 이온으로 이루어져 있는 이온성 액체는 전기적 전도도가 높으면서도 고온에서도 매우 안정한 특징을 보이기 때문에 리튬 이온 배터리 등의 전해질로의 응용도 활발히 연구되고 있다[6,7]. 또한 이온성 액체 자체가 가진 독특한 전기적 특성은 촉매로써의 활용 가능성도 밝혀져 친환경 청정 촉매로써의 응용도 연구되고 있다[1-3]. 이온성 액체의 이러한 독특한 특징과 물성은 그 구성 이온의 크기와 종류에 따라 달라질 수 있고 사용자의 목적에 맞게 합성하는 것이 가능하기 때문에 그 활용도가 매우 높으며 이런 관점에서 이온성 액체를 이루는 이온의 종류에 따른 거동 특성을 이해하는 것은 매우 중요하다[4,5].
이러한 이온성 액체의 장점들을 실제 산업에 응용하기 위해서는 이온성 액체의 물리화학적 특성에 대한 이해가 선행되어야 한다. 양이온과 음이온 혹은 양이온의 치환기 종류 및 길이에 따른 이온성 액체의 물리화학적 특성에 대한 연구를 위해 본 연구에서는 최근 활발히 연구가 진행 중인 액적의 직접 충전 현상에[8-12] 의한 전기화학적 전하 전달 시스템을 활용하여 이러한 연구를 수행하고자 한다.
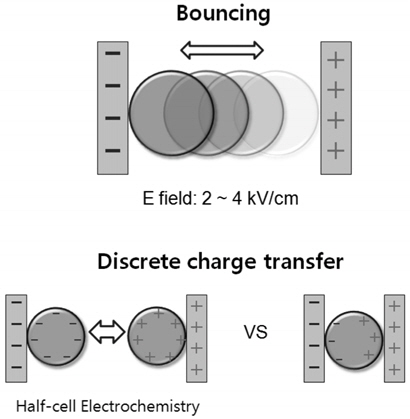
액적의 직접 충전 현상은 Figure 1 상단에 나타난 바와 같이 비전도성 매질 내 존재하는 전도성 액적이 고압의(약 2~4 kV/cm) 전극에 직접 접촉하면 접촉과 동시에 액적이 전극과 같은 전하로 충전되면서 전기적 반발력에 의해 반대편 전극으로 이동하는 현상이다. 이 현상의 흥미로운 점은 반대편 전극으로 이동된 충전 액적이 반대편 전극에 접촉하면 이전에 가지고 있던 전하의 방전과 함께 다시 반대 극성의 전하로 충전되면서 다시 처음 접촉했던 전극으로 되돌아 가 두 전극사이에서 지속적인 왕복 운동을 하게 되는 점이다[8,9]. 또한 액적이 충전되는 원리는 전도성 액적의 전기화학적 반응에 의해 전하가 전달되고 충전과 방전이 Figure 1 하단에 나타난 것처럼 한쪽 전극에서만 일어나기 때문에 전기화학적 관점에서 볼 때 가상적으로만 존재하는 반쪽 전기화학반응(half cell electrochemistry)을 실제 시스템에서 구현하는 것이 가능한 매우 독특한 시스템이기도 하다. 현재 이러한 액적의 충전 현상은 녹조류의 형질 전환 등 미세유체를 이용한 청정기술 응용 분야에 연구가 활발히 진행되고 있다[10-12]. 특히 이온성 유체의 계면 장력 측정[11] 및 양이온의 선택적 추출 연구 등 이온성 유체의 충전 현상에 대한 연구도 활발히 진행 중이다. 하지만, 아직 이온성 유체의 이온의 종류에 따른 전기화학적 충전 특성에 대한 체계적인 연구는 부재한 실정이다. 따라서 본 연구에서는 이온성 액체 액적의 충전 거동을 다양한 이온성 액체에 대해 수행하여 관련된 전기화학적 특성을 규명하고자 한다.
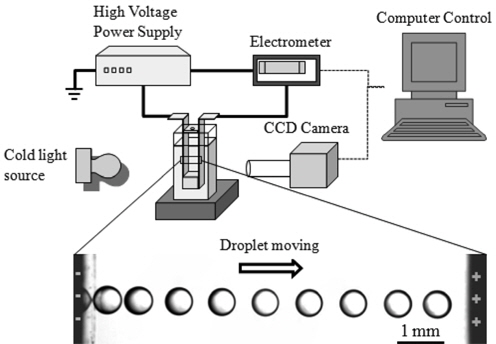
액적 충전 실험의 기본 장치에 대한 개략도는 Figure 2에 나타난 바와 같다. 충전에 필요한 전극은 구리판 전극을(폭 1 cm × 높이 4 cm) 사용하였으며 아크릴 구조물을 이용해 평행한 두 전극 쌍을 구성하고 액적은 아크릴 구조물 중앙에 위치한 구멍(직경 3 mm)을 통해 마이크로 파이펫을 사용해 공급하게 된다. 전극의 한쪽은 고압 전원 장치에 연결하고 나머지 한 쪽은 고정밀 전류계에(electrometer) 연결하였으며 액적의 움직임을 관찰하기 위한 카메라와 전류계는 컴퓨터를 이용해 제어하여 액적이 왕복 운동하는 동안 액적의 움직임과 전류의 변화를 동시에 측정할 수 있게 구성하였다. 실험 장치에 대한 보다 자세한 설명은 참고문헌[8,9]에서 찾을 수 있다.
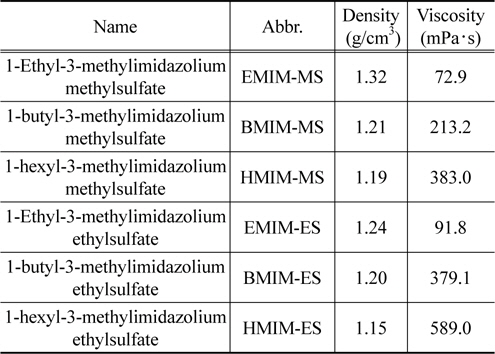
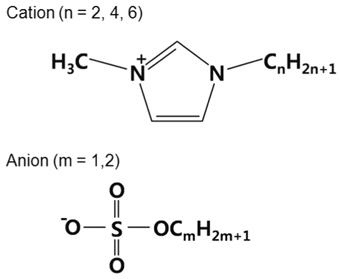
액적의 충전 현상을 비전도성 매질 내에서 수행하기 위해 본 연구에서는 비전도성 매질로 실리콘 오일을(Shin-Etsu KF-96) 사용하였다. 사용된 실리콘 오일의 동점도는 100 cSt이고, 밀도는 970 kg/m3이며 전기전도도는 6.87 × 10−14 S/m이다. 본 실험에 사용된 이온성 액체는 크기가 서로 다른 세 가지의 양이온과 두 가지의 음이온 조합으로 구성된 총 6가지의 이온성 액체에 대해 이온성 액체 액적 충전 실험을 수행하였으며 실험에 사용된 이온성 액체의(C-TRI 제작, water content < 300 ppm) 물성은 Table 1에 나타난 바와 같다[11].
[Table 1.] Physical Properties of ILs used in the droplet contact charging experiments
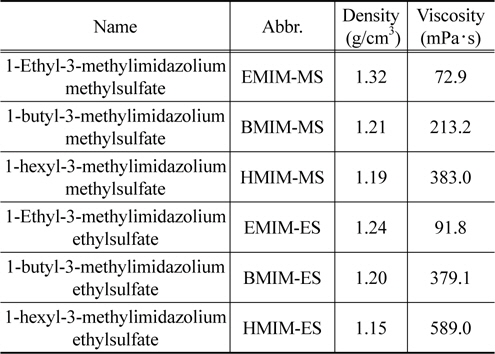
Physical Properties of ILs used in the droplet contact charging experiments
액적의 충전 실험 방법은 다음과 같다. 먼저, 실리콘 오일을 준비된 큐벳에 채우고 전극 쌍을 큐벳에 장착한다. 장착된 전극쌍 한쪽은 고전압 전원장치에 연결하고 나머지 한쪽은 고정밀 전류계에 연결한다. 전원창치를 켜면 두 전극 사이에 고전압이 생성되며(2~4 kV/cm) 이 상태에서 시스템이 평형을 유지할 때까지 약 10분간 유지한다. 평형 상태에 있는 전극 사이에 마이크로 파이펫을 이용해 직경 0.5~1 mm 크기의(100~1000 nL) 이온성 액체 액적을 투입하면 이온성 액체 액적은Figure 2 하단에 나타난 것과 같이 두 전극 사이에서 왕복 운동을 하게 된다. 액적의 움직임은 카메라를 통해 기록되며 컴퓨터를 통해 카메라와 전류계를 동기화 시켜 액적의 움직임에 따른 전류의 변화를 동시에 기록하였다. 액적이 가진 전하량은 스톡스 영역(stokes regime) 내 액적의 움직임을 가정하여 액적의 이동 속도로부터 추정할 수 있으며 또한 전류계를 통한 전류의 변화로부터 직접 측정하는 것 또한 가능하다[9]. 실험 방법에 대한 보다 자세한 설명은 참고문헌[8,9]에서 찾을 수 있다.
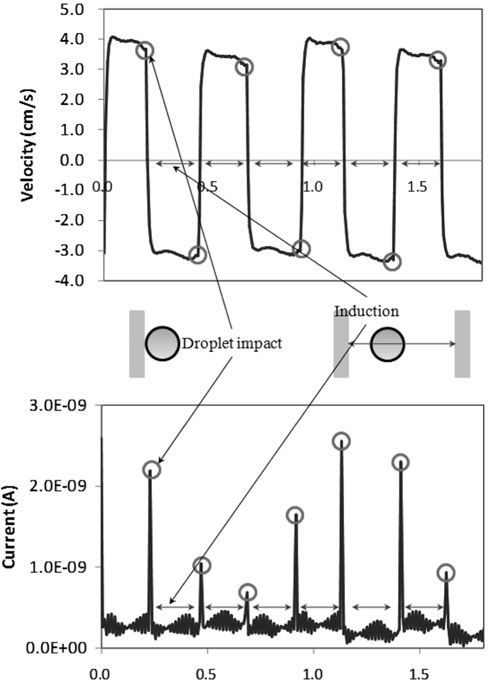
Figure 3에는 800 nL(직경 약 1 mm) 이온성 액체(EMIM-MS) 액적의 충전 시, 시간에 따른 액적의 이동 속도 변화와 액적 움직임에 따른 전류의 변화 데이터가 나타나 있다. 우선, 액적의 속도 분포도에서 액적의 일정한 왕복 운동을 확인할 수 있으며 붉은색 원으로 표시된 부분은 액적이 전극에 접촉하면서 방전과 충전이 일어나 다시 반대편 전극을 향해 이동하는 시점을 나타낸 것이다. Figure 3 하단의 전류의 변화 그래프에서 볼 수 있듯이 액적이 전극에 접촉하는 순간 일정량 이상의 피크 전류가 흐르는 것을 확인할 수 있으며 이러한 이온성 액체 액적의 충전 거동은 순수한 물의 충전 현상과 전체적으로 유사한 특징을 보였다[8]. 흥미로운 사실은 이전 수용액적의 충전 현상과 유사하게, 액적에 충전되는 전하의 양이 매우 일정한 값을 가져 액적의 왕복 운동이 매우 일정한 속도로 유지됨에도 전류계에서 접촉 순간에 측정되는 피크 전류의 값은 그 변화 폭이 매우 큰 특징을 나타내며 이러한 측정 결과는 현재 사용된 전류계의 민감도가(resolution) 매우 짧은 순간 일어나는 충전 현상을 측정하는데 부족하기 때문인 것으로 해석된다. 하지만 다행히, 액적이 충전 후 반대편 전극으로 이동하는 동안 액적이 가지고 있는 전하에 의해 반대편 전극에 유도되는 전류를 이용하여 전하를 측정하는 것은 이전 연구와 동일하게[9] 가능하였다. 즉, 이온성 유체 액적의 충전 현상은 전체적으로 수용액적의 충전 거동과 유사한 특성을 보였으며 수용 액적에 대한 충전 거동 해석 방법론을 동일하게 적용하는 것이 가능했다.
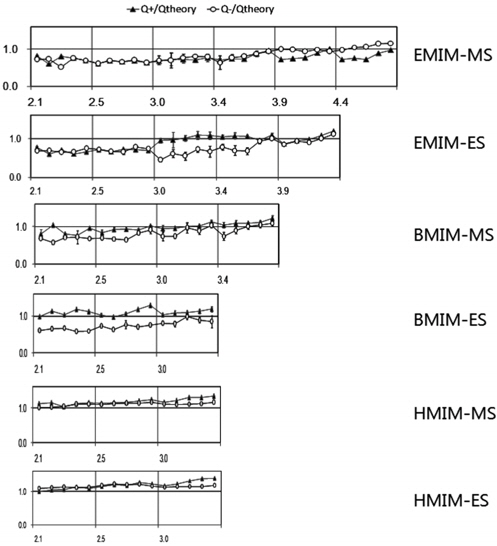
앞선 EMIM-MS 이외에 본 연구에서는 이온의 크기가 서로 다른 6가지 종류의 이온성 액체 액적에 대한 충전 현상에 대해 실험을 수행해 Figure 4에 나타난 것과 같은 전하량 측정 결과를 얻었다. Figure 4 그림에서 x축 방향으로 표시된 숫자는 각각 블록 내에서 가해진 전기장의 크기를 나타내며 동일한 블록 즉 동일 전기장 하에서는 왼쪽에서 오른쪽으로 갈수록 액적의 크기가 증가함을 나타낸다. 가해준 전기장의 세기 범위는 2.1~4.4 kV/cm이었으며 동일 전기장 하에서 액적의 크기를 100, 300, 500, 800, 1000 nL의 다섯 가지 서로 다른 크기로 변화 시켜가면서 전하량을 측정하여 측정된 전하량을 완전도체 가정에서 얻을 수 있는 전하량으로 나누어 무차원 전하량으로 표시하였다(무차원 전하량이 ‘1’에 근접할수록 완전 도체 이론값에 가까워짐을 의미한다). 전체적으로 이전 수용액적의 연구 결과와 유사하게[8], 가해준 전기장의 세기가 셀수록 그리고 동일 전기장 하에서는 액적의 크기가 클수록 (그래프에서 왼쪽에서 오른쪽으로 진행) 전하량이 상대적으로 높게 나타나는 경향을 보였다. 하지만 이온 종류에 따른 경향은 매우 다양하게 나타났으며 특히 EMIM-ES와 BMIM-ES의 경우 상대적으로 다른 이온성 유체 대비 양전하로 충전된 양과 음전하로 충전된 양의 차이가 두드러지게 나타났다. 특히 낮은 전기장 하에서는 이러한 차이가 더 크게 나타나고 전기장의 세기가 세지면서 차이가 감소하는 특징을 나타냈다. 이온성 액체의 경우, 수용액적 대비 실리콘 오일 내에서의 계면장력이 상대적으로 매우 낮기 때문에 액적의 이동 속도만으로 전하를 측정하는 것은 액적 충전 시 발생할 수 있는 액적의 표면적 변화 등 다른 요인을 고려해야 하는 한계 등이 있기 때문에 본 연구에서는 전류계를 이용한 전하의 측정도 병행하여 보다 정확한 전하량을 측정해 보았다.
3.3. 완전 도체 가정에서 본 이온성 액체 액적의 충전 거동 분석
구형 도체가 전압이 인가된 전극에 접촉할 때 얻게 되는 전하량은 다음의 이론식으로 나타낼 수 있다[8].
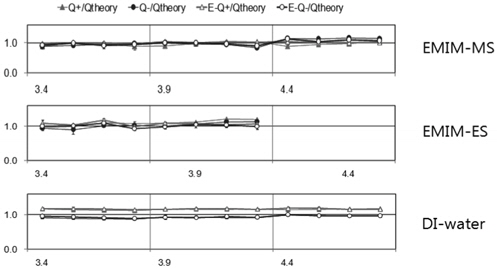
Figure 5에는 전류계를 이용해 측정한 액적의 전하량이 나타나 있다. 전류계를 이용한 측정의 경우, 전기장의 세기가 3.4 kV/cm 이하에서는 노이즈 시그널 때문에 전류계를 이용한 전하의 측정이 어려웠기 때문에 6가지 이온성 액체에 대한 측정은 불가능했다. 특히 HMIM-MS와 HMIM-ES의 경우 3 kV/cm 이상의 전기장에서는 낮은 계면 장력 때문에 액적이 찢어지는 문제가 있어 측정이 불가능 했다. 측정 가능한 영역에서 전류계를 이용한 이온성 액체의 충전량은 Figure 5에 나타난 바와 같이 이론식에 매우 근접한 값을 나타냈다. 따라서 이온성 액체 액적의 충전현상은 기본적으로 완전도체 가정으로 해석이 가능했다.
3 kV/cm 이상의 비교적 높은 전기장하에서 이온성 액체 액적의 충전 현상은 앞서 설명된 바와 같이 기본적으로 완전 도체 가정으로 설명하는 것이 가능하다. 하지만 Figure 4에 나타난 바와 같이 3 kV/cm 이하의 낮은 전기장 하에서의 충전 거동은 이온성 액체의 이온 종류에 따라 매우 다양한 양상을 나타냈다. 가장 두드러진 특징은 크게 두 가지로, 첫 번째는 양이온의 크기에 따른 충전량 차이를 들 수 있다(이온의 구조 및 크기는 Figure 6 참조). Figure 4에서 EMIM-MS의 경우 3 kV/cm 이하에서의 충전량은 이론치보다 최대 30% 이하로 충전되는 양상을 보이는데 반해 HMIM-ES의 경우 모든 측정 값에서 이론치보다 항상 큰 값을 나타내는 것을 볼 수 있다. 두 번째 특징은 음이온의 크기에 따른 특징으로 특히 EMIM과 BMIM 양이온의 경우 음이온이 MS인 경우 대비 ES로 음이온 크기가 커지면 음전하로 충전되는 전하량이 상대적으로 낮게 나타나는 특징을 보인다. 하지만 이 두 번째 특징은 양이온이 HMIM인 경우는 다소 다른 양상으로 나타나는데 가장 낮은 전압인 2.1 kV/cm에서는 양전하와 음전하의 크기 차이가 거의 없다가 오히려 높은 전기장하에서 그 차이가 들어나는 특징을 보였다.
이러한 이온성 액체 액적의 이온 종류에 따른 충전 특성은 이온의 분자적 구조 및 크기를 이용해 해석하는 것이 가능하다. 가령, 이온성 액체의 경우 물에 비해 전하를 전달하는 측면에서 상대적으로 분자의 크기가 크기 때문에 매우 짧은 시간 내에 이루어지는 전기화학 반응에서 상대적으로 불리해, 낮은 전기장에서 덜 충전되는 현상을 설명하는 것이 가능하다. 하지만 이온의 크기에 따른 변화 양상은 단순히 크기가 큰 이온이 충전에 불리한 것만은 아니며 양이온과 음이온 사이의 인력에 큰 영향을 받는다. 가령, HMIM-MS, ES의 경우 양이온의 크기가 가장 큰 이온임에도 낮은 전압에서 오히려 완전도체 이론치보다 높은 전하량으로 충전되는 양상을 보이는데 이는 양이온과 음이온의 인력이 약해져서 각각의 이온들이 전하를 충전 받는 데 방해를 덜 받기 때문이며 또한 같은 이유로 액적의 계면 장력이 낮아 변형에 의한 표면적 증가로 더 많은 양의 전하량을 충전 받기 때문이다. 여섯 가지 이온성 유체 중 이온의 크기가 가장 작은 EMIM-MS의 경우, 두 이온 간의 인력이 가장 강해 양전하, 음전하 충전 모두 이론 대비 낮은 값을 가지는 것을 볼 수 있으며 나머지 이온성 액체들에 대해서도 비슷한 해석이 가능하다. 하지만 보다 정확하고 면밀한 분석을 위해서는 분자 모델링 등을 활용한 연구가 필요하며 향후 이러한 연구가 뒷받침 된다면 액적의 충전현상을 활용해 이온성 액체의 전기화학적 특징을 분석할 수 있을 것으로 기대된다.
비전도성 매질 내 액적의 접촉 충전 현상을 이용하여 여섯 가지 서로 다른 이온성 액체에 대한 충전 거동을 고찰해 보았다. 큰 틀에서 비전도성 매질 내 이온성 액체 액적의 충전 현상은 이전 수용 액적의 충전 현상과 유사한 특징을 나타내었으며 기본적으로 완전 도체 이론으로 설명이 가능하였다. 하지만 이온 종류에 따른 상세 거동은 다소의 변화가 관찰되었으며 보다 면밀하고 체계적인 연구를 위해서는 분자 모델링 등의 추가 연구가 필요하다. 본 연구의 결과는 청정 용매 및 촉매로 최근 각광받고 있는 이온성 액체의 전기화학적 특성을 이해하고 분석하는데 유용하게 활용될 수 있을 것으로 기대 되며 특히, 이온성 액체를 전해질로 사용하는 경우 전압에 따른 전기화학적 특성 차이 등을 설명하는데 활용될 수 있을 것으로 기대된다.