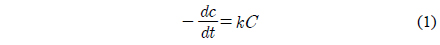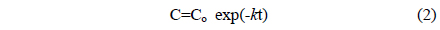Lead molybdate (PbMoO4) oxides were successfully synthesized using a conventional hydrothermal method and a microwave-assisted hydrothermal method. They were characterized by XRD, DRS, BET, Raman, SEM and PL. We also investigated the photocatalytic activity of these materials for the decomposition of Rhodamine B under UV-light irradiation. From XRD and Raman results, well-crystallized PbMoO4 crystals have been successfully synthesized regardless of preparation method and had 42~59 nm particle size. The PbMoO4 catalysts prepared using microwave-assisted process had the similar particle size and enhanced the photocatalytic activity when compared to that prepared by hydrothermal method. The PbMoO4 catalysts prepared under the irradiation of microwave for 75 min showed the highest photocatalytic activity. The PL peaks appears at about 530 nm at all catalysts and it was also shown that the excitonic PL signal is proportional to the photocatalytic activity for the decomposition of Rhodamine B.
불균일 광촉매반응은 유기화합물의 분해할 수 있는 새로운 기술로 알려져 있다[1]. 광촉매 반응은 다른 처리 방법에 비해 많은 장점을 가지고 있으며, 이 기술은 매우 친환경적이며 상온에서 쉽게 반응이 진행될 수 있으며, 낮은 농도의 유기물을 효과적으로 처리할 수 있다. 금속산화물의 광촉매 반응은 세 가지 공정에 의해 조절될 수 있다. 첫 번째는 빛의 조사에 의해 광여기된 전자와 정공의 생성이며, 두 번째는 이들이 재결합하지 않고 전달되어야 하며 그리고 세 번째로 촉매 표면에 흡착된 반응물로 전자나 정공의 이동이 이루어져야 한다. 일반적으로 광여기된 전자와 정공의 재결합은 전자적 구조에 의해 영향을 받는 것으로 알려져 있다[2].
AMoO4의 구조식을 가지고 있으며 molybdates계에 속하는 회중석 구조(scheelite structure)를 가진 화합물은 광발광체, 고상 레이져, 광섬유, 섬광물질, 자성물질 및 촉매와 같은 넓은 분야에서 사용되고 있다[3-5]. 또한 이들은 Ca+2, Sr+2, Ba+2 및 Pb+2와 같은 양이온이 A에 위치하면 이들은 회중석 구조를 가지는 것으로 알려져 있다. 특히, PbMoO4는 정방정계 회 중석 구조로 Mo+6은 4개의 O-2에 의해 Pb+2는 8개의 O-2에 의해 둘러 싸여 있으며,
본 연구에서는 PbMoO4를 수열합성법 및 마이크로파 공정을 이용하여 제조하였다. 또한 마이크로파의 조사 시간에 따른 그들의 물리적 특성을 조사하였다. 또한, Rhodamine B의 분해반응에서 광촉매로서의 활성을 조사하였다.
본 촉매는 기존의 수열합성법과 마이크로파 공정을 사용하여 촉매를 합성하였다. 먼저 수열합성법에서는 100 mL 용량을 가진 teflon-lined 스테인레스 스틸 고압반응기에 Pb(NO3)2, (NH4)6Mo7O24과 에틸렌 글리콜 20 mL를 넣고 혼합된 용액을 잘 저어주면서 4몰의 NaOH 용액으로 혼합물의 pH를 11로 조절하였다. 이 용액을 온도를 160℃로 유지하면서 고압반응기에서 12시간 동안 수열 합성하였다(이하 HT로 표시). 한편, 마이크로파 공정을 이용한 합성법에서는 위의 용액을 마이크로파를 흡수할 수 있는 teflon-lined ultem polyetherimide 반응기에 넣고 주문 제작된 300 W, 2.45 GHz 마이크로웨이브 장치(LG Electronic Co.)에서 온도를 105℃로 유지하면서 마이크로파 주사 시간을 변화시키면서 합성하였다(MW로 표시). 이렇게 제조된 물질을 상온으로 식힌 다음 여과과정을 통해 얻어지는 고체 분말을 충분히 세척하여 불순물을 제거한 후 120℃에서 12시간 동안 건조시켜 제조하였다.
제조된 촉매들의 결정 구조를 확인하기 위해서 X선 회절기(XRD, Philips X'pert diffractometer/Cu Kα radiation)를 사용하여 결정성을 확인하였으며, 제조된 촉매들의 흡광도 및 띠 간격을 알아보기 위해 UV-vis diffuse reflectance spectroscopy (DRS, Varian Cary 100)를 이용하여 측정하였다. 촉매의 미세구조 관찰 및 모양, 크기분포 등은 scanning electron microscope (HITACHI S-2400, Japan)를 사용하여 관찰하였고, 촉매의 분광학적 특징을 살펴보기 위해 상온에서 광원으로 Xe 램프를 장착한 photoluminescence spectrometer (PL, KIMMON KOHA, Japan)를 사용하였다. 제조된 촉매의 micro-Raman 스펙트라는 Raman spectrometer (Dimension -pl-Raman, USA)를 사용하여 측정하였다. 촉매의 표면적, 기공 부피 및 기공의 분포 등을 측정하기 위해 표면 측정 장치(Quntachrome, Autosorb-1 Surface Analyzer)를 이용하여 측정하였다.
제조된 촉매의 광촉매 활성 특성을 알아보기 위해 반응물 Rhodamine B에 대한 광활성 능력을 조사하였으며, 반응물의 초기농도는 10 ppm, 촉매 첨가량을 0.1 g/mL, 반응액 양을 100 mL로 동일하게 하였다. 반응장치는 회분식 반응기, Xe 램프조절기, Xe 램프, 냉각필터, 석영렌즈, 교반기 등으로 이루어져 있으며, 반응기는 내열유리로 제작되었으며 반응기 아래에 교반기를 설치한다. 이는 광촉매반응시 반응기에 spin bar를 넣어 촉매가 침전하는 것을 막고 골고루 교반시키기 위해서이다. 광원으로는 Xe램프를 사용하였으며 광원의 효율을 높이기 위해 반응기와 water filter를 알루미늄호일로 감싸 광원이 주변으로 누출되는 것을 차단시켰다. 반응물은 일정 시간마다 채취하여 UV-vis spectrophotometer (Mecasys Optizen Pop)를 이용하여 분석하였다. 이때 반응물의 흡광파장은 664 nm에서 흡광도를 측정하여 시간에 따른 농도변화를 확인하였다.
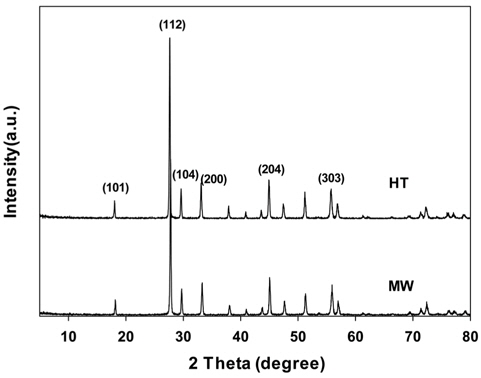
수열합성법과 마이크로파 공정으로 제조한 PbMoO4 산화물들의 결정성을 알아보기 위해 XRD 측정을 행하여 그 결과를 Figure 1에 나타내었다. 순수한 PbMoO4 산화물은 사면체 구조를 가지며, JCPDS No.가 44-1486으로 알려져 있다[12]. Figure 1에 나타나듯이 제조 방법에 관계없이 2θ=17.5, 27.5, 29.5, 33.7, 44.9 및 57.2°에서 PbMoO4 산화물의 특성 결정면인 (101), (112), (204), (200), (204) 및 (303)을 잘 나타내고 있다. 그러나 제조방법에 따라 서로 다른 피크의 세기를 나타내는데, 이것은 다른 합성조건에 따른 결정면의 이방성 성장 때문으로 생각된다.
또한, 촉매들의 결정크기는 X-선 회절 피크에 상응하는 라인의 넓이로부터 미세 결정크기
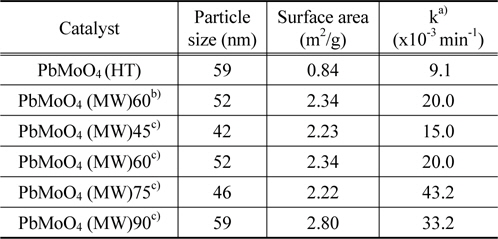
위의 식으로부터 얻어진 촉매들의 결정의 크기는 42에서 59 nm의 크기를 보여주었으며, 그 결과는 Table 1에 나타내었다.
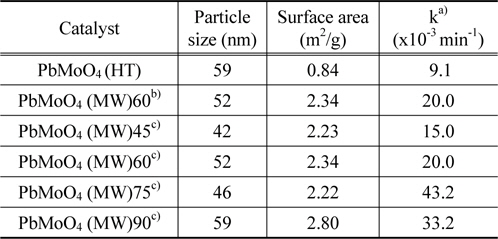
The physical properties and photocatalytic activity of various PbMoO4 catalysts prepared by different method
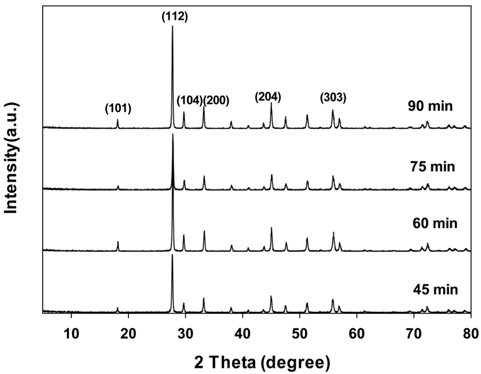
Figure 2에서는 마이크로파의 주사시간을 달리하여 제조한 PbMoO4 산화물의 XRD 결과를 나타내었다. 마이크로파의 주사시간과 무관하게 PbMoO4 산화물의 특성피크가 잘 나타났으며, 주사시간이 길어짐에 따라 피크의 세기가 증가하는 것을 볼 수 있다. 또한 Scherrer 식에서 얻어진 결정의 크기는 주사 시간이 길어질수록 42 nm에서 59 nm로 증가하는 것으로 나타났다.
한편 수열합성법과 마이크로파 공정으로 제조한 PbMoO4 산화물의 비표면적을 측정하여 Table 1에 나타내었다. 수열합성법으로 제조된 촉매들에 비해 마이크로파 공정으로 제조된 PbMoO4 촉매의 비표면적이 큰 것으로 나타났다.
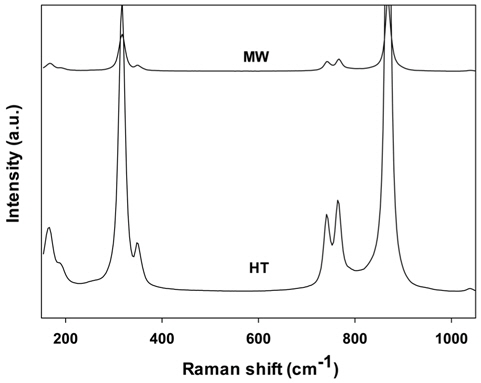
Figure 3에 수열합성법 및 마이크로파 공정으로 제조한 PbMoO4 산화물의 150~1000 cm-1의 범위에서 얻어진 Raman 스펙트럼의 결과를 나타내었다.
먼저 869.5 cm-1에서의 피크는 PbMoO4 결정 내의 [MoO4] 덩어리의 대칭성 신축진동모드인
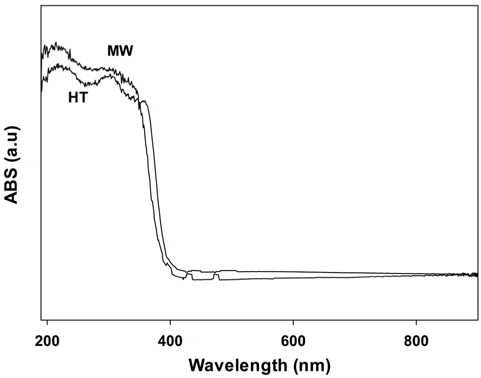
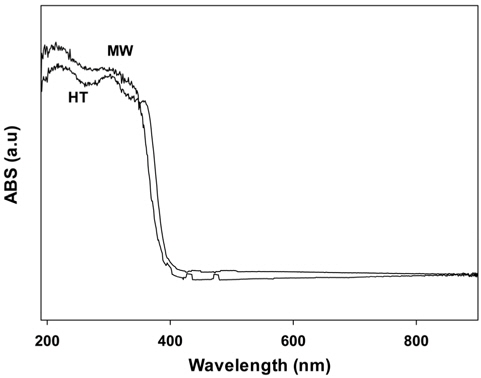
광촉매들의 빛의 흡수에 대한 성질은 diffuse reflectance UV-Vis spectroscopy (DRS)에 의해 확인할 수 있다. Figure 4에 수열합성법 및 마이크로파 공정으로 제조한 PbMoO4 산화물의 DRS 결과를 나타내었다. Figure 4에서 나타나듯이 모든 촉매들은 자외선 영역에서 비슷한 흡수스펙트럼을 보여주고 있으며, 띠간격(band gap)은 약 3.2 eV로 PbMoO4 화합물에 대한 다른 결과와 비슷한 값을 나타내었다[12]. PbMoO4 화합물의 밴드 구조는 Mo4d (conduction band, CB)와 O2p 및 Pb6s (valence band, VB)의 혼성화로 이루어져 있다.
[Figure 4.] Diffuse reflectance absorption spectra of PbMoO4 catalysts prepared by different method.
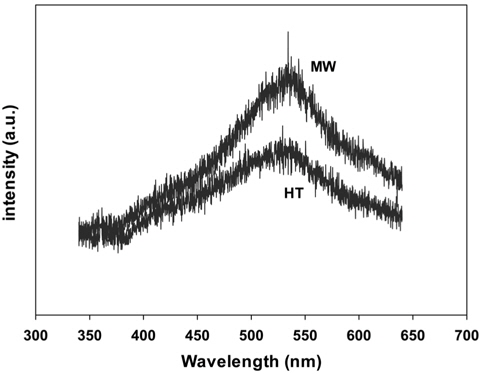
PL 분광계는 전하 운반체의 포집 효율 및 반도체 입자내부에서 생기는 전자/전공쌍의 거동 등을 조사하기 위해 이용되는 분석방법이다. 여기광의 파장은 300 nm로 조사하였다. 촉매가 방출되는 빛의 발광에너지는 330~700 nm 범위에서 측정하였다. Figure 5에 수열합성법 및 마이크로파 공정으로 제조한 PbMoO4 산화물의 PL 분석 결과를 나타내었다. 제조 방법에 관계없이 모두 같은 모양의 PL 피크를 나타내고 있으며, 530 nm 부근에서 강하고 넓은 PL 흡수밴드를 나타내었다.
또한 PL 피크의 강도가 커질수록 산소 결함이나 공백의 정도가 커진다. 또한 광촉매반응이 진행되는 동안 산소 결함이나 공백은 전자와 정공이 재결합하는 것을 방지하기 위해서 빛에 의해 얻어진 전자를 포획하게 된다. 더구나 산소공백은 산소의 흡착을 증가시켜 산소공백과 결합된 전자와 흡착된 산소 간의 강한 상호작용이 생성된다. 이와 같은 결과는 산소공백의 광유도된 전자들의 결합이 동시에 생성된 흡착된 산소나 산소라디칼의 광유도된 전자들을 포획하게 된다. 따라서 산소공백이나 결함은 광촉매 반응에서 유기화합물의 산화반응을 촉진시키는데 강한 활성점으로 작용하게 된다. 결국 PL 피크의 강도가 커질수록 산소 결함이나 공백의 정도가 커지면서 광촉매 활성도 증가하게 된다. 따라서 마이크로파 공정으로 제조된 PbMoO4 산화물의 PL 피크는 수열합성법으로 제조된 촉매보다 강한 세기를 보여주고 있으며, 높은 광촉매 활성을 보여주고 있다(Table 1).
수열합성법 및 마이크로파 공정으로 제조한 PbMoO4 산화물의 형태를 SEM으로 측정하여 그 결과를 Figure 6에 나타내었다. Figure 6에서 나타나듯이 수열합성법으로 제조된 PbMoO4 산화물은 서로 다른 크기를 가진 입자들이 뭉쳐져 있는 것을 볼 수 있는 반면에 마이크로파 공정으로 제조된 촉매는 균일한 입자 크기를 보여주고 있다.
각 조건에 따라 제조된 촉매의 광분해 활성을 알아보기 위해 반응물 Rhodamine B에 대한 광활성 능력을 조사하였으며, PbMoO4 산화물 촉매들의 광촉매적 활성에 대한 결과는 UV를 조사하기 전 단계에서 확인한 촉매 흡착실험에서 흡착은 거의 일어나지 않았다.
일반적으로 유기물질의 광분해 반응의 경우 Langmuir-Hinshelwood 속도식을 따른다고 알려져 있다. 이를 식으로 나타내면 다음과 같다[15].
그리고 이것을 적분해서 나타내면 다음과 같이 나타낼 수 있다.
여기서 Co는 초기 유기물질의 농도이며
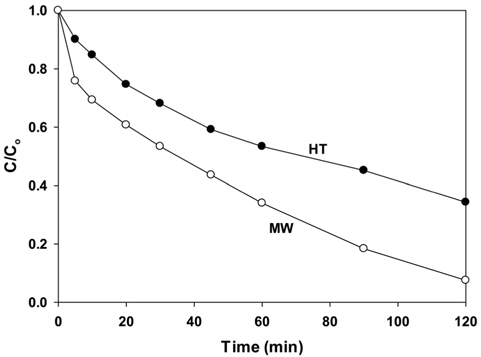
수열합성법 및 마이크로파 공정으로 제조한 PbMoO4 산화물 촉매에 대한 Rhodamine B의 광분해 반응성을 Figure 7과 Table 1에 나타내었다. 수열합성법으로 제조된 촉매에 비해 마이크로파 공정으로 제조된 PbMoO4 산화물 촉매가 높은 광분해 활성을 보여주었으며, 반응 2시간 만에 거의 95% 이상의 분해가 진행되었다. 일반적으로 광분해 활성은 입자의 크기, 표면적 및 결정성 등 많은 인자들의 영향을 받는 것으로 알려져 있다[15]. 따라서 마이크로파 공정으로 제조된 촉매의 경우가 표면적이 크고, 입자의 크기가 작으므로 광분해 활성을 증가시키는 것으로 생각된다. 또한, 앞에서도 언급하였던 것처럼 PL 특성피크의 세기가 클수록 전자와 정공의 재결합을 효과적으로 막음으로써 Rhodamine B의 광분해 활성을 증가시키게 된다. Figure 5에 보여주듯이 마이크로파 공정으로 제조된 PbMoO4 촉매의 PL 특성피크의 결과와 광분해 활성의 결과가 잘 일치하는 것을 볼 수 있다.
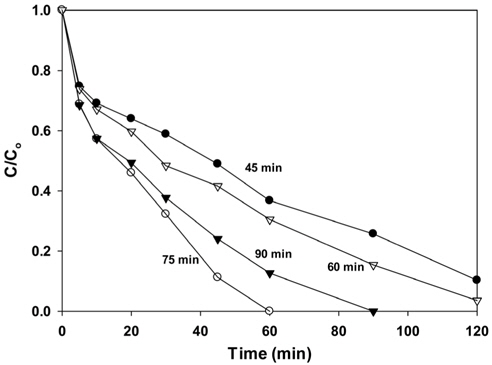
마이크로파의 주사시간을 달리하여 제조한 PbMoO4 산화물의 광분해 활성을 Figure 8과 Table 1에 나타내었다.
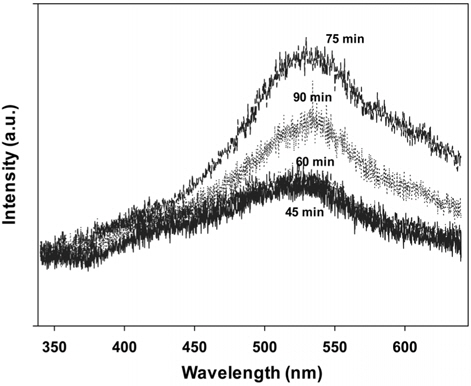
촉매 제조 시 마이크로파의 주사 시간이 길어질수록 Rhodamine B의 광분해 활성이 증가하다가 90분 동안 마이크로파를 주사하여 제조한 촉매에서는 오히려 활성이 낮아지는 것을 볼 수 있다. 이와 같은 결과는 Figure 9에 나타난 것처럼 PL 분석 결과와도 잘 일치하고 있는데, PL 특성피크의 강도의 순서와 광촉매 활성의 순서가 일치하는 것을 볼 수 있다. Figure 9에 나타나듯이 주사시간과 무관하게 530 nm 부근에서 강하고 넓은 PL 흡수밴드가 나타났으며, 75분간 마이크로파를 주사하여 제조한 촉매가 가장 큰 피크를 보여주었으며, 가장 높은 광분해 활성을 나타내었다.
PbMoO4 산화물을 수열합성법과 마이크로파 공정으로 합성하여 XRD, DRS, BET, Raman, SEM 및 PL 등에 의해 특성분석을 하였다. 또한 제조된 촉매들을 사용하여 자외선 조사하에서의 Rhodamine B의 광분해 반응에서의 활성을 조사하였다. XRD 및 Raman의 분석 결과에 의하면 대부분의 촉매들은 제조방법과 무관하게 잘 결정화된 PbMoO4 구조를 가지고 있었으며 42에서 59 nm의 크기를 나타내었다. 마이크로파 공정으로 제조된 PbMoO4 촉매는 통상적인 수열합성법으로 제조된 촉매에 비해 균일한 입자를 가지고 있으며, 높은 광분해 활성을 나타내었다. 마이크로파 주사 시간을 75분으로 제조한 PbMoO4 촉매가 가장 높은 광분해 활성을 나타내었다. 모든 촉매들은 530 nm 부근에서 강하고 넓은 PL 흡수밴드가 나타났으며, 이 피크의 세기가 커질수록 광분해 활성이 증가하는 것으로 나타났다.