군 훈련장 및 사격장, 건설공사 현장, 광산, 화약 및 포탄 제조 시설에서는 2,4,6-trinitrotoluene(TNT), hexahydro-1,3,5-trinitro-1,3,5-triazine(RDX), octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine(HMX) 등과 같은 화약류를 많이 사용하고 있다. 화약류는 사용목적에 따라 TNT 단독으로 사용되거나, RDX 혹은 HMX와 혼합하여 사용되고 있으며, 토양 및 지하수를 비롯한 자연환경 오염의 원인이 되고 있다(Brannon et al., 2000; Kalderis et al., 2011; Mese and Lehmpuhl, 2008; Zhang et al., 2011). 미국의 경우 2013년을 기준으로 30여개의 국가우선순위목록(National Priority List; NPL)에서 TNT가 검출되고 있으며, 우리나라의 경우도 사격장 및 훈련장에서 TNT에 의한 토양 오염이 발견되고 있다(Bae and Park, 2014). 특히 TNT는 사격 훈련 시 불완전 연소 또는 불발탄 발생 등으로 환경으로 유출되며, 토양 속에서 발견되는 TNT 결정은 강수에 의해 용해되어 지속적인 환경 오염원으로 작용한다(Brannon et al., 2000).
동물 실험 결과에 의하면 고농도의 TNT 섭취는 간, 혈액, 면역 체계에 손상을 주며, 자연환경 상의 TNT는 곰팡이, 세균, 효모 등의 성장을 억제하는 것으로 알려져 있다(Kim et al., 2002). 미국 환경부는 TNT를 먹는물 수질기준에서 인간에게 암을 유발할 가능성이 있는 물질인 ‘C’ 등급으로 분류하고 있으며, 허용되는 최대 섭취량(reference dose, Rfd)은 0.0005 mg/kg/day이다(U.S. EPA, 2012). 우리나라의 경우 아직 TNT에 대한 토양 및 수질 환경기준은 정립되어 있지 않다. 그러나 현재 사용중인 군 사격장 및 훈련장 토양은 TNT에 의해 오염되고 있으며, 군 사격장 및 훈련장 용도 종료 후에는 향후 안전한 사용을 위하여 민간이전 이전에 토양 및 지하수 오염에 대한 환경정화가 선행되어야 한다.
토양, 음용수, 하수의 TNT 제거를 위해서는 물리, 화학, 생물학적인 원리를 이용한 분해 방법들이 주로 사용되고 있으나, 여러가지 기술적 제한으로 친환경적인 처리기술 개발이 요구되고 있다. 활성탄을 활용한 흡착은 물리적 방법을 이용한 매질 속의 TNT 제거를 위한 대표적인 방법이다(Zhang et al., 2011). 하지만 활성탄을 이용한 흡착은 활성탄 가격이 비싸고, 완전한 TNT 분해를 위해 대기오염 발생 우려가 있는 추가적인 소각 절차가 필요하다. 이에 대한 보완 방안으로 Wei et al. (2011)은 활성탄에 Cu2+를 첨착시켜 TNT로 오염된 물의 화학적산소요구량(COD)을 낮추었다. 생물학적 처리 공법은 저비용과 운전의 용이성에서 장점을 가지고 있으나 긴 처리 소요 시간과 처리 효율에서 한계를 지닌다(Kwon et al., 2004). 미생물을 이용한 분해는 자연 환경의 영향을 많이 받으며, 불완전한 분해는 오염물질보다 더 해로운 분해산물을 만들어 내기도 한다.
TNT 처리를 위하여 고도산화공정에 대한 연구가 활발히 이루어져오고 있다(Ayoub et al., 2010). 고도산화공정을 활용한 용액 속의 TNT 분해는 서로 다른 종류의 철을 함유한 광물들과 과산화수소를 활용하는 펜톤 분해(Ayoub et al., 2011; Matta et al., 2007), UV와 펜톤반응을 결합한 분해(Chen et al., 2005; Li et al., 1998), 광에너지와 펜톤반응을 결합한 분해(Liou et al., 2004), UV와 과산화수소를 이용한 분해(Kwon et al., 2010), TiO2 촉매가 포함된 용액에 과산화수소를 넣고 자외선을 조사하는 분해(Dillert et al., 1996; Shin and Kim, 2002; Son et al., 2004), 그리고 오존 혹은 오존과 UV를 결합한 분해(Chen et al., 2007), 초음파를 활용한 분해(Hoffmann et al., 1996), 감마선을 이용한 분해(Lee and Jeong, 2009; Lee and Lee, 2005) 등을 포함한다. 그러나 이러한 분해 공정은 TNT 뿐만 아니라 다른 유기물들에게도 비선택적으로 작용하고 탄화수소를 산화시켜 재활용할 수 없는 단점이 있다.
이러한 단점을 보완하기 위하여, 물 속에 포함된 살충제 및 유해한 할로겐 물질들을 분해하기 위하여 촉매를 활용한 환원기술들이 활발히 연구되어 왔다. 촉매를 활용한 수질 오염물질의 분해는 인간이 활동하는 온도와 압력 하에서 신속히 반응하며, 반응기 규모가 작기 때문에 활용이 용이하다. Hundal et al. (1997)은 영가철 혹은 영가철과 이어진 과산화수소 처리를 통해 화약류로 오염된 용액을 정화하였고, Zhang et al. (2010)은 나노 사이즈의 영가철을 활용하여 TNT 용액을 분해하였으며, 연구 결과 낮은 pH에서 수소 이온들이 TNT의 분해를 촉진함을 발견하였다. Bae (2006)는 마이크로와 나노 크기의 영가철을 활용하여 TNT 등에 대한 환원 동역학을 측정하였다.
최근에는 palladium (Pd)과 수소를 활용한 유기물질 분해에 대한 연구도 활발히 진행되고 있다(Sriwatanapongse, 2005). Lowry and Reinhard (1999)는 수소가 충분히 공급되는 환경에서 Pd을 이용한 환원성 촉매반응으로 트리클로로에틸렌(trichloroethylene, TCE)을 할로겐을 함유한 분해산물 없이 에탄과 염산으로 분해하였다. Pd을 흡착한 알루미나(Al2O3) 촉매는 넓은 비표면적, 적정한 화학적 활성도, 그리고 저렴한 가격으로 많이 사용되고 있다(Nasri et al., 2015). Smith et al. (2001)은 수소의 낮은 용해도 때문에 포름산을 질산으로 오염된 지하수의 탈질화를 위한 수소 공급원으로 활용하였다. 그러나 아직까지 Pd 촉매와 포름산을 활용한 TNT 분해에 대한 연구 결과는 아직 보고되지 않았다.
본 연구에서는 환원반응에 의한 TNT의 신속한 분해를 위하여 Pd이 첨착된 알루미나(Al2O3) 촉매(5% palladium catalyst impregnated onto alumina, henceforth Pd-Al catalyst)와 수소의 공급원으로서 포름산을 활용하여 TNT의 신속한 환원성 분해에 대해 연구하였다. 본 연구에서는 Pd-Al 촉매량(10 mg, 20 mg, 40 mg), TNT 초기농도(10 mg/L, 30 mg/L, 50 mg/L), TNT 용액의 온도(4℃, 20℃, 30℃), 수소공급원인 포름산 농도(80 mg/L, 190 mg/L, 390 mg/L), TNT 용액의 pH (3, 5, 10), 그리고 인공지하수에 포함된 이온 농도 등의 영향을 검토하였다. Pd-Al 촉매를 활용한 TNT 분해는 영가철(Fe0)을 이용하였을 때와 비교하여 반응속도를 현격히 향상시킬 수 있어서, 활용 가능성이 크게 기대되는 정화방법이다.
본 연구에 사용한 TNT는 A사로부터 기증받았다. Pd-Al 촉매는 Tokyo Chemical Industry Co.에서 구매 후 별도의 처리없이 사용하였다. TNT의 중간 분해산물로 예상되는 2-amino-4,6-dinitrotoluene, 4-amino-2,6-dinitrotoluene, 2,6-diamino-4-nitrotoluene, 2,4-diamino-6-nitrotoluene은 AccuStandard에서 구매하였다. TNT의 중간 분해산물 추출을 위하여 solid phase micro-extraction fiber assembly(SPME, 50/30 μm Divinylbenzene /Carboxen /Polydimethylsiloxane fibers)는 Supelco사로부터 구매하였다. 필터링을 위한 Econofltr 주사기 필터, PTFE 47 mm filter paper는 각각 agilent technology와 Grace사로부터 구매하였다. 포름산(formic acid, ≥ 95%), n-헥산(hexane), 수산화나트륨(NaOH), 메탄올은 SigmaAldrich로부터 구매하였고, 브롬화칼륨(KBr)은 MERCK로부 터 구매하였다. 인공지하수 조성을 위해 사용된 염화마그네슘(MgCl2)은 Junsei Chemical에서, 질산나트륨(NaNO3)과 황산칼슘이수화물(CaSO4·2H2O)은 삼전순약에서 각각 구매하였다. 또한, 모든 용액제조 및 실험에서는 Barnstead Nanopure(Thermo Scientific)에 의해 제조된 초순수(>18 MΩ·cm)를 사용하였다. 실험에 사용된 질소와 헬륨가스는 한미가스테크로부터 구매하였다.
TNT 용액(50 mg/L)은 TNT 결정을 초순수에 넣고 24시간 동안 자석교반기를 이용하여 교반 후 0.45 μm 필터(PTFE, 47 mm, Grace)를 통과시켜 준비하였다. Ro et al. (1996)는 TNT의 용해도가 20℃에서 일반적으로 알려진 100~200 mg/L에 미치지 못하고, 86~97 mg/L의 분포를 보인다는 것을 발견하였다. 저온 실험(예: 4℃)의 경우 온도 저하에 따라 TNT 용해도가 감소하기 때문에 용액 제조 후 0.45 μm로 필터링 후 실험에 사용하였으며, 동일한 실험 조건 조성을 위해 모든 TNT 용액은 제조 후 필터링 후 실험에 사용하였다. 필터링 한 TNT 용액은 갈색병에 넣고 실험에 적합한 온도에 보관하였다. 인공지하수는 초순수에 0.09 mM MgCl2, 0.2 mM NaNO3, 0.2 mM CaSO4·2H2O를 혼합하여 조성하였고, 동일한 과정으로 필터링 및 보관하였다.
TNT의 분해 실험은 회분식 반응기를 이용하여 실시하였다. TNT 용액 300 ml가 든 400 ml 비이커에 Pd-Al 촉매를 넣고 magnetic stir bar와 plate (PC-420, Corning)를 이용하여 균질하게 혼합하였다. TNT 오염 시료에 수소 공급원인 포름산을 추가하기 전에 초기 농도 측정을 위한 시료를 채취하였다. 이후 실험 목적에 맞게 포름산 농도(80 mg/L, 190 mg/L, 390 mg/L)를 조성한 후 반응을 관찰하였다. 실험 목적에 맞는 온도(4℃, 20℃, 30℃)는 회분식 반응기 아래에 수조를 준비한 후 hot plate (PC-420, Corning)를 이용하여 수조를 일정한 온도로 유지하였다. 동일한 조건에서 실험은 2회 실시하였으며 각 실험의 평균값을 분석하였다.
용액 속 TNT의 분해를 관찰하기 위해 반응시간 동안 2 ml의 시료를 5 ml plastic syringe (NORM-JECT)를 이용하여 일정한 간격(2~5분)으로 채취하고 0.45 μm pore size syringe 필터(Econofltr PVDF, Agilent Technologies)로 여과한 후 시료를 HPLC (High Performance Liquid Chromatography, Agilent technologies 1200 series)를 사용하여 분석하였다. 분석용 칼럼은 ZORBAX Eclipse Plus C18 (4.6×250 mm, 5 μm, Agilent technologies)을 사용하였고, 운반용매는 메탄올과 증류수를 50:50으로 혼합하여 사용하였으며, 이때 운반용매의 유속은 1 ml/min이었다. 시료는 autosampler용 syringe를 사용하여 10 µL 주입하였으며, TNT와 분해산물 검출은 photo-diode array detector를 사용하여 254 nm 파장에서 이루어졌다. TNT의 중간 분해산물로 예상되는 2-amino-4,6-dinitrotoluene (or 4-amino-2,6-dinitrotoluene), 2,6-diamino-4-nitrotoluene (or 2,4-diamino-6- nitrotoluene) 표준액을 HPLC로 분석하여 반응도중 검출되는 중간 분해산물의 크로마토그래피 상의 체류시간과 비교 분석하였다.
또한, 반응과정의 중간 분해산물 확인은 gas chromatography and mass spectrometer(GC/MS, Agilent technologies 7890A)를 이용하였고 이때 5975C 검출기를 사용하였다. 중간 분해산물은 SPME를 이용하여 10분 동안 추출하였고, GC/MS에 splitless mode로 주입하였으며, 운반기체는 헬륨 1 ml/min 이었다. 이때 사용한 칼럼은 DB-5MS (0.32 mm×30 m, 0.25 μm film thickness)이고, 칼럼 오븐 온도는 초기 40℃에서 200℃까지 8℃/min 비율로 증가하였으며, 이후 300℃까지 20℃/min 비율로 증가한 후 5분간 유지하였다.
반응 전과 후 고형물의 작용기 분석은 Universal ATR sampling accessory를 부착한 Fourier Transform Infrared Spectrometer(FT-IR, PerkinElmer)를 활용하여 분석하였다. 절구와 사발을 사용하여 약 5 mg의 고형물과 400 mg의 브롬화칼륨(KBr)을 각각 부드럽게 간 후, 균일하게 혼합하고 장치를 이용하여 분석하였다. 스펙트럼은 4000 cm−1부터 400 cm−1까지 구간을 4 cm−1 해상도로 500회 스캔하여 획득하였다.
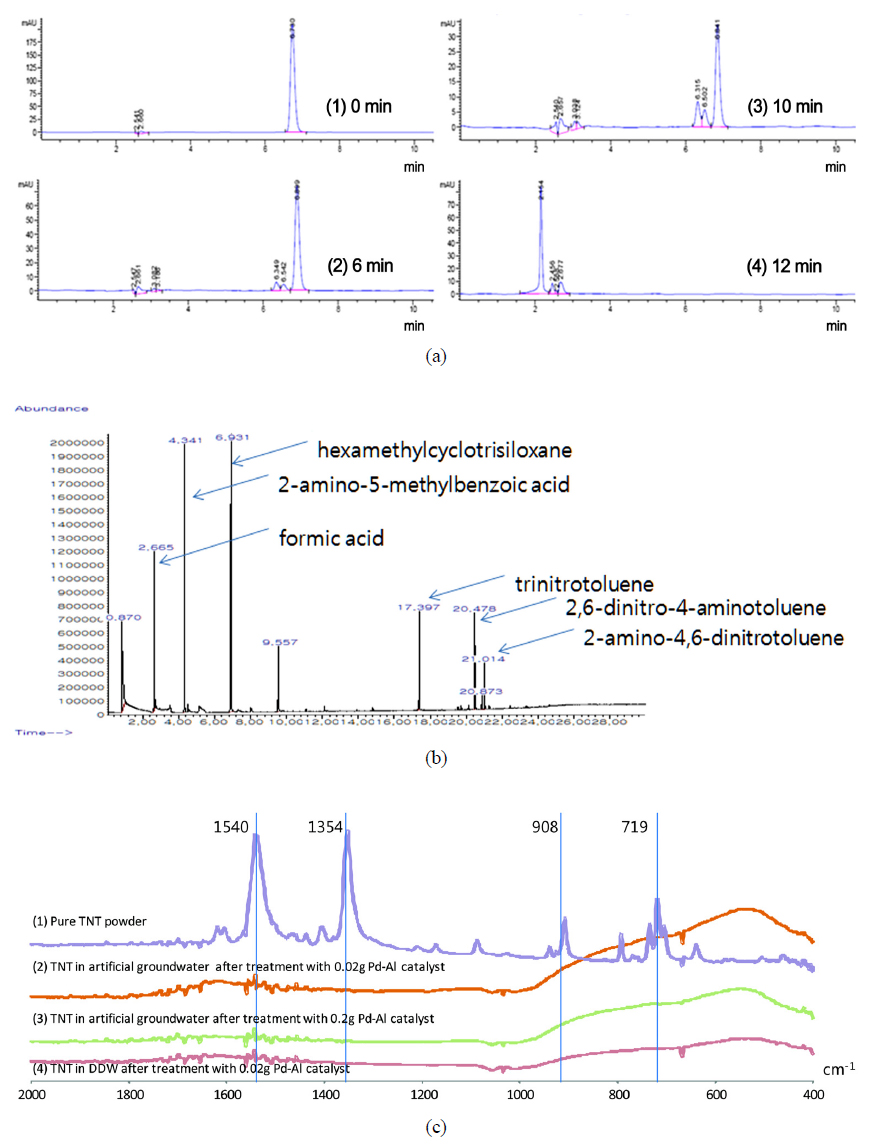
TNT 분해 과정 및 결과물에 대한 HPLC 크로마토그램, GC/MS 크로마토그램, 그리고 푸리에 변환 적외선 분광분석 스텍트럼은 Fig. 1과 같다. 반응이 진행됨에 따라 초기 TNT 농도가 점차 감소하면서 분해산물들이 만들어진다(Fig. 1(a)). 분해산물로 예상되는 표준물질을 동일한 조건에서 HPLC로 분석하고 피크가 나오는 체류시간 분석을 통하여 dinitrotoluene과 nitrotoluene이 생성됨을 알 수 있었다. HPLC 분석결과 TNT는 6.7분, 2-amino-4,6-dinitrotoluene와 4-amino-2,6-dinitrotoluene은 6.3분, 그리고 2,6-diamino-4-nitrotoluene와 2,4-diamino-6-nitrotoluene은 2.1분에 각각 피크가 관찰되었다. TNT는 환원 분해 과정을 통해 nitro기가 amino기로 치환되면서 연속적으로 2-amino4,6-dinitrotoluene (or 4-amino-2,6-dinitrotoluene)으로 분해된 후 diaminonitrotoluene을 거쳐 triaminotoluene으로 전환되는 것으로 알려져 있다(Elovitz and Weber, 1999). 아민기를 보유한 방향족 화합물은 여전히 독성을 나타내지만 TNT와 비교할 때 쉽게 생분해된다(Hundal et al., 1997).
Pd-Al 촉매와 수소 공급원으로서 포름산을 활용한 TNT 분해 반응에서 발생하는 분해산물은 HPLC 피크 변화 뿐만 아니라 반응 중 시료를 SPME로 채취한 후 GC/MS 분석하였다(Fig. 1(b)). 반응 중 생성되는 분해산물은 HPLC에서 관찰한 2-amino-4,6-dinitrotoluene 외에도 2-amino-5-methylbenzoicacid와 hexamethylcyclotrisiloxane이 관찰되었다. 그러나 triaminotoluene은 관찰되지 않았다. 또한 반응이 완료될 시점에도 포름산이 검출되어 환원 반응을 위한 수소는 충분히 공급되고 있음을 알 수 있다. TNT 분해반응 종료 후에는 TNT 뿐만 아니라 분해산물인 2-amino-4,6-dinitrotoluene도 관찰되지 않아 분해되었음을 확인하였다.
또한 TNT 분해를 HPLC, GC/MS 뿐만 아니라 반응이 완료된 고형물에 대한 푸리에 변환 적외선분광분석법을 통해서도 관찰하였다(Fig. 1(c)). FTIR spectra에서 TNT는 1,540 cm−1 (C-C ring stretch), 1,354 cm−1 (C-C ring stretch), 908 cm−1 (C-N ring stretch), 719 cm−1 (C-C ring bending)에서 피크를 관찰할 수 있다(Banas et al., 2009). 순수한 TNT를 FTIR로 분석한 결과 위에서 기술한 피크를 모두 관찰할 수 있었으나, 실험 후 채취한 고형물에 대한 분석 결과 TNT에서 나타나는 대부분의 피크가 사라져, TNT가 분해되었음을 확인할 수 있었다.
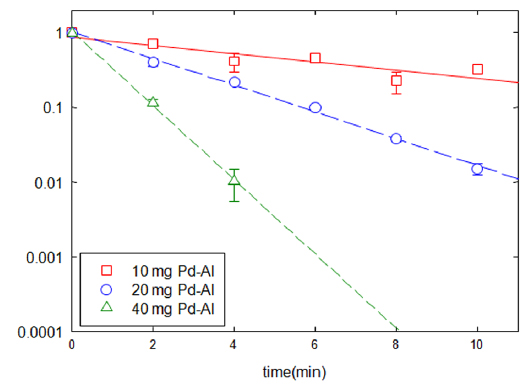
TNT의 분해는 유사 1차 반응식으로 표현할 수 있으며, 투입된 촉매의 양에 따라 보정하여 표준화(normalized)한 속도상수로 나타내고 비교하였다. Pd-Al 촉매는 5%의 Pd을 포함하고 있으므로, 실제 Pd 양에 의한 분해 상수는 촉매의 양에 의한 분해 상수보다 20배 크다. 회분식 반응조에 동일한 조건에서 촉매의 양을 달리하면서 환원속도에 미치는 영향을 분석하였다(Fig. 2). TNT의 농도 저감 속도는 투입되는 촉매의 양과 비례하였다. 따라서 촉매의 양이 증가함(10 mg, 20 mg, 40 mg)에 따라 1차 분해상수는 각각 0.05, 0.17, 0.47 min−1 로 증가하였고, 촉매의 단위 질량 당 분해상수는 4.74, 8.37, 10.93 min−1g−1 으로 나타났다. 특히 40 mg의 촉매를 사용한 경우 50 mg/L TNT 용액 300 ml를 8분 안에 분해할 수 있었다.
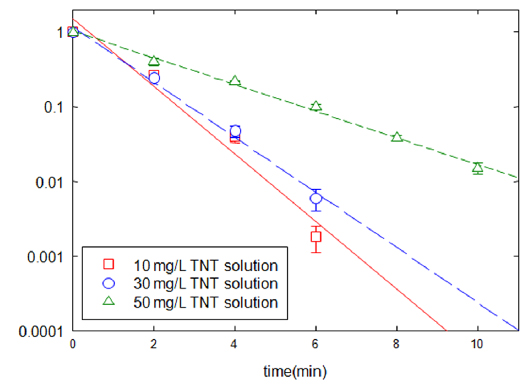
회분식 반응조 실험의 동일한 조건에서 초기 TNT 농도를 달리하면서 환원속도에 미치는 영향을 분석하였다(Fig. 3). TNT의 농도 저감 속도는 초기 TNT 농도와 반비례하였다. 초기 농도가 50 mg/L에서 30 mg/L, 10 mg/L로 낮아짐에 따라 반응상수는 8.37, 22.56, 23.11 min−1g−1로 각각 증가하였다. 따라서 초기 TNT 농도가 낮으면 빠른 시간 내에 분해가 완료되었으며, 이 결과는 감마선 조사를 통해 TNT를 분해한 Lee and Lee (2005) 연구 등과 유사하였다.
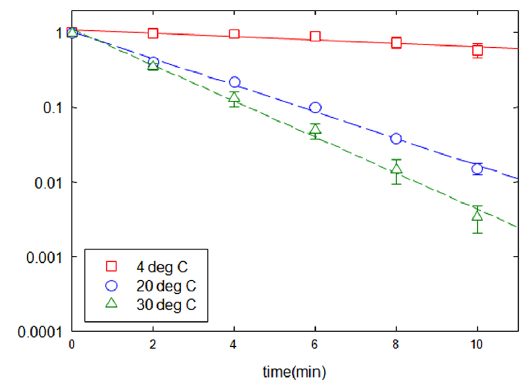
회분식 반응조 실험의 동일한 조건에서 반응 온도를 달리하면서 환원속도에 미치는 영향을 분석하였다(Fig. 4). TNT의 농도 저감 속도는 온도가 증가에 비례하였다. 반응 온도가 4℃, 20℃, 30℃로 높아짐에 따라 반응상수는 1.40, 8.37, 11.16 min−1g−1로 각각 증가하였다. 따라서 TNT의 신속한 분해를 위해서는 상온보다 높은 온도 설정이 요구된다. 온도 상승에 따른 TNT 분해 속도 증가는 확산 속도의 증가, TNT의 용해도 증가, 그리고 반응속도 증가에 기인하는 것으로 판단된다(Hundal et al., 1997).
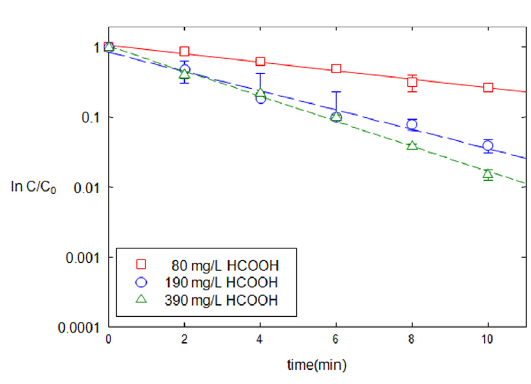
회분식 반응조 실험의 동일한 조건에서 포름산의 농도를 달리하면서 환원속도에 미치는 영향을 분석하였다(Fig. 5). 실험에서 포름산을 추가하지 않았을 때 TNT는 Pd-Al 촉매의 양에 관계없이 분해되지 않았다. 또한 Pd-Al 촉매없이 포름산을 추가하여도 양에 관계없이 TNT는 분해되지 않았다. Pd-Al 촉매를 투여한 TNT 용액에서 TNT의 농도 저감속도는 포름산의 농도에 비례하였다. 포름산의 농도가 80 mg/L, 190 mg/L, 390 mg/L로 증가됨에 따라 반응상수는 3.32, 6.57, 8.37 min−1g−1로 각각 증가하였다. 따라서 충분하지 못한 포름산의 공급은 TNT의 분해속도를 저하시키는 원인이 될 수 있다.
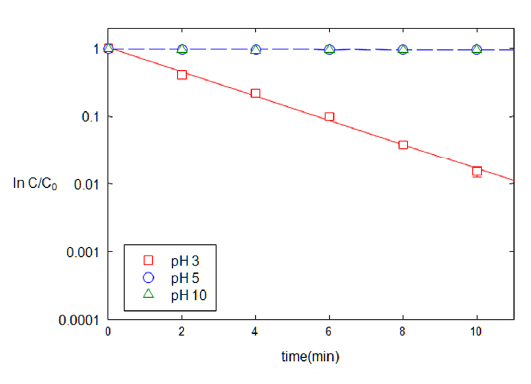
회분식 반응조 실험의 동일한 조건에서 pH를 달리하면서 환원속도에 미치는 영향을 분석하였다(Fig. 6). TNT의 농도 저감 속도는 pH가 증가함에 따라 감소하였고, pH가 5보다 큰 경우 거의 반응이 일어나지 않았다. pH가 3, 5, 10으로 증가됨에 따라 반응상수는 8.37, 0.06, 0.06 min−1g−1로 각각 감소하였다. TNT는 수소에 의해 환원되기 때문에 수소 이온 농도가 낮은 높은 pH에서는 TNT의 분해가 거의 이루어지지 않았다. 반응 후 각 시료의 pH는 3, 6, 10으로 거의 변화가 없었고, 높은 pH에서 추가되는 포름산은 TNT 환원에는 사용되지 못하고 OH 이온과 반응한 것으로 판단된다. 한편, Lee and Lee (2005)의 감마선 조사를 통한 TNT 분해 시는 pH 13에서 분해 효율이 가장 높아 분해 메카니즘에 따라 반응에 용이한 pH는 서로 다름을 알 수 있다.
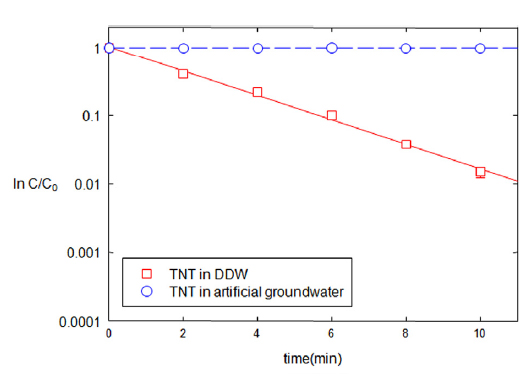
회분식 반응조 실험의 동일한 조건에서 인공지하수를 조성하여 환원속도에 미치는 영향을 분석하였다(Fig. 7). TNT의 농도 저감 속도는 이온의 양이 증가함에 따라 현저히 감소하였다. 증류수와 인공지하수를 처리한 TNT 분해상수는 8.37, 0.06 min−1g−1로 각각 나타났다. TNT는 수소에 의해 환원되기 때문에 추가된 포름산은 다른 이온과 반응하고 TNT의 분해에 영향을 미치지 못하는 것으로 판단된다.
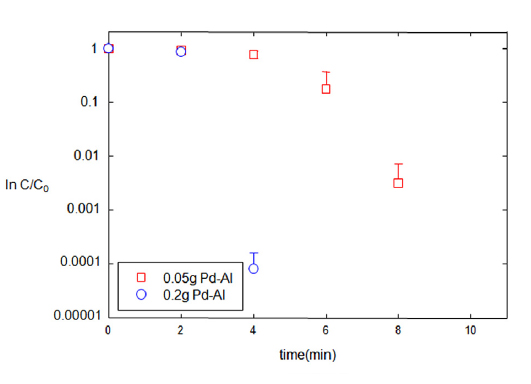
인공지하수의 TNT 오염을 정화하기 위하여 Pd-Al 촉매의 양, 포름산의 농도, 그리고 반응 시간을 증가시켰다(Fig. 8). 인공지하수의 TNT 분해는 증류수 속의 TNT 분해와 달리 즉각적인 분해가 일어나지 않고 분해를 위한 지연기간이 나타났다. 촉매의 양이 적을수록 지연구간은 증가하여 200 mg의 촉매를 사용하여 반응 시 약 5분 정도의 지연 기간이 나타났지만, 50 mg의 촉매 사용 시 약 10분 정도의 지연기간이 나타난 후 분해되었다. 물속의 이온들이 촉매에 흡착된 TNT와 포름산과의 반응을 지연시키는 것으로 판단된다. 반응 지연의 구체적인 메카니즘에 대한 추가적인 연구가 요구된다.
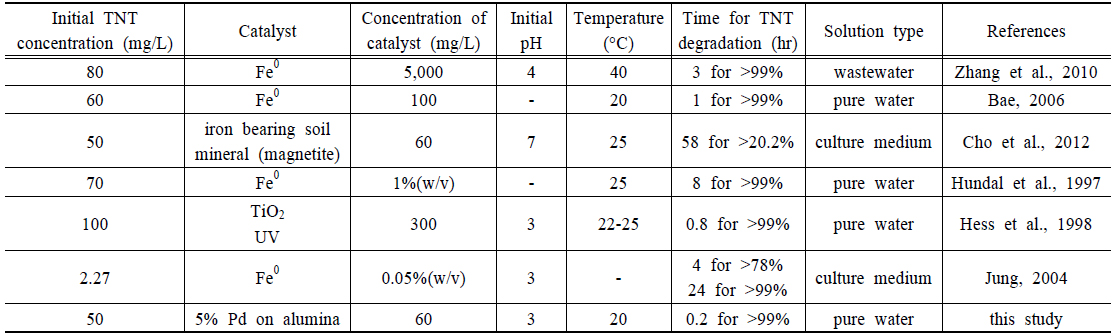
다른 연구들과 TNT 분해 효율에 대한 직접적인 비교는 실험 조건이 서로 다르기 때문에 쉽지 않다. 따라서 환원반응을 이용한 TNT 분해 중 초기 농도, 촉매의 양, 이온농도 등을 고려하여 비교하면 Table 1과 같다.
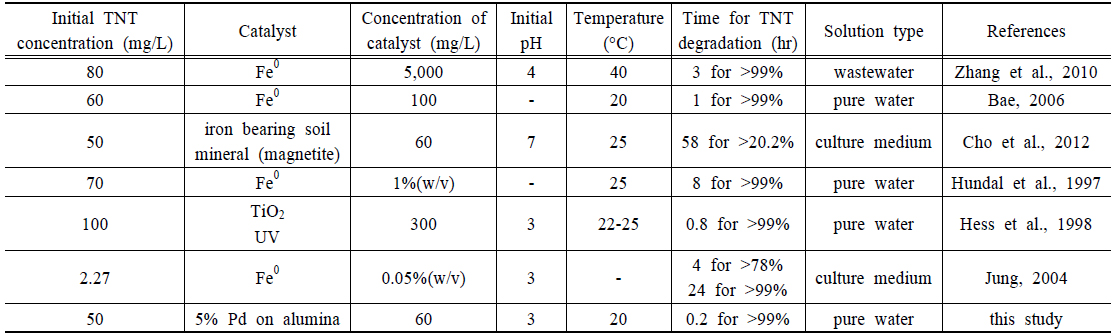
Comparison of trinitrotoluene (TNT) degradation from the literature with the data of the present paper. - means unknown
환원에 의한 TNT 분해는 순수한 물의 경우, 초기 TNT 농도가 낮은 경우 비교적 빠른 시간에 분해됨을 알 수 있었고, 영가철과 비교하여 본 연구에서 실험한 Pd-Al 촉매의 효능이 뛰어남을 알 수 있다. 하지만 상대적으로 Pd-Al 촉매 가격이 영가철과 비교하여 비싸기 때문에 효율적으로 재사용하는 방안에 대한 연구가 필요하다. 또한 지하수의 경우 많은 이온들이 공존하고 있기 때문에 Pd-Al 촉매의 효능이 저하되는데, 촉매의 활성도를 유지하기 위한 방안에 대한 연구도 요구된다.
TNT는 군 사격장, 훈련장, 사업현장에서 필요에 의해 사용되며, 사용 후 정화를 통하여 주변 자연환경 및 인간에 미치는 영향을 최소화해야 한다. 본 연구에서는 Pd-Al 촉매와 포름산을 환원 반응을 위한 수소공급원으로 활용하여 용액 속의 TNT를 상온에서 분해하였다. 본 실험을 통하여 Pd-Al 촉매와 포름산을 활용한 액상의 TNT 분해 시 TNT의 초기농도, pH, 이온농도가 낮을수록, 그리고 온도가 높을수록 분해는 빠르게 진행되었다. 아울러 Pd-Al 촉매와 포름산의 농도가 증가할수록 TNT는 빠르게 분해되었다. 하지만 실험에서 포름산을 추가하지 않았을 때 TNT는 Pd-Al 촉매의 양에 관계없이 분해되지 않았으며, 또한 Pd-Al 촉매없이 포름산을 추가하여도 양에 관계없이 TNT는 분해되지 않았다.
실험결과 Pd-Al 촉매는 촉매의 단위 질량당 분해상수가 8.37 min−1g−1 (실험조건: C0 = 50 mg/L, V = 300 ml, Pd-Al catalyst = 20 mg, HCOOH = 390 mg/L, temperature = 20℃, pH = 3)로서 기존에 발표된 영가철을 이용한 연구결과와 비교하여 빠른 시간 내에 TNT를 분해하였으며, 반응도중 환원반응의 분해산물로 2,6-diamino-4-nitrotoluene과 2-amino-4,6-dinitrotoluene이 발견되었고, 반응 완료 후 중간 분해산물들로 완전히 분해되어 더 이상 감지되지 않았다. 따라서 Pd-Al 촉매와 포름산을 이용하여 유기오염물질을 환원반응을 통해 빠른 시간 내에 분해하는 것은 촉망받는 정화공법으로 판단된다. 하지만, 인공지하수에 용해된 TNT 분해 시 포름산 투입 후 일정한 시간이 경과한 후 분해 반응이 발생하는 원리 등에 대한 추가적인 연구가 필요하다. 또한 추후 실제 오염 지하수에서 촉매의 성능, 촉매의 비활성화(poisoning), 촉매의 유출(leaching) 등에 대한 추가적인 연구가 이어져야겠다.