뜸부기[
뜸부기는 서남해안에서는 전통적으로 제사상의 나물재료로 이용되는 등 식용으로 널리 이용되어 왔는데, 시중에서 판매되고 있는 뜸부기의 가격은 현재 건중량 1 kg 당 10-12만원으로 거래되고 있다.
최근에는
또한 모자반과에 속하는 뜸부기는 배우체 세대가 없는 복상의 생활사 형태만을 가지고 있어서, 수정이 몸의 외부에서 일어나므로 유배의 방출(Peason et al., 2004)과 배형성(Bogaert et al., 2013), 극성(Kropf et al., 1999; Peters and Kropf, 2010)과 비대칭 세포분열(Peters et al., 2008; Hable and Hart, 2010) 등 분야에서 오랫동안 세포생물학 연구의 좋은 모델 생물이 되어왔다(Nagasato et al., 2010). 그러나 녹조류의 파래류, 갈조류의 미역 및 다시마류와 같이 다량의 유주자를 방출함으로써 대규모의 양식 또는 자연군락을 용이하게 형성할 수 없다는 생식 특성 때문에 뜸부기의 인공적인 대규모 양식 및 자연군락 조성에 어려움이 있다.
뜸부기에 대한 국내의 연구결과로는 분류 및 분포(Song et al., 1996), 배의 형태형성(Yoon et al., 1994), 발생형태학적 연구(Yoon and Sho, 1998) 및 양식학적 연구(Gong et al., 1999) 등이 이루어졌으나, 뜸부기 자연군락 개체군의 생장과 성숙주기를 상세히 밝히기 위한 연구는 거의 없는 실정이다.
따라서 이 연구에서는 육지와 인접한 진도 연안에 서식하는 뜸부기 자연개체군의 생태학적 시계열성 연구를 통한 뜸부기의 생장과 성숙주기를 정확히 밝힘으로써, 보호대상종인 뜸부기의 인위적인 증식 및 자연개체군의 효율적인 보호와 보전 관리의 과학적 근거를 마련하고자 하였다.
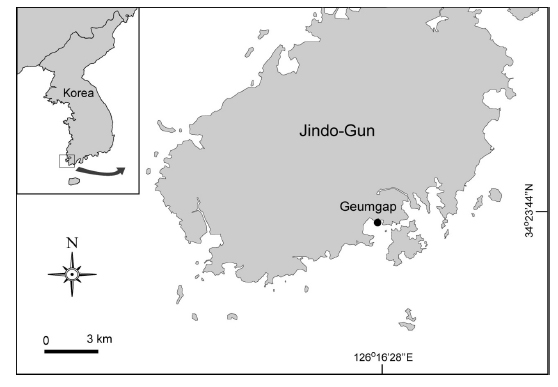
뜸부기의 분포는 뜸부기가 주로 서식하는 진도군 진도읍 금갑 해변의 조간대 암반지역을 대상으로 정성 및 정량조사에 의해 실시하였다(Fig. 1). 서식지의 환경은 수온, 염분, 전기전도도 및 용존산소를 YSI-85 (YSI Inc., USA)로 매월 정성조사시 현장에서 측정하였다.
뜸부기의 생장 및 성숙 주기는 2013년 1월부터 12월까지 매월 간조시 25×25 cm 방형구법을 통한 정량조사법으로 실시하였으며, 시료는 최소한 3개 이상의 방형구내에 분포하는 뜸부기의 엽체를 전량 채취하였다. 현존량 분석은 방형구별 뜸부기의 출현 개체수 및 중량을 단위면적당 습중량 및 밀도로 환산하였다.
채집된 뜸부기 엽체의 형태 형질은 시료를 실험실로 옮겨 엽장, 엽폭 및 엽중량 등 생장도와 생식기 가지의 형성률을 분석하였다(Figs. 2-4). 생식기 가지의 형성률은 Fig. 2와 같이 뜸부기 엽체의 생식기 가지 형성 유무 확인과 생식기 가지 형성 개체의 출현비율을 월별로 측정하여 분석하였다.
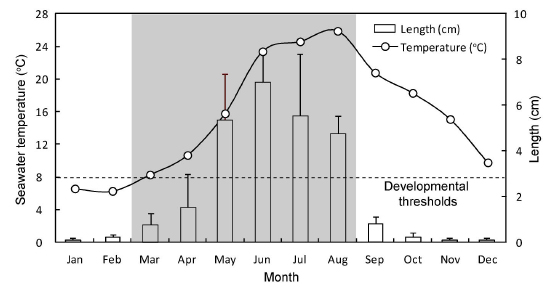
뜸부기의 성숙 유효 적산온도 추정은 생장 자료를 근거로 하여 뜸부기의 생물학적 영점온도를 8℃로 설정하였고(Fig. 5), 조사지점의 표층수온 측정치와 진도 지역의 연안수온 관측치 (2012년부터 2014년까지 3개년 동안 뜸부기의 주생장기인 3월부터 5월까지의 누적치를 평균한 값, Table 1)을 근거로 하여 1일 평균 생육수온에서 성숙 유효 하한수온(8℃)을 뺀 값을 누적시켜 구하였다(Hwang et al., 2010).
Morphological data of Silvetia siliquosa at the natural population in Geumgap, Jindo-gun, Korea from January to December 2013
뜸부기 생장 자료의 통계 분석은 분산분석법(one-way ANOVA)을 이용하여 실시하였으며, 통계프로그램은 SPSS ver 8.0과 SYSTAT ver 9.0을 이용하여 유의수준 0.05 수준에서 이루어졌다.
뜸부기는 진도군 진도읍 금갑해변의 조간대 암반지역에 주로 분포하고 있었다. 조사지역에서 뜸부기 개체군이 분포하는 면적은 약 10 ha로 추정되는 지역에서 엽체들이 분산된 작은 패치(patch)를 형성하여 서식하고 있었다(Fig. 1). 현재까지 알려진 뜸부기의 분포지역은 우리나라의 경우 흑산도, 추자도와 진도 등 일부 도서지역(Gong et al., 1999)에서 군집이 발견되었으나, 육지에 인접한 지역에서 뜸부기가 군집을 형성하는 곳은 매우 드물다. 뜸부기가 분포하는 지역은 암반지역으로 투명도가 높으며, 외양역에 면해 조류 소통이 원활한 지역인 것으로 분석되었다.
뜸부기 서식지의 환경조사 결과 수온은 6.3-25.9℃였으며, 2월에 가장 낮고 8월에 가장 높았다. 염분 농도는 31.7-34.3 psu 범위였으며, 용존산소 농도는 6.1-10.7 mg L-1, 그리고 전기전도도는 34.7-50.8 ms 범위였다.
진도 금갑 해변의 서식지 저질은 폭넓게 발달된 암반지역이며, 돌김류, 파래류, 풀가사리류, 톳, 지충이와 패 등 다양한 해조류 군락이 발달된 지역이다(Fig. 3).
조간대에서 해조류의 서식 위치는 종종 적정 서식대에 분포하는 종들의 상호경쟁에서 생장, 생존 및 생식에 영향을 미치게 되는데(Wright et al., 2004), 이러한 미세한 환경구배는 특히 조간대에 서식하는 해조류에서 나타나는 현저한 서식 지역별 형태변이의 원인이 되기도 한다(Fowler-Walker et al., 2006, Hays, 2007). Kang (1968)과 Song et al. (1996)이 보고한 바와 같이 뜸부기는 조간대의 암상에 군락을 이루는 해조류로 체형의 변화가 커서 다양한 생육형이 존재한다고 하였다. 뜸부기의 서식환경에 따른 체형변화에 관해서도 보다 심도있는 연구가 필요할 것으로 판단된다.
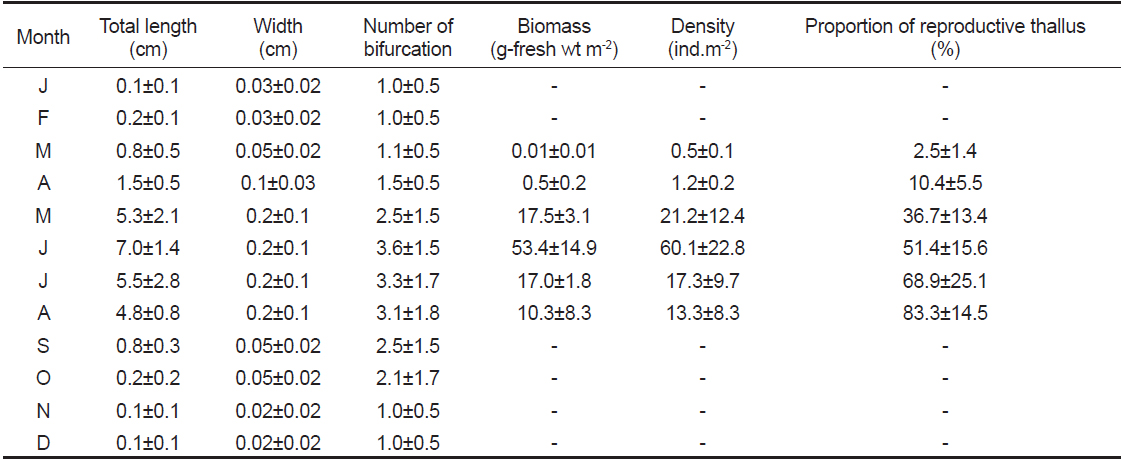
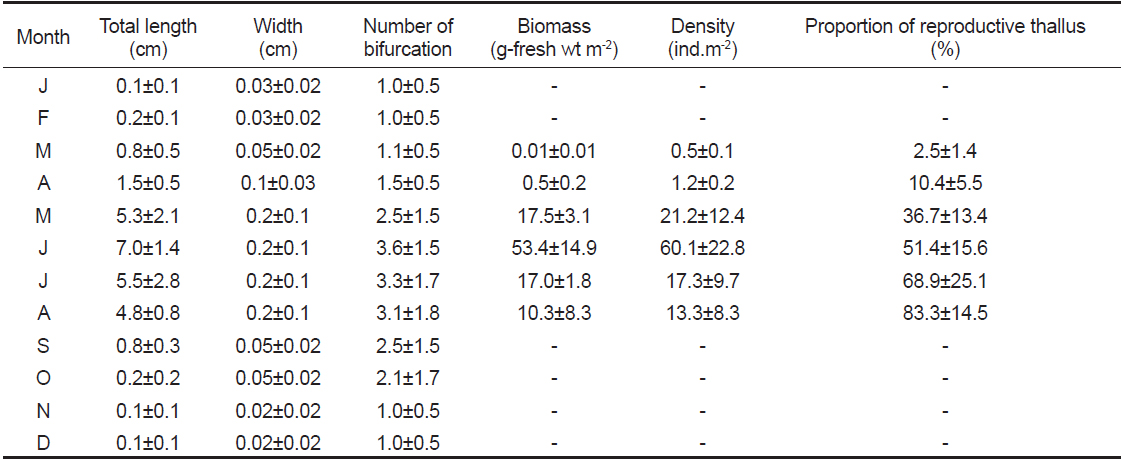
뜸부기의 엽장(Table 1)은 수온이 8℃이상으로 증가하기 시작하는 2013년 3월부터 빠른 신장이 이루어져, 수온 23℃인 6월에 7.0±1.4 cm (mean±SD)로 최대생장을 나타내었고, 이후 점차 감소하기 시작하여 9월이후에는 대부분의 엽체가 소실되고 주지의 일부와 가근 부분만 남아 겨울을 보내는 것으로 관찰되었다(Fig. 3B). 엽폭(Table 1)은 주생장 시기인 3월부터 8월까지 0.05±0.02~0.2±0.1 cm로 유의한 차이를 보이지 않았다. 분기 수(Table 1) 역시 1.0±0.5~3.1±1.8회로 생장초기인 1-2월과 엽체 소실기인 9-12월을 제외하면 유의한 차이를 보이지 않았다.
뜸부기의 단위면적당 현존량(Table 1)은 수온10℃이상으로 상승하기 시작하는 4월부터 점차 증가하기 시작하여 6월에 53.4±14.9 g-fresh wt m-2로 최대치를 보였고, 이후 점차 감소하여 9월 이후에는 엽체의 형태를 인지할 수 없을 정도로 소실되었다. 단위면적당 개체수(Table 1)도 6월에 60.1±22.8 개체 m-2 로 가장 많았으며, 이후 점차 감소하였다.
Song et al. (1996)은 충남 태안에 분포하는 뜸부기 엽체의 형태 분석을 통해, 뜸부기는 연중 서식하며, 길이생장과 현존량은 8월(수온26℃)에 최대를 보인다고 하였다. 또한 Gong et al. (1999)은 전남 해남군 송지면 갈산리 지역의 자연개체군에서7월(수온 23.0℃)에 뜸부기의 엽장이 최대에 도달하였다고 보고하였다. 그러나 본 연구결과에서는 수온 23℃인 6월에 엽장과 현존량이 모두 최대치에 도달하여, 서식지의 환경조건에 따라 최대 생장에 도달하는 시기에는 차이가 있는 것으로 나타났다. 이와 같은 결과는 뜸부기가 서식환경에 따라 엽체의 생장특성을 달리한다는 것으로, 뜸부기 자연군락의 보호, 육성, 이용, 관리 등의 양상과 시기가 서식지 환경에 따라 세심하게 관리되어야 한다는 것을 의미한다.
미역이나 다시마류의 분포 및 생물량은 일반적으로 수온에 따라 매우 다른 양상을 보인다(Kirihara et al., 2006). 즉, 22℃ 또는 그 이상의 수온 조건에서 성숙 또는 생물량이 증가하는 해조류 종류로는 미역, 넓미역, 곰피 등이 있으나 대부분의 다시마류는 20℃ 이하의 수온 조건하에서 성숙된다(Kirihara et al., 2006)는 것이다. 뜸부기의 성숙시기에 관하여 Song et al. (1996)은 연중 생식기 가지의 형성을 보인다고 하였으나, 본 연구 결과에서는 생식기 가지의 형성이 3월부터 8월까지 나타났으며, 그 외의 시기에는 엽체의 일부만이 남아 있는 상태였다(Fig. 4).
즉, 뜸부기가 생식기가지를 형성하고 생식기집을 성숙시켜 유배를 방출시키는데 요구되는 수온은 25℃ 이상으로 미역이나 다시마류의 성숙과 유주자 대량방출을 위한 수온 조건 20-22℃보다 상대적으로 높았다. 이는 뜸부기가 자연군락에서 자연적으로 성숙을 위한 누적적산수온의 측면에서도 많은 시간을 요할 뿐만 아니라 유배의 방출도 주로 대조기로 제한되어 단속적으로 이루어지므로 대량 번식에 불리한 측면이 있는 것으로 추론할 수 있다.
본 연구에서 생식기 가지를 형성한 뜸부기 성숙 엽체의 출현비율은 3월(수온 8.3℃) 이후 8월(수온 25.9℃)까지 지속적으로 증가하는 경향을 나타내었다. 생식기가지의 형성비율은 8월에 83.3±14.5%로 최대값을 보였으며(Fig. 4, Table 1), 이후에는 점차 유배의 방출 및 수온 상승에 따른 엽체의 소실 때문에 감소하여 9월에 엽체의 대부분이 거의 소실되는 경향을 보였다.
적산온도(accumulated temperature)의 개념은 Boussingault (1837)에 의하여 처음 제시되었는데, 곡물의 생장시 개화부터 성숙시기까지 소요되는 총 온도(기온)의 합을 측정하는 것이다. 후에 이 개념은 Candolle (1855)에 의해 식물지리학에 도입되었으며, 1978년 영국의 농업 기상학에도 적용(Gregory, 1954)되기 시작하였다. 해양은 육상에 비교하여 온도의 변화가 매우 안정적이라 할 수 있으므로, 생물의 발달과 성숙에 미치는 온도의 영향은 육상의 그것보다 매우 중요한 요인이 된다. 따라서 전복과 어패류 등의 성성숙시 적산수온이 매우 중요하게 작용하며, 적산수온을 계산할 때 생물학적 영점온도(biological minimum temperature)의 적용이 필요하다. 생물학적 영점온도는 발생이 정지하는 기초수온을 나타낸다(Chang et al., 2000).
Chen et al. (1970)은
해조류의 경우 종별 생장과 성숙 등 각 발달 단계에 요구되는 누적온도의 총합은 항상 일정하며, 그 총합은 온도와 시간의 조합으로 나타낼 수 있다(Baskerville and Emin, 1969; Allen, 1976). 뜸부기의 경우 야외 개체군 조사에서 생물학적 영점온도는 8℃로 추정되었으며(Fig. 5, Table 2), 성숙유효 적산온도 약 196 degree-days가 경과되면 자연 상태에서 뜸부기 엽체가 생식기가지를 형성하는 것으로 추정되었다. 이는 Hwang et al. (2003)이 옥덩굴 개체군의 성숙유효 적산온도를 270 degreedays로 보고한 것과, Hwang et al. (2010)이 넓미역 개체군의 성숙유효 적산온도를 236 degree-days로 보고한 것 보다는 비교적 짧은 것으로 나타났다. 이러한 차이는 해조류의 종별 생리 생태학적 특성 차이에서 기인된 것으로 보인다.
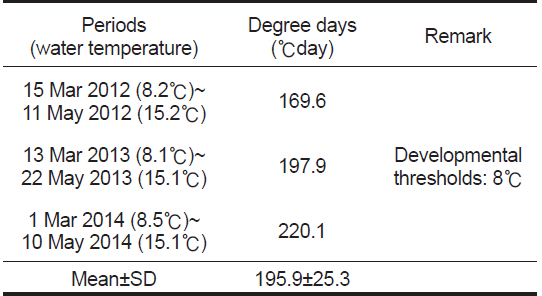
Calculation of degree-days for maturation of Silvetia siliquosa at the natural population in Geumgap, Jindo-gun, Korea from December 2012 to May 2014
이 논문에서는 전남 진도 금갑해변에 서식하는 보호대상 해조류인 뜸부기의 생장과 성숙주기를 밝힘으로써 뜸부기 자연자원의 보호와 효율적인 이용을 위한 필수적인 자료를 제공하고자 하였다. 또한 유용 수산자원인 뜸부기의 생태학적 특성을 이용하여, 양식을 통한 자연군락 보존과 이용에 효과적으로 활용될 수 있을 것이다.