미세 사상형 조류는 암반은 물론 다른 생물 표면 또는 내부에서 각각 착생해조(epiphytes)와 내생해조(endophytes)로 서식한다(Correa et al., 1994; Correa, 1997). 많은 미세 사상형 조류는 크기가 큰 숙주(host)의 내부에 깊숙이 박혀 생활하고 있으며, 이 내생조류는 숙주와 공생의 한 형태로 생활한다고 인식되고 있다(Lewis, 1973; Goff, 1982; Douglas and Smith, 1989; Ganuna and Parodi, 2008). 이중 특히 미세 사상형 갈파래과 분류군은 대략 109종이 AlgaeBase에 보고되어 있으나(Guiry and Guiry, 2015), 동정이 쉽지도 않고, 연구도 미흡하여 실질적인 종다양성은 이보다 높을 것으로 예상된다. 일반적으로 미세 사상형 내생조류는 대부분 숙주에 해를 끼치지 않거나 또는 그들의 숙주를 약간만 변형시켜 영향을 주지 않지만, 일부 종들은 숙주 내부에 종양과 같은 병변을 일으켜 다른 해조류 또는 산호의 병원균이 되기도 한다고 알려져 있다(Andrews, 1977; Yoshida and Akiyama, 1979; Nielsen and McLachlan, 1986a, b; Peters, 1991; Correa et al., 1994; Correa, 1997).
특히 상업적으로 유용한 해조의 경우에는 내생조류가 숙주의 생물량과 품질에 영향을 끼칠 수가 있는데, 북미와 유럽에서 유용종으로 활용되고 있는 홍조 진두발류(Chondrus crispus)에서는 Ulvella, Phaeophila, Bolbocoleon속(genus)에 속해 있는 내생녹조들이 숙주에게 심한 병변과 세포적 손상을 끼친다고 보고 되었다(Correa et al., 1988; Correa and McLachlan, 1991, 1992). 또한 유용 갈조류 미역(Undaria pinnatifida)은 내생갈조(e.g. Streblonema)에 의해 조직이 두꺼워 지고(Yoshida and Akiyama, 1979), 다시마류 일종인 Laminaria hyperborea의 경우에는 내생갈조에 의해 심하게 감염되어 숙주해조의 상업적 가치를 떨어뜨리기도 한다(Lein et al., 1991).
그러므로 해조양식이 많이 이루어지고 있는 아시아 지역에서는 양식 해조류에 대한 질병 감염에 다소 민감하다(Cragie and Correa, 1996). 따라서 대규모 해조양식이 행해지고 있는 우리나라의 경우에는 내생조류에 관한 연구가 반드시 필요한 실정이지만 아직까지 한국산 내생조류에 관한 연구는 미미하다. Ulvella속(genus)의 한 종인 한국산 가지녹실딱지(Ulvella viridis =as Entocladia viridis)는 이미 Lee et al. (1998)에 의해 확인되었지만, 이 종은 홍조 왜비단잘록이(Griffithsia japonica) 엽체 위에서 서식하고 있는 착생해조로서 보고되었을 뿐이다. 최근 Lee et al. (2013)은 한국산 진두발(Chondrus ocellatus) 엽체의 내부에 Ulvella sp.가 서식하고 있음을 최초로 보고하였다. 그 후 Kim et al. (2014)은 도박류(Grateloupia spp.) 엽체 내부 에 내생조류가 서식하고 있음을 확인하였고, 숙주로부터 이를 분리 배양하여 이들 종이 Blastophysa rhizopus, Bolbocoleon piliferum, Ulvella leptochaete임을 밝혀서 한국산 미기록종으로 보고한 바 있지만 이 내생조류들의 분류와 형태학적 특징을 제외하고는 다른 정보가 거의 없다.
따라서 본 연구는 지금까지 수행되지 않았던 한국산 내생녹조류의 생장과 숙주에 대한 감염에 있어 빛과 온도의 영향을 밝혀 차후 유용해조의 내생조류 감염에 관한 중요한 정보로 활용될 수 있는 기초적 자료를 확보하고자 시도되었다.
본 연구에 사용된 내생녹조류의 숙주인 가는개도박(Grateloupia lanceolata)은 2013년 8월에 제주시 도두동(33°32'N, 126°28'E)의 조하대 5 m 수심에서 채집되었다. 가는개도박의 엽체로부터 내생조류의 감염이 의심되는 반점 부분을 Cork borer (직경 2.5 cm)를 이용하여 도려내고, 이 부분을 멸균해수와 붓을 이용하여 수 회 깨끗이 씻어낸 후, 30 mL의 PES배지가 담긴 용기에서 20℃, 100 µmol m−2s−1 , 16:8 h LD 광주기 조건에서 배양하였다. 규조류의 번식을 억제하기 위해 배양액에 산화게르마늄 5 mgL−1을 첨가하였으며, 매 5일마다 배지를 전량 교체하였다. 2주 후 내생녹조류가 숙주 엽체 밖으로 나오면 이 내생녹조류의 일부를 떼어내어 새로운 배양 용기에 옮겨서 배양하였다. 이 과정을 수 회 반복하여 오염되지 않은 단일 종의 내생녹조류 세 종, U. leptochaete, B. piliferum, B. rhizopus을 얻었다. 빛과 온도에 대한 생장 반응 실험을 위하여 분리된 세종의 내생녹조류 2 g을 각각 멸균해수 10 mL에 넣고 믹서기로 30 초간 분쇄하여 균질화시키고, 용액 1 mL씩을 뽑아 20 mL의 PES배지에 넣어 배양하였다. 실험은 6개의 온도(9, 13, 17, 21, 25, 29℃), 2개의 광도(60, 100 µmol m−2s−1)를 조합한 배양기에서 총 21일 동안 수행되었다. 이때 염분은 34 psu였고, 광주기 16:8 h LD이었으며, 매 3일마다 PES배지를 전량 교환하여 주었다. 내생조류의 생장은 각 조건마다 매 3일 간격으로 광학현미경(Leica DM LB, Germany) 하에서 현미경 사진촬영장치로(Q imaging Micropublisher 5.0RTV camera, Canada) 촬영한 후, Image J 프로그램(1.4s, National Institute of Health, Bethesda, USA)을 이용하여 길이를 측정하였는데, 사상형 엽체 가지의 길이를 모두 합하여 산출하였다. 각 실험구별로 내생녹조류 30개체의 길이를 측정하였으며 3개의 반복구를 두었다. 길이를 측정한 후 상대생장률(RGR, relative growth rate)은 아래의 식으로 계산하였다(Kraan et al., 2000).
RGR=100 (lnL2-lnL1) / t2-t1 L1, 실험 개시 때 엽체 길이; L2는 측정 시 엽체 길이, t1, t2는 배양일수
생장에 대한 실험 자료는 Duncan multiple range tests를 이용한 일원산분석을 통하여 분석하였고, 모든 통계분석은 SPSS 18.0을 이용하여 수행하였으며 신뢰한계 P<0.05였다.
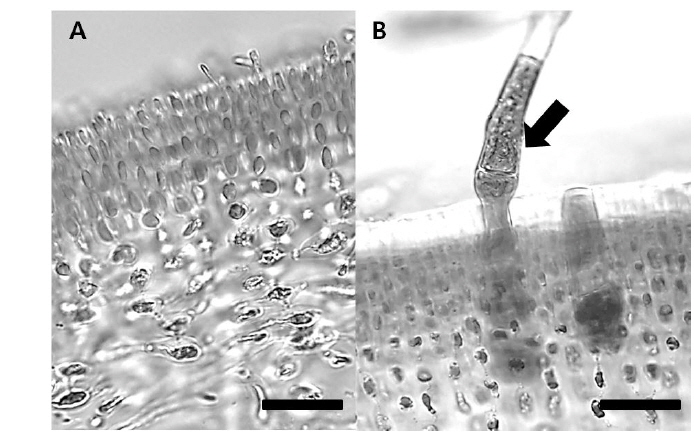
온도와 빛이 숙주의 감염에 어떠한 영향을 주는지 알아보기 위하여 생장실험에 사용되었던 세 종의 내생녹조류(U. leptochaete, B. piliferum, B. rhizopus)로 감염 실험을 수행하였다. 내생조류 감염 실험에서 감염시킬 숙주 해조류로는 녹조류 창 자파래(Ulva intestinalis), 갈조류 고리매(Scytosiphon lomentaria), 홍조류 꼬시래기(Gracilaria vermiculophylla), 진두발(Chondrus ocellatus), 참도박(Grateloupia elliptica)이 이용되었다. 녹조류 창자파래는 실험실에서 유주자를 받아 엽체로 배양한 개체를 활용하였으며, 나머지 해조류는 전남 완도 정도리 조간대에서 2014년 1월에 채집하여 실험을 수행하였다. 감염 실험에 사용된 숙주는 해부현미경 하에서 멸균해수와 붓을 이용하여 각 해조류의 정단 부분을 씻어내어 착생되어있던 생물들을 모두 제거하였으며, 실험 개시 전 미리 단면을 잘라 내생조류의 감염 여부를 확인하였다. 내생조류가 없음이 확인된 깨끗한 숙주의 정단부로부터 약 2 cm 정도의 크기로 잘라, 대조구에는 숙주 개체만, 감염 실험구에는 숙주 개체와 함께 각 세 종의 내생녹조 2 g을 멸균해수 10 mL에 넣어 믹서기로 균질화시킨 용액 1 mL씩 넣고 각각의 20 mL의 PES배지에 넣어 배양하였다. 실험에 사용된 숙주 개체는 각 실험구마다 5 개체씩이었으며, 3개의 반복구를 두었다. 감염 실험은 4개의 온도(10, 15, 20, 25℃), 2개의 광도(60, 100 µmol m−2s−1) 조건하에서 수행하였으며, 염분은 34 psu, 광주기는 16:8 h LD 조건을 유지하였다. 실험 개시 15일 후에 각 실험구로부터 숙주 해조류를 3개체씩 꺼내어 면도날로 절편을 제작, 각 숙주의 단면을 확인하여 숙주 내부에 내생해조의 감염 여부를 확인하였다.
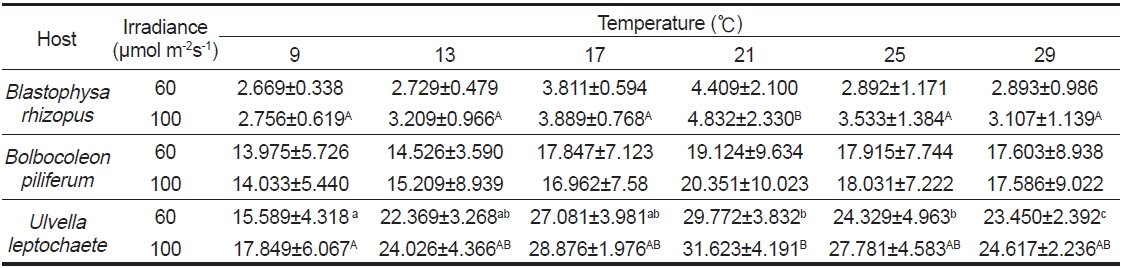
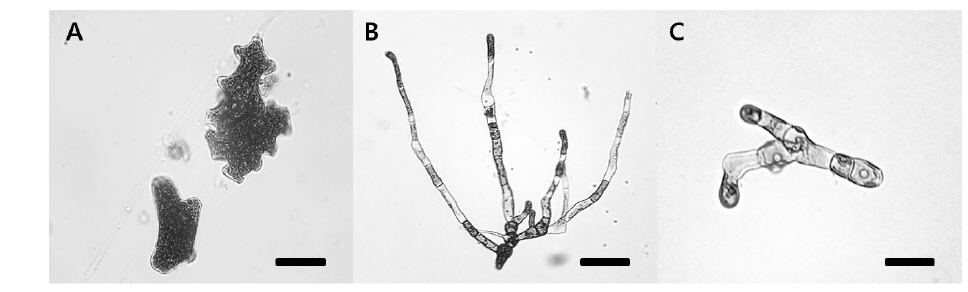
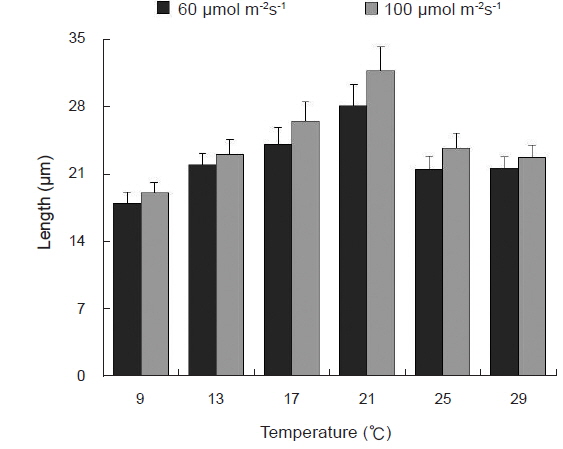
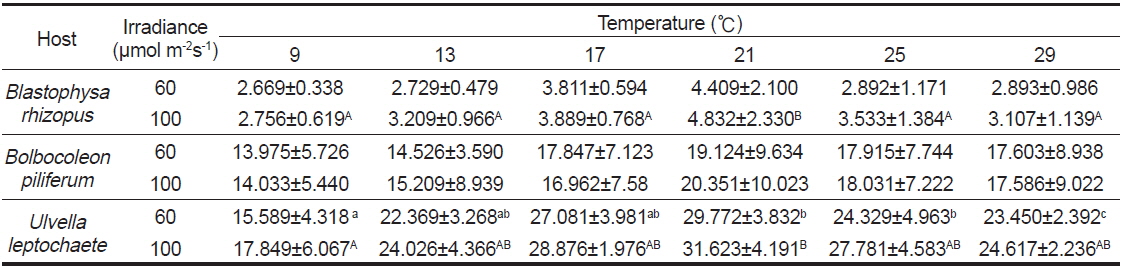
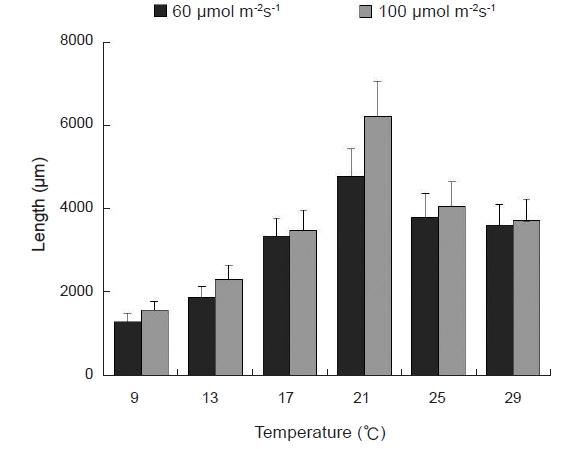
Blastophysa rhizopus의 사상형 세포는 길이가 53.8±22.2 μm, 너비가 10.0±3.8 μm이며 구형에서부터 튜브 형태까지 다양하며, 다른 두 종의 내생해조와는 형태가 뚜렷이 구별된다(Fig. 1A). 이 종은 배양 21일 후 60 µmol m−2s−1 조건에서 온도에 따른 엽체 길이는 17-28 µm 범위였으며, 21℃에서 최대, 9℃에서 최소였다. 100 µmol m−2s−1 조건에서도 각 온도에 따라 19-32 µm 범위로 생장하였고, 최대값과 최소값을 보인 온도는 각각 21℃와 9℃로 60 µmol m−2s−1 조건과 동일하였다(Fig. 2). 모든 온도 조건에서 초기 길이[9.28±0.76 (mean±SE) µm]에 비하여 2-3배 정도 생장하였다. 상대생장률은 배양 21일에 60 µmol m−2s−1 조건에서 2.67-4.41%day−1으로 21℃에서 가장 높았고, 9℃ 에서 가장 낮았으나 각 온도간 생장률에 있어 통계적인 유의차는 없었다(P<0.05) (Table 1). 100 µmol m−2s−1 조건에서는 생장률이 2.76-4.83%day−1으로 역시 최대값은 21℃, 최소값은 9℃ 였고, 21℃를 제외한 나머지 값은 통계적으로 유의차가 없었다(Table 1).
Bolbocoleon piliferum은 다소 불규칙한 사상형 세포의 형태로 214.3±95.7 μm의 길이와 39.4±21.0 μm의 폭에 다소 옅은 녹색을 띠는 내생녹조이다(Fig. 1B). 이 종은 배양 21일 후 60 µmol m−2s−1 조건에서 엽체의 길이가 각 온도에 따라 38,788-143, 620 µm 범위로 생장하였고, 21℃에서 최대, 9℃에서 최소였다. 100 µmol m−2s−1 조건에서는 각 온도에 따라 46,848-187,188 µm 범위로 생장하였고, 최대, 최소값을 보인 온도는 21℃와 9℃였다(Fig. 3). 모든 온도조건에서 초기 길이 (69.02±5.91 µm)에 비하여 많은 생장을 하였다. B. piliferum의 상대생장률은 배양 21일에 60 µmol m−2s−1 조건에서 13.98-19.13%day−1으로 21℃에서 가장 높았고, 9℃가 가장 낮았으나 각 온도간 상대생장률은 통계적으로 유의한 차가 없는 것으로 확인되었다(Table 1). 100 µmol m−2s−1 조건에서는 생장률이 14.03-20.35% day−1으로 역시 최대, 최소값은 60 µmol m−2s−1 조건과 동일한 경향을 보였지만 이 역시 온도간 상대생장률은 통계적으로 유의한 차가 없었다(Table 1).
Ulvella leptochaete는 작은 사상형 세포로 길이 17.0±12.3 μm, 너비 4.5±2.0 μm로서 녹색을 띠는 내생녹조이다(Fig. 1C). 이 종은 배양 21일 후 60 µmol m−2s−1 조건에서 엽체의 길이가 각 온도에 따라 46,546-506,902 µm 범위로 생장하였는데, 21℃에서 최대, 9℃에서 최소값을 기록하였다. 100 µmol m−2s−1 조건에서는 각 온도에 따라 57,888-670,558 µm 범위로 생장하였고, 최대값과 최소값을 보인 온도는 60 µmol m−2s−1 조건과 동일하였다(Fig. 4). 이 종도 배양기간 동안 초기 길이 (42.62±3.34 µm)에 비하여 활발한 생장을 하였다. Ulvella leptochaete의 상대생장률은 배양 21일에 60 µmol m−2s−1 조건에서 15.59-29.77% day−1으로 21℃에서 가장 높았고, 9℃ 순으로 낮아졌는데, 다른 종과 다르게 온도에 따른 생장률에 있어 통계적인 유의차를 보였다(Table 1). 100 µmol m−2s−1 조건에서는 생장률이 17.85-31.62%day−1으로 역시 생장률의 최대값과 최소값은 각각 21℃, 9℃를 기록했지만 온도에 따른 통계적 유의차는 없었다.
감염 실험 개시 후 15일 후에 대조구와 감염 실험구를 관찰한 결과 대조구에서는 내생해조가 관찰되지 않았지만 감염 실험구에서는 내생해조가 관찰되었다(Table 2, Fig. 5). 특히 U. leptochaete는 5개의 모든 숙주에서 감염이 확인되었다. 꼬시래기와 진두발 실험구에서는 U. leptochaete을 제외한 다른 두 내생해조를 관찰할 수 없었고, 고리매 실험구에서는 B. rhizopus를 숙주 내부에서 관찰할 수 없었다. 참도박 실험구에서는 세 종의 내생해조가 숙주에 모두 감염되었다. 그러나 두 조건과 10℃로 조합된 실험구의 경우 숙주 5종 모두에서 어떠한 내생해조도 관찰할 수 없었다.
내생조류에 대한 연구는 확인과 동정의 어려움으로 인해 그리많지 않으며, 이 내생조류의 생장에 관한 연구는 더욱 빈약한 실정이다. 대부분의 연구가 내생조류의 분류나 계통발생학적인 연구에 집중되어있고(O’kelly et al., 2004; Rinkel et al., 2012; Nielsen et al., 2013, 2014), 각 내생조류와 숙주인 각 해조류와의 상관관계를 밝히려는 연구들이다(Correa et al., 1988; Correa and McLachlan, 1991, 1992, 1994; Lein et al., 1991; Sánchez et al., 1996; Del Campo et al., 1998; Gauna and Parodi, 2008).
Blastophysa rhizopus는 중남미(Ballantine and Wynne, 1986; Villaca et al., 2010), 유럽(Brodie et al., 2006; Guiry, 2012), 호주(Bostock and Holland, 2010), 일본(Iima and Tatewaki, 1987)등 많은 지역의 다양한 숙주에 서식하고 있음이 보고되었지만, 이 연구들 대부분이 단순한 출현종 목록 또는 분포론적인 연구이다. Iima and Tatewaki (1987)는 홍조 미끌도박(Grateloupia turuturu) 엽체 내부에 일본산 B. rhizopus가 서식하고 있음을 보고하면서, 생활사와 숙주 특이성에 대한 연구를 수행하였다. 그들의 배양실험 결과 이 종은 18-22℃의 온도 범위와 14:10 h LD의 장일주기 조건에서 잘 자라지만, 10-14℃의 온도 범위와 10:14 h LD의 단일주기 조건에서는 생장이 억제되고, 5℃에서는 생장이 전혀 이루어지지 않는다고 하였다. 본 연구에서는 60, 100 µmol m−2s−1 광도 조건 모두 21℃에서 생장이 가장 좋았고, 그 다음으로는 17℃이었다. 비록 일본산 B. rhizopus는 광도, 온도 등 배양 조건에 대한 정보가 부족하지만 우리의 연구와 유사한 온도 범위에서 최적 생장을 보이고 있다고 추정할 수 있다.
Bolbocoleon piliferum의 경우 배양을 통한 최적 생장 조건을 구명하는 연구는 전무하다. 이 종의 계통발생적 연구를 수행하기 위한 시료 확보 차원에서 배양이 이루어졌고(O’Kelly et al., 2004), 최적의 생장 배양 조건이 아닌 간단한 온도 및 광도 조건만이 제시되었다. O’Kelly et al. (2004)은 미국산 갈조류 다시마목과 해조 Cymathaere triplicate에 내생하고 있는 B. piliferum을 연구하면서 18℃, 5-20 µmol m−2s−1, 12:12 h LD 광주기 조건으로 배양하였다. 또한 Kokame and Yoshida (1988)는 홍조실풀(Glosiophonia capillaris)에 내생하고 있는 이 종을 일본산 미기록종으로 처음 보고하면서, 배양은 10℃, 16:8 h LD 광주기 조건만을 언급하였다. 다양한 온도와 광도를 조합하여 배양한 실험 연구가 아니기에, 본 연구 결과와 직접적인 비교는 어렵다. 따라서 이종의 생장 최적조건에 대한 다양한 정보가 없는 상황에서 이번 연구는 차후 이종과 관련된 연구를 수행하게 될 때 기초적 자료로 활용될 수 있을 것이다.
Ulvella leptochaete가 속한 Ulvella속은 현재 48종이 알려져 있어(Guiry and Guiry, 2015), 다른 두 속에 비하여 그 다양성이 높은 편이다. 그렇지만 많은 연구가 분류와 계통발생학적인 연구이고(Rinkel et al., 2012; Nielsen et al., 2013, 2014), 유용종인 서구산 주름진두발(Chondrus crispus)과 Ulvella (as Acrochate) 종의 감염 종, 숙주 특이성, 미세구조 등에 관한 연구들이다(Correa et al., 1988; Correa and McLachlan, 1991, 1992, 1994). 다른 두 종에 비하여 상대적으로 많은 연구가 수행되었음에도 Ulvella속 종의 생장에 대한 정보는 빈약한 편으로, B. piliferum처럼분류학적 연구를 수행하기 위한 시료 확보 차원에서의 배양 조건만을 제시한 경우가 많았다(Rinkel et al., 2012). Deng et al. (2011, 2012)은 염주말류(Chaetomorpha)에 착생했던 U. leptochaete (as Acrochate leptochaete)을 중국에서 처음으로 보고하면서 다양한 온도와 광도를 조합하여 배양 실험을 수행하였다. 그들의 실험에 의하면 17℃, 36 µmol m−2s−1, 10:14 h LD 조건에서 생장이 가장 좋았다. 최적 생장 온도에 있어 Deng et al. (2012)의 17℃와 본 연구의 21℃와의 차이는 우리 연구의 일부 실험구에서 통계적 유의차가 없는 경우도 있었기에 비교적 큰 차이가 없는 것으로 판단된다. 광도에 있어서 Deng et al. (2012)은 36 µmol m−2s−1에서 72, 108 µmol m−2s−1으로 증가함에 따라 오히려 생장이 더욱 감소하였다고 한 점은 다소 이례적인 결과로 판단된다. 비록 이번 연구에서 30 µmol m−2s−1 광도에서의 실험은 수행되지 않았지만 60 µmol m−2s−1에서 보다는 100 µmol m−2s−1조건에서 생장률이 유의하게 증가하였으므로 Deng et al. (2012)의 연구와는 매우 상반되었다 할 수 있다. 차후에 이러한 결과가 서식지역, 착생과 내생해조, 구체적 실험 방법의 차이인지는 보다 정밀하게 구명해봐야 될 것으로 판단된다.
감염 실험 결과 U. leptochaete는 5종의 모든 숙주 내부에서 발견되어 가장 쉽게 숙주에 감염 가능한 내생해조로 확인되었다 U. leptochaete는 지금까지 보고된 많은 연구에서도 다양한 숙주에서 발견되었다(Deng et al., 2012; Nielson et al., 2014; Kim et al., 2014). 따라서 아직까지 이 종이 발견된 한국산 숙주해조는 불과 수 종밖에 되지 않지만 차후 지속적인 내생해조 연구를 수행한다면, 보다 많은 숙주해조가 발견될 것으로 예상된다. 또한 다양한 온도와 광도의 조합 실험구중 온도 10℃ 조건에서는 5종의 숙주 모두에서 어떠한 내생해조도 관찰되지 않았다. 생장 실험에서 내생해조 3종 모두 비록 높은 온도에 비교해서는 생장이 느렸지만, 9℃에서도 여전히 사멸되지 않고 생장되었기에 낮은 온도가 내생조류 감염을 저해하는 절대적인 요인이라고 단정짓기는 어려울 것으로 판단되며, 장차 야외 개체군에서 수온, 숙주와 내생해조의 감염률 차이를 확인해보아야 보다 더 명확한 해답을 얻을 수 있으리라 생각된다.
아직까지 선행된 한국산 내생해조의 종류, 생태학적, 생리학적 자료가 많지 않아 이번 연구와 비교 고찰하기가 쉽지 않았다. 그러나 이번 연구가 한국산 내생해조에 대한 기초적 자료가 될 것이라 기대하며, 향후 이 자료가 더욱 축적된다면 우리가 보다 더 관심 갖고 있는 유용 해조류의 내생해조 연구에도 많은 도움이 될 수 있으리라 예상한다.