양어사료에서 단백질원료의 사용 비율은 매우 높으며, 이는 양어사료의 품질과 가격을 결정짓는 중요한 요인으로 작용한다. 어분은 높은 수준의 단백질과 우수한 아미노산 조성을 가지고 있는 주요 단백질 사료원료로 특히 육식성 해산어류의 사료내 첨가 비율(50-70%)이 매우 높다. 따라서 어획량 감소에 의한 가격상승으로 양어사료 내 어분을 대체할 수 있는 사료원료 개발에 대한 관심이 부각되고 있다(Yang et al., 2011; Song et al., 2014). 대두박은 다른 식물성원료와 비교하여 상대적으로 높은 단백질 함량과 우수한 아미노산 조성을 가지고 있으며 어분에 비해 가격이 저렴하여 가장 효율적으로 어분을 대체할 수 있는 것으로 알려져 있다(Storebakken et al., 2000; Leenhouwers et al., 2006; Gatlin et al., 2007). 하지만 대두박에는 영양소의 소화와 흡수를 저해시키는 protease inhibitor, tannins, lectins 및 non-starch polysaccharides와 같은 항영향인자(antinutritional factors, ANF)를 포함하고 있어 어류의 성장에 부정적인 영향을 미침으로써 양어사료원료로서의 사용에 많은 제약이 따른다(Francis et al., 2001). ANF는 열처리, 용매추출 또는 생물학적처리(bioprocess) 등을 통해 함량을 낮추고 제거하거나 불활성화시킬 수 있다(Rumsey et al., 1994; Buttle et al., 2001;Refstie et al., 1998, 2005). 최근에는 대두박의 어분대체 효율을 높이기 위해 대두박에 별도의 가공처리를 하여 이용성을 높이는 연구가 수행되고 있다. 분리대두단백(soy protein isolates, SPI), 농축대두단백(soy protein concentrates, SPC), 고단백대두박(high protein soybean meal, HSB)은 주요 대두가공품(soy products)으로 주목 받고 있다(Chou et al., 2004; Glencross et al., 2005). 이와 같은 대두가공품은 상대적으로 높은 단백질과 낮은 탄수화물 및 섬유소를 함유하고 있어 다른 식물성 사료원료에 비해 이용성이 높은 것으로 알려져 있다(Ao, 2011; Cavins et al., 1972).
산 가수분해 농축대두박(acid-concentrated soybean meal, ACSBM)은 어분대체 효율 및 생체 내 이용성을 높이기 위해 탈지대두박(defatted soybean meal)을 산 가수분해 방법을 통해 가공처리하여 생산되었다. 일반적으로 대두박을 열처리(steaming 및 roasting) 및 산과 알코올을 이용하여 가공처리하면 oligosaccharides, lectins, soya antigens, phytase 및 trypsin inhibitors와 같은 ANF의 함량이 감소하는 것으로 보고되고 있다(Refstie et al., 1998; Watson et al., 2014). 본 연구는 넙치 치어를 대상으로 가공처리 시킨 산 가수분해 농축대두박이 일반 대두박과 비교하여 이용성이 향상되었는지를
실험에 사용된 산 가수분해 농축대두박(단백질 67.0%, 지방 3.4%, 회분 3.5%)은 CJ 제일제당에서 제공받았다. 탈지대두박 중량에 5배의 증류수를 가수한다. 그 후 혼합하면서 1 N HCl을 첨가하여 pH 4.5 수준으로 조성하였다. 조성물을 30분간 실온에서 교반한 후 원심분리기를 이용하여 5,000
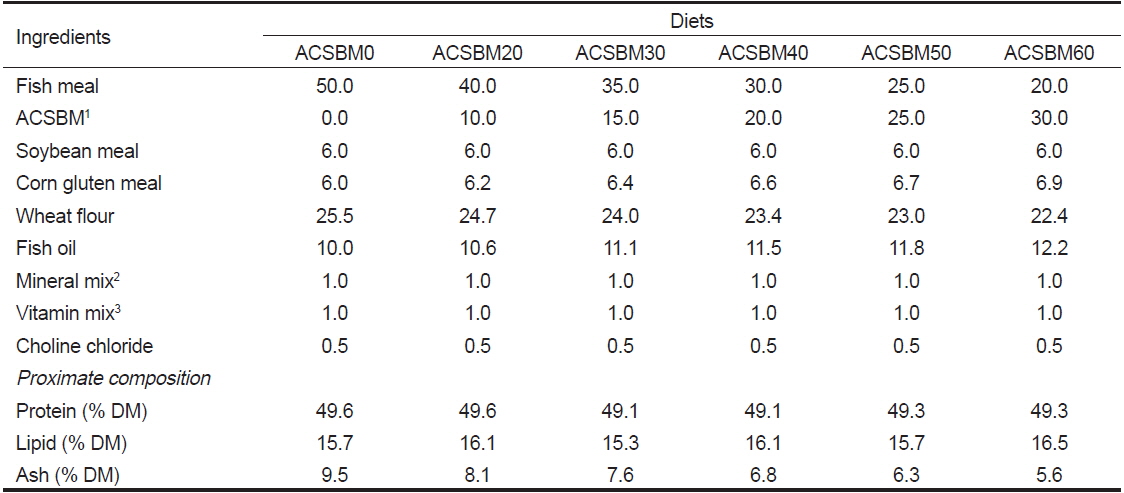
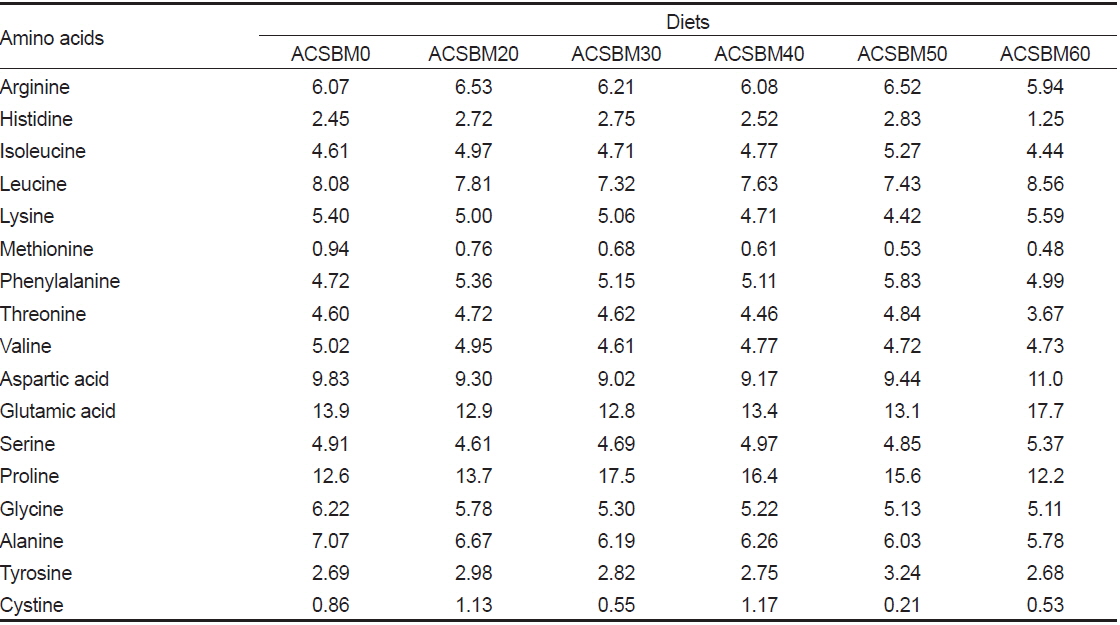
실험에 사용된 산 가수분해 농축대두박(단백질 67.0%, 지방 3.4%, 회분 3.5%)은 CJ 제일제당으로부터 제공되었다. 실험사료제작에 사용된 사료조성표와 실험사료의 일반성분은 Table 1에 나타내었으며 실험사료의 아미노산 조성은 Table 2에 나타내었다. 실험사료는 어분을 기초로 한 사료를 대조구로 하였으며 ACSBM으로 어분단백질을 20%, 30%, 40%, 50% 및 60% 대체하여 총 6개의 실험사료를 제작하였다(ACSBM0, ACSBM20, ACSBM30, ACSBM40, ACSBM50 및 ACSBM60). 실험사료는 우선 사료원들을 혼합기에 넣어 완전히 섞은 다음, 어유를 첨가한 뒤 사료원 총량의 30%에 해당하는 증류수를 첨가하여 사료혼합기(NVM-14-2P, Daeyoung, Korea)로 혼합, 반죽하였다. 혼합반죽물은 소형초파기(SMC-12, Kuposlice, Busan, Korea)를 이용하여 알맞은 크기로 뽑아내었다. 실험사료는 건조기를 이용하여 24 h 동안 건조시켜 사료 공급 전까지 −20℃에 보관하면서 사용하였다.
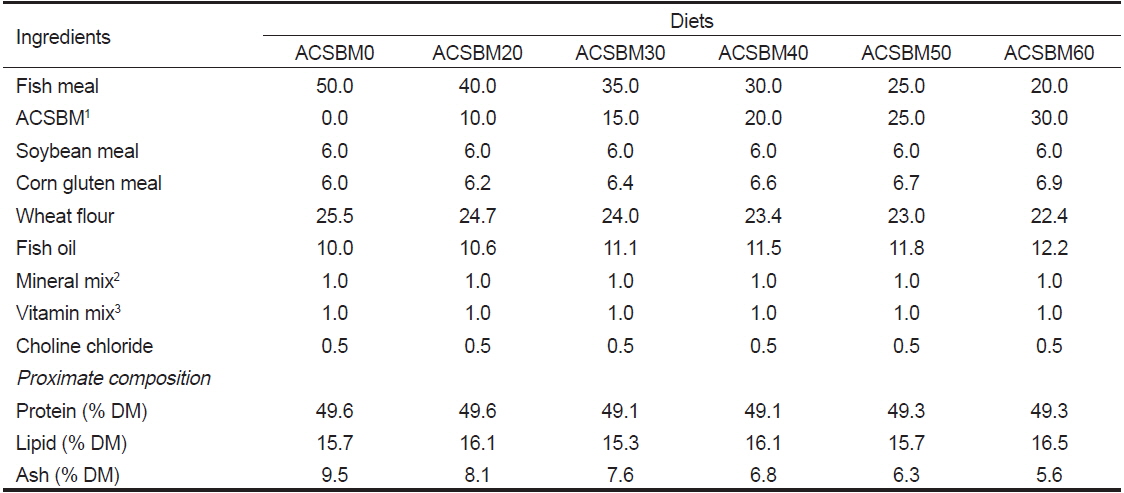
Formulation and proximate composition of the experimental diets for olive flounder Paralichthys olivaceus
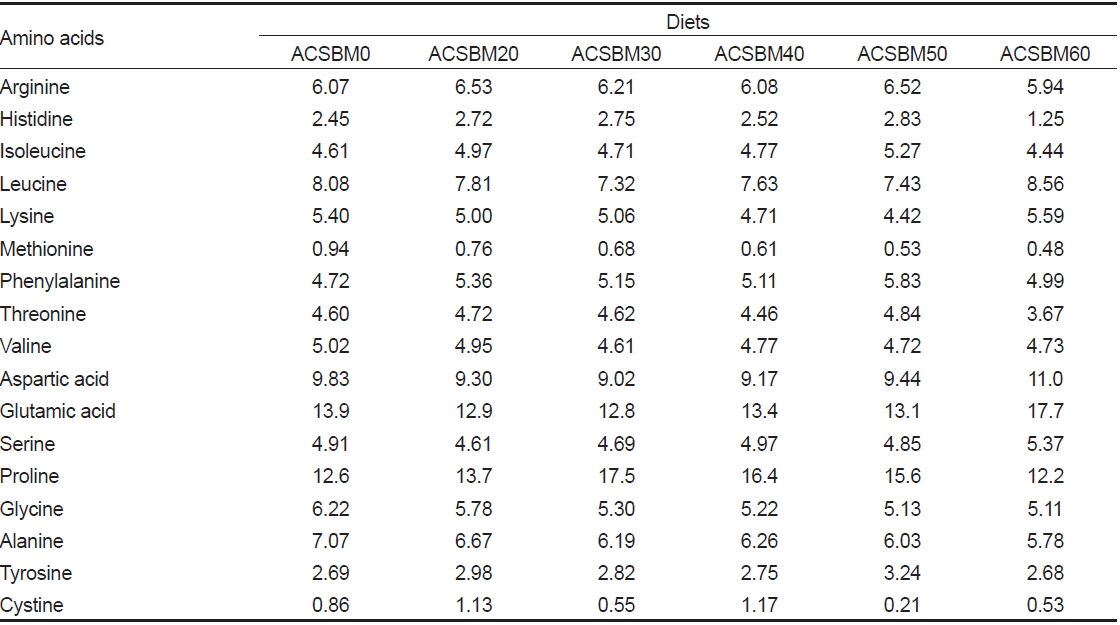
Amino acid composition (% protein) of the experimental diets for olive flounder Paralichthys olivaceus
실험에 사용된 넙치치어는 제주도내에 위치한 종묘배양장 우도수산에서 구입하여 제주대학교 소속 해양과환경연구소로 이송하였다. 실험어류는 2주 동안 시판 배합사료를 공급하면서 실험환경에 적응할 수 있도록 순치되었다. 예비사육 후 넙치(초기 평균무게: 14.3±0.03 g)는 총 18개의 150 L 원형 플라스틱 수조에 각 수조 당 40마리씩 무작위로 선택하여 배치되였다. 사육수는 모래여과해수를 사용하여 2-3 L/min의 유수량이 공급되도록 조절하였고 모든 실험수조에 용존산소 유지를 위하여 에어스톤을 설치하였다. 사육수온은 자연수온(15-22℃)에 의존하였으며 광주기는 형광등을 이용하여 12-h light/12-h dark로 유지되었으며 실험사료 공급은 1일 2회(08:00 h 및 18:00 h) 만복공급을 하였다. 어류무게측정은 매 3주마다 실시하였으며 측정 24 h 전에 실험어류의 스트레스를 줄이기 위해 모든 실험어류를 절식시켰다. 사료공급실험은 총 12주간 진행되었다.
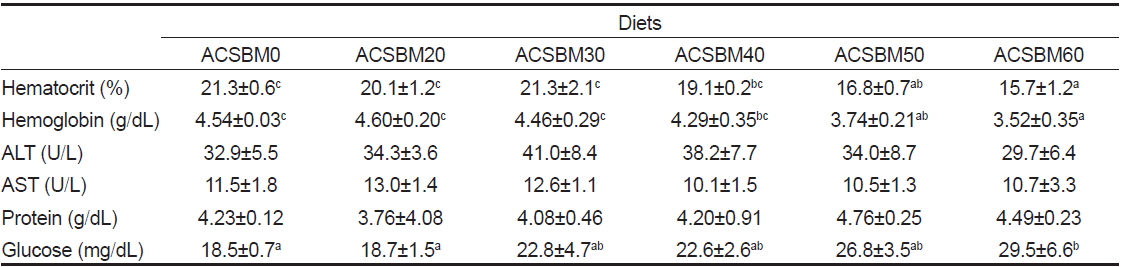
실험종료 후 실험어류의 최종 무게를 측정하여 증체율(weight gain), 일간성장률(specific growth rate), 사료전환효율(feed conversion ratio), 단백질이용효율(protein efficiency ratio) 및 생존율(survival)을 산출하였다. 최종무게 측정 후 수조당 3마리의 어류를 무작위로 선별하여 2-phenoxyethanol(200 ppm)용액으로 마취 시킨 후 헤파린 처리된 주사기를 이용하여 미부동맥에서 채혈을 하였다. 채혈된 전혈은 hematocrit, hemoglobin 분석에 사용되었다. 분석 후 남은 혈액은 원심분리기를 이용하여 혈장을 분리한 후 alanine aminotransferase(ALT), aspartate aminotransferase (AST) 분석을 실시하였다. Hematocrit은 microhematocrit technique 방법으로 분석하였으며, hemoglobin, ALT, AST, protein 및 glucose 함량은 자동 생화학 분석기(Express plus system, Bayer, USA)를 이용하여 측정하였다.
실험사료의 일반성분 분석은 AOAC (1995) 방법에 따라 수분은 상압가열건조법(125℃, 3 h), 회분은 직접회화법(550℃, 6 h), 조단백질은 자동조단백질 분석기(Kejltec system 2300, Sweden)로 분석하였으며, 조지방은 Folch et al. (1959)의 방법에 따라 Soxhlet 추출장치(Soxhlet heater system C-SH6, Korea)를 이용하여 분석하였다. 실험사료의 아미노산 분석은 Sycom S-433D automatic amino acid analyzer (Sykam, Eresing, Germany)를 이용하여 분석되었다.
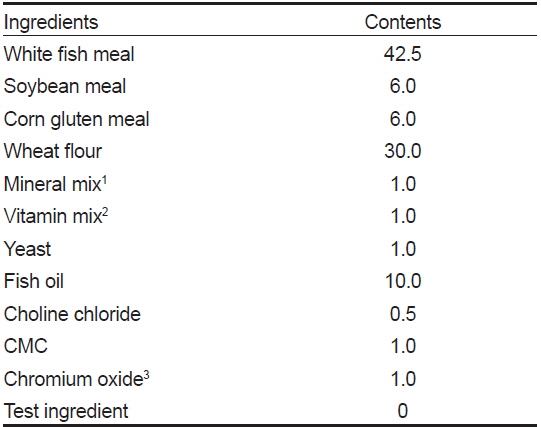
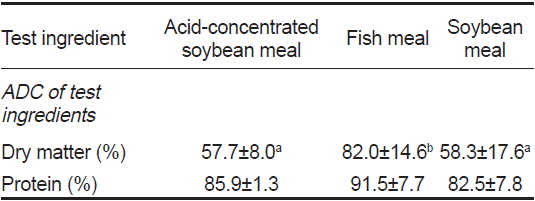
실험사료원료(산 가수분해 농축대두박, 어분, 대두박)의 외관상소화율을 조사하기 위해 실용사료원을 기초로 참고사료(reference diet)와 실험사료(test diets)를 제작하여 사용하였다. 참고사료 조성표는 Table 5에 나타내었다. 실험사료는 참고사료와 실험사료원료를 7:3의 비율로 혼합하여 제작되었다. 소화율을 분석하기 위한 지시제(indicator)로 chromium oxide (Cr2O3, Sigma-Aldrich)를 사용하였으며 참고사료와 실험사료에 각각 1.0%가 포함되도록 설계되었다.
[Table 5.] Formulation of the reference diet for digestibility test (% of DM basis)
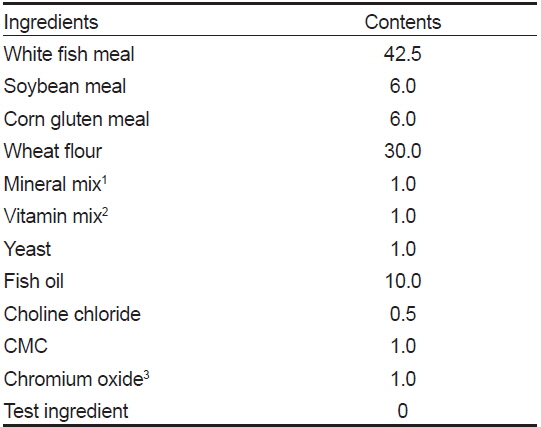
Formulation of the reference diet for digestibility test (% of DM basis)
실험어류는 2주 동안 분 수집장치(Guelph system)수조에서 참고사료를 공급하면서 실험환경에 적응할 수 있도록 순치시킨 후 소화율실험에 사용하였다. 넙치 치어(초기평균무게: 50.6±2.4 g)는 총 6개의 400 L Guelph system 분 수집장치 수조에 각 수조 당 60마리씩 무작위로 선택하여 배치하였다. 사육수는 1차적으로 모래 여과된 해수를 다시 카트리지필터가 장착된 하우징을 설치하여 2차 여과기를 통과시키면서 1 L/min의 유수량이 되도록 조절하였다. 사료공급은 매일 17:00 h에 만복공급 하였으며 사료공급 후 수조 내 이물질 제거를 위해 환수를 실시하였다. 익일 09:00 h에 분(feces) 수집장치에 모인 분을 채집하였다. 채집된 분은 여과지(110 mm, F1093-110, Chmlab)를 이용하여 해수를 제거하여 −70℃에 보관한 뒤 동결건조하여 분석에 사용되었다. 분 채집은 총 10일 간 실시하였으며 사육수온은 자연수온(19-22℃)에 의존하였다.
실험사료와 분에서 지시제로 사용된 chromium oxide 함량은 Divakaran et al. (2002)의 방법을 토대로 분석되었다. 샘플을 회화로(550℃)에서 3 h 동안 회화시킨 후 얻어진 시료를 분석에 사용하였다. 먼저 chromium oxide를 mono-chromate 형태로 산화시키기 위해 샘플 5-10 mg을 측량하여 glass test tube에 옮긴다. 시료가 담긴 glass test tub에 perchloric reagent 4 mL를 첨가한다. Perchloric reagent는 100 mL의 증류수에 200 mL의 질산을 혼합한 후, 냉각시킨 다음 70% perchloric acid 200 mL을 혼합하여 만든다. 시료와 perchloric reagent가 첨가된 glass test tube를 가열판에 넣고 300℃에서 20분간 가열한 후 실온에서 방냉시킨다. 전처리가 끝난 샘플은 50 mL 유리플라스크에 옮긴 후 3차 증류수로 25 mL가 되도록 정량한다. 그 후 분광광도계(Beckman DU-730, USA)를 이용하여 350 nm에서 흡광도를 측정하였다. 측정한 흡광도는 시료분석과 같이 전처리된 Standard 용액으로 만들어진 standard 방정식을 이용하여 시료의 Chromium oxide 함량을 계산하였다.
사료원료 소화율은 다음과 같은 방법으로 계산되었다.
=100×[1−(사료내 지시제 %/분내 지시제%)×(분내 영양소 %/사료내 영양소 %)]
실험원료의 영양소 소화율(%)
=[(사료내 영양소 함량×실험사료의 영양소 소화율)−(0.7×참고사료의 영양소 함량× 참고사료의 영양소 소화율)]/[(1−0.7)×실험원료의 영양소 함량]
통계학적 분석
실험사료의 배치는 완전확률계획법(Completely randomized design)을 실시하고, 성장 및 분석결과는 SPSS (Version 12.0) 프로그램을 이용하여 One-way ANOVA로 통계 분석된다. 데이터 값의 유의차는 Tukey's test (
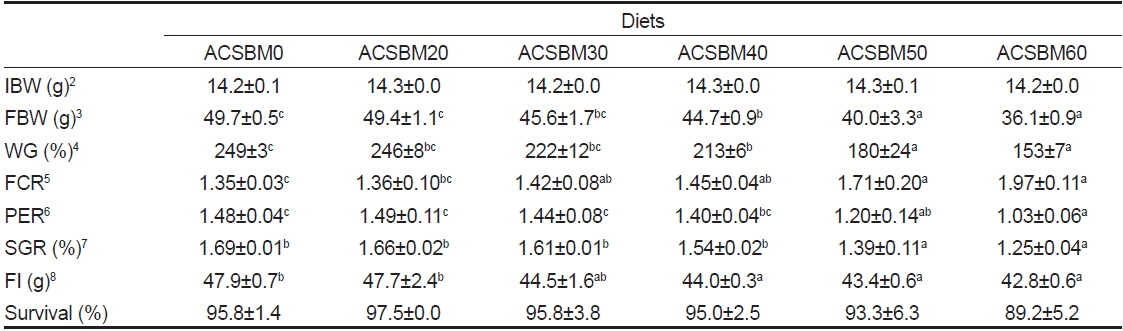
12주간 수행된 사료공급실험의 성장결과는 Table 3에 나타내었다. 증체율과 일간성장률 분석결과 어분 단백질을 20%에서 30%까지 대체한 ACSBM20, ACSBM30 실험구는 대조구인 ACSBMS0실험구와 유의적인 차이를 보이지 않았으나, 40% 이상 실험구인 ACSBM40, ACSBM50 및 ACSBM60실험구는 대체 함량이 증가함에 따라 ACSBM0실험구에 비해 유의적으로 감소하였다. 단백질전환효율 역시 증체율과 같은 경향을 보였다. 사료전환효율의 경우 ACSBM20 실험구는 ACSBM0 실험구와 유의적인 차이를 보이지 않았으나 ACSBM30, ACSBM40, ACSBM50, ACSBM60 실험구는 ACSBM0 실험구에 비해 유의적으로 낮은 효율을 보였다. 사료섭취율은 ACSBM20과 ACSBM30이 대조구와 유의적인 차이를 보이지 않았으며, ACSBM40, ACSBM50, ACSBM60 실험구는 대조구 및 ACSBM20에 비해 유의적으로 낮은 섭취율을 보였다. 생존율은 모든 실험구에서 유의적인 차이를 보이지 않았다. 이상의 성장결과를 종합해 보면, 산 가수분해 농축 대두박을 이용하여 넙치 사료 내 어분단백질을 40%까지 대체하여도 성장에 대한 유의적인 차이가 없는 것으로 사료된다. 하지만 어분을 30% 이상 대체한 실험구의 성장이 경향적으로 감소되는 것으로 보아 장기간 실험이 진행될 경우 30% 이상 어분을 대체한 실험구의 성장이 유의적으로 감소될 것으로 예상된다. 대두박은 육식성 어류의 사료 내 어분을 20-30% 대체할 수 있는 것으로 보고되고 있다(Chou et al., 2004; Hernandez et al., 2007; Lim and Lee, 2008). Soy protein hydrolysates의 경우 강도다리 사료 내 어분을 85%까지 대체 할 수 있었으며(Song et al., 2014), Soy protein concentrate (SPC)의 경우 대서양 넙치(Atlantic halibut, Berge et al.,1999), 대서양 연어(Atlantic salmon, Refstie et al.,2001), 잉어(Common carp, Escaffre et al., 1997), 무지개송어(Rainbow trout, Médale et al., 1998; Mambrini et al., 1999) 및 세네갈 서대(Senegalese sole, Aragão et al., 2003)의 사료 내 어분을 완전 또는 부분적(40-75%)으로 대체할 수 있는 것으로 보고되었다. 하지만 넙치와 Turbot에서 사료 내 SPC의 어분대체 비율은 본 연구결과와 유사한 25%로 상대적으로 낮은 것을 알 수 있었다(Day et al., 2000; Deng et al., 2006). 식물성사료원료의 어분대체 비율은 제한아미노산(methionine, lysine)의 첨가 여부, 실험사료조성 및 어종에 따라 다르게 나타날 수 있다(Deng et al., 2006). 본 연구는 별도의 제한아미노산(methionine)을 첨가하지 않은 실험사료를 사용하여 실험을 진행하였으며 어분대체 비율이 증가함에 따라 실험사료의 methionine 함량이 감소되는 것을 확인할 수 있었다(Table 2). 이러한 필수아미노산 함량의 변화에 따른 사료 내 추가 보충이 없어서 20% 이상 대체하였을 때 성장률이 감소된 것으로 판단된다. 따라서 산 가수분해 농축 대두박은 넙치 치어 사료 내 어분을 20%까지 안정적으로 대체 할 수 있을 것으로 판단되며, 제한아미노산(methionine, lysine 등), 철, 인, phytase 등 첨가 시 20% 이상의 어분대체가 가능한지에 대한 추가 연구가 필요할 것으로 사료된다.
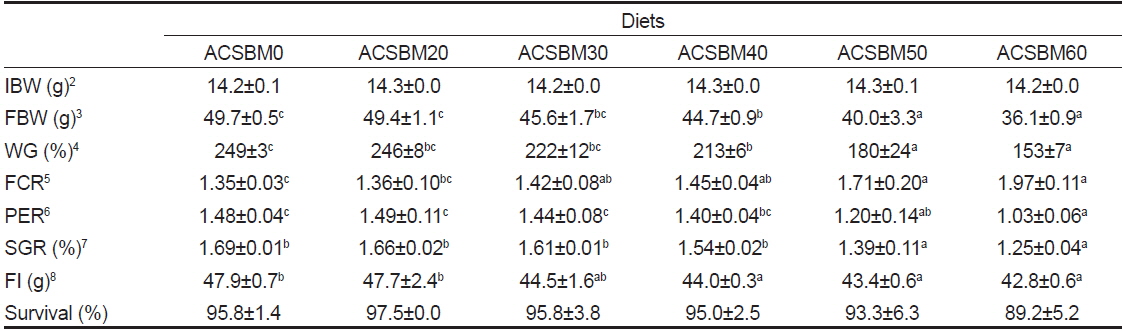
Growth performance of olive flounder Paralichthys olivaceus fed the six experimental diets for 12 weeks1
실험어류의 일반적인 건강도를 알아보기 위한 혈액학적 분석결과는 Table 4에 나타내었다. Hematocrit 분석결과 ACSBM20, ACSBM30 및 ACSBM40 실험구는 ACSBM0 실험구와 유의적인 차이를 보이지 않았으나 ACSBM50과 ACSBM60 실험구는 ASBM0 실험구에 비해 유의적으로 감소하였다. Hemoglobin 의 경우 ACSBM20과 ACSBM30 실험구는 ACSBM0 실험구와 유의적인 차이가 없었으며, ACSBM40, ACSBM50 및 ACSBM60 실험구는 ACSBM0 실험구에 비해 유의적으로 감소하였다. Glucose 수치는 ACSBM60 실험구가 ACSBM0과 ACSBM20 실험구에 비해 유의적으로 높았다. ALT, AST, protein 수치는 모든 실험구에서 유의적인 차이를 보이지 않았다. 혈액성분 분석은 어류의 건강도와 체내대사를 알아보기 위한 지표로 사용된다. ACSBM으로 어분대체 함량이 증가할수록 hematocrit, hemoglobin 수치는 유의적으로 감소하였으며, 이와 반대로 glucose 함량은 어분대체 함량이 증가함에 따라 유의적으로 증가하였다. ACSBM으로 어분을 대체하게 되면 어분과 비교하여 대두박에서 부족하기 쉬운 methionine 및 lysine 등 필수아미노산 등이 제한 아미노산으로 작용하고, 식물성단백질원이 가지고 있는 항영양인자의 함량이 증가하기 때문에 대체 함량이 증가함에 따라 유의적으로 낮은 hematocrit 및 hemoglobin 수치를 보인 것으로 판단된다. 또한 대체 함량이 증가함에 따라 사료섭취율 역시 유의적으로 감소하는 것을 알 수 있었다. 식물성 원료인 ACSBM의 함량이 증가함에 따라 기호성이 떨어져 결국 사료섭취량이 감소한 것도 영향을 미친 것으로 판단된다. 이와 반대로 ACSBM50과 ACSBM60 실험구에서는 유의적으로 높은 glucose수치를 보였다. Glucose 는 어류의 체내 대사가 원활할 때 그 값이 감소한다고 보고되고 있으며(Gordon, 1968), 스트레스를 받으면 그 값이 증가하여 스트레스의 지표로도 활용되기도 한다. 이 결과 역시 ACSBM으로 어분의 대체함량이 증가함에 따라 사료섭취량이 감소하고, 필수아미노산의 함량이 감소함에 따라 영양대사 불균형으로부터 기인한 것으로 사료된다.
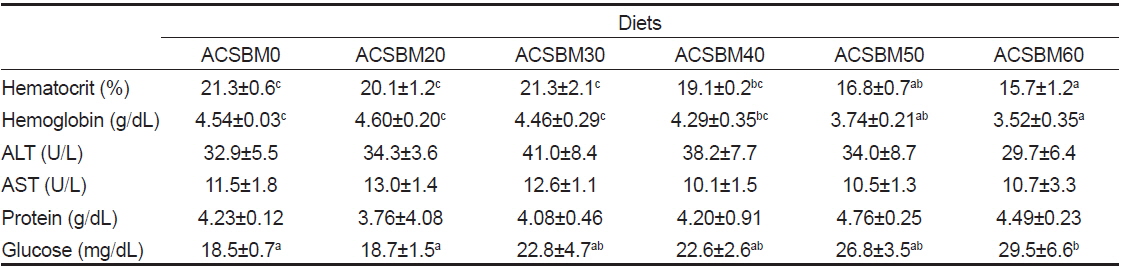
Serological characteristics of olive flounder Paralichthys olivaceus fed the six experimental diets for 12 weeks1
사료원료의 외관상 소화율 분석결과는 Table 6에 나타내었다. 건물 소화율은 어분이 대두박과 ACSBM에 비해 유의적으로 높은 값을 보였다. 단백질 소화율의 경우 어분이 91.5%로 가장 높았으며 ACSBM은 85.9%로 일반 대두박(82.5%)에 비해 다소 높은 값을 나타내었다. 따라서 산 처리를 통한 가수분해 방법으로 농축시킨 가공처리 방법은 일반 탈피대두박의 소화율을 향상시켜 그 이용성을 높일 수 있는 가공처리 방법이라 판단된다.
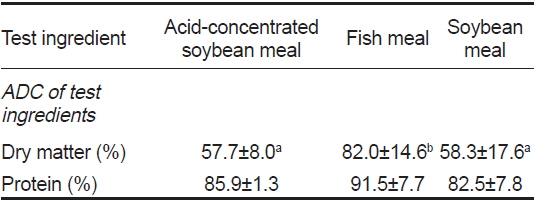
Apparent digestibility coefficient (%, ADC) of dry matter and protein in the test ingredient determined by fecal collection method (Guelph system) for olive flounder Paralichthys olivaceus1
연구결과를 종합해 보면, 산 가수분해 농축 대두박은 넙치 치어 사료 내 어분을 20%까지 대체할 수 있을 것으로 판단되며, 산 가수분해 방법은 일반 대두박의 이용성을 보다 더 향상시킬 수 있는 가공방법으로 판단된다. 향후 제한아미노산 등을 첨가하여 어분을 보다 더 대체할 수 있는 추가 연구가 수행되어야 할 것으로 판단된다.