



경골어류의 번식내분비계는 시상하부-뇌하수체-생식소의 축(Hypothalamus-pituitary-gonad; H-P-G axis)으로 이루어져 있으며, 이들은 서로 상보적인 기능에 의하여 조절된다. 즉, 어류의 난소발달 과정은 빛과 수온 등 외부환경요인에 의하여 개시되며(Goos et al., 1993), 이러한 환경요인들은 감각기관을 거쳐 시상하부에 전달되어 Gonadotropin releasing hormone(GnRH, 생식소자극호르몬방출호르몬)와 뇌하수체의 Gonadotropin (GTH, 생식소자극호르몬) 분비를 순차적으로 자극함으로써 이들이 난소성숙 과정의 매개체 역할을 하고 있다. 난소에 난황이 축적되기 시작하는 난황형성기(vitellogenesis)에는 estradiol-17β (E2)가 주요 스테로이드로 작용하며, 난황축적이 종료된 직후부터 배란시기까지는 progesterone의 유도체인 17α,20β-dihydroxy-4-pregnen-3-one (17α20βP)나 17,20β,21-trihydroxy-4-pregnen-3-one (17α20β21P) 등이 주요 성 스테로이드 호르몬으로 알려져 있다(Nagahama, 1994; Yoshizaki et al., 2001; Patino et al., 2003). 난황형성기는 어류의 번식에서 중요한 과정으로 난모세포에서 합성·분비된 E2에 의해 간에서 난황전구물질(vitellogenin, Vg)이 합성되어 난모세포내에 축적 그리고 난황물질(vitellin)로의 전환과정을 포함한다. 이 기간 동안에 난모세포가 주로 성장하게 되는데, 난모세포 크기가 점점 증가하면서 크기가 최종 난모세포의 98% 까지 도달하게 된다(Tyler et al., 1988).
홍바리(
본 연구에서는 홍바리의 번식기술 개발을 위한 기초자료로 난황형성기의 홍바리 난모세포를 대상으로(평균난경 0.45, 0.48 그리고 0.50 mm) 이시기에 관여하는 주요 성 스테로이드 호르몬을 분석하였다. 동시에 기존의 연구(Hwang et al., 2012)에서 확인하지 못한 스테로이드를 검정하였다.
실험에 사용된 홍바리는 제주대학교 해양과환경연구소에서 수온과 광주기 조절(25℃, 14L:10D)로 성숙 유도시킨 홍바리 암컷 3개체를 대상으로 하였다. 실험에 사용된 개체의 전장은 31.6-37.0 cm, 체중은 528-851 g 이었다.
실험어는 0.5 mL/L의 2-phenoxyethanol로 마취시켜 전 채혈한 후 무균상태에서 난소를 절취하여 ice-cold balanced salt solution (132.96 mM NaCl, 3.09 mM KCl, 0.28 mM MgSO4·7H2O, 0.98 mM MgCl2·6H2O, 3.40 mM CaCl2·6H2O, 3.65 mM HEPES)으로 세척하였다. 절취된 난소는 가는 핀셋을 이용하여 개체별로 난모세포를 조직상태로 분리하였다.
분리된 난모세포는 난경별로 24-well plate에 well당 Leibovitz L-15 (Gibco, USA) 1 mL에 적출한 난소조직 일부(5.1-10.9 mg)를 넣은 후 18℃에서 24시간 배양하였다. Balanced salt solution과 L-15 배양액의 pH는 7.85, 삼투농도는 370 mOsmol kg-1로 조절하였다. 난모세포에서 생성되는 성 스테로이드 호르몬 종류를 분석하기 위해 방사표지된 전구물질인 17α-hydroxyprogesterone ([3H]-17αP, Amersham Life Science, UK)을 난경별로 각각 55 kBq 첨가하여 배양하였다.
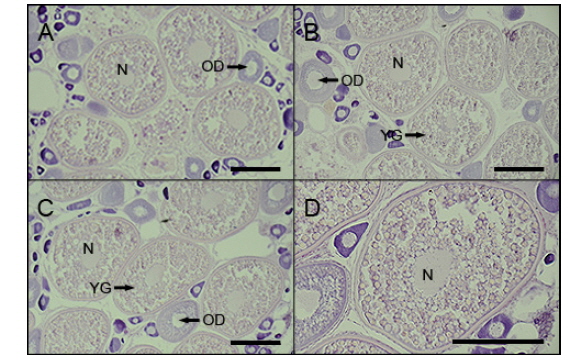
난모세포 발달 단계의 조직학적 관찰을 위해 적출한 난소를 Bouin's solution에 고정하여 파라핀으로 포매한 후 5-6 μm 두께의 절편을 만들어 Mayer's hematoxylin과 eosin으로 비교 염색하여 광학현미경(U-ND25-2, Olympus, Japan)하에서 관찰하였다.
배양 후 난모세포와 배양액은 함께 80% ethanol로 균질화하여 원심분리한 후 상등액만을 모아 건조시킨 뒤 증류수 500 μL에 용해시켜 dichloromethane으로 2번 추출하여 유리 스테로이드만을 얻었다.
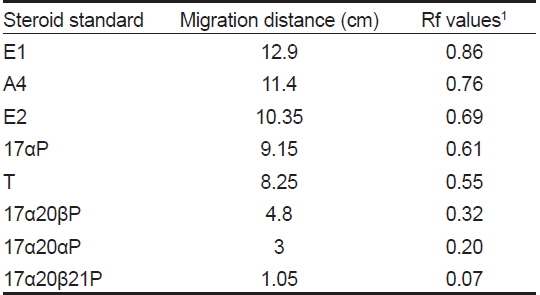
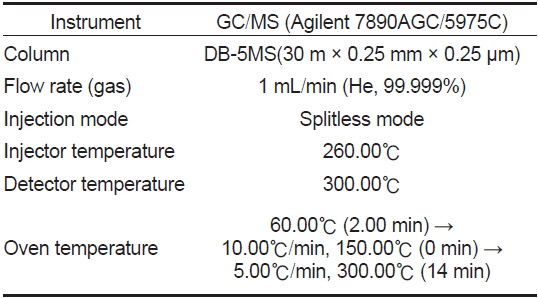
스테로이드 추출물은 스테로이드 표준물질과 동시에 실리카겔을 입힌 얇은 막 지지체(TLC plate, 60F254, Merck)에 점적시킨 후 밀폐된 혼합용매(benzene:acetone=80:20와 Benzene:ethylacetate=80:20)속에서 전개시켰으며, 각각의 반점에 해당하는 Retention fraction (Rf) 값은 Table 1과 같다. 전개 후 TLC plate를 건조시킨 뒤 대사물질들의 반점 중 estrone (E1)과 estradiol-17β (E2)는 요오드 증기로, 나머지 반점들은 254 nm의 자외선 하에서 확인하였다. TLC plate에 나타난 대사물질들은 방사선 사진법(autoradiography, Fuji Bas 3000)으로 재확인하였으며, 재확인된 반점에 해당되는 실리카겔 밴드를 잘라 5 mL의 혼합용매 (dichloromethane:methanol = 9:1)로 용리하였다. 용리된 대사물질은 HPLC (Wa ters)를 이용하여 표준물질의 retention time과 일치하는 분획만을 분리하였다. 분리된 분획은 Liquid Scintillation Counter (PACKARD TRCARB-2100T, USA)를 이용하여 radioactivity 측정 후 대사물질별로 대사율을 계산하였으며, 분리된 대사물질은 HPLC-radiodetector (β-RAM MODEL 4, USA)로 확인하였다. HPLC 기기분석 조건은 Table 2와 같다. HPLC-radiodetector로 확인된 대사물질은 gas chromatography-mass spectrometry (GC/MS) (GCMS-QP5050A, Shimadzu, Japan) 로 동정하였으며, GC/MS 작동조건은 Table 3과 같다.
[Table 1.] The retention factor (Rf) values of steroid metabolites on the TLC plates
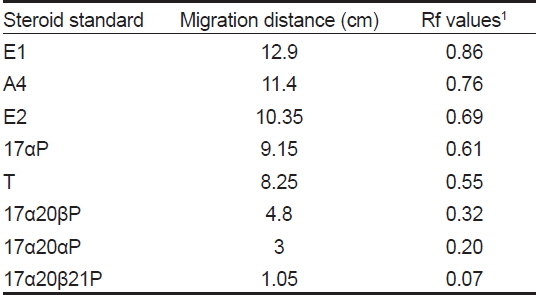
The retention factor (Rf) values of steroid metabolites on the TLC plates
[Table 2.] HPLC instruments and analysis conditions for separation of steroid metabolites

HPLC instruments and analysis conditions for separation of steroid metabolites
[Table 3.] Analytical conditions of GC/MS for identification of steroid metabolites
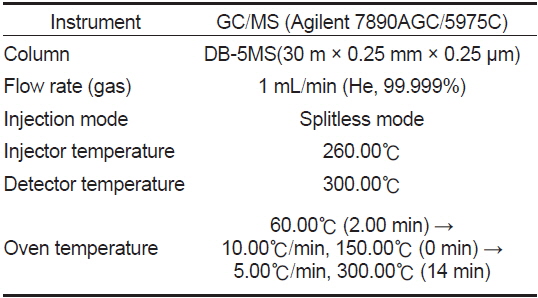
Analytical conditions of GC/MS for identification of steroid metabolites
홍바리의 난소내 난모세포의 조직학적 관찰은 Fig. 1과 같다. 평균 난경 0.45, 0.48 그리고 0.50 mm에 해당하는 난모세포들은 모두 세포질 내에 난황과립(yolk granule, Yg)이 충만하였으며, 다양한 크기의 유구(oil droplet, OD)들이 관찰되었다(Fig. 1A,1B,1C). 난경 0.45과 0.48 mm인 난모세포에서는 핵 (nucleus, N)이 대부분 세포질 중앙에 위치 하였으나, 난경 0.50 mm인 난모세포에서는 핵의 이동이 시작되는 난모세포도 관찰되었다(Fig. 1D).
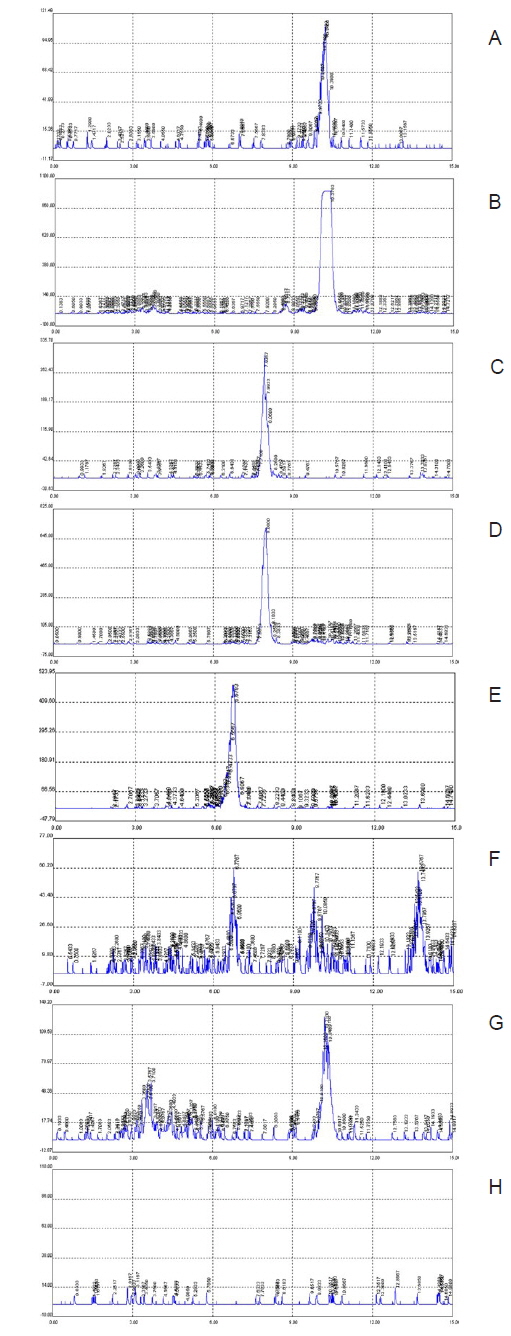
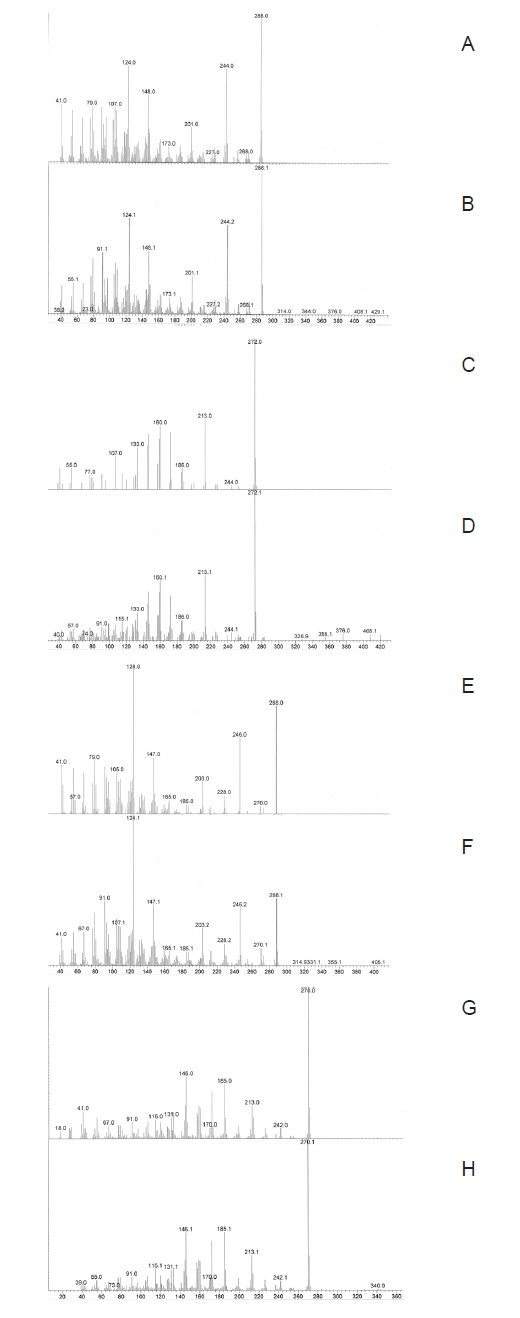
평균난경이 약 0.45, 0.48, 그리고 0.50 mm인 난모세포에서 [3H]17α-hydroxyprogesterone으로부터 생성된 스테로이드 대사물질들의 TLC상의 반점은 A4, T, E2 그리고 E1 등의 표준물질과 일치하였다(Fig. 2). 전구물질로부터 생성된 주요 대사물질들 즉, A4, T, E2 는 HPLC-radiodetector를 거쳐 GC-MS에 의해 최종 동정되었다(Fig. 3). 그리고 E1은 대사된 농도가 낮아 radiodetector에서는 검출되지 않았지만 GC-MS에 의해 동정되었다(Fig. 4).
난황형성기 난모세포에서 전구물질, [3H]17α-hydroxyprogesterone로 전환된 성 스테로이드 대사율은(Fig. 5)과 같다. A4의 대사율은 평균난경 0.45, 0.48 mm인 난모세포에서 각각 73.5, 67.2% 였고 0.50 mm인 난모세포에서 80%이상의 높은 대사율을 보였다. T로의 대사율에서는 평균난경 0.45, 0.48 mm인 난모세포에서 각각 6.1, 8% 였고 난경 0.50 mm인 난모세포에서 13.2%로 증가하였다. E2의 대사율은 평균난경 0.45, 0.48 mm 난모세포에서 각각 2.9, 2.6% 였고 평균난경 0.50 mm 난모세포에서 0.5%로 낮은 대사율을 나타냈다. E1의 대사율도 평균난경 0.50 mm인 난모세포에서 0.3%를 나타냈다.
본 연구에 사용된 홍바리(blacktip grouper,
홍바리의 난황형성기 난모세포에서 합성되는 주요 스테로이드 호르몬은 androgen인 A4와 T, estrogen인 E2와 E1으로 동정되었다. 난경에 따른 주요 스테로이드 호르몬의 대사율 변화를 살펴보면 estrogen인 E2와 E1는 난경의 크기가 증가할수록 감소하는 것을 확인하였다. 즉, 난경 0.50 mm 난모세포에서는 난경 0.45, 0.48 mm의 난모세포보다 감소하는 것을 확인하였다. 이와 반대로 androgen의 대사율은 estrogen의 대사율과는 반대로 난경 0.45, 0.48 mm의 난모세포보다 난경 0.50 mm의 난모세포에서 증가 현상을 보였다. 일반적으로 알려진 경골어류의 스테로이드 호르몬 대사과정에 있어서 testosterone (T)은 aromatase에 의해 E2로 전환되는 전구물질로(Kagawa et el., 1982) 난소내에서 GtH (gonadotropic hormone)의 반응을 높여주는 것으로 보고되어 있다(Fostier et al., 1983). 또한 T는 aromatase에 의해 E2로의 대사가 충분히 이루어진 후에는 혈중으로 분비 된다고 알려져 있으나(Campbell et al., 1976), 참돔,
평균난경 0.50 mm에서 androgen인 A4와 T 의 대사율이 0.45와 0.48 mm 보다 높고, 반면 estrogen인 E2와 E1의 대사율은 감소하는 것으로 나타나 0.50 mm 크기의 난모세포가 난황형성 종료후 성숙단계로 넘어가는 과정에서 여러 생리적 기능을 하는 것으로 생각되어진다. Androgen은 시상하부에서 스테로이드 호르몬의 분비 조절과 estrogen 전구물질로 알려져 있다(Montero et al., 1995). 그리고 척추동물에서 androgen은 생식학적으로 여러기능을 할뿐만 아니라, 생식외적인 부분인 뉴런의 성장, 근육과 뼈의 발달, 표피세포의 발달에 중요한 역할을 한다(Staub and Beer, 1997). 어류 난황형성기의 주요 성 스테로이드인 estrogen뿐만 아니라 이들의 전구물질인 androgen의 역할에 대해서 그리고 또 다른 스테로이드의 존재 가능성에 대해서도 계속적인 연구가 필요하다.

![Autoradiograms of steroid metabolites incubated with [3H]17α-hydroxyprogesterone from blacktip grouper Epinephelus fasciatus ovarian follicles at three different oocyte diameter. Four metabolites were separated by thin layer chromatography developed with a benzene: acetone (4:1) and benzene: ethyl acetate (4:1) solvent system. A, Oocytes of 0.45 mm diameter; B, Oocytes of 0.48 mm diameter; C, Oocytes of 0.50 mm diameter; A4, androstenedione; E1, estrone; E2, estradiol-17β; T, testosterone; ?, unknown.](http://oak.go.kr/repository/journal/16229/KSSHBC_2014_v47n6_882_f002.jpg)
![Radioactivities of steroid metabolites from [3H]17α-hydroxyprogesterone in blacktip grouper Epinephelus fasciatus oocytes. The percentage of radioactivity associated with each isolated steroid was calculated to the percentage of total steroid recovered from HPLC. Values are mean±SE.](http://oak.go.kr/repository/journal/16229/KSSHBC_2014_v47n6_882_f005.jpg)