총 암모니아성 질소(TAN, total ammonia nitrogen)는 양식 생물에 의해 배설되는 주요 질소 대사 산물이며(Colt and Armstrong, 1981; Foss et al., 2004), 수중 용존산소가 충분할 경우 어류의 생존과 생산성에 영향을 주는 첫 번째 제한요인이다(Park, 2005). 암모니아는 어체에 축적되어 유독성을 나타내는데(Randall and Wright, 1987; Paust et al., 2011), 단기 증상으로는 아가미 호흡의 증가, 불규칙한 움직임, 평형감 상실, 먹이 섭취의 감소(Meade, 1985; Russo and Thurston, 1991) 등이 나타날 수 있으며, 만성적으로 노출될 시에는 성장 감소(Lang et al., 1987), 중추신경계의 손상(McKenzie et al., 1993) 및 폐사에 이르게 된다(Ip et al., 2001).
돌돔은 남해안에서 해상가두리와 육상 수조식으로 주로 양식하고 있는 온수성 어류로, 적정 수온이 20℃ 이상이라서(Kim, 2011), 동절기 저수온에서는 생존율이 낮은 문제가 있기 때문에(Kang et al., 1998; Oh et al., 2006), 동절기에 돌돔의 생산성을 높이기 위해서 육상양식장에서는 가온을 실시하여 사육하기도 한다. 이럴 경우에는 에너지 비용이 경영상 부담이 될 수가 있으므로, 에너지 절약형 사육시스템의 도입이 필요한데, 순환여과시스템은 다양한 수처리 시설을 이용하여 물을 지속적으로 재사용하는 생산시스템으로 외부로 빠져나가는 열에너지를 최소화하여 난방 효율을 극대화시킬 수 있어(Suh et al., 2001), 돌돔의 육상 수조식 양성에서는 매우 적합한 시스템이다(Kim, 2011). 또한 환수를 최소한으로 조절하므로써 외부 환경에 대한 간섭을 적게 받을 수 있고 유입되는 질병의 원인을 사전에 차단할 수 있다는 장점이 있어 세계적으로도 관심을 모으고 있다(Van Rijn, 1996).
다만, 순환여과시스템은 양식 생물의 최적 성장을 위한 적절한 수질관리가 필요하므로, TAN과 같은 대사산물은 수중으로부터 신속하고 효과적으로 제거되어야 한다. 따라서 본 연구에서는 돌돔을 순환여과시스템에 적용하여 생산하는데 필요한 TAN 농도 기준을 제시하고자 TAN 농도에 따른 돌돔의 성장과 혈액학적 특성을 조사하였다.
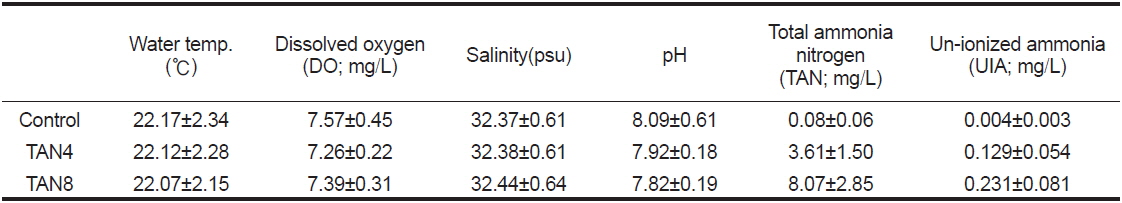
실험에는 Park et al. (2013)과 동일한 규격(총 수량 4,500 L)의 독립된 3개의 순환사육시스템을 활용하였고, 실험기간 중의 수온, 용존산소(DO, dissolved oxygen), 염분 및 pH 측정은 하루 두 차례(09:00, 17:00)의 사료 공급 30분 후에 다항목수질측정기(YSI 556MPS, USA)로 측정하였으며, TAN는 분광광도계(HACH DR 4000U, USA)로 매일 1회 측정하였다. 어류에게 유독한 비이온화 암모니아(NH3, UIA)의 농도는 Johansson and Wedborg (1980)에 따라 계산하였으며, 실험기간 동안의 수질은 Table 1과 같다.
[Table 1.] Water environment for the experiment
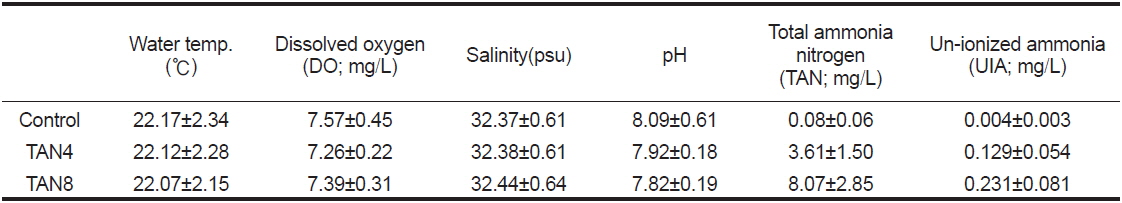
Water environment for the experiment
경상남도 통영의 가두리에서 사육중인 약 200 g의 돌돔을 구입하여 실험에 이용하였다. 수조(1.0 m×1.0 m×1.0 m) 별로 100마리씩(사육밀도 33 kg/m3) 3반복으로 수용하였고, 6주간 해산어류용 상품 사료(우성사료, 조단백 43.5±0.6%, 조지질 11.8±0.1%)를 일간 2회(09:00, 17:00) 만복 공급하였다. 용존산소(DO)의 공급은 산소발생기(OXUS Aqua-7L, Korea)를 이용하여 포화도 80% 이상으로 유지하였고, 산소포화도는 휴대용 OxyGuard (OxyGuard A/S, Birkerød, Denmark) 로 매일 아침마다 측정하여 확인하였다.
실험 TAN 농도는 사전예비실험을 통하여 사료 섭취량이 평상시의 70% 이하로 떨어지는 약 8 mg/L를 기준으로 하여, 0 mg/L (대조구), 4 mg/L (TAN4) 및 8 mg/L (TAN8)의 3구간을 설정하였다.
그리고 시스템 내 암모니아의 주입은 별도의 150 L 암모니아 탱크에 NH4Cl 수용액(TAN4는 10%, TAN8는 20%)을 넣고, 정량펌프(AX1-32-PFC-HWS-K, Korea)를 이용하여 시스템의 sump에 90 mL/min 속도로 주입하였다. 암모니아 용액은 매일 새로 만들어 20:00에 탱크 청소 후 재주입하였으며, sump에 공급된 암모니아는 포말분리기와 여과조를 거쳐 사육수와 충분히 혼합된 후 사육수조로 들어가도록 설계하였다. 환수량은 7 L/min으로 설정하여, 시스템 별 일간 약 2.2회의 환수가 되도록 하였다.
TAN 농도에 따른 돌돔의 성장을 조사하기 위해 실험 시작 전, 2주, 4주 및 6주 후에 돌돔을 계측하였고, 이때 실험구마다 15마리씩(수조별 5마리) 총 45마리를 무작위로 선택하여 미부동맥에서 채혈하여 실험에 사용하였다. 혈액은 냉장고에서 3시간 방치하고 응고시킨 뒤 원심분리(3,000 rpm, 10 min)하여 상등부의 혈청(serum)을 분석에 이용하였다. 코티졸(cortisol) 분석은 Jeon et al. (2000)의 방법으로 하였으며, 총 단백질(total protein), 알부민(albumin), 포도당(glucose), 총 콜레스테롤(total cholesterol), glutamic oxaloacetic transaminase (GOT), glutamic pyruvic transaminase (GPT)는 Cobas Integra 800 analyzer (Roche Diagnostics, USA)로 측정하였다.
본 실험에 대한 결과는 mean±S.D.로 나타내었고, SPSS ver. 10.0 프로그램을 사용해 ANOVA로 검증한 후,
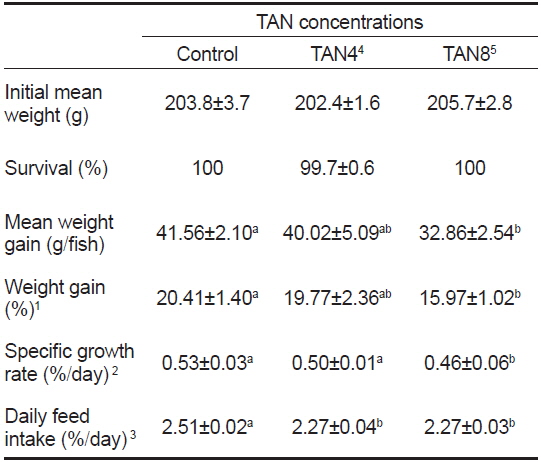
TAN 농도에 따른 돌돔의 성장 결과를 Table 2에 나타내었다. 실험기간 동안 TAN 농도에 따른 생존율 차이는 없었다(
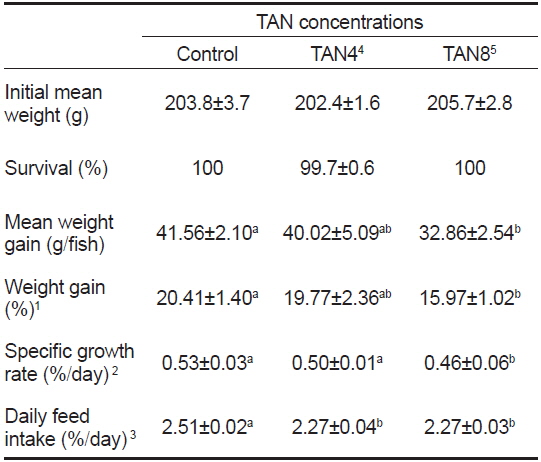
Growth performance of parrotfish Oplegnathus fasciatus reared with 3 different total ammonia nitrogen TAN concentrations for 6 weeks
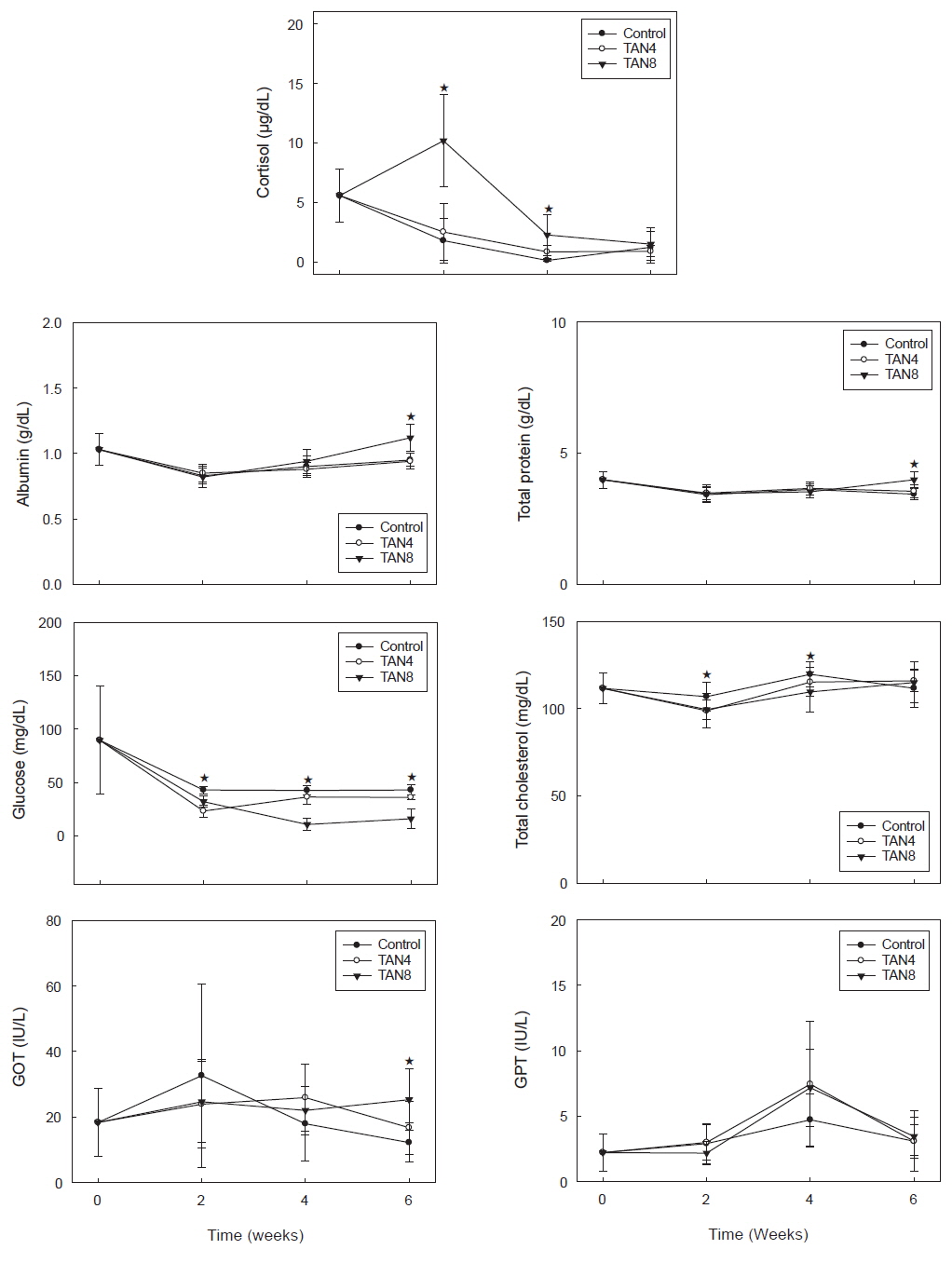
돌돔의 사육 중 주요 혈액성분의 변화는 Fig. 1과 같다. 우선, 스트레스 지표인 혈중 코티졸의 농도는 실험 시작 시 5.6 μg/dL였으나, 대조구와 TAN4 실험구는 2주 후에 각각 1.8 μg/dL과 2.5 μg/dL로 차이가 없었고, 이런 경향은 4주와 6주 후에도 변함이 없었다. 그러나 TAN8 실험구에서는 2주 후에 10.2 μg/dL로 다른 두 실험구와 유의적인 차이를 보이면서 급상승했다가, 4주 후에도 비록 낮아지긴 했지만 여전히 두 실험구와 유의적인 차이를 보였고, 6주 후에는 1.2-1.5 μg/dL로 실험구간에 차이가 없었다.
주요 영양성분인 알부민의 농도는 실험 시작 시 1.0 g/dL에서 2 주 후 0.8 g/dL수준으로 모든 실험구에서 낮아졌다가, 이후에는 증가경향을 보였다. 그리고 4 주 후에는 0.9 g/dL 수준으로 증가하긴 했으나 실험구 간에 유의적인 차이를 보이진 않았고, 6 주 후에는 TAN8 실험구에서 1.1 g/dL로 상승하여 대조구와 TAN4 실험구(0.9 g/dL)에 비해 유의적으로 높았다(
또 다른 에너지원인 포도당 농도는 대조구에서는 실험 기간동안 42-43 mg/dL로 큰 변화 폭을 보이지 않았으나, TAN4 실험구는 23-36 mg/dL, TAN8 실험구에서는 10-32 mg/dL로 대조구에 비해 유의하게 낮았다. 총콜레스테롤 농도에서는 두 암모니아 실험구에서는 4 주 후까지는 대조구에 비해 낮은 농도였으나, 6 주 후에는 대조구와 차이를 보이지 않았다.
GPT 활성은 실험 시작 시 2.2 IU/L에서 2 주차에는 실험구 별로 2.2-3.0 IU/L 수준이었고, 4 주차에는 전반적으로 세 실험구 모두 약간 증가한 후 6 주차에는 다시 낮아지는 공통된 경향을 보였으며, 실험기간 중 실험구 간에 유의적인 차이는 없었다(
순환여과시스템은 주로 담수어류를 중심으로 발전되어 왔으며(Park, 2005), 특히 북유럽에서는 순환여과 양식을 뱀장어 양식에 도입하여 유럽에서의 뱀장어 총 생산량의 절반 이상을 담당하고 있다(FFI, 1996). 하지만 해수의 경우 염분으로 인한 질산화 효율의 감소로(Son et al., 2000) 대사산물인 TAN을 제거하기 위한 장비의 규모가 커야 하기 때문에 경제성이 떨어진다(Kim, 2011). 따라서 해수어류를 순환여과시스템을 이용하여 사육하려면 대상 어종의 TAN에 대한 내성 수준을 고려하여 수처리 장치의 규모를 설정하는 작업이 먼저 이루어 져야만 한다.
먹이를 통해 아미노산 형태로 공급되는 질소는 아미노산과 단백질의 합성에 필수적인 성분이지만(Chin et al., 1998), 어류는 체내 흡수되고 남은 단백질과 체내 조직 단백질의 이화과정을 통해 최종적인 질소대사산물로 암모니아를 배설하게 된다(Forster and Glodstein, 1969). 이렇게 배설된 암모니아는 독성이 있어, 조직의 구조와 기능, 혈액 성상, 삼투압 조절, 내병성, 성장, 번식에 심각한 영향을 미치기도 하여 생산성을 크게 감소시키는 주된 원인이 되며(Russo, 1985; Jeney et al., 1992), 특히 산소포화도가 낮으면 독성은 더욱 크게 발현되는 것이 보고되고 있다(Thurston et al., 1981; Wajsbrot et al., 1991). 그래서 본 실험은 산소포화도를 80% 이상으로 유지시키면서 고농도 암모니아가 어류의 성장에 미치는 영향을 보고자 한 것이다.
수중 암모니아(TAN)에는 이온화되지 않은 암모니아(NH3, UIA)와 암모늄 이온(NH4+)의 두 가지 형태가 존재하는데(Bower and Bidwell, 1978), 이 중에서 어류에게 해로운 것은 이온화되지 않은 암모니아이다. 본 연구에서 TAN4 및 TAN8 실험구의 UIA농도는 각각 0.13 및 0.23 mg/L인데(Table 1 참조), 이 농도는 여러 어류의 성장이나 건강에 부정적인 영향을 나타낼 정도로 높은 수준이며, 이와 같은 고암모니아 농도에 노출시켜 어류 성장에 미치는 영향을 조사한 연구는 매우 부족하다(Foss et al., 2009). 그러나 환경 내성은 종이나 성장 단계에 따라 다르기 때문에 확인할 필요가 있을 것이라 여겨진다.
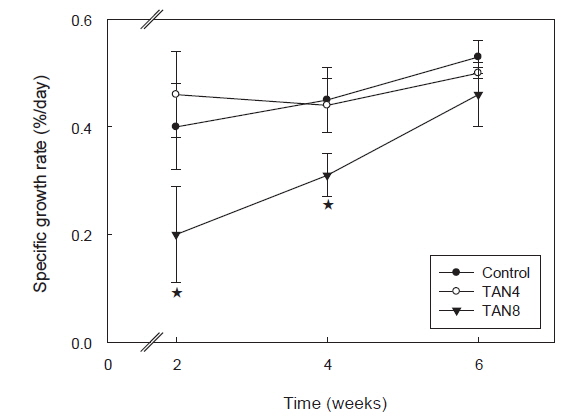
본 실험에서는 200 g 내외의 돌돔을 6 주간 사육하였더니, TAN8 실험구는 대조구와 비교하여 평균 증중량, 증중률, 일간 성장률 및 일간사료섭취율 등 전반적인 성장지표가 모두 유의적으로 낮았지만(
한편, 다른 동물(Selye, 1973)과 마찬가지로, 어류도 스트레스를 받으면 강도나 지속시간에 따라 신경계 및 내분비계가 자극되어 코티졸 등이 과다 분비되고, 이로 인해 삼투질 농도(Avella et al., 1991)나 포도당 및 콜레스테롤과 같은 에너지원 성분도 영향을 받는다는 것이 잘 알려져 있다(Schreck, 1981; Waring et al., 1992).
본 실험에서는 급작스런 스트레스 환경에 노출된 돌돔이 순간적으로 혈중 코티졸의 농도가 11 μg/dL까지 상승하다가 시간이 흐르면서 2 μg/dL 수준으로 하강하여 안정되었는데, 이런 결과는 Biswas et al. (2008)의 보고와도 잘 일치한다. 그리고 이 결과는 고암모니아 농도가 초기에는 돌돔에게 큰 스트레스로 작용하지만, 돌돔은 고암모니아 환경에 잘 적응하고 있음을 보여준다. 한편, 에너지원으로 사용되는 포도당과 총콜레스테롤의 혈중 농도가 모두 감소하는 경향을 보였고, 특히 포도당 농도에서 감소가 높은 것은, 호흡을 위한 아가미 운동 등으로 많은 에너지를 사용하면서 고갈된 것이 아닐까 여겨진다(Lang et al., 1987). 이와 관련하여, Remen et al. (2008)도 고농도 암모니아(0.115-0.120 UIA mg/L)에 노출시킨 juvenile Atalnatic cod (
이들 결과를 정리하면, 고농도(TAN8)의 암모니아 환경은 어류의 성장에 영향을 미칠 뿐 아니라, 혈액 성분의 농도에도 영향을 미치는 등, 전반적으로 돌돔에게 부정적인 영향을 미치지만 시간 경과에 따라 다소 적응하는 것으로 사료된다.