우리나라의 알려진 호소는 약 18,000개(2006년 기준)로 나타나고 있으며 위락용 저수지를 합산할 경우 전체호소수는 더욱 증가할 것이다(Kim et al., 2006). 최근 비점오염원 등에서의 영양염류의 유입으로 부영양화된 호소 및 하천에서, 이상 고온, 느린 유속, 갈수 등 다양한 원인에 의해 조류 대발생이 증가하고 있다(Cho, 2013). 녹조현상은 하천 및 호소수에서 수온 및 영양염류 등의 영향으로
조류에 의한 피해는 조류 발생의 억제 및 발생된 조류의 제거에 의해 저감 또는 방지할 수 있다. 조류 발생은 점오염원 및 비점오염원 등에서 발생하는 영양염류 제거에 의해 억제할 수 있다. 그러나, 직접적인 영향을 측정하기 어렵고 소요비용이 과다한 것으로 알려져 있다(Lau et al., 1995). 황산동을 투입하여 조류의 성장을 억제 할 수 있는 것으로 알려져 있으나, 조류 대발생을 사전에 파악하기에 어려움이 있으며, 대발생 후에는 그 효과가 매우 작은 것으로 알려져 있다(Park et al., 2006). 또한, 차광막을 설치하여 햇빛을 차단하는 방법이 있으나, 설치 면적이 매우 넓고 비용이 많이 소모되기 때문에 잘 사용되지 않고 있다(Nam et al., 2011).
다른 대안으로써 녹조를 직접적으로 제거하는 방법이 있으며, 화학 약품을 이용한 응집 침전이나 스크린 등을 이용한 물리적 처리, UV/H2O2, UV/O3, O3,/H2O2, Fenton 시약 등을 이용한 고도산화처리 등이 있다(Azarian et al., 2007; Hong, 2008; Kim et al., 2005; MOE, 1998; Na et al., 1998; Ni et al., 2010; Park et al., 2005). 화학 약품을 사용한 응집의 경우(화학적 응집) 응집제 투입에 따른 pH 저하로 인하여 효율이 감소하기 때문에 추가적인 pH 조절을 필요로 하고, 고도산화는 고농도 조류 제거에는 적합하지 않은 것으로 알려져 있다.
최근에 다양한 입자성 또는 용존 오염물 제거에 있어, 전기응집(electrocoagulation)이 연구되고 있다(Aji et al., 2012). 전기응집은 응집제로 금속염을 처리대상 폐수에 용해시켜 사용하는 화학적 응집과 달리, 응집제 역할을 하는 금속(철, 알루미늄 등) 전극에 전류를 적용하여, 전극을 전기적으로 용해시켜(electro-dissolution) 응집제를 공급한다. 전기응집은 적용되는 전류에 의한 물의 전기분해에 의해 수산화 이온(OH-)이 생성되므로, 기존의 화학적 응집 시 발생하는 pH 저하가 없으며, 오염물 처리 속도 및 효율이 우수하고 운전이 용이하다는 장점이 있다(Gao, Du et al., 2010; Gao, Yang et al., 2010). 이에, 본 연구에서는 전기응집을 이용한 조류 및 영양염류의 제거를 위한 전기응집 특성 평가를 위하여, 회분식 및 연속식 실험을 수행하여, 전극의 면적, 전류 밀도, pH의 영향 및 교반속도 등이 조류 제거에 미치는 영향을 검토하였다.
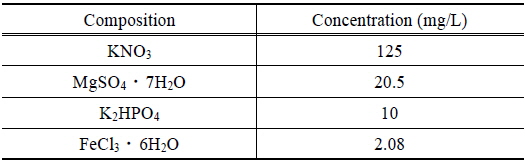
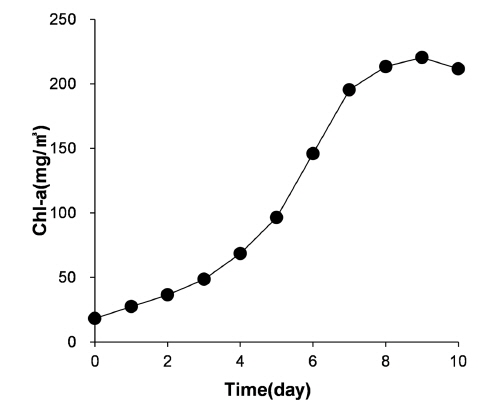
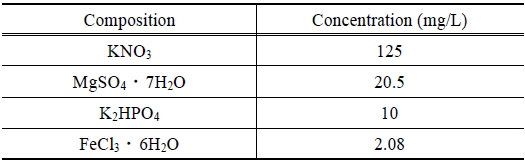
조류는 경기도 소재 신갈 저수지에서 호소수와 함께 채취하고, 이 호소수 5 L를 탈이온수 75 L와 혼합하였다. 이 혼합액의 조성이 Table 1에 제시된 바와 같도록 영양염류를 첨가하고, 실온(20 ± 2°C)에서 240 시간 동안 조류를 배양하였다. 조사 및 암전은 각 12시간 이었으며, 조사 시 광량은 53.3 μmol/m2/s 이었다. 배양 기간 동안, 클로로필-a (Chl-a) 농도로 나타낸 조류의 성장곡선은 Fig. 1과 같다.
[Table 1.] Chemical composition of feed solution for algae growth
Chemical composition of feed solution for algae growth
조류의 성장이 정체기에 도달하는 10일간 배양 후, 침전 및 원심분리에 의해 조류를 분리하고, 분리된 조류는 탈이온수를 이용하여 3회 세척하여 잔류 영양염류를 제거하였다.분리된 조류는 실험 수행 전에 탈이온수와 혼합하고 이 혼합액의 Chl-a 농도를 측정하여 표준 조류 혼합액으로 이용하였다. 실험 수행 시, 이 조류 혼합액을 탈이온수와 혼합하여 원하는 농도의 조류 현탁액을 제조하여 이용하였다(Cheong, 2008; Clescerl et al., 2010).
전기응집을 위한 전극으로는 99% 알루미늄 소재 및 99% 철 소재를 폭, 길이 및 두께 각각 2 cm, 15 cm, 0.5 cm으로하여 전극을 사용하였으며, 전극 사용 후 지속적인 재사용을 위해 반응 후 전극을 0.1 M의 HCl 용액에 1일간 담구어 세척 후 사용했다.
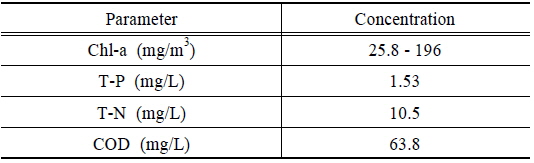
실험에 사용된 조류는 현재 환경부에서 고시하고 있는 조류예보제의 조류 대발생 기준 100 mg/m3 를 기준으로 하여 회분식 실험 시 Chl-a의 농도를 150 mg/m3 을 사용하였고 연속식 실험 시 Chl-a의 농도를 25.8 ~ 196 mg/m3 을 사용했다.
회분식 실험은 1 L 유리 비이커에 조류 현탁액 1 L를 주입하고, 전해질 농도를 0.1 g/L NaCl로 조절한 후, 이 현탁액에 전극을 침지시킨 후, 150 rpm으로 교반하면서, 전원공급장치(SI-30200A. CNG)를 이용하여 일정량의 전류를 공급하여 수행하였다. 정해진 시간에 따라 시료를 채취하고, 시료를 1 시간 침전시킨 후, 상등액을 채취하여 Chl-a 농도를 분석하였다.
응집 공정에 있어서 오염물이 제거되는 특성은 응집 플록의 표면전하를 측정함으로써 평가할 수 있기 때문에 알루미늄 및 철 전극의 표면 전하를 측정하고자 1시간 동안 10분 간격으로 시료를 채취하여 플록의 제타전위(zeta potential)를 측정하였다. 회분식 실험을 통하여 알루미늄 및 철 전극 종류에 따른 차이, 전류 밀도(10, 20, 30 mA/cm2) 및 전극의 면적(40, 80, 120 cm2)의 차이, 초기 pH에 따른 차이 등에 따른 Chl-a 및 인의 제거에 대한 실험을 진행했다. T-P 제거 실험은 각 실험 조건에서 20분간 전기응집 반응 후 30분간 100 rpm으로 교반후 1시간 침전 시킨 다음 상등액을 측정했다.
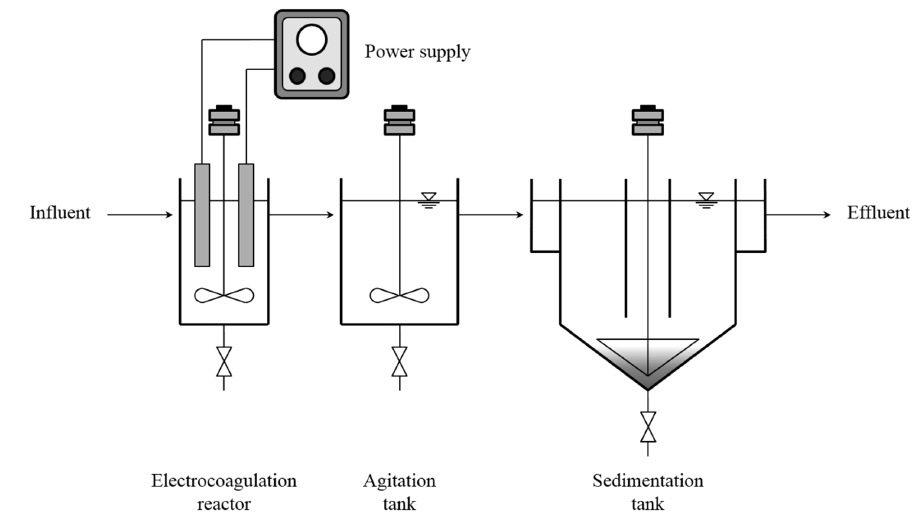
연속식 실험에 사용된 전기응집반응기는 실험실 규모로 제작, 이용하였다(Fig. 2). 유량은 0.33 L/min 이었고, 각 반응조의 수리학적 체류시간은 전기응집 반응조, 탈기를 위한 교반조 및 침전조가 각각 3, 15 및 60분이었다. 전기응집 반응조와 교반조의 교반속도는 각각 150과 50 rpm 이었다.
일반적으로, 전기응집에 의한 조류 제거 시에는 고액분리 수단으로 용존공기 가압부상을 이용한다. 그러나, 용존공기 가압부상은 공기압축기, 부속배관 및 필요 시 계면활성제 등을 이용하므로, 중력식 침전에 비해 시설비와 운영비가 더 소요될 수 있다(Wiley et al., 2009). 그러므로, 본 연구에서는 전기응집 시 물의 전기분해에 의해 발생하는 기체 (O2, H2 등)의 탈기 및 중력식 침전에 의한 고액분리 가능성을 검토한 후, 상기의 공정을 제안하였다. 침전성 검토는 1 L의 조류 혼합액을 알루미늄 전극을 이용한 전기응집 반응조에서 3 분간 반응시킨 후, 각각 10, 50 및 150 rpm에서 15분 간 교반하고 이를 1 L 매스 실린더에 주입하여, 30 분 침전 후 스컴(scum) 층, 상등수 층, 그리고 농축 슬러지 층의 Chl-a 농도를 측정하여 수행하였다.
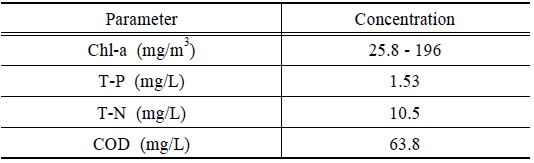
원수 및 처리수의 Chl-a 및 영양염류 등은 Standard method (Clescerl et al., 2010)에 의거하여 분석하였으며 제타전위(zeta potential)은 제타전위 측정장치(Zetaplus, Brookhaven)를 사용하여 측정했다. 제타전위 측정 시 5 A/m2의 전기 밀도 조건에서 용출된 알루미늄 및 철 콜로이드(colloid)의 표면전하를 측정하였으며 이때 pH는 1 M의 HCl과 NaOH를 이용하여 pH 6.5로 설정했다. 연속실험 시 유입수의 조건은 Table 2와 같다.
[Table 2.] Influent quality for continuous electro-coagulation experiment
Influent quality for continuous electro-coagulation experiment
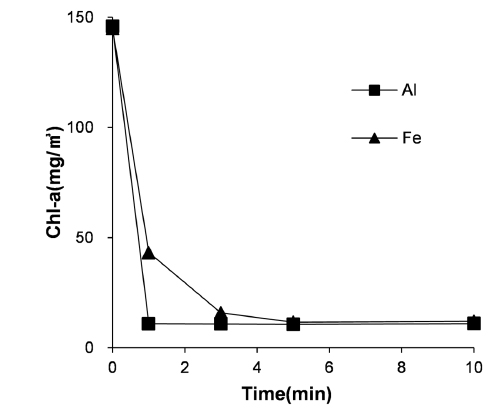
전극 종류에 따른 조류의 제거 효율을 알아보기 위해 알루미늄 재질의 전극과 철 재질의 전극에 대한 비교 실험을 진행했다. 이때 시간에 따른 Chl-a의 잔류 농도 변화는 Fig. 3과 같다. 알루미늄 전극을 이용한 경우 약 1분 만에 Chl-a가 급격히 낮아지는 것이 확인되지만 철 전극을 사용시 5분 이후에 낮은 농도로 수렴하는 것이 확인된다. 상기 결과는 알루미늄 전극에 의한 전기응집 또는 알루미늄염에 의한 화학적 응집이 철 전극 또는 철염에 비해 조류 제거에 유리함을 나타내며, 이는 기존 연구결과와 일치하는 것이다(Hong, 2008; Im et al., 2003; Lin et al., 1971; Rahmani, 2008).
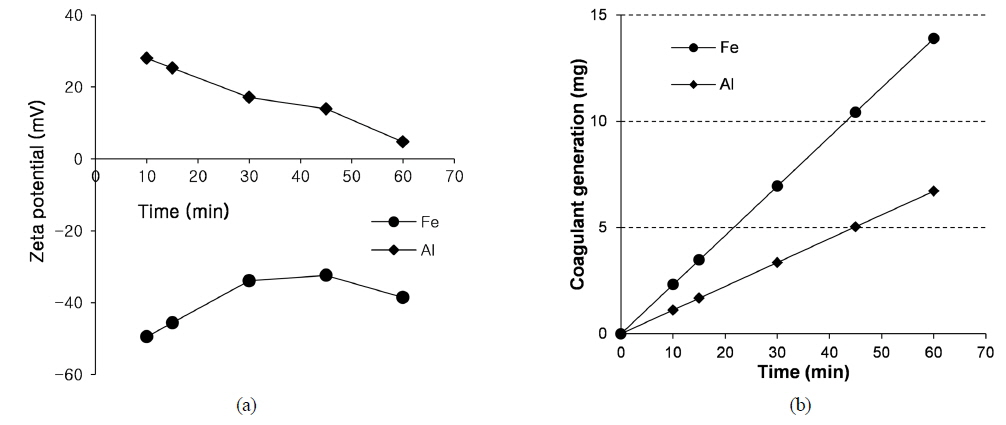
알루미늄이 철에 비해 조류 제거에 유리한 것은 생성되는 플록의 정전기적 특성에 기인하는 것으로 생각된다. 알루미늄 및 철 전극의 표면 전하를 측정하고자, 탈이온수와 전해질(0.1 g/L NaCl)만 존재하는 상태에서 전류를 공급하여, 생성되는 플록의 제타 전위를 측정하였다(Fig. 4(a)). 전체 60 분의 반응시간 동안, 알루미늄 플록은 양의 제타전위를 나타내었으며, 철 플록은 음의 제타전위를 나타내었으며, 이는 기존 문헌과 일치하는 결과이다(Trompette and Vergnes, 2009). 조류가 음의 표면전하를 가지므로, 알루미늄 전극이 철 전극에 비해 조류 표면과의 정전기적 인력이 높아, 조류제거에 있어 더 유리할 수 있다(Kim et al., 2014). 문헌에 의하면, 알루미늄 전극은 음의 전하를 가지는 입자성 물질 (SS, 조류 등) 및 Ortho Phosphate (PO43--P) 제거에, 철 전극은 양의 전하를 가지는 중금속 제거에 더 유리한 것으로 알려져 있다(Gao et al., 2010; Irdemez, Demircioglu et al., 2006; Irdemez, Sevki Yildiz et al., 2006; Kim et al., 2014).
또한, 상기 제타전위 측정을 위한 실험에서 각 전극에 의해 발생되는 플록의 양을 측정하였으며, 철 플록의 단위중량이 알루미늄이 보다 더 높아 생성되는 슬러지의 양이 더 많은 것을 알 수 있다(Fig. 4(b))(Lemos and Faria (2007)). 이는 조류의 제거에 있어서는 플록의 정전기적 특성이 플록의 양에 비해 더 크게 영향을 미치는 것을 의미한다.
한편, 알루미늄 플록의 제타전위는 반응시간이 증가함에 따라 감소하였다. 이는 반응시간에 따라 pH가 증가하면서 수산화 알루미늄(Al(OH)3) 등 알루미늄 침전에 소모되는 양에 비해 많은 양의 OH-가 양극에서 생성되어, 플록 표면에 축적되었기 때문으로 생각된다(Trompette and Vergnes, 2009). 한편, 전기응집 시스템에서 생성되는 철 플록은 magnetite (Fe3O4) 등의 철 산화물로 구성되어 있으며(Kim et al., 2013), magnetite는 전해질 농도 10−4-10−2 M (KCl)에서, pH 5 이상에서 음의 제타전위를 가진다(Erdemoğlu and Sarıkaya, 2006).
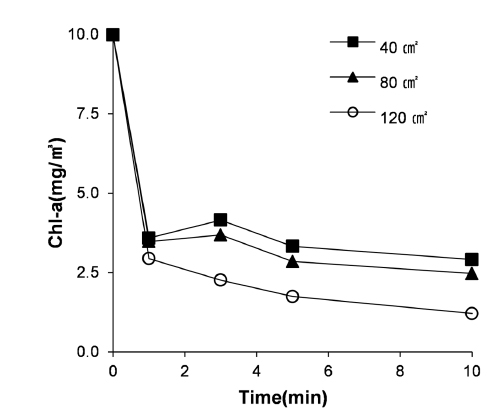
전극의 면적에 따른 Chl-a의 제거 효과는 Fig. 5와 같다. 전극의 면적이 클수록 제거효율이 증가하였다. 전극면적이 40 cm2에서 80 cm2로 증가하였을 때에는 Chl-a 제거율이 약간 증가하였으나, 전극 면적이 120 cm2일 때에는 제거율이 크게 증가하였다. 이는 동일한 전류 밀도 조건임에도 전극 면적이 증가함에 따라 용출되는 알루미늄 양이 증가하였기 때문으로 생각된다. 이러한 현상은 아래에 나타난 패러데이 법칙(Faraday’s law, 식 (1))에 의하여 설명할 수 있다. 즉, 용출되는 이온의 양은 전류 밀도, 전극 면적, 시간 등에 비례하므로 이에 따른 조류의 제거 효율이 증가한다(Xu et al., 2007).
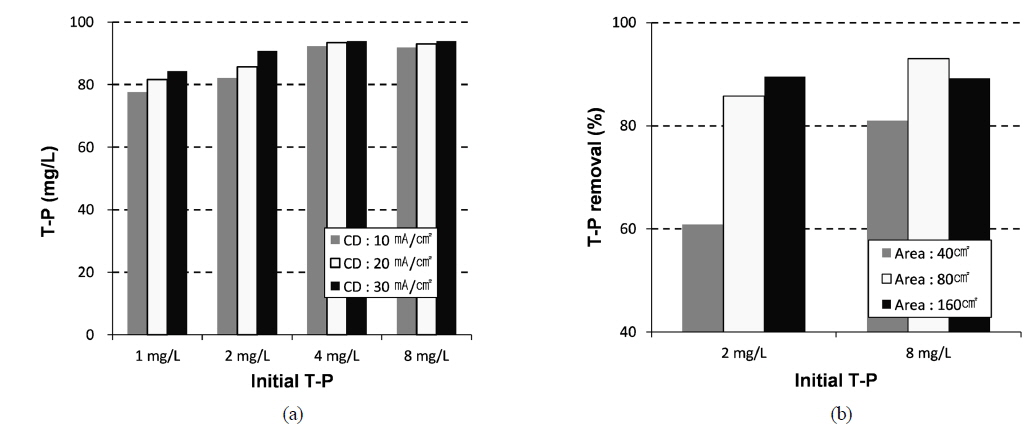
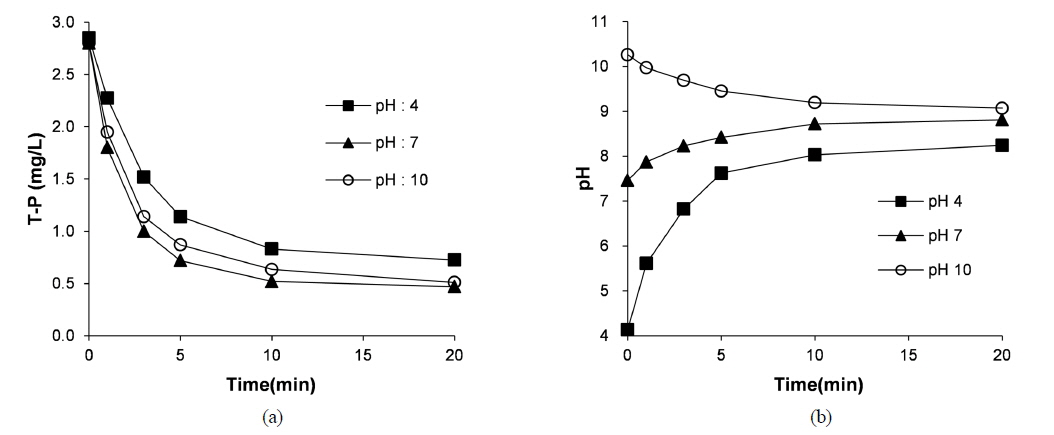
전극의 면적 및 전류 밀도에 따른 영양염류의 제거율을 평가하기 위해 초기의 총인(T-P) 농도별 회분식 실험을 수행하였다. Chl-a 제거실험 결과와 같이, 실험 결과, 총인 농도가 높고 전극면적이 넓으며 전류밀도가 증가할수록 총인 제거율이 높은 것으로 나타났다(Fig. 6). 초기 pH를 달리 하였을 때 총인 제거율 및 시간별 pH 변화는 Fig. 7과 같다. 총인 제거율은 초기 pH가 중성일 때(7) 가장 높았으며(Fig. 7(a)), 반응 중에 pH가 계속 변화하여, 초기 pH가 4, 7 및 10일 때, 최종 pH는 각각 8.24, 8.81 및 9.07이었다(Fig. 7(b)). 상이한 초기 pH에 따른 총인 제거율 변화는 각 pH에서의 Al 화학종의 차이와, 이에 따른 상이한 응집 메커니즘에 기인하는 것으로 생각된다.
전기응집 시, pH가 낮을 때에는 양의 전하를 가지는 단량체(monomer) 및 중합체(polymer) Al 화학종(Al3+, Al(OH)2+, Al2(OH)24+, Al3(OH)45+, Al6(OH)153+, Al7(OH)174+, Al8(OH)204+, Al13O4(OH)247+, Al13(OH)345+) 들이 주로 존재하여, 음의 전하를 가지는 오염물의 전하를 중화시켜(charge neutralization) 오염물이 제거된다. 반면, pH가 충분히 높을 때에는 무정형의 수산화 알루미늄(Al(OH)3) 침전이 형성되어(“sweep flocculation”) 오염물이 제거된다(Mouedhen et al., 2008). 본 연구에서 초기 pH 7에서의 총인 제거율이 초기 pH 4일 때에 비해 높았으므로, Al 전극을 이용한 전기응집에 의한 인 제거에는 “sweep flocculation”이 가장 큰 역할을 하는 것으로 생각된다. 총인 제거를 위해 화학적 응집을 적용할 때에도, 최적 pH는 Al(OH)3 침전이 가장 많이 형성되는 7.6 정도로 알려져 있다(Driscoll and Schecher, 1990). 한편, 초기 pH 10일 때 총인 제거율이 낮은 것은, pH가 매우 높거나 양극에서 OH-가 많이 발생되면, OH-가 플록에 축적되어 플록이 음전하를 띄게 되어, 음의 전하를 가지는 오염물 제거율이 감소하기(Trompette and Vergnes, 2009) 때문으로 생각된다.
3.2. 연속식실험을 통한 조류, 영양염류 및 유기물의 제거
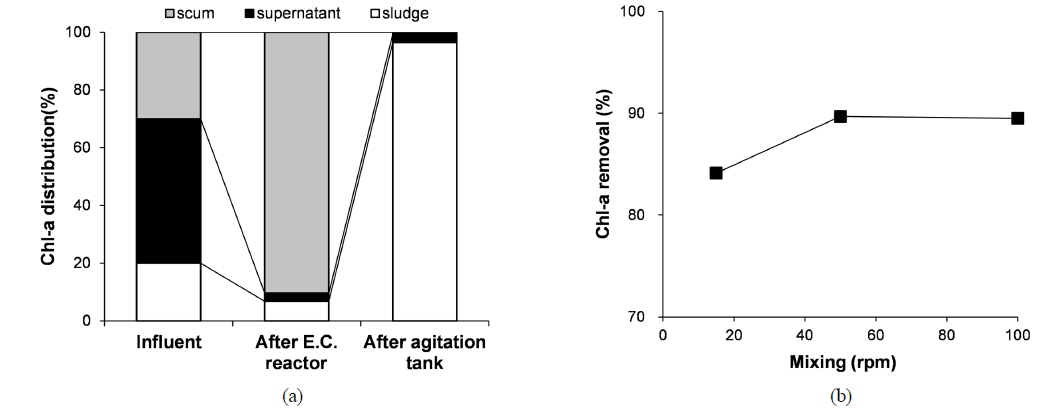
연속식 실험에서 조류제거를 평가하는데 있어서 중요한 운전인자 중 하나는 전기응집 반응 후 교반의 유무 및 교반속도라 할 수 있다. 따라서 Fig. 8(a)과 같이 전기응집 반응 전, 전기응집 반응 후, 교반 후 등 3가지 경우로 나누어 조류가 분포하는 영역을 확인하기 위하여 전기응집조 유입수, 유출수 및 교반조에서의 유출수를 채취하여 Chl-a의 분포를 분석했다. 전기응집조 유입수에서는 조류 성분이 스컴층, 수용액층과 하부의 슬러지층에 고르게 분포하고 있다. 교반을 하기 전의 전기응집조 유출수 시료에서는 대다수의 조류가 상층부 5 cm에 주로 존재하고 있으며 이는 전기응집 시 발생되는 기포가 응집 플록을 포집하여 상층부로 부상시키기 때문인 것으로 생각된다(Gao, Du et al., 2010). 교반조 유출수에서는 대부분의 조류가 하부 8 cm에 분포하는 것으로 확인되었다. 이는 교반조에서 전기응집 시 발생하였던 기포를 교반을 통해 제거하여 침전성을 향상시켰기 때문으로 생각된다. 전기응집 공정 적용 시, 고액분리는 부상 뿐만 아니라 교반을 통해 슬러지의 침전을 유도하여 고액분리가 가능할 것으로 판단되며, 이 때 부상에 필요한 공기압축기 및 관련 시설비와 전력비 등 운전비를 절감할 수 있을 것으로 생각된다. 교반 시 교반속도에 따라 조류가 침전되는 정도가 달라지기 때문에 교반속도를 일반적 운전범위인 10, 50, 100 rpm으로 변화시키며 실험을 진행한 결과는 Fig. 8(b)와 같다. 50 rpm의 교반속도가 다른 교반속도보다 효과적인 것으로 확인 되며 교반속도가 10 rpm일 경우 기포제거 성능이 떨어져서 침전성이 저하되고 교반속도가 100 rpm일 경우 응집 침전되는 플록이 깨져 침전성의 저하를 유발하는 것으로 확인되었다. 때문에 효과적인 침전을 위해서는 약 50 rpm 정도가 적절할 것으로 판단된다.
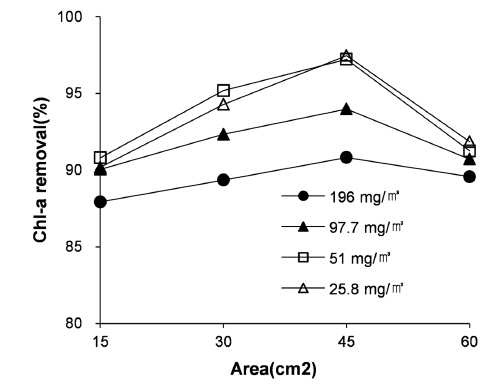
초기 Chl-a의 농도를 달리하여 전극의 면적별 실험을 진행한 결과는 Fig. 9와 같다. 전극의 면적이 증가할수록 Chl-a의 제거 효율이 증가하게 된다. 그러나 60 cm2과 같은 과다한 전극 표면적의 증가는 전극 표면적에서 생성되는 기포의 증가로 인하여 침전성이 저하되기 때문에 제거효율이 감소하는 것으로 확인된다. 또한 Chl-a의 농도가 높고 낮음에 크게 영향을 받지 않고 초기 Chl-a의 농도의 크기에 상관없이 약 90% 이상의 제거 효율을 보여주는 것으로 확인된다.
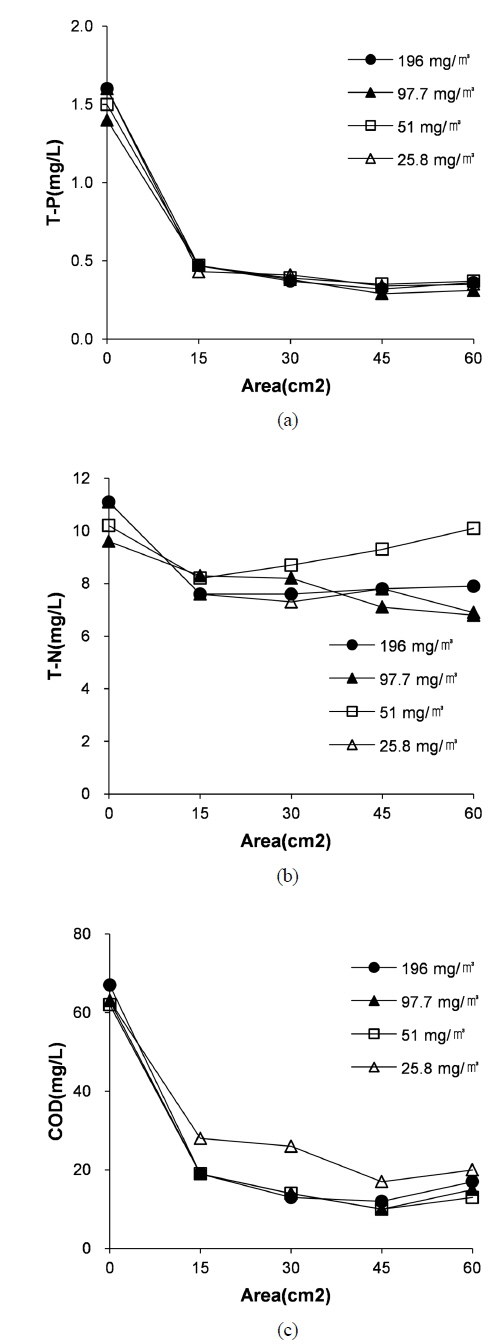
연속식 공정에서의 조류성분의 제거와 함께 수용액 내에 존재하는 영양염류 및 유기물에 대한 제거효과의 평가를 위해 T-P, T-N, COD의 제거를 위한 실험을 전극의 면적별로 수행하였으며 결과를 Fig. 10과 같다. T-P 및 COD는 약 75-85%의 높은 제거효율을 갖는 것으로 확인되는데 T-P는 식 (2)와 같은 응집 반응에 의하여 제거되며 COD는 조류 내에 포함되어 있는 유기물질이 응집, 침전을 통하여 조류와 같이 제거 되는 것으로 판단된다. 초기 조류의 농도가 다르더라도 영양염류 및 유기물에 대한 제거율은 크게 다르지 않은 것으로 확인된다. 전극의 면적이 증가함에 따라 제거율이 증가하나 그 차이가 크지 않은 것으로 보이며, 질소의 경우 제거율이 약 24%인 것이 확인되는데 이는 기존의 연구 결과와 유사하다(Kim and Kang, 2003).
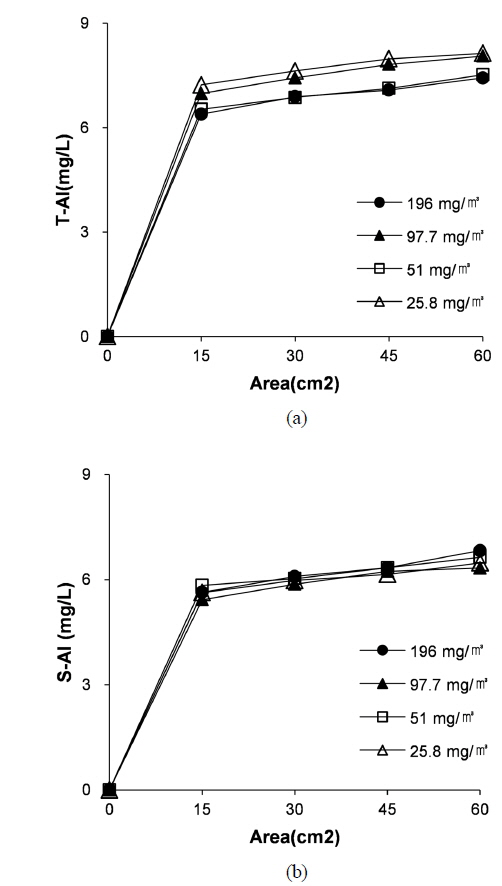
잔류 응집제는 응집 공정에서 유발될 수 있는 문제점 중 하나이다. 자연 수계에 존재하는 알루미늄은 약 0.001 - 0.05 mg/L 정도이지만 잔류된 알루미늄이 0.5 - 1 mg/L 정도로 상승하게 되면 수계내 독성물질을 가질 수 있으며 알츠하이머 병을 유발하는 것으로 알려져 있다(WHO, 1998; Tomperi et al., 2013). 따라서 본 연구에서는 잔류되는 알루미늄을 측정하였으며 Fig. 11과 같다. Fig. 11(a)는 상등액에 존재하고 있는 모든 알루미늄의 양을 측정한 값이고, Fig. 11(b)는 상등액에 존재하는 용존 알루미늄의 양만을 측정한 결과이다. 많은 양의 잔류 알루미늄이 상등액에 용존되어 있는 것이 확인되었으며 초기 조류의 양은 잔류하는 알루미늄의 양에 영향을 미치지 못하는 것으로 판단된다.
조류의 효과적인 제거를 위해 전기응집을 회분식 및 연속식 실험을 통하여 전류밀도, 전극의 면적, pH, 응집 시 교반강도, 조류의 초기 농도 등에 대한 실험을 실시한 결과 다음과 같은 결론을 얻을 수 있었다.
1) 전기응집을 통한 조류제거에 있어서 알루미늄 응집 플록은 표면전하가 양(+)의 전하를 띠기 때문에 음(-) 전하를 띠는 철 전극에 비하여 적합한 전극재료로 사용될 수 있다.
2) 초기 pH가 다르더라도 반응 후에는 약 pH 9 정도 값에 수렴하게 되는데 이는 전기응집 시 발생하는 전기분해에 의한 OH- 이온에 의해 pH가 중성보다 약간 높은 pH 9에 수렴하게 되는 것으로 판단되며 중성의 초기 pH 영역에서 높은 인 제거율을 보였다.
3) 전기응집 반응 시 기포가 발생하기 때문에 전기응집 후 침전 제거를 위해서는 전기응집 슬러지의 교반을 통해 기포를 제거해야 하며 교반 강도는 50rpm이 적합한 것으로 판단된다.
4) 연속식 실험에서 Chl-a의 농도가 25.8~196 mg/m3의 범위 내에서 87.9~97.5%의 제거 효율의 범위를 보이는데 이는 환경부에서 운영중인 조류 대발생의 기준이 되는 Chl-a 농도 100 mg/m3의 조류에 대해서도 제거가 가능한 범위로써 다양한 조류발생에 적용이 가능하다.
5) 전류 밀도가 높고 전극 면적이 증가함에 따라 조류제거 효율은 증가한다. 이러한 결과는 전기응집에 의해 생성되는 알루미늄 플록의 발생량이 전류 밀도 및 전극 면적에 따라 증가하기 때문으로 생각된다. 하지만 일정 면적 이상에서는 전기응집 시 발생하는 기포의 양이 급격히 증가하여 플록의 침전성이 저하된다.
6) 전기응집을 사용할 시 잔류 알루미늄에 대한 고려가 필요할 것으로 판단된다.
7) 총인이나 COD에 대해서는 75% 이상의 높은 제거효율을 가지나 총질소의 경우 약 24%의 낮은 효율을 갖기 때문에 총질소의 제거를 위해서는 추가적인 공정이 필요할 것으로 판단된다.