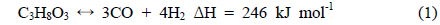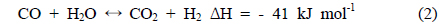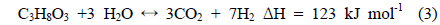In this study, we investigated the structure and properties of a highly heat conductive metal-ceramic core-shell CoAl2O4@Al micro-composite for heterogeneous catalysts support. The CoAl2O4@Al was prepared by hydrothermal surface oxidation of Al metal powder, which resulted in the structure with a high heat conductive Al metal core encapsulated by a high surface area CoAl2O4 shell. For comparison, CoAl2O4 was also prepared by co-precipitation method and also utilized for a catalyst support. Rh catalysts supported on CoAl2O4@Al and CoAl2O4 were prepared by incipient wetness impregnation and characterized by N2 adsorption, X-ray diffraction (XRD), scanning electron microscopy (SEM), CO chemisorption, and temperature-programmed reduction (TPR). The properties of catalysts were investigated for glycerol steam reforming reaction for hydrogen production at 550 ℃. Rh/CoAl2O4@Al exhibited about 2.8 times higher glycerol conversion turnover frequency (TOF) than Rh/CoAl2O4 due to facilitated heat transport through the core-shell structure. The CoAl2O4@Al and CoAl2O4 also showed some catalytic activities due to a partial reduction of Co on the support, and a higher catalytic activity was also found on the CoAl2O4@Al core-shell than CoAl2O4. These catalysts, however, displayed deactivation on the reaction stream due to carbon deposition on the catalysts surface.
최근 화석연료의 급격한 사용에 따른 자원고갈, 지구온난화 및 환경오염 등의 문제 해결을 위한 방안으로 미래의 새로운 대체에너지 개발이 대두되고 있다. 그 중에서 수소는 무공해 청정 에너지원으로서 수소연료전지를 적용한 미래의 연료전지 자동차, 주거 및 산업용 전력생산 분야에서 필수적인 신에너지원으로써 그 중요성이 증대되고 있다. 현재의 상업화된 수소생산 기술은 천연가스의 촉매화학적 개질반응과 석유 화학 원료의 탈수소화 부산물 등에 그 기반을 두고 있으나, 대체원료를 이용한 고부가가치 수소제조 기술의 개발은 향후 그 중요성이 매우 커질 것으로 기대된다. 특히, 바이오매스를 원료로 한 수소의 생산은 그 특성상 친환경적이며 미래지향적 부가가치화 기술로 평가된다[1-4]. 예를 들어, 최근의 바이오디젤 생산 및 사용량 증가에 따른 저급 글리세롤 부산물(원재료의 약 10%)의 지속적 증가는 공급과잉에 따른 가치 하락과 더불어 바이오디젤의 경쟁력 제고에도 제한적 영향을 미치고 있는 것으로 평가되고 있다[5,6]. 따라서, 이러한 저부가 가치 글리세롤 부산물을 고부가가치 청정연료인 수소로 전환하여 이용하는 방안은 바이오매스 전환을 통한 수소제조의 주요 분야로 최근 연구와 개발이 지속적으로 진행되고 있는 실정이다[7,8].
글리세롤 수증기 개질반응(glycerol steam reforming)은 글리세롤의 탈수소화(dehydrogenation)와 수성가스이동(watergas-shift) 반응으로 표현되며, 그 반응식은 다음과 같다.
• 탈수소화반응
• 수성가스이동반응
• 수증기 개질반응
글리세롤 수증기 개질반응의 촉매로는 알루미나 또는 활성탄 등에 담지 된 Ni[9], Co[10], Pt[11], Rh[12], Ru[13], Ir[14] 등의 전이금속 촉매들에 대한 연구가 최근에 보고되었다.
스피넬(spinel)로 일컫는 금속산화물은 넓은 비표면적, 우수한 열적, 화학적, 기계적 안정성으로 인하여 불균일계 촉매의 담지체로서 사용된다[15-17]. 대표적인 스피넬 구조체인 MgAl2O4는 메탄 개질 반응[18,19]과 에탄올 개질 반응[20] 등에 다양하게 연구되고 있다. 최근의 연구에서 우리는 간단한 수열합성법에 의하여 스피넬 복합산화물 shell과 알루미늄 금속 core로 이루어진 MgAl2O4@Al, CoAl2O4@Al, ZnAl2O4@Al Core-Shell 구조체를 합성하였다[21]. 특히, Rh/MgAl2O4@Al의 경우 Rh/MgAl2O4 보다 글리세롤 수증기 개질 반응에서 40% 가량 높은 촉매적 반응활성을 나타내었으며 Rh의 소결 또한 줄어드는 것을 확인하였다[21]. 이는, 금속-세라믹 Core-Shell로 이루어져 있는 구조체가 갖는 높은 열전달과 물질전달 특성 때문에 불균일계 촉매의 지지체로 사용되었을 때 촉매의 활성을 증진시킨 것으로 보여진다. 또한 구조체의 우수한 표면 모폴로지 특성에 따라 분산된 촉매입자의 소결 또한 줄어들어진 것으로 평가되었다.
본 연구에서는 Al 금속분말을 재료로 하여 수열반응에 의하여 합성된 열전도성이 향상된 CoAl2O4@Al Core-Shell 구조체를 담지체로 하여 Rh/CoAl2O4@Al 촉매를 합성하고, 이를 글리세롤 수증기 개질반응에 적용하여 그 촉매화학적 특성을 연구하고 고찰하였다. 또한, 결과물의 특성비교를 위하여 공침법을 이용하여 얻은 CoAl2O4를 CoAl2O4@Al와 동일한 온도에서 소성한 후 Rh/CoAl2O4 촉매를 합성하고 글리세롤 수증기 개질반응에 적용하여 결과를 고찰하였다.
Core-shell CoAl2O4@Al 복합 구조체는 Al 금속분말(good fellow, ϕ ≤ 25 µm)의 수열 산화반응에 의하여 얻었다[21]. 2 g의 Al 금속분말을 0.93 M 코발트 전구체(Co(NO3)2・6H2O, Alfa) 수용액 40 mL에 넣고 고압반응기에서 교반 하에 150 ℃에서 3 h 동안 합성하였다. 반응기 내부의 온도는 PID 온도 조절기를 사용하여 제어하였다. 이 결과물을 증류수로 수차례 세척하고 여과한 후, 120 ℃에서 12 h 건조하고, 550 ℃에서 4 h 동안 소성하였다.
특성비교를 위한 CoAl2O4 담지체는 공침법(coprecipitation)으로 제조하였다. 0.5 M 코발트 전구체(Co(NO3)2・6H2O, Alfa) 수용액 200 mL와 1.0 M 알루미늄 전구체(Al(NO3)3・9H2O, Junsei Chem.) 수용액 200 mL을 혼합하고, 이 혼합용액에 8 M의 암모니아수를 조금씩 첨가하고 충분히 교반하며 pH 9.5를 유지하면서 침전물을 얻었다. 생성된 결과물은 수 차례 세척하고 여과한 후, 120 ℃에서 12 h 건조하고, 550 또는 800 ℃에서 4 h 동안 소성하여 CoAl2O4 담지체를 얻었다.
Rh/CoAl2O4@Al과 Rh/CoAl2O4 촉매는 Rh전구체(RhCl3・xH2O, Alfa) 수용액을 위에서 합성한 담지체에 단순침적법 (incipient wetness impregnation)으로 담지하여 합성하였다. 합성된 촉매는 120 ℃에서 12 h 건조하고, 550 ℃에서 4 h 동안 소성 한 후 250~425 µm 크기의 팰렛으로 성형하여 글리세롤 개질반응에 사용하였다. Rh의 담지량은 두 촉매에서 3 wt.%로 동일하였다.
촉매의 표면형상을 분석하기 위해 주사전자현미경(scanning electron microscope, XL-30 FEG, FEI)을 사용하였고, EDX (energy dispersive X-ray spectroscopy) 분석을 통해 촉매 구조체 표면의 조성특성을 분석 하였다. 또한 촉매 구조체의 결정성 및 담지된 Rh 입자의 크기를 측정하기 위해 X-선 회절(X-ray diffraction, X’Pert PW 3040, Philips) 분석을 이용하였다. X-선은 파장 1.5406 Å의 Cu-Kα를 이용하여 40 kV, 30 mA의 조건으로 사용하였고, 스캔범위는 20~90°, 스캔간격은 0.05°, 스캔속도는 1초/step으로 적용하였다. 분석을 위한 촉매들은 수소 분위기하에서 10 ℃ min−1로 승온시킨 후, 550 ℃에서 0.5 h 동안 환원 처리하였다. 분산된 Rh 촉매입자의 크기는 Debye-Scherrer 방정식으로 계산하였다. 또한 촉매의 비표면적, 기공부피, 기공크기의 분포도를 측정하기 위해서 250 ℃에서 4 h 동안 진공분위기에서 전처리 후 77 K에서 질소 흡-탈착 분석을 진행 하였다(NOVA 2200e, Quantachrome). 촉매의 표면적과 기공크기는 각각 Brunauer-Emmett-Teller (BET)와 Barrett-Joyner-Halenda (BJH) 이론을 적용하여 계산하였다.
촉매의 특성분석을 위하여 승온환원법(temperature-programmed reduction, TPR)을 적용하여 촉매의 환원특성을 측정하였다 (Autochem II 2920, Micromeritics). 0.1 g의 촉매를 반응기에 충전 후 10 mol% H2/Ar을 50 mL min-1의 속도로 흘려주며 온도를 10 ℃ min−1으로 상온에서 800 ℃까지 승온시키면서 특성분석을 진행하였다. Rh 촉매의 분산도(dispersion)는 일산화탄소(CO) 화학흡착법을 이용하여 얻었다. 이를 위하여 촉매를 550 ℃에서 0.5 h 동안 수소 분위기하에 환원하고, 헬륨 퍼징(purging) 하에 35 ℃로 냉각시킨 후, 10 mol% CO/He을 펄스로 주입하여 촉매로의 CO 흡착량을 계산하였다.
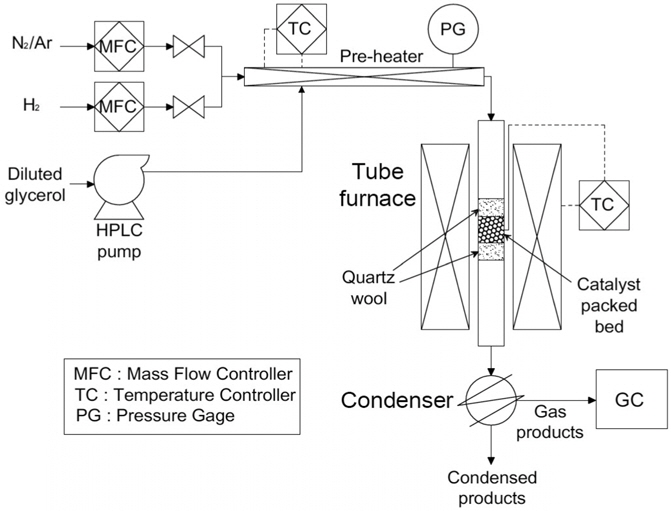
글리세롤 수증기 개질 촉매반응 연구를 위한 실험장치의 모식도를 Figure 1에 나타내었다. 글리세롤 수증기 개질 반응은 고정층 석영 반응기(외경: 10 mm, 내경: 8 mm, 길이: 450 mm)에 촉매 0.1 g 을 충진하고 550 ℃ 상압 조건에서 수행하였다
반응기는 수직형 관로(tubular furnace)에 설치되었고 반응온도는 반응기 외벽에 부착된 열전쌍(k-type thermocouple)과 PID 온도 조절기를 사용하여 제어 하였다. 촉매는 전처리를 위하여 H2를 50 mL min−1로 흘리면서 550 ℃에서 0.5 h 동안 환원하였고, Ar을 100 mL min−1으로 30 min 동안 흘려주어 잔류 H2를 제거 하였다. 반응물인 글리세롤 수용액(증류수/글리세롤 molar ratio = 4.5)은 HPLC 펌프(Series II, LabAlliance)를 이용하여 350 ℃로 예열된 관을 거쳐 증발, 예열된 후 반응기로 유입하였다. 반응물의 carrier gas로 1 mol% N2 (internal standard)가 포함된 Ar를 이용하였다(Ar/반응물 molar ratio = 0.74). 최종적으로 가스화된 반응물의 weight hourly space velocity (WHSV)를 17,000 또는 34,000 mL g−1 h−1로 흘려주어 반응실험을 수행하였다. 반응기 후단의 액체 생성물 및 미반응물은 −4 ℃에서 응축기를 이용하여 분리하였고, 가스 생성물은 열전도감지기(thermal conductivity detector)가 장착된 가스 크로마토그래프(gas chromatograph, 7890A, Agilent)를 이용하여, 일정한 간격으로 실시간 분석하였다. 글리세롤의 반응 전환율 및 생성물의 선택도는 다음과 같이 정의되고 평가되었다.
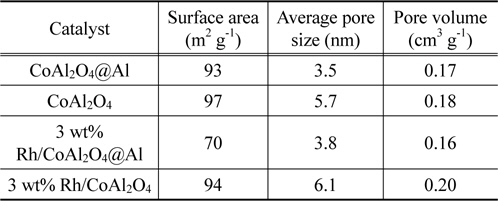
Rh 촉매의 담지체로 사용된 CoAl2O4@Al core-shell 구조체와 CoAl2O4, 그리고 Rh/CoAl2O4@Al 및 Rh/CoAl2O4 촉매의 비표면적, 평균 세공크기, 기공부피 측정결과를 Table 1에 나타내었다. CoAl2O4@Al와 CoAl2O4의 비표면적은 각각 93과 97 m2 g−1로 비슷하였고 총 기공부피 또한 0.17과 0.18 cm3 g−1로 유사한 값을 나타내었다. 그러나 평균 기공크기는 CoAl2O4@Al core-shell 구조체에서 3.5 nm로 CoAl2O4 (5.7 nm)보다 작은 것으로 평가되었다. 이는 Al 금속의 수열반응으로 형성된 CoAl2O4@Al 복합구조체 표면의 CoAl2O4 shell은 공침법으로 합성된 CoAl2O4에 비하여 상대적으로 높은 비표면적과 작은 기공크기를 갖는다는 것을 나타낸다. Rh이 3 wt% 담지된 Rh/CoAl2O4@Al 및 Rh/CoAl2O4 촉매에서 각각의 담지체에 비하여 비표면적의 감소를 보여주었고, 그 감소폭은 Rh/CoAl2O4@Al에서 비교적 높았다.
[Table 1.] Surface area, pore size, and pore volume of the supports and the catalysts
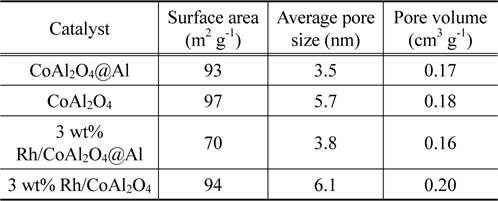
Surface area, pore size, and pore volume of the supports and the catalysts
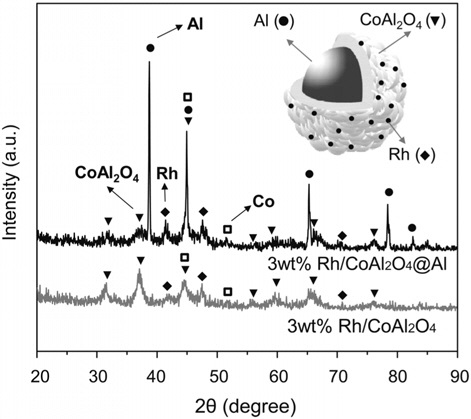
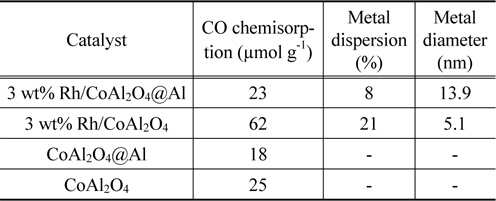
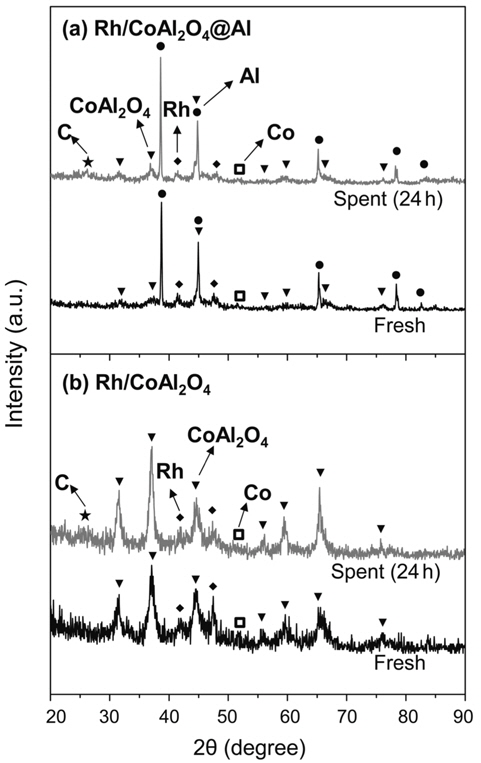
Rh/CoAl2O4@Al과 Rh/CoAl2O4 촉매의 XRD 분석결과를 Figure 2에 나타내었다. Rh/CoAl2O4@Al 촉매의 구조는 Figure 2의 오른쪽 상단에 표현된 그림과 같이 Al 금속 core와 CoAl2O4 shell로 이루어진 금속-세라믹 복합구조체 위에 Rh 입자가 분산되어 고정화 된 형태이다. 이에 따라, Rh/CoAl2O4@Al 촉매는 core-shell 담지체의 Al 금속 core에 의한 강한 회절피크 (JCPDS:04-003-6600)와 더불어 스피넬 CoAl2O4 shell에 기인한 회절피크(JCPDS:04-006-8196)가 동시에 관찰 되었다. 또한 담지된 Rh 금속에 의한 특성피크가 2θ값 41°와 48° (JCPDS: 04-016-4692)에서 관찰되었다. Rh/CoAl2O4 촉매에서도 Rh/CoAl2O4@Al과 동일한 위치에서 CoAl2O4의 피크와 Rh 입자의 회절피크가 관찰되었으나, Al 금속의 회절피크는 관찰되지 않았다. 두 촉매 모두에서 코발트(Co) 금속의 회절피크가 미세하게 관찰되었는데, 이는 산화물 담지체 중의 일부 코발트가 전처리 과정을 통하여 환원되었음을 나타낸다. 이러한 담지체의 환원특성은 전처리 온도에 따라 달라졌으며, 관련 결과는 아래에서 좀 더 자세히 다루었다. Rh/CoAl2O4@Al와 Rh/CoAl2O4 촉매에서 관찰된 Rh 입자(111) 결정면 회절피크의 FWHM (full width at half maximum) 값으로부터 Debye-Scherrer 방정식을 적용하여 Rh 입자크기를 계산한 결과 각각 13과 7 nm로 Rh의 분산도는 Rh/CoAl2O4@Al 촉매에서 다소 낮은 것으로 판명되었다. 이러한 결과는 일산화탄소 흡착에 의한 분석결과와 유사하였다. Rh/CoAl2O4@Al와 Rh/CoAl2O4 촉매의 일산화탄소 화학흡착 분석결과를 Table 2에 나타내었다. 일산화탄소는 Rh/CoAl2O4@Al와 Rh/CoAl2O4 촉매에서 각각 23과 62 µmol g−1 화학흡착 되었고, 이를 기반으로 계산된 활성금속의 분산도는 각각 8%와 21%이었다. 분산된 촉매 입자의 형상을 반구형으로 가정하여 평가된 크기는 각각 13.9와 5.1 nm로 위에 XRD 분석결과로부터 측정된 값과 매우 유사함을 확인할 수 있다.
[Table 2.] Specific properties of the supports and the catalysts obtained by CO chemisorption
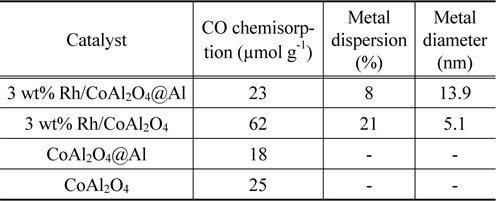
Specific properties of the supports and the catalysts obtained by CO chemisorption
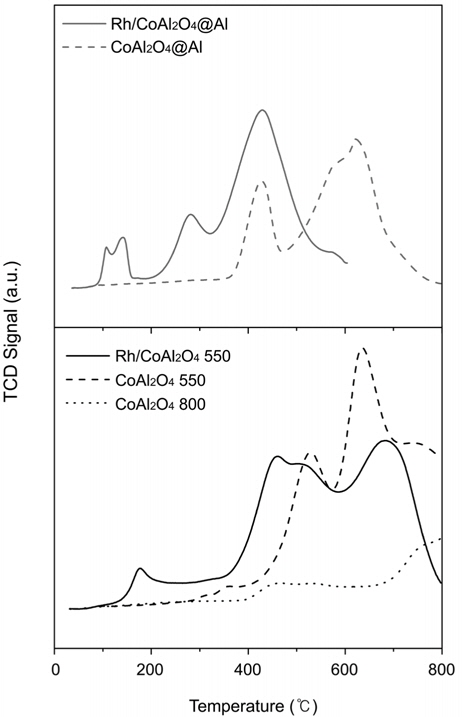
Rh/CoAl2O4@Al와 Rh/CoAl2O4 촉매의 temperature programmed reduction (TPR) 분석결과를 Figure 3에 나타내었다. CoAl2O4@Al 구조체는 430, 580, 그리고 620 ℃에서 구성 금속산화물 일부의 환원특성이 관찰되었고, CoAl2O4 담지체에서도 유사한 특성의 환원 피크가 상대적으로 높은 온도인 530, 640, 그리고 760 ℃에서 관찰되었다. 이러한 환원특성 결과는 core-shell 구조체의 CoAl2O4 shell 및 CoAl2O4 담지체상에 잔류하여 분포된 일부 코발트산화물(CoOx)에 기인한 것으로 판단된다. CoAl2O4 스피넬의 결정화도는 소성온도에 따라 다르며, 550 ℃ 이하의 소성온도에서는 미반응된 코발트산화물 (CoO, Co2O3, Co3O4)들이 미량 존재할 수 있는 것으로 알려져있다[22]. 그러나, 800 ℃ 고온에서 소성된 CoAl2O4에서는 이러한 환원특성이 대부분 사라졌으며, 이는 잔존하는 코발트 산화물들이 반응에 의하여 CoAl2O4를 형성하고 결정도를 향상시킨 것으로 판단된다. Rh/CoAl2O4@Al 및 Rh/CoAl2O4 촉매에서 이러한 잔류 코발트산화물의 환원은 보다 낮은 온도에서 일어났으며, 이는 Rh에 의한 수소의 spillover에 의한 영향으로 보여진다[22].
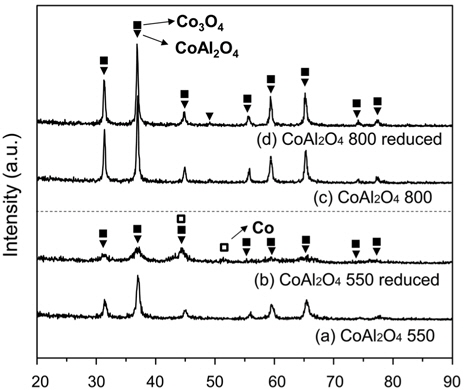
Figure 4에서는 550 ℃와 800 ℃에서 소성처리 한 CoAl2O4 시료들의 환원 전, 후 XRD 분석결과를 비교하여 나타내었다. 550 ℃에서 소성된 CoAl2O4는 동일온도에서 수소로 환원 후 CoAl2O4 회절피크가 전체적으로 줄어든 것을 확인할 수 있었다. 또한 환원된 Co 금속의 회절피크가 2θ값 45°와 52°에서 약하게 나타나는 것을 확인할 수 있었다. 반면에, 800 ℃에서 소성처리 된 CoAl2O4는 550 ℃에서 환원 후에도 CoAl2O4를 나타내는 회절피크에 변화가 없었으며 Co의 회절피크도 나타나지 않았다. 이는 고온의 소성과정을 통하여 CoAl2O4의 결정성이 크게 증가된 것을 나타낸다.
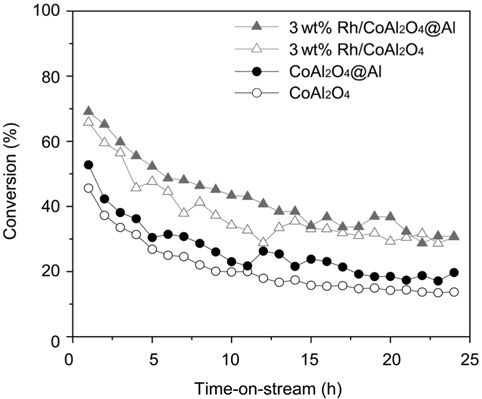
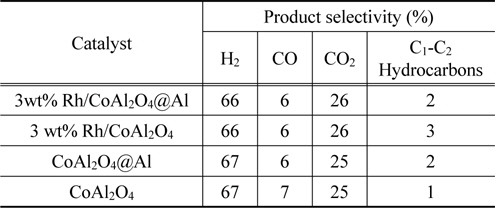
Rh/CoAl2O4@Al, Rh/CoAl2O4 촉매 및 CoAl2O4@Al, CoAl2O4 담지체의 글리세롤 수증기 개질 반응에 대한 특성을 평가하기 위한 실험을 550 ℃에서 수행하였다. Figure 5는 글리세롤 수증기 개질반응에 따른 글리세롤의 전환율을 24시간 동안 연속 측정하여 나타낸 time-on-stream 결과이다(550 ℃, WHSV 34,000 mL g−1 h−1). Rh/CoAl2O4@Al 촉매는 Rh/CoAl2O4에 비하여 동일 반응조건에서 약 3~10% 정도 높은 글리세롤 전환율을 보여주었다. 그러나, 두 촉매 모두에서 초기의 약 15시간 정도의 반응시간 동안 촉매의 비활성화에 따르는 50~60% 정도의 글리세롤 전환율 감소가 일어났으며, 이후에는 안정화되는 경향을 보여주었다. 글리세롤 수증기 개질반응에 대한 촉매적 활성은 CoAl2O4@Al 구조체와 CoAl2O4 담지체에서도 관찰되었는데, 이는 일부 코발트 산화물의 환원에 의하여 표면에 노출, 분포된 Co 금속입자에 의한 것으로 보여진다. 글리세롤의 전환율은 CoAl2O4@Al 구조체에서 CoAl2O4에 비하여 높게 나타났으며, 이들 모두에서 반응시간에 따른 글리세롤 전환율의 감소가 관찰되었다. Rh/CoAl2O4@Al과 Rh/CoAl2O4 촉매 및 CoAl2O4@Al, CoAl2O4 담지체에서의 글리세롤 수증기 개질반응에 따른 생성물의 선택도를 Table 3에 나타내었다. 이들 모두에서 생성물의 선택도는 매우 유사하였으며, 높은 수소 제조의 선택도(66~67%)와 더불어 CO (6~7%), CO2 (25~26%), CH4, 에틸렌, 아세틸렌 등의 탄화수소(1~3%) 생성이 관찰되었다.
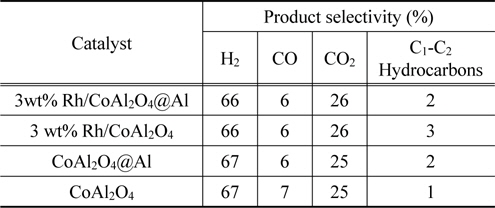
Product selectivity for glycerol steam reforming on the catalysts (550 ℃, WHSV = WHSV 34,000 mL g?1 h?1)
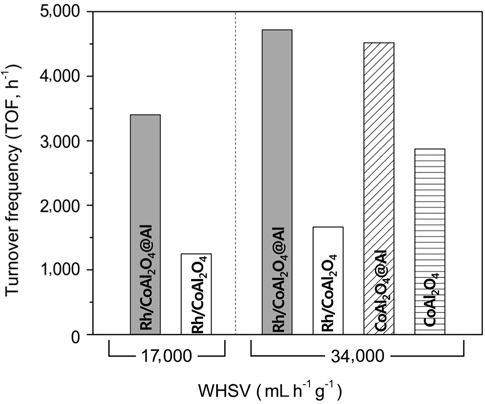
글리세롤 전환율은 Rh/CoAl2O4@Al 촉매에서 Rh/CoAl2O4보다 다소 높은 경향을 보여 주었다. 그러나, 두 촉매에서 활성금속의 분산도가 서로 다르기 때문에 Table 2에 제시된 CO 흡착량을 이용하여 각 촉매에서의 글리세롤 개질반응 turn over frequency (TOF)를 계산하고 이를 비교하였다. Figure 6에는 두 가지의 공간속도(WHSV = 17,000, 34,000 mL g−1 h−1) 조건에서 Rh/CoAl2O4@Al과 Rh/CoAl2O4 촉매에서의 글리세롤 개질반응 TOF를 비교하여 나타내었다. 두 공간속도 조건에서 Rh/CoAl2O4@Al 촉매는 Rh/CoAl2O4에 비하여 약 2.8배 높은 TOF 값을 보여주었고, 이로써 Rh 촉매의 활성이 CoAl2O4@Al 금속-세라믹 복합 구조체에 담지된 경우 크게 증가된 것을 확인할 수 있다. 이는, 금속-세라믹 core-shell 구조체는 높은 열전도성을 갖는 Al 금속의 기여로 구조체의 열전도성을 크게 향상시켜, 높은 흡열특성을 갖는 촉매반응에서 열의 이동을 용이하게 하고 촉매의 반응특성을 향상시킨다는 이전의 연구결과와 부합된다[21,23]. 글리세롤 수증기 개질반응에 대한 활성은 Rh이 담지 되어지지 않은 CoAl2O4@Al 구조체 및 CoAl2O4 담지체에서도 나타났는데(WHSV = 34,000 mL h−1 g−1), 이는 환원과정을 통하여 표면에 노출된 Co에 의한 촉매적 활성으로 판단된다. Rh/CoAl2O4@Al과 Rh/CoAl2O4 촉매에서와 마찬가지로, 글리세롤 전환반응의 TOF는 CoAl2O4@Al core-shell 구조체에서 CoAl2O4 보다 높게 나타났고 이는 금속-세라믹 복합 구조체의 우수한 열전달 특성에 의한 기여로 판단된다.
글리세롤 개질반응에서 core-shell 구조체의 안정성을 평가하기 위해서 Figure 7에 Rh/CoAl2O4@Al과 Rh/CoAl2O4 촉매의 반응 전, 후 XRD 분석결과를 나타내었다. Rh/CoAl2O4@Al는 반응 전, 후에 Al core와 CoAl2O4 shell의 회절피크의 비율 이 동일하였고, 이는 CoAl2O4@Al가 본 연구의 글리세롤 수증기 개질반응 조건에서 화학적 및 구조적으로 안정하다는 것을 나타낸다. 또한 반응 전, 후의 Rh/CoAl2O4@Al과 Rh/CoAl2O4 촉매에서 Rh 및 Co의 XRD 회절 피크의 강도 및 폭에서 변화가 없었으며, 이는 이들 촉매에 분산된 Rh 및 Co 촉매입자의 반응에 의한 소결은 미미하다는 것을 나타낸다. 그러나, 반응 후의 촉매들에서 결정성 탄소의 XRD 회절피크 (2θ = 25°)가 관찰되었고 이는 반응에 의한 촉매표면의 coking이 진행되었음을 나타낸다. Rh/CoAl2O4@Al 촉매에 대한 반응 전, 후의 SEM 분석결과를 Figure 8에 나타내었다. 반응 전의 촉매 구조체 형상은 얇은 판 모양의 CoAl2O4 구조가 Al 표면에 조밀하게 성장하여 마치 꽃잎과 같은 형상을 이루고 있는 core-shell 형태임을 확인할 수 있다. 그러나, 반응후의 촉매에서는 이러한 꽃잎과 같은 구조체들 사이에 섬유형태와 덩어리진 물질들이 엉겨 붙어 있는 것을 확인하였다. EDX를 적용한 조성분석 결과, 반응 전에는 검출되지 않았던 탄소가 반응 후에는 촉매표면에 약 50 atomic %의 높은 표면 농도로 존재하는 것을 확인하였다. 이는 SEM에서 관측된 반응 후 촉매 표면의 생성물질들은 글리세롤 수증기 개질반응을 통하여 강하게 흡착된 탄소성분들임을 알 수 있다. 글리세롤 수증기 개질 반응에서 촉매의 주요 비활성화 요인은 촉매금속 입자의 소결과 탄소침적에 의한 것임이 이전의 연구들에서 보고된 바 있다[21,24]. 상기의 XRD, SEM, EDX 조성분석 결과로 볼 때, 본 연구의 Rh/CoAl2O4@Al, Rh/CoAl2O4, CoAl2O4@Al, CoAl2O4 촉매의 주요 비활성화 원인은 촉매금속 입자의 소결보다는 반응에 의한 탄소침적이 지배적이라는 것을 확인할 수 있다.
본 연구에서는 수열합성으로 얻어진 열전도성이 향상된 금속-세라믹 core-shell CoAl2O4@Al 구조체와 공침법으로 합성하여 얻은 CoAl2O4에 각각 3 wt%의 Rh을 담지하여 Rh/CoAl2O4@Al과 Rh/CoAl2O4 촉매를 합성하고, 이들의 구조적인 특성과 글리세롤 수증기 개질 반응에 대한 촉매화학적 특성을 연구하였다. 담지체로 적용된 CoAl2O4@Al와 CoAl2O4 에는 550 ℃의 비교적 낮은 소성온도로 기인하여 미량의 CoOx가 포함되어 있었으나, 800 ℃의 소성온도에서는 CoAl2O4의 결정성 향상과 더불어 미반응된 CoOx의 양이 현저히 줄어드는 것을 확인하였다. 글리세롤 수증기 개질반응(550 ℃, H2O/C3H3O8 반응물 몰비= 4.5)에 대하여 Rh/CoAl2O4@Al 촉매는 Rh/CoAl2O4 보다 약 2.8배 높은 글리세롤 전환 turnover frequency (TOF)를 보여주었다. CoAl2O4@Al 및 CoAl2O4에서도 글리세롤 반응특성이 관찰되었고, 이는 환원과정을 통하여 표면에 형성된 일부 Co 금속입자에 의한 영향으로 평가되었다. 이들 촉매에서 글리세롤 수증기 개질반응에 의한 비교적 높은 비활성화 경향이 관찰되었다. XRD, SEM, EDX 조성분석 결과를 통하여, core-shell 구조체는 적용된 반응조건에서 화학적 및 구 조적으로 Rh 및 Co 입자의 소결은 매우 미미한 것으로 판명되었다. 그러나, 이들 촉매에서 반응 후에 매우 많은 량의 탄소침적이 관찰되었고 이는 본 연구에서 제시된 촉매들의 주요 비활성화의 요인으로 평가된다.