The disease resistant (OsCK1) rice was generated by inserting choline kinase (
The
The results of this study suggested that there was no significant difference in toxicity for
유전자변형(Genetically Modified, GM) 작물은 2012년에 1억 7,300만 헥타르가 재배되어 처음 상업적인 재배해인 1996년보다 무려 100배가 증가하였고, 25작물 196품목의 GM작물이 상업화 승인된 것으로 국제생명공학응용정보서비스(ISAAA)는 보고하고 있다(James, 2012). 그러나, GM작물 재배를 통하여 식품 및 사료가 재배되기 시작한 1996년부터 재배면적의 증가와 함께, 환경과 인체에 미칠 영향에 대한 우려도 꾸준히 제기되고 있는 실정이다.
국내에서는 아직 상업화적으로 재배가 승인된 GM작물은 없으나 벼, 감자, 콩, 배추, 고추, 토마토, 들깨 등을 중심으로 다양한 기능의 유전자 도입이 시도되어 왔으며, 이중 일부 GM작물의 이벤트 계통들에 대한 안전성평가를 통한 실용화연구를 수행하고 있다(Shin
GM벼의 개발은 미국, 일본, 중국, 인도 및 우리나라에서 활발하게 이루어지고 있다. 벼 형질전환체는 Toriyama 등(1988)에 의해서 최초 개발됨으로써 농업생명공학 분야에 큰 관심을 일으키며 연구가 시작되었다(Toriyama
벼는 한국을 비롯하여 동남아시아 국가의 주요 농산물 중 하나로 재배면적이나 생산량 및 소비량에 있어서 가장 우위를 차지하고 있다. 벼는 담수조건에서 생육하므로 GM벼의 실용화를 위한 환경위해성 평가 항목에서 일반적인 평가 대상인 나비목, 노린재목, 딱정벌레목 등의 대표 곤충 이외에 물벼룩, 잉어, 미꾸리 등의 수서환경 비표적생물체에 대한 평가도 이루어져야 한다. 최근 환경위해성 평가 항목인 비표적수서생물종에 미치는 영향을 분석하기 위하여 해충저항성 Bt벼가 물벼룩(
본 시험에서는 병저항성 GM벼에 대한 환경 생물 독성시험을 위해서 환경생물 독성 시험 기준과 방법 (농촌진흥청 고시 제 2010-29호)에 명시된 환경생태독성 시험 생물로서 가장 널리 사용되는 생물검정 재료인 미꾸리와 잉어를 대상으로 병저항성 GM벼에 대한 영향을 분석하였다. 병저항성 GM벼의 choline kinase (
병저항성 GM벼(event LS28 30-32-20-9-7)와 비형질전환 모품종인 낙동벼를 GMO 격리 포장(경기도 수원시 서둔동)에서 재배하고 잎과 줄기부위를 수확하여(출수기) 동결건조한 후(일신랩 FD8518, 한국) 분쇄기를 이용하여(한일전기, HMF-3100S, 한국) 분말화 하였다. 분쇄된 시료는 600 ㎛의 표준망체(청계산업, 한국)를 통과시킨 후, 사육용수에 현탁하여 급성독성 분석용 시료로 이용하였다.
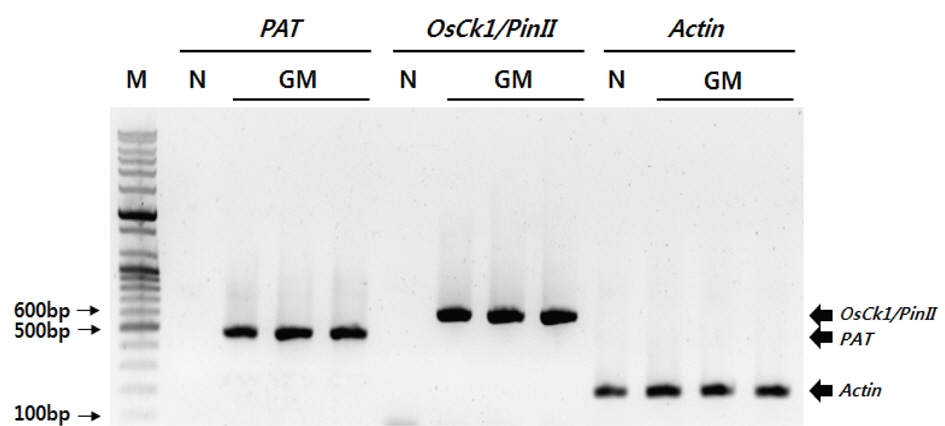
병저항성 GM벼와 낙동벼 시료를 각 1 g 씩을 취하고, 막자사발에서 액체질소와 함께 분말화한 후 DNeasy plant kit (Qiagen, CA, USA)를 이용하여 genomic DNA를 분리하였다. NanoDrop Spectrophotometer ND-1000 (NanoDrop Technologies, Inc, Wilmington, USA)을 이용하여 260/280 nm 값이 1.8∼2.0 사이인 추출액을 실험에 이용하였다. 식물 형질전환용 운반체의 유전정보를 바탕으로 OsCK1/PinII, PAT, Actin 유전자 확인용 프라이머를 제작하였다(Table 1). PCR 검정을 위하여 dNTP(10mM) 4 ㎕, 10X PCR buffer 4 ㎕, 프라이머 각 20 μM, f-Taq DNA polymerase 1 unit(Solgent, 한국), template genomic DNA 200 pg을 추가한 후 최종 반응 부피를 40 ㎕로 하였다. PCR 반응은 PTC-100 Thermal cycler (MJ Research, USA)를 이용하여 1 cycle(95℃, 5분), 35 cycle(95℃, 30초 - 55℃, 30초 - 72℃, 30초), 1 cycle(72℃, 5분)반응을 순차적으로 실시하였다. 증폭된 PCR산물은 1% agarose gel에서 전기영동한 후 UV조사로 확인하였으며 Gel Extraction kit(Qiagen, 28704)를 이용하여 정제하고 pGEM T-easy vector (Promega Madison, USA)에 삽입하여 정확한 염기서열 정보를 확인하였다.
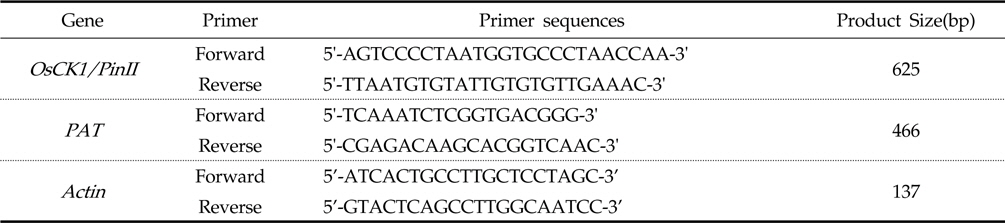
[Table 1.] Primers list used for PCR analysis
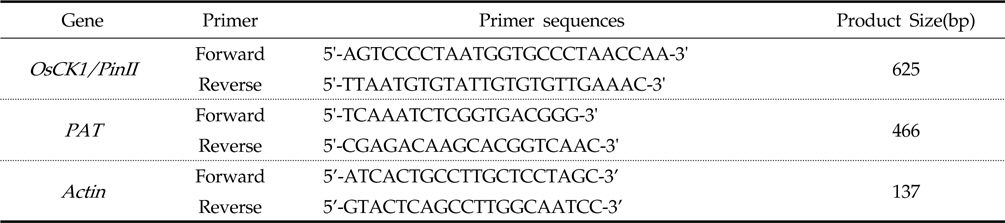
Primers list used for PCR analysis
독성분석용 비표적 생물체인 미꾸리는 대한농산(전라북도 남원시 송동면, 한국)에서, 잉어는 오창 양어장(충청북도 청원군, 한국)에서 각각 구입하여 배양하였다. 미꾸리는 1,000 L 용량의 장방형 수조(환경독성실험동 담수어사육실)에서 수온 21∼25℃, 광조건 16시간, 암조건 8시간의 조건으로 배양하였으며, 오전에 1회 미꾸리용 탑밀(제일사료, 한국)을 먹이로 매일 공급하였다. 잉어는 1,000 L 용량의 장방형 수조에서 수온 20∼24℃, 광조건 16시간, 암조건 8시간의 조건으로 배양하였으며, 오전에 1회 잉어용 고형사료(세화사료, 한국)를 먹이로 매일 공급하였다. 어류 사육실의 온도 및 배양수조의 수온은 자동온도측정기에 의하여 매 30분마다 측정하여 시험에 영향을 미칠 정도의 변동이 없음을 확인하였다. 배양에 사용된 용수는 전처리필터(1.0 μm)와 세균제거 필터(0.2 μm)를 통과시킨 지하수를 저수조에서 24시간 이상 폭기시킨 후 사용하였다. 수질의 측정은 한국화학융합시험연구원 헬스케어연구소의 표준작업순서(SOPs)에 따라 6개월에 1회 한국화학융합시험연구원에서 먹는 물 수질 분석기준에 따라 분석하였으며, 검사 결과 시험에 영향을 미치는 요인은 발견되지 않았다.
병저항성 GM벼와 낙동벼의 시료를 각각 0, 10, 100, 1,000 및 5000 mg/L의 농도로 시험용수에 현탁 처리하였으며, 24, 48, 72, 96시간 마다 공시어종인 미꾸리와 잉어에 미치는 영향을 관찰하였다. 시료의 각 농도에 대하여 탁도(2100AN model, HACH)를 측정하였다. 병저항성 GM벼와 낙동벼의 농도별 시험 결과를 분석한 후, 최종 농도로 5,000 mg/L에서 한계시험(limit test)을 수행하였다. 시험용액의 조제는 시험물질 10 g을 정확히 측량하여 12.5 L의 시험용 수조에 넣고 시험용수를 전량 10 L가 되도록 추가한 후 완전히 현탁될 때까지 충분히 교반시켜 시험용액으로 사용하였다. 음성대조구(무처리)는 시험용수인 지하수를 사용하였으며, 양성대조구는 Pentachlorophenol sodium salt (Fluka, USA)를 양성대조물질로 하여 잉어에서는 0.06, 0.08, 0.12, 0.16 및 0.23 mg/L의 설정농도(nominal concentration)와 미꾸리에서는 0.10, 0.16, 0.26, 0.41 및 0.66 mg/L 의 설정농도로 적용하여 사용하였다. 미꾸리에 대한 노출실험은 23.5 L 용량의 원통형 유리수조(38cm H × 28cm φ)에 20 L의 시험용액에서 실시하였으며, 각각 10마리씩을 처리하였다. 잉어는 12.5 L 용량의 원통형 유리수조(28cm H × 24cm φ)에 10L의 시험용액에서 실시하였으며, 각각 10마리씩을 처리하였다. 시험개시 24시간 전부터 시험 종료 시까지 사료 급여는 중단하였다.
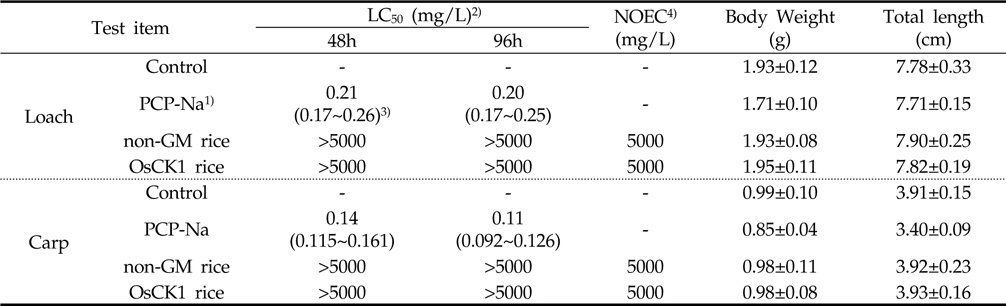
공시 어류의 일반증상 및 치사수 관찰은 모든 시험 수조에 대하여 처리 12, 24, 48, 72 및 96시간 경과 후 일반중독증상, 특이증상 및 치사유무 관찰을 실시하였다. 각 처리에 대하여, 미꾸리와 잉어를 유리막대로 건드렸을 때 움직임이 없거나 아가미 호흡이 중단된 경우 치사어로 판단하였다. 시험기간중 모든 수조에 대하여 1일 1회 수온, pH(PP-15 pH meter, Sartorius), DO(Orion 4 Star DO meter, Thermo Scientific)를 측정하였다. LC50산출 및 NOEC는 시험물질처리 후 48 및 96시간 경과 후 치사개체가 없었으므로 반수치사농도(LC50)및 신뢰한계는 산출하지 않았다. 무영향농도(NOEC)는 중독증상이 없고 치사어가 발생하지 않는 최고 시험농도로 표시하였다.
농업적, 환경적, 경제적 및 사회적인 이익으로 유전자변형(GM) 작물이 점점 더 많은 국가에서 재배되고 있다. 국내에서도 주요 작물을 대상으로 유용 GM작물이 개발되고 있으며, 벼유래의 Choline kinase 유전자(
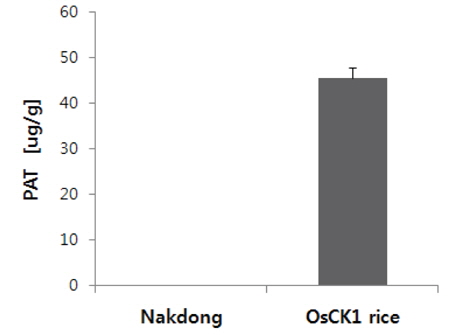
비표적 생물체 독성 평가 시료로 사용된 병저항성 GM벼로부터
병저항성 GM벼에서
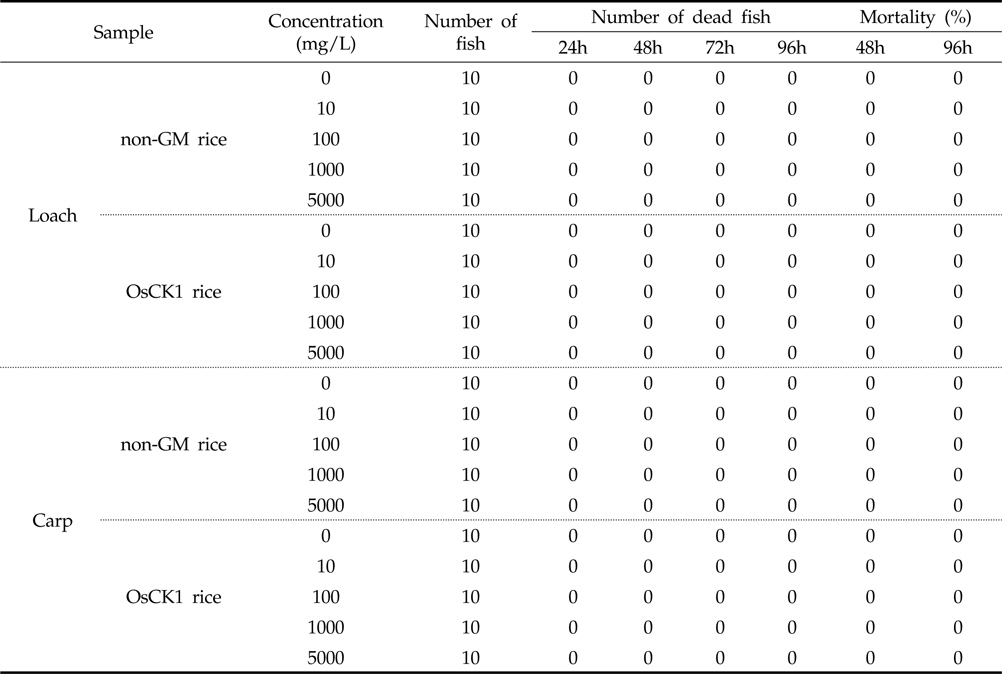
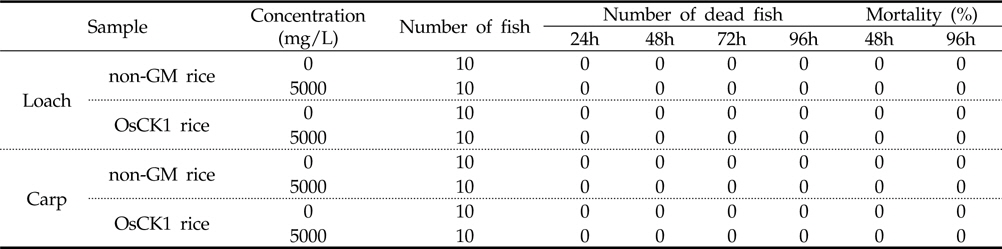
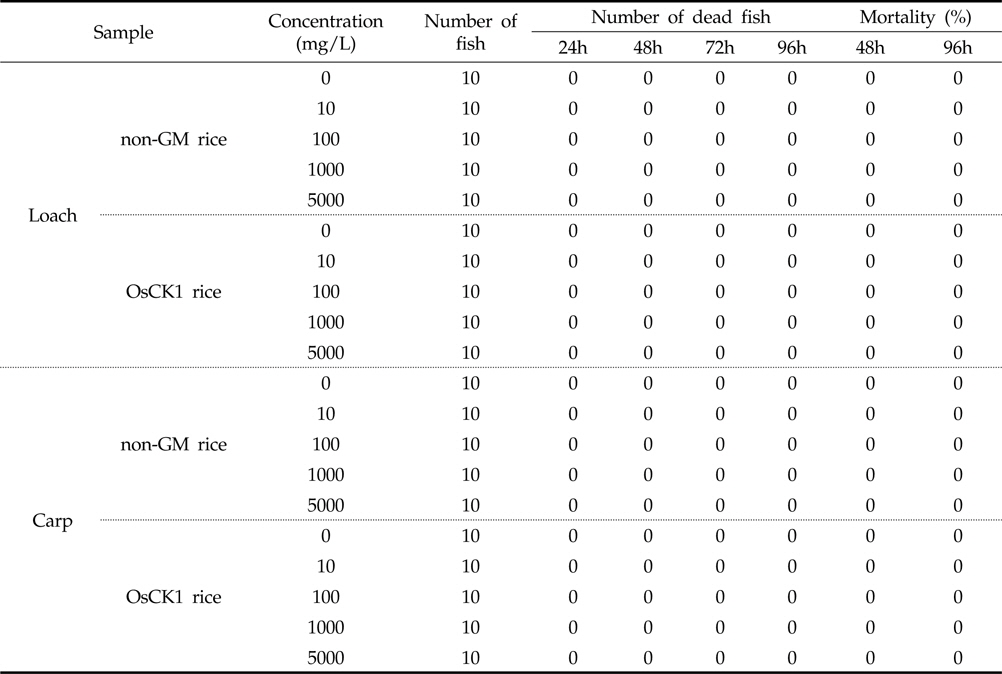
병저항성 GM벼와 낙동벼의 미꾸리 및 잉어에 대한 급성독성 여부를 처리 농도별로 분석하기 위해 각 시료를 0, 10, 100, 1000 및 5,000 mg/L의 농도로 시험용수에 현탁 처리하였으며 각각 24, 48, 72, 및 96시간 마다 독성여부를 분석하였다. 96시간 동안 지수식으로 실시하여 각 농도 별 노출된 어류 10마리에 대한 생사 수 및 일반중독증상을 측정한 결과, 96시간 후 최고 처리농도인 5,000 mg/L 조건에서 미꾸리와 잉어 모두 치사어가 관찰되지 않았다(Table 2). 각 시료의 0, 10, 100, 1000 및 5,000 mg/L 처리 농도별 탁도를 측정한 결과, 평균 3.42, 6.23, 40.76, 261.8, 2,214 NTU로 측정되었다. 이를 기반으로, 병저항성 GM벼의 어류에 대한 급성독성시험의 최종 농도로 5,000 mg/L로 설정하여 한계시험을 수행하였다.
Cumulative immobility of Misgurnus anguillicaudatus and Cyprinus carpio in the range-finding test
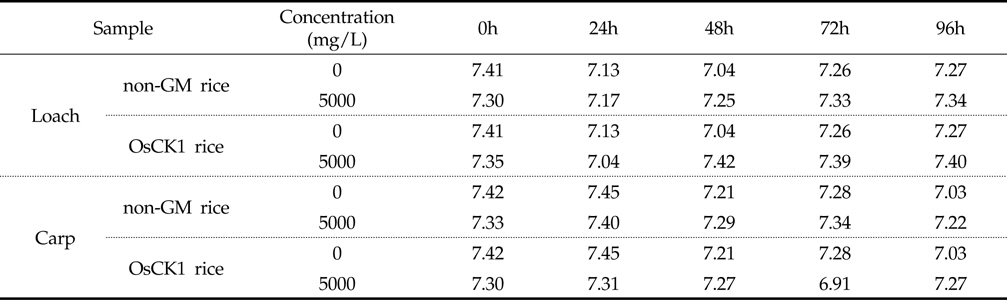
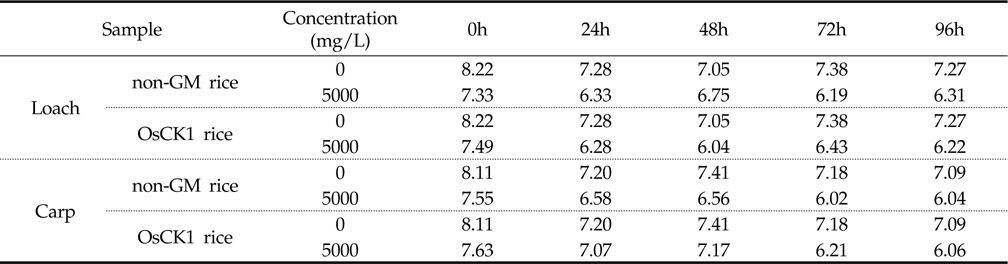
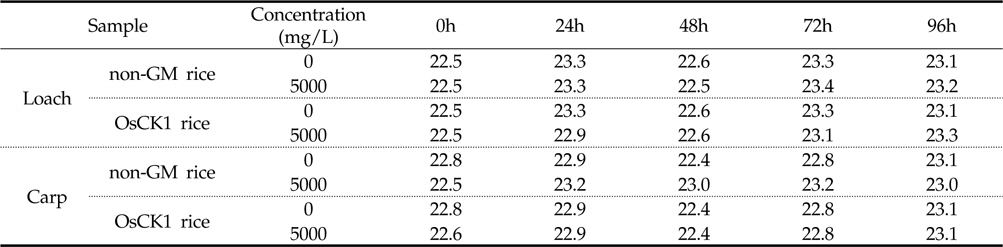
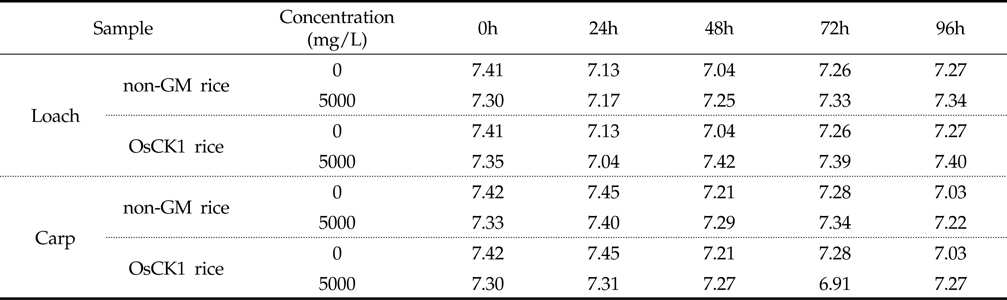
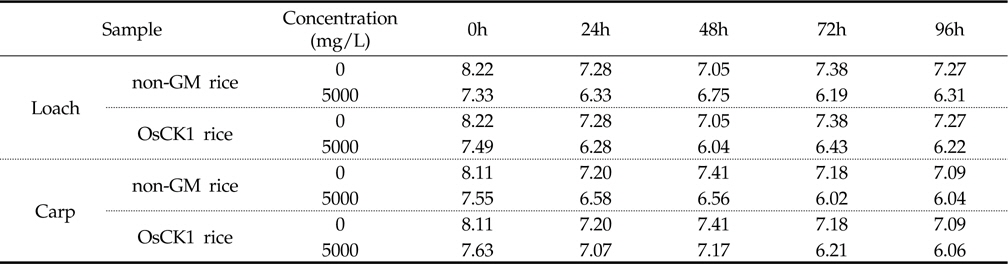
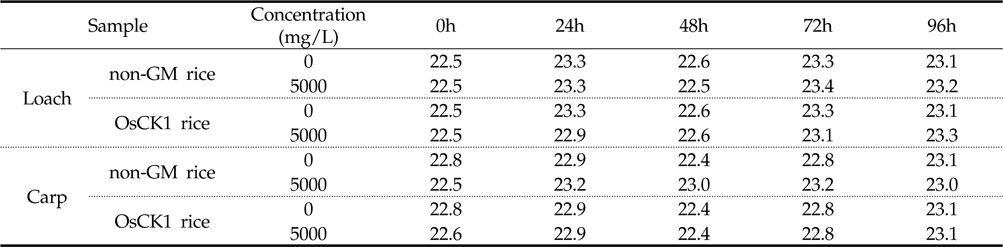
잉어와 미꾸리에 대한 환경생물 독성 생물검정은 기존의 시험 기준과 방법(농촌진흥청 고시 제 2010-29호)에 명시된 독성조사법을 바탕으로 하였는데, 유기 및 무기 독성물질에 모두 민감하게 반응하고 농약의 독성 측정을 위하여 일반적으로 24 또는 48시간이 요구된다. 본 시험에서는 처리기간 (24, 48, 72, 96시간) 동안 시험용수의 수질검사를 1일 1회 모든 수조에 대하여 pH, DO (Dissolved Oxygen) 및 수온을 조사하였다. 또한, 시험 기간 동안에 DO 측정결과 48시간 경과 후 DO가 포화용존산소량의 60% 이하로 내려갈 것이 예상되는 예비결과를 바탕으로 매 24시간 간격으로 약 1시간동안 병저항성 GM벼와 낙동벼 처리구 및 음성 대조구에 산소를 공급하여 주었다. 시험기간 중 배양 수조내 pH는 분석 결과, 미꾸리 처리구의 경우, 낙동벼와 병저항성 GM벼에 대하여 각각 평균 7.27±0.69 (7.17∼7.34) 및 7.32±0.15 (7.04 ∼7.42)이었으며, 잉어 처리구의 경우 각각 평균 7.31±0.06 (7.29∼7.40) 및 평균 7.21±0.16 (6.91∼7.31)로 측정되었다(Table 3). 처리 수조내의 DO 분석결과 미꾸리 처리구에서는 낙동벼와 병저항성 GM벼에 대하여 각각 평균 6.58±0.45 mg/L (6.19∼7.33mg/L) 및 6.49±0.57 mg/L (6.07∼7.49 mg/L)이었으며, 잉어 처리구에서 각각 평균 6.55±0.62 mg/L (6.02∼7.55 mg/L) 및 6.82±0.66 mg/L (6.06∼7.63 mg/L)이었다(Table 4). 처리 수조내의 수온변화의 경우 미꾸리 처리구에서 낙동벼 및 병저항성 GM벼에 대하여 각각 평균 22.98±0.44 ℃ 및 22.88±0.33 ℃ 수준을 보였고, 잉어 처리구에서는 각각 평균 22.98±0.28 ℃ 및 22.76±0.27 ℃ 수준을 보여 처리구간에 큰 차이가 없음을 보였다(Table 5). 미꾸리와 잉어에 대한 낙동벼와 병저항성 GM벼의 처리에 따른 pH 및 수온의 변화를 분석한 결과 유의적인 차이를 보이지는 않았으나, 각 처리구의 DO 수준이 음성대조구에 비해서는 감소하는 경향을 보였다.
Changes of pH
Changes of DO
[Table 5.] Changes of water temperature
Changes of water temperature
DO수준의 경우, 미꾸리의 음성대조구에서 7.44±0.44 mg/L (7.05∼8.22 mg/L) 수준이었고 낙동벼(6.58±0.45 mg/L)와 병저항성 GM벼(6.49±0.57 mg/L) 처리구에서는 감소 경향을 보였고, 잉어의 경우도 음성대조구(7.39±0.41 mg/L)에 비하여 낙동벼(6.55±0.62 mg/L)와 병저항성 GM벼(6.82±0.66 mg/L) 처리구에서 감소하는 경향을 보였다. 이와 같이 음성대조구에 비해 낙동벼 및 병저항성 GM벼 처리구에서 DO가 감소한 이유는 처리구의 시료가 유기물이며, 대상 생물체인 미꾸리와 잉어의 생리작용(호흡 등)과 유기물 분해 작용 등의 영향을 받은 것으로 판단되었다.
병저항성 GM벼와 낙동벼에 의한 미꾸리와 잉어의 급성독성시험을 96시간 동안 지수식으로 실시하였으며, 각 농도별 노출 어류 10마리에 대한 생사수, 일반중독증상, 체중 및 전장을 관찰하여 측정하였다. 병저항성 GM벼와 낙동벼의 처리시 각 농도별(0, 10, 100, 10,00 및 5,000 mg/L) 처리시간(24, 48, 72, 96시간)에 따른 치사어 분석 실험결과 최고농도인 5,000 mg/L에서 미꾸리 및 잉어 모두 치사어를 보이지 않았다(Table 2).
Oh 등(2012)은 해충저항성 Bt벼에 대한 어류 영향 평가시에 최대 1,000 mg/L 농도로 설정하여 실험을 수행하였으며(Oh
본 실험에서는 병저항성 GM벼가 어류에 직접적인 영향을 줄 수 있는 최고 농도로 5,000 mg/L를 설정하여 실험을 수행하였다. 이는 포장기대농도(EEC)의 100배 이상의 농도이고, 시험용수의 탁도가 1,000 mg/L(261 NTU)의 8.5배인 2,214 NTU 수준으로 실험어종인 미꾸리와 잉어의 생육환경에 제약 요인으로 작용할 수 있을 것이며, GM작물의 어류에 대한 영향 평가 실험중에 최고 농도로 실험한 것이다.
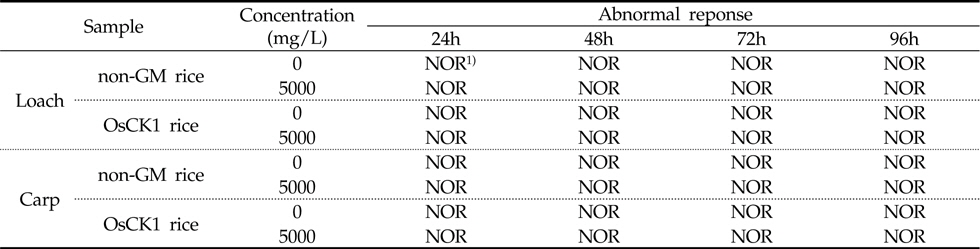
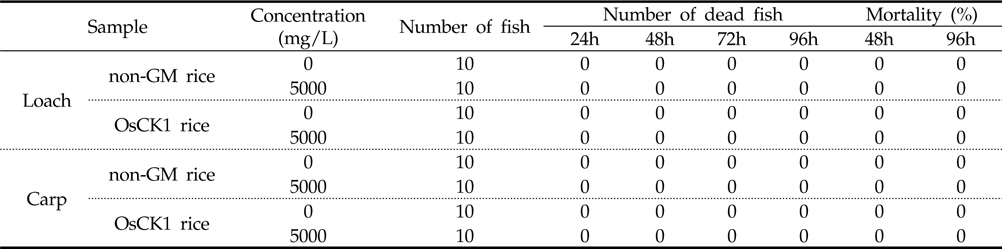
5,000 mg/L 수준에서 낙동벼와 병저항성 GM벼의 한계시험(limit test)을 수행한 결과, 96시간 경과 시까지 각 처리구에서 미꾸리와 잉어에 치사어가 관찰되지 않았다(Table 6). 또한 시험 기간 중 음성대조구 및 처리구간에 일반중독증상 또는 특이증상은 관찰되지 않았다(Table 7). 처리에 따른 체중 및 전장에 대한 분석 결과, 미꾸리 실험에서 낙동벼 처리구는 1.93±0.08 g 및 7.90±0.25 cm 였으며, 병저항성 GM벼 처리구는 1.95±0.11 g 및 7.82±0.19 cm로 측정되었다. 잉어의 경우, 낙동벼 처리구는 0.98±0.11 g 및 3.92±0.23 cm 이였고, 병저항성 GM벼 처리구는 0.98±0.08 g 및 3.93±0.16 cm 수준을 보였다(Table 8). 무영향농도 분석의 경우, 시험기간중 낙동벼와 병저항성 GM벼에 의한 중독증상을 보이지 않았고 최대농도(5,000 mg/L)조건에서 96시간 경과시까지 치사어가 발생하지 않았다. 따라서 낙동벼와 병저항성 GM벼에 의한 미꾸리와 잉어의 급성독성 시험의 96시간-LC50 값은 5,000 mg/L 이상인 것으로 추정하였다.
[Table 6.] Cumulative immobility of Misgurnus anguillicaudatus and Cyprinus carpio in the limit test
Cumulative immobility of Misgurnus anguillicaudatus and Cyprinus carpio in the limit test
[Table 7.] Abnormal response of Misgurnus anguillicaudatus and Cyprinus carpio in the limit test
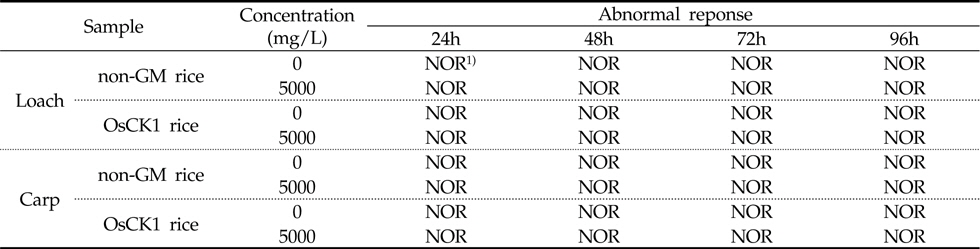
Abnormal response of Misgurnus anguillicaudatus and Cyprinus carpio in the limit test
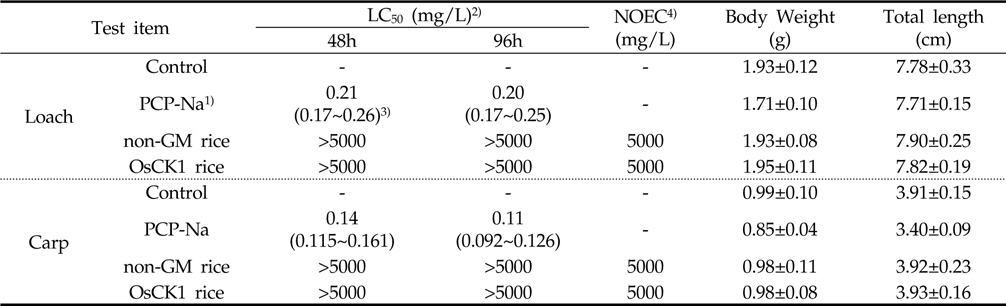
LC50 values
이번 어류에 대한 영향 평가는 Kim 등(2007)이 보고한 탁도 200 NTU 보다 약 11배 이상 높은 5,000 mg/L (2,214 NTU)수준에서 수행되었음에도 96시간 급성 독성 평가에 따른 이상 증후는 발견되지 않았다. 그러나, Kim 등(2007)의 보고에 따르면 장기간의 영향 평가는 어류의 아가미 조직에 영향을 미칠 수 있기 때문에 향후, 어류의 아가미, 신장 등의 이상 유무 검정을 포함한 조직학적 검사 및 혈액학적 항목이 평가 요소에 반영될 필요가 있을 것으로 사료된다.
본 연구를 통해서