To explore hydrolysis methods for the efficient manufacture of sugar solutions from the freshwater alga Water-net (
석유자원의 고갈, 에너지 수요 증가, 지구온난화와 CO2배출, 환경규제 강화 등 여러 문제에 직면한 상황에서 미래 환경과 자원고갈에 슬기롭게 대비하기 위해서는 필수적으로 식물자원 바이오매스의 효율적 활용기술 개발이 필요한 바, 이에 적합한 식물자원중의 하나는 제3세대 바이오매스로 알려진 조류(algae)이다(Kim et al 2012). 왜냐하면 algae는 대부분 비식용자원으로서 담수 또는 해수 등 다양한 환경에서 생장이 가능하고 생장속도가 빠르며, 이산화탄소 고함유 폐가스나 각종 폐수를 활용하여 대량생산할 수도 있기 때문이다(Brennan and Owende, 2010; Mata et al., 2010). 특히 조류 중에는 특정 성분이 고함량 존재하는 종들이 많고, 리그닌이 거의 없기 때문에 리그노셀룰로오스계 바이오매스(리그닌 15~30% 함유)보다 값싼 공정개발이 가능하다. 그리하여 최근 미세조류 또는 해양 거대조류를 활용하여 바이오연료 또는 바이오화학소재 생산을 위한 많은 연구(Adams et al., 2009; Choi et al., 2010; Ge et al., 2011; Harun et al., 2010; Isa et al., 2009; John et al., 2011; Lee et al., 2009; Mata et al., 2010; Nguyen et al., 2012; Scott et al., 2010; Ueno et al., 1998)가 추진되고 있으며, 성분 활용이라는 측면에서 고려해 볼 때 크게 두 그룹의 연구내용이 진행되고 있다. 하나는 지질 고생산 조류종을 가지고 비이오디젤 또는 기능성 소재(DHA, astaxanthin 등) 등을 생산하는 연구이며, 다른 하나는 탄수화물 고생산 조류종을 가지고 발효당을 얻어 바이오알콜, 유기산, 기타 바이오화학소재를 생산하는 내용이다.
탄수화물 기반 바이오매스 활용에 있어서 가장 중요한 기술 중의 하나는 고품질의 발효당을 얻기 위한 전처리/당화(가수분해) 기술로서 바이오매스 내의 고분자 탄수화물을(cellulose, hemicellulose, starch 등) 저분자의 당(glucose, mannose, galactose 등)으로 전환시키는데 있어서 단당류로의 전환율을 높이고, 생산공정이 친환경적이며, 생산된 발효당의 품질이 우수하고(발효억제물질 함유량이 낮을 것), 아울러 보다 낮은 비용의 공정기술을 확보하는 것이 필요하다(Alvira et al., 2010; Daroch et al., 2013). Algae는 리그닌이 거의 없기 때문에 리그노셀룰로오스계 바이오매스에 비하여 전반적으로 전처리/당화조건이 보다 용이하다고 알려지고 있지만(Daroch et al., 2013) 발효당을 고효율로 얻기 위해서는 바이오매스의 물리화학적 특성에 따라 이에 부합된 최적의 전처리/당화조건이 각각 확립되어야 한다.
현재 바이오화학산업용 바이오매스의 원료로서 산업화되는 것은 주로 농산물(옥수수, 밀 등의 곡물) 또는 농산물 부산물이다. 그러나 앞으로는 적어도 바이오화학산업용으로 사용될 바이오매스의 경우는 농산물과 경합되지 않는 바이오매스로 대체하는 것이 바람직하며, 또한 생산된 바이오화학제품의 가격 경쟁력을 갖추기 위해서는 바이오매스 활용에 있어서도 저에너지/저비용 공정 기술이 확립되어야 할 것이다. 그물말(
담수 녹조류 중의 하나인 그물말(
당화효소는 cellulase(Celluclast 1.5 L 또는 Celluclast Conc. BG, Novozymes사 제품, E1으로 표시)와 β-glucosidase (Sigma C6105, 311 U/mL, E2로 표시)를 사용하였다. Celluclast Conc. BG의 경우는 1 g의 효소파우더를 5 mL의 1M citrate buffer(pH 4.8)에 녹여서 64 FPU mL-1의 효소활성을 가진 용액으로 만들어 사용하였다.
건조된 HR 분말 1 g을 28 mL 유리 시험관에 담고, 0~10% 황산 12.5 mL를 주입한 다음 잘 섞어주었다. 이를 알루미늄 pressure vessel에 넣고, 120~150℃에서 1시간 동안 산가수분해 반응을 시켰다. 그 후 CaCO3로 반응액을 중화시키고 12,000 rpm에서 10분 동안 원심분리하여 상징액을 취한 다음, 얻어진 가수분해물에 대해 glucose, 환원당, hydroxyl methyl furfural(HMF) 및 furfural 분석을 실시하였다.
건조된 HR 분말(0.25, 0.5, 0.75, 1 g)을 28 mL 유리 시험관에 담고 2% 황산 12.5 mL를 주입한 다음 잘 섞어주었다. 이를 알루미늄 pressure vessel에 넣고, 120℃에서 1시간 동안 산가수분해 반응을 시켰다. 그 후 CaCO3로 반응액을 중화시키고 12,000 rpm에서 10분 동안 원심분리하여 상징액을 취한 다음, 얻어진 가수분해물에 대해 glucose, 환원당, HMF 및 furfural 분석을 실시하였다.
1차 가수분해시의 고형분 함량/산용액 부피 차이에 따른 당화
건조된 HR 분말(0.1 g, 1.0 g)을 28 mL 유리 시험관에 담고, 72% 황산을 1.0 mL 또는 1.5 mL를 주입하여 10분마다 저어주면서 25℃ 수조에서 1시간 동안 반응시켰다(1차 산가수분해). 그 후 1차 산가수분해물에 증류수 23.5~24 mL를 가하고 1분 동안 잘 섞어준 다음 알루미늄 pressure vessel에 시험관을 넣고, 120℃에서 1시간 동안 2차 가수분해를 실시하였다. 가수분해 종료 후 CaCO3로 반응액을 중화시키고, 12,000 rpm에서 10분 동안 원심분리하여 상징액을 취한 다음, 얻어진 가수분해물에 대해 glucose, 환원당, HMF 및 furfural 분석을 실시하였다.
건조된 HR 분말 1.0 g을 28 mL 유리 시험관에 담고, 72% 황산을 1.5 mL를 주입하여 10분 마다 저어주면서 수조에서 여러 온도별로(30~80℃) 1시간 동안 1차 가수분해를 실시하였다. 그 후 1차 산가수분해물에 증류수 23.5 mL를 넣은 다음 120℃에서 1시간 동안 2차 산가수분해를 실시하였고, 나머지 실험 과정은 1차 가수분해에서 기술한 바와 같다.
>
산+효소 복합가수분해(Combined hydrolysis)
건조된 HR 분말 5 g에 2% HCl 20 mL를 넣고 섞어준 다음 위에서와 같이 120℃에서 1시간 동안 산가수분해를 하였다. 얻어진 산가수분해물을 10 N NaOH로 pH 4.8~5.0까지 중화시켜 125 mL 삼각플라스크에 옮겼다. 그 후 1% NaN3가 포함된 0.1 M citrate buffer를 여러 부피(3.8, 4.88, 10.8, 11.88, 22.8, 23.88 mL)로 주입하여 잘 혼합한 다음 당화효소 E1+E2 (0.12~1.2 mL)를 가하였다. 조제된 반응용액을 Shaking incubator에 넣고, 150 rpm, 50℃에서 24시간 동안 효소가수분해를 실시하였다. 반응 종료 후 12,000 rpm에서 10분 동안 원심분리하여 얻어진 상징액에 대하여 glucose, 환원당, HMF 및 furfural 분석을 실시하였다.
D-glucose의 정량은 YSI 2700 Select Biochemistry Analyzer (YSI Incorporated, Ohio, USA)를 가지고 제시된 assay kit를 이용하여 분석하였다.
환원당 정량은 3,5-dinitrosalicylic acid를 포함한 DNS reagent를 시료와 혼합하여 100℃ 수조에서 5분 30초 동안 반응시킨 후 spectrophotometer에서 540 nm의 흡광도를 측정하였다(Matrai et al., 2000; Nguyen et al., 2012). 환원당의 표준곡선은 D-glucose를 농도별로 희석하여 시료와 동일하게 DNS reagent와 반응 시킨 후 흡광도를 측정하여 작성하였다.
HPLC(Waters사)를 사용하여 280 nm에서 HMF 또는 furfural을 정량하였다. Column은 Comosil 5C18-MS-II(4×150 mm)을 사용하였고, 이동상은 0분 water : methanol (98 : 2, v/v), 10분 water : methanol (75 : 25, v/v), 15분 water : methanol (40 : 60, v/v), 20분 water : methanol (0 : 100, v/v), 30분 water : methanol (0 : 100, v/v)로 설정하여 수행하였고, flow rate는 0.6 mL min-1 이었다. 분석시료(가수분해물)는 membrane filter (40 μm)로 여과한 후 주입하였고, 표준물질을 메탄올로 용해한 다음 검량선을 작성하여 정량에 이용하였다.
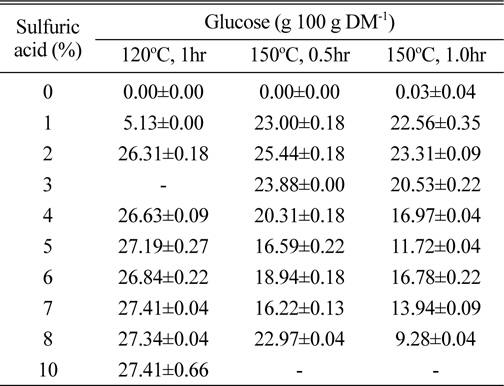
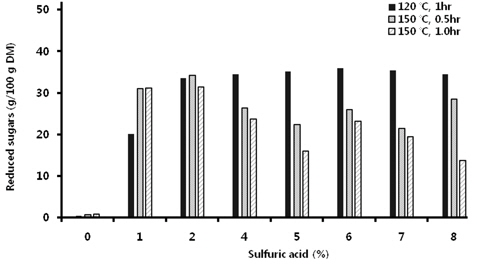
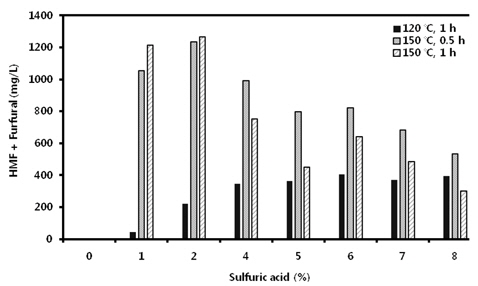
담수조류인 HR의 가수분해를 보다 저비용으로 수행할 수 있는 방안으로서 산당화 조건을 검토하였다. 바이오매스의 산당화를 실시할 때 보다 경제성을 확보하려면 저농도 고형분 함량보다는 고농도 고형분 함량에서의 당화조건을 확립하는 것이 바람직하다. 먼저 고형분 함량 8% 수준에서 one-step acid hydrolysis를 실시하였다. 이때 당화시 얻어지는 단당류가 많이 생성될수록 좋고, 아울러 대표적인 발효억제물질로 알려져 있는 HMF와 furfural이 산가수분해동안 각각 6탄당 및 5탄당으로부터 자연 생성되는데(Qian et al., 2005), 이들 성분의 생성을 최소화시키기 위해서는 산처리 농도, 반응시간, 반응온도 등의 최적화가 필요하다. 이를 위해 여러 산 농도에서 반응온도 및 시간차이에 따른 당 수득율 및 발효억제물질 생성정도를 비교한 결과, 2% 이상의 황산을 이용하여 120℃에서 1시간동안 가수분해 시킬 경우 다른 산처리 조건에서보다 glucose 생성량이 높았다(Table 1). 그렇지만 본 실험의 산가수분해 조건에서 가장 높게 생성된 glucose 함량은 27.4 g 100 g DM-1수준으로서, 사전 실험에서 8% 고형분함량에서 효소가수분해를 통해서 얻었던 glucose 생성량(37.4 g 100 g DM-1)의 73%에 불과한 수치이다. 그리고 150℃에서 산가수분해를 할 경우에는 2% 황산까지 glucose 생성량이 증가하다가 그 이상의 산농도에서는 산농도가 증가할 수록 glucose 생성량이 점차 감소되는 경향을 보였는데, 그정도는 0.5시간 처리보다 1시간 처리에서 더 뚜렷하였다(Table 1). 이는 강산조건으로 인해 당이 타 성분으로 전환되기 때문으로 판단되었다. 이러한 결과는 환원당의 생성에서도 유사한 경향이었다(Fig. 1). 한편 단당류의 가수분해 산물이면서 발효억제물질로서 알려진 HMF+furfural 함량을 조사한 결과를 보면 예상한 바와 같이 120℃ 처리조건에서보다 150℃ 처리조건에서 그 함량이 높은 경향이었 다. 즉, 120℃ 1시간 반응의 경우 5%까지 황산농도가 증가함에 따라 HMF 또는 furfural도 증가하였지만 5% 이상의 황산농도에서는 별다른 차이가 없었다. 한편 150℃ 처리의 경우는 2%까지 황산농도가 증가함에 따라 HMF 또는 furfural도 증가하였지만, 그 이상의 농도에서는 오히려 감소하였다(Fig. 2). 이들 실험결과로부터 2%의 황산 용액으로 120℃에서 1시간동안 가수분해시킬 때 상대적으로 당수율도 우수하고, HMF+furfural 생성량도 낮은 것으로 판단되었다(Table 1, Fig. 2).
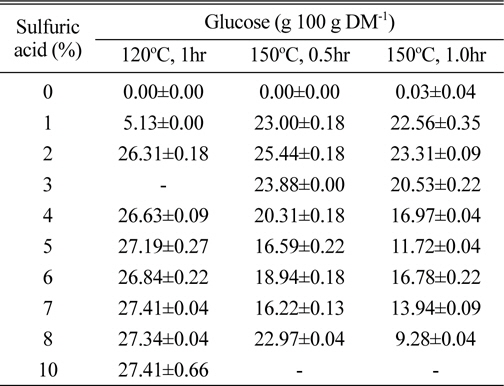
Effect of various conditions on the saccharification of H. reticulatum in one-step acid hydrolysis method.
다음으로는 one-step acid hydrolysis에 있어서 적정 HR 고형분 함량을 알아보기 위해 위 실험에서 확립한 2% 황산, 120℃ 1시간 가수분해 조건에서 HR 고형분 함량별 당화정도의 차이를 조사하였다. 그 결과, 2~4% 고형분에서 glucose 생성량이 27 g 100 g DM-1 내외였으나 그 이상의 고형분에서는 glucose 생성량이 다소 감소하는 경향을 나타내었으나 그 차이는 미약하였다(Table 2). 그러나 HMF+furfural 생성량은 고형분의 농도가 높아짐에 따라 뚜렷하게 증가하였다.
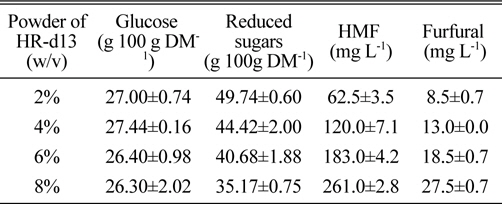
Effect of various solid contents on the saccharification of H. reticulatum in one-step acid hydrolysis method.
따라서 최소한의 발효억제물질 생성과 최대한의 당수득율, 공정비용 절감 등을 고려하여 HR의 one-step acid hydrolysis는 120℃에서 4% 고형분을 2%의 황산 용액에서 1시간동안 반응시키는 것이 적절한 것으로 판단되었다. 그런데 이러한 one-step acid hydrolysis에서 생성되는 glucose 함량도 사전실험의 효소당화시 보다는 낮은 수준이므로 보다 개선된 방법의 탐색이 요구되었다.
보다 개선된 산가수분해를 위해 two-step acid hydrolysis를 실시하였다. 이는 1차, 2차 산 가수분해를 통해 당화하는 과정으로서 1차 산 가수분해는 고농도 산용액에서(72% 황산) 신속히 조직을 swelling 및 softening 시키고, 2차 가수분해에서 고분자를 보다 효율적으로 단당화시키고자 하는 방법이다(NREL, 2010).
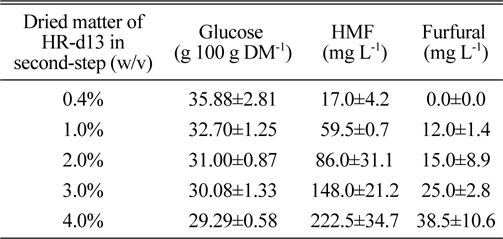
본 실험에서는 먼저 적정 HR 고형분 함량을 알아보고자 실험하였다. 기본 실험조건은 72% 황산 1 mL를 30℃에서 1시간 동안 1차 처리한 후, 증류수 24 mL를 추가하여 120℃에서 1시간 동안 2차 산가수분해 반응을 실시하였다. 그 결과, 고형분 함량이 증가될수록 glucose 생성량은 감소하는 경향이었다(Table 3). 2차 산가수분해 당시의 고형분 함량을 기준으로 검토하여 보았을 때, 0.4% 고형분함량에서 glucose 생성량이 35.88 g 100 g DM-1 이었고, 4% 고형분 함량에서의 glucose 생성량은 29.3 g 100 g DM-1 이었으며 4% 고형분 함량의 one-step acid hydrolysis 결과와 비교해 볼 때 약간 증가된 생산성을 나타내었다.
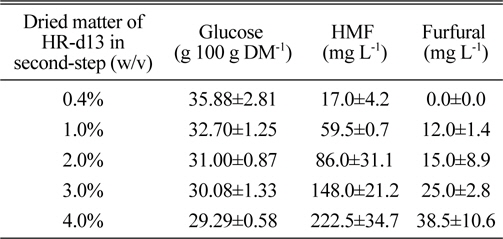
Saccharification efficiency according to solid contents of H. reticulatum in two-step acid hydrolysis method.
한편 1차 산 가수분해시의 산용액(72% 황산) 부피를 1 mL에서 1.5 mL로 증가시킨 후 당화율을 검토해 보았다. HR 4% 고형분 함량 조건에서 위의 실험조건과 동일하게 two-step hydrolysis를 실시한 결과, 1차 가수분해 산용액 부피를 1.5 mL로 하였을 때 glucose 생성량이 31.50 g 100 g DM-1로서 1.0 mL 처리에서의 glucose 생성량(30.33 g 100 g DM-1) 보다 증가하였다. 그런데 HMF 및 furfural 생성은 1.5 mL 첨가구에서 2배 이상 낮았다(Table 4).
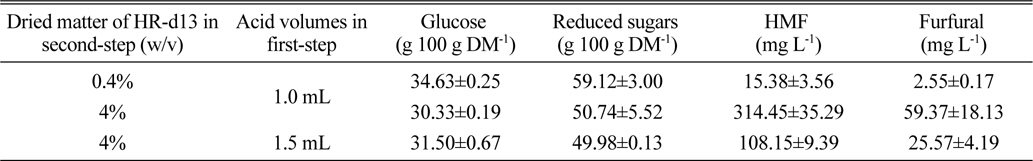
Saccharification efficiency of H. reticulatum according to acid volumes in two-step acid hydrolysis method.
지금까지의 실험을 통해서 확립한 조건(4% 고형분 함량, 1차 가수분해시 72% 황산 1.5 mL를 30℃에서 1시간 동안 반응한 후, 2차 산 가수분해시 증류수를 넣은 후 120℃에서 1시간 동안 반응)에서 1차 가수분해시의 온도를 30℃에서 80℃까지 달리하여 당화실험을 실시하였다. 그 결과, glucose 생성량의 경우 60℃까지 온도가 증가할수록 증가하다가 60℃ 이상부터는 점차 감소하는 경향이었다(Table 5). 그리고 60℃에서의 glucose 생성량은 효소당화시킨 것과 유사하였다. 아울러 HMF 및 furfural 생성량도 60℃에서 가장 낮은 것으로 나타났다. 결과적으로, HR-d13의 4% 고형분 함량조건에서 HR 건조중 : 72% 황산을 1 g : 1.5 mL로 하여 1시간 동안 1차 가수분해시킨 다음, 증류수 23.5 mL를 가한 후 120℃에서 1시간 가수분해하면 가장 바람직한 당화 결과를 보여주는 것으로 확인되었다. HR-d13 시료는 고형분 함량 2%와 8% 조건에서 효소당화시킬 경우 glucose 생성량이 각각 40.8, 37.47 g 100 g DM-1 이었다. 결국 산가수분해만을 통해서 효소당화의 90-95%까지 glucose를 수득할 수 있기 때문에 1차가수분해 시 강산을 사용한다는 점이 단점이 있기는 하지만, 본 공정은 보다 빠른 시간 내에 HR로부터 저비용으로 당화액을 조제할 수 있는 방법이 될 것으로 판단되었다.
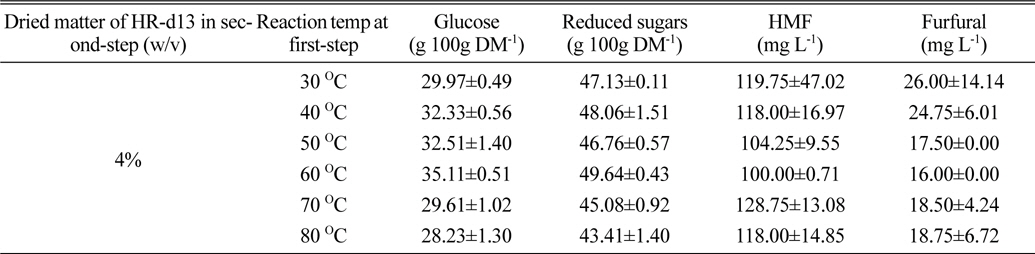
Saccharification efficiency of H. reticulatum according to the reaction temperatures at first-step of two-step acid hydrolysis method.
산가수분해만을 실시할 경우 저비용 당화액 조제에는 바람직할지라도 환경 위해물질 배출, 장비 부식, 고농도당화의 한계 등 여러 단점이 지적되고 있다(Mosier et al. 2005). 이러한 단점을 최소화시키면서 보다 고농도 고형분에서 당화시킬 수 있는 방법을 확립하고자 본 연구에서는 산가수분해와 효소가수분해를 조합하여 실시하였다. 예비실험 결과, 초기 산가수분해시 고농도 고형분을 사용하고자 할 때는 황산보다 염산을 사용하는 것이 glucose의 생산에 유리하였고 HR-d23+26 건조분말 5 g에 2% 염산 20 mL 사용하여 120℃에서 1시간 반응하는 것이 바람직하였다. 따라서 이들 산가수분해 조건을 고정시키고 이후 효소가수분해시의 buffer 추가량 및 효소 첨가량의 최적조건을 파악하기 위한 실험 결과, glucose 생산량은 첨가된 buffer양이 많아질수록 증가되었고, E1+E2 효소의 고농도(1+0.2 mL g DM-1) 처리시가 저농도(0.1+0.02 mL g DM-1) 처리시보다 glucose 생성율이 약 25% 증가되었다(Table 6). 이는 반응액의 점도와 관련이 있을 것으로 추정된다. 결국 1차 산가수분해물에 buffer 22.8 mL를 추가하고 E1 +E2 효소를 각각 1+0.2 mL g DM-1 첨가하여 효소가수분해를 실시했을 때 glucose 생성량이 33.5 g 100 g DM-1 으로서 가장 우수한 결과를 보였다(Table 6). 이는 초기 고형분 함량이 25%인 조건에서 산가수분해를 실시하고, 이어서 4.0% 고형분 함량이 되도록 buffer와 효소를 첨가한 다음 효소가수분해를 실시하는 과정으로서, 궁극적으로 고농도 고형분 함량에서 산 또는 효소 단독으로 가수분해를 수행하는 것보다 우수한 당화 결과를 보여 주었다. 이러한 판단의 근거는 본 실험에 사용되었던 HR-d23+26시료의 경우, 예비실험에서 10% 고형분 함량의 효소가수분해만을 통해 33.8 g 100 g DM-1 의 glucose 생성량을, two-step acid hydrolysis에서는 0.4% 고형분 함량에서 33.5 g 100 g DM-11 을 나타내었었기 때문이다.
[Table 6.] Saccharification efficiency of H. reticulatum (HR-d23+26) by combined hydrolysis method.
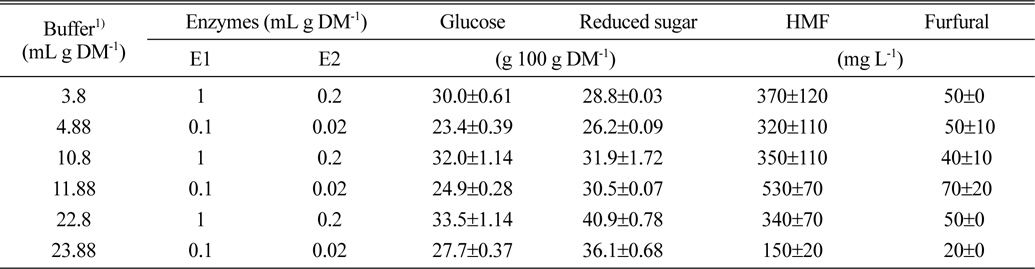
Saccharification efficiency of H. reticulatum (HR-d23+26) by combined hydrolysis method.
이상의 결과로부터, HR의 당화를 위해서는 효소가수분해와(Kim et al. 2012) 더불어 two-step acid hydrolysis와 산+효소 복합가수분해(combined hydrolysis)가 우수한 것으로 나타났다. 즉, two-step acid hydrolysis에서는 효소가수분해의 94% 수준에 달하는 glucose를 얻을 수 있었고, combined hydrolysis를 통해서는 고농도 고형분 함량(25%)에서 가수분해를 시작하여 비슷한 량의 glucose를 생산 할 수 있었다. 일반적으로 산가수분해의 경우는 지금까지 보고된 기술 중에서 상대적으로 가장 값싼 공정으로 인정받고 있으나 장비 부식, 산용액 배출, 발효억제물질 HMF 또는 fufural의 용이한 발생 등이 단점으로 지적되고 있다. 효소가수분해의 경우는 높은 효소 생산 비용과 낮은 반응속도로 인해 공정 비용이 상대적으로 높아지는 단점이 있으나, 반응에 투입되는 에너지가 낮고, 효소 조합에 따라 전체적인 당화율을 조절할 수 있으며, 발효억제물질인 HMF+fufural 생성이 거의 없고, 친환경적인 공정이라는 장점을 가지고 있다. 산+효소 복합가수분해는 산 또는 효소가수분해 보다 공정단계가 한 단계 추가되지만 이들의 장단점을 적당히 조절하면 당화효율을 높이면서 고품질의 당용액을 생산할 수 있는 조건확립이 가능하다(Wingren et al., 2005). 따라서 실용적 차원에서 HR을 당화시키고자 할 경우에는 상기 방법들의 장단점을 고려하여 주변 상황에 맞는 당화조건을 선택, 운용하는 것이 바람직할 것이다.
그 동안 미세조류(microalgae) 및 거대조류(macroalgae)의 당화에 관한 연구는 몇몇 조건에서 시도되어 왔다(Daroch et al., 2013). 먼저 미세조류에서 산가수분해를 이용한 방법으로