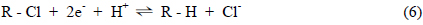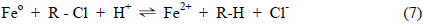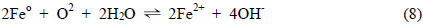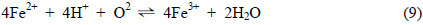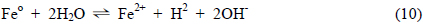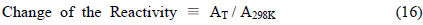The influence of temperature on the treatment efficiency of chlorinated organic substances contained in groundwater by permeable reactive barrier which is composed of Feo has been investigated by constructing the Pourbaix diagrams for Fe-H2O system at different temperatures based on thermodynamic estimation. In aerobic condition, the equilibrium potentials for Feo/Fe2+ and Fe2+/Fe3+ were observed to increase, therefore, the dechlorination reaction for organic pollutants by Feo was considered to decline with temperature due to the diminished oxidation of reactive barrier. The result for the variations of the ionization fraction of Fe2+ and Fe3+ ion in the pH range of 0 ~ 2.5 obtained by employing Visual MINTEQ program showed that the ionization fraction of Fe2+ increased with pH, however, that of Fe3+ decreased symmetrically and the extent of the variation of ionization fraction for both ions was raised as temperature rises. The equilibrium pH for Fe3+/Fe(OH)3 was examined to decrease with temperature so that the treatment efficiency of chlorinated organic substance was expected to decrease with temperature due to the enhanced formation of passivating film in aerobic condition. The change of the reactivity of a specific chemical species with temperature was defined quantitatively based on the area of its stable region in Pourbaix diagram and depending on this the reactivity of Fe3+ was shown to decrease with temperature, however, that of Fe(OH)3 was decreased monotonously as temperature is raised for Fe3+/Fe(OH)3 equilibrium system. In anaerobic condition, the equilibrium potential for Feo/Fe2+ was observed to rise and the equilibrium pH for Fe2+/Fe(OH)2 were examined to decrease as temperature increases, therefore, similar to that for aerobic condition the efficiency of the dechlorination reaction for organic substances was considered to be diminished when temperature rises because of the reduced oxidation of Feo and increased formation of Fe(OH)2 passivating film.
산업이 발달함에 따라 많은 종류의 독성 물질이 환경에 방류되고 있으며, 이들 가운데에는 자연계에서의 그 존속기간이 길어 생태계에 지속적으로 그 영향을 미치는 경우가 있다. 산업에 활용되고 있는 여러 화학 물질들은 크게 유기물과 무기물로 구분될 수 있는 바, 이들 가운데 유기물은 상대적으로 무기물질들에 비해 그 처리 방법의 적용성 및 처리 효과가 낮아 폐수에 함유되어 있을 경우 더욱 면밀한 처리공정이 적용될 필요가 있다(Louch et al., 1992; Wei et al., 2012). 즉, 산업 공정에서 발생하는 폐수중에 포함되어있는 독성 무기물은 많은 경우에 중금속 성분이며 이들은 침전법 및 흡착법, 그리고 이온교환법 등과 같은 처리법을 적용하여 용이하게 처리될 수 있는 반면, 폐수 중에 용해되어 있는 독성 유기 성분에 대한 일반적인 처리법은 특별히 제시되는 방안을 적용하는 경우보다는 그 폐수의 성상 및 농도 특성에 따라 특정 처리법이 적용되는 방식으로 처리되고 있다(Luo et al., 2014; Pandhram and Nimbalkar, 2013). 따라서, 산업 폐수 가운데 환경에 영향을 미치는 측면에서 고려할 때 독성 유기 성분이 함유되어 있는 폐수의 영향이 상대적으로 그 비중이 높은 것으로 생각할 수 있으며 이를 방류하기 전에 규제 농도 이하로 조절하는 것이 중요하다.
산업 공정에서 배출되는 폐수 중 독성 유기 성분이 함유되어 있는 경우 이들 유기물은 많은 경우에 있어 방향족 화합물의 형태이며, 또한 그 구조식 내에 할로겐족 원소들이 포함되어 있다(Ju et al., 2008). 즉, 이러한 구조의 유기화합물은 사슬형의 유기화합물에 비해 자연 상태에서 그 분해정도가 매우 낮으므로 환경에 대한 영향이 상대적으로 클 뿐 아니라 독성 측면에 있어서도 그 위해성이 더 높은 물질일 경우가 많은 것으로 고려할 수 있다(Henschler, 1994). 그리고, 할로겐족 원소 물질은 그 자체 독성이 높으며 또한 유기화합물과 결합된 상태에서 그 합체의 독성을 상승시키는 효과를 나타내는 특성도 있다(Deborde and von Gunten, 2008). 특히, 할로겐족 물질 가운데 염소 성분이 결합되어 있는 유기 물질들은 근래 산업적인 용도가 크게 확장되고 있는 추세인 바, 반도체 회로 제작 공정 및 도금 공정에서의 세정제로 그 사용량이 크게 증가하고 있으며 각종 섬유 제품의 세정 공정에서도 많이 사용되고 있다(Chary and Fernandez-Alba, 2012; Ellis and Rivett, 2007; Shapiro et al., 2004). 또한 이러한 유기 물질은 일상 생활 주변에서도 사용되고 있는 바, 따라서 이들 물질들이 적절히 처리되지 않은 상태로 환경에 배출될 가능성이 있으며 특히 토양층을 침투해 지하수에 혼입될 경우 그 처리가 매우 어렵게 된다.
염소 등의 할로겐족 원소가 함유된 유기화합물로 오염된 지하수를 In-Situ 방식으로 처리하는 방안으로서 근래 제시된 방법이 투과성 반응 벽체(Permeable Reactive Barrier)에 의한 처리법이다(Benner et al., 1999; Matheson and Tratnyek, 1994). 이 방법은 염소 성분이 포함된 유기화합물이 함유된 지하수가 이들 반응 벽체를 투과하여 이동하는 과정에서 반응 벽체를 이루는 물질이 산화함으로써 유기화합물로부터 염소 성분을 분리하는 반응을 일으켜 유기화합물의 독성을 저감시키는 반응을 이용하는 처리 기술이다. 즉, 특정화합물에 할로겐족 성분이 결합하는 반응은 개념적으로 산화 반응이라고 할 수 있는 바, 따라서 유기화합물로부터 염소 성분이 분리되는 반응은 이와는 반대인 환원 반응이 된다. 그러므로, 염소가 결합되어 있는 유기물질이 환원됨은 이로부터 염소가 분리되는 반응이며 이 결과로 유기화합물의 독성이 저감되어 환경에 대한 영향을 감소시킴과 동시에 자연 분해능을 상승시켜 폐수의 자연적 처리 효과를 도모할 수 있다. 이러한 반응 벽체를 구성하는 물질로 가장 널리 고려되고 있는 것이 철 성분인 바, 이는 자연상태의 산화/환원 반응 측면에서 철이 지하에서 Feo 상태를 유지하는데 적합할 뿐 아니라 경제적 측면에 있어서도 적절한 물질이기 때문이다(Ruhl et al., 2014). 이러한 반응벽체와 염소가 결합되어 있는 유기화합물간의 반응성은 이론적으로 열역학적 산정에 의해 정확히 예측될 수 있으며 이의 결과에 의거하여 반응 벽체의 물리적인 크기 및 그 형상, 그리고 반응의 진행 정도 등과 같은 반응 벽체의 운영에 있어 주된 인자들을 도출할 수 있다. 그런데, 이러한 열역학적 산정 시 사용되는 열역학 자료들은 대부분 298K 온도 조건의 자료인 바, 지하에서 철로 구성된 반응 벽체를 투과하는 지하수는 그 온도가 298K가 아닌 경우가 많으므로 이러한 열역학적 산정 결과는 실제 상황을 검토하고 예측하는데 있어 오류를 발생시킨다. 따라서, 반응 벽체에 의한 오염 지하수를 처리하는 과정에 있어 온도 효과를 검토하는 것은 필수적인 상항이나 현재 이에 대한 연구 결과는 매우 미미한 실정이다.
본 연구에서는 염소가 함유된 유기화합물로 오염된 지하수를 철로 구성되어 있는 반응 벽체의 의해 처리하는 과정에서 반응에 필수적인 인자 도출에 요구되는 열역학적 산정 시 현재 고려되어 있지 않은 온도의 영향을 정량적으로 고찰하여 반응 벽체의 구성 및 반응 정도를 예측하는데 있어 정확도를 향상시키고자 하였으며 실제 적용상 그 처리효과를 정밀하게 추정하는데 있어 기여하고자 한다.
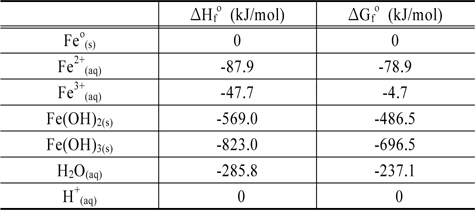
투과성 반응 벽체는 지하수와 물리적으로 접촉하여 오염된 지하수를 처리하는 물질로 구성되며 이는 주로 철 성분으로 이루어지는 바, 본 연구에서는 이에 대한 반응계에 존재하는 구성 성분으로 Feo, Fe2+, 그리고 Fe3+ 및 산화반응의 후단계에서 생성되는 침전물로 Fe(OH)2 와 Fe(OH)3를 상정해 모두 5 종의 화학종을 고려하였다. 그리고, 이러한 화학종간의 반응에 의해 유기오염물로부터 염소가 분리되는 과정에 미치는 온도의 영향을 검토하기 위해 수중 반응에 미치는 주된 영향 인자들인 pH 및 전위에 따른 각 화학종의 안정영역을 나타내는 Pourbaix Diagram 상에서 화학종 간의 경계가 온도에 따라 변화하는 양상을 조사하였다. Table 1은 본 연구에서 고려된 화학종들 및 액상의 물과 H+ 이온의 표준상태(Standard Ambient Temperature and Pressure) 에서의 열역학 자료로서 이에 의거하여 각 화학종들의 안정영역을 제시하는 Fe-H2O System 에 대한 Pourbaix Diagram 을 구축하였으며 일련의 열역학적 산정과정을 통해 이의 변화에 미치는 온도의 영향을 검토하여 철로 구성된 반응 벽체에 의한 염소유기화합물의 처리 반응의 변화를 평형론적 측면에서 고찰하였다.
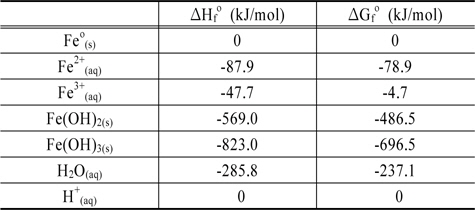
Thermodynamic data of ironic species considered in this study at standard ambient temperature and pressure (Lemos et al., 2007)
상기 제시된 Table에서 ΔGfo 는 298K 와 1 bar 에서의 각각의 철 화합물이 원소 상태의 물질로부터 형성되는 반응에서의 Gibbs 자유에너지의 변화를 의미하며 ΔHfo 는 표준 생성 엔탈피 변화량을 의미한다.
본 연구에서 고려된 화학종들의 안정영역을 Pourbaix Diagram 상에서 나타내기 위해서는 각 화학종간의 평형반응에 대한 pH 함수로서의 평형전위의 변화에 대한 식을 도출해야 하는 바, Fe-H2O System에서의 각 화학종간의 반응은 전기화학반응으로 간주할 수 있으며 다음의 열역학적 관계식에 의해 전기화학반응에 대한 Nernst Equation을 구성하였다(Bieniasz, 2004).
where, ΔG ; Change in the Gibbs Free EnergyΔGo ; Change in the Gibbs Free Energy at SATP (298K, 1 bar)R ; Gas Constant (8.314 J/K・mol)T ; Absolute TemperatureQ ; Reaction Quotient
전기화학반응에서 ΔG와 ΔGo 는 −nEF 및 −nEoF 로 대치될 수 있는 바, 여기서 n 과 F 는 각각 반응에 참여하는 전자의 수 및 Faraday Constant (96,500 C/mol) 를 의미한다. 따라서, 이들 관계식을 이용하여 식 (1)은 다음의 Nernst Equation으로 전환될 수 있으며 이에 의거해 Pourbaix Diagram 상에서 각 화학종간의 경계선을 산정해 이들의 안정영역을 구축하였다.
Fe-H2O System 에서 고려된 화학종 가운데 Feo/Fe2+ 및 Fe2+/Fe3+ 간의 경계는 전위만에 의해, 그리고 Fe2+/Fe(OH)2 및 Fe3+/Fe(OH)3 간의 경계는 pH 만에 의해 결정되어지는바, 전위만에 의해 결정되는 경계의 경우에는 반응의 ΔGo에 해당하는 Eo 에 의해 경계조건의 전위를 산정하였으며 pH 만에 의해 정해지는 경계에 대해서는 식 (1)의 좌변이 평형상태에서 0 이 됨을 고려하여 다음의 식에 의해 화학종간의 평형 pH를 도출하였다. 식 (3)에서 K 는 평형상태에서의 Reaction Quotient 에 해당하는 Equilibrium Constant를 의미한다.
온도가 변화함에 따른 각 화학종의 안정영역의 변화는 화학종간의 경계가 온도에 따라 이동하는 양상에 의거하여 검토하였다. 이를 위해 다음의 van't Hoff Equation 을 해당 온도구간에서 적분하여 298K 이외의 온도에서의 Equilibrium Constant 를 산정하였으며 이 과정에서 반응의 ΔHo는 상수로 간주하였다(Willson et al., 2005).
이에 의해 도출된 임의의 온도에서의 K 에 의거하여 해당 온도에서의 Eo 및 pH 를 구하였으며, 또한 특정 온도에서의 Nernst Equation 에 의해 화학종간의 경계를 도출해 Pourbaix Diagram 을 구축하였다.
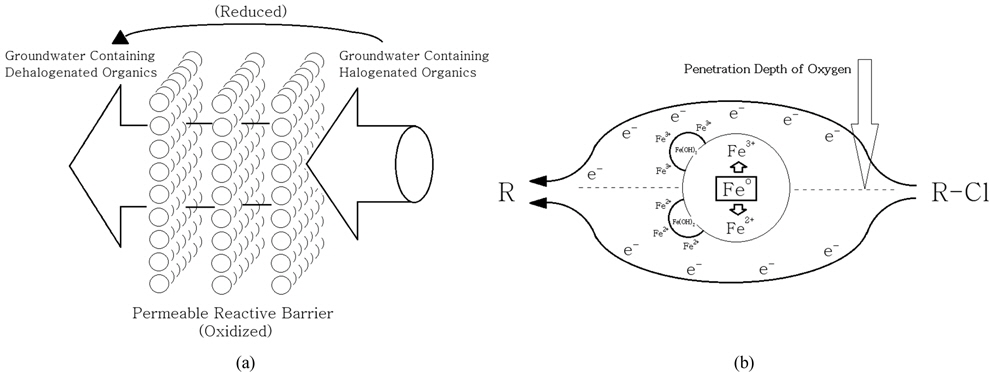
염소가 결합된 유기물이 함유되어 있는 지하수가 철 성분으로 구성되어 있는 벽체를 투과하는 과정에서 유기물로부터 염소가 분리되어 그 독성이 저감되는 반응은 Fig. 1(a)에서와 같이 개념적으로 제시될 수 있다. 즉, 지하수에 포함되어 있는 염소가 함유된 유기물은 반응 벽체를 구성하고 있는 Feo와 접촉한 상태로 투과하는 상황에서 식 (5)의 산화반응에 대응하는 환원반응(식 (6))에 의해 탈염소화 되는 것으로 고려할 수 있다.
따라서, 반응식 (5)와 (6)이 결합된 전체반응은 식 (7)과 같으며 이의 결과로 생성되는 유기화합물은 Cl− 이온이 H+ 이온으로 대치된 형태로서 무독성물질로 전환된 것으로 판단할 수 있다.
그런데, 식 (5)에 제시된 Feo의 산화반응은 대기 중 산소의 토양층에 대한 투과 깊이에 따라 그 반응의 양상이 달라지게 되는 바, 즉 Fig. 1(b)에 제시된 것과 같이 산소의 투과에 의한 공급이 원활한 조건에서는 Feo의 산화에 의해 형성된 Fe2+이온이 Fe3+형태로 전환되는 반면 (식 (8), (9)), 지하수가 상대적으로 토양층의 깊은 위치에 존재하여 대기중 산소의 투과에 의한 전달이 용이하지 못한 조건에서는 Feo의 산화는 Fe2+로의 전환으로 종결되는 것으로 생각할 수 있다(식 (10)).
이러한 Feo의 산화반응의 결과로 두 경우 모두 식 (8) 및 식 (10)에서와 같이 OH−이온이 생성되는 바, 이는 다음의 반응식들에서와 같이 역시 산화반응의 산물인 Fe3+이온 및 Fe2+이온과 반응하여 각각 Fe(OH)3 및 Fe(OH)2형태의 침전물을 형성하게 된다. 즉, 지하에 위치하고 있는 반응 벽체에 대해 산소의 공급이 원활한 조건에서는 Fe(OH)3상의 침전이, 그리고 산소의 전달이 용이하지 않은 조건에서는 Fe(OH)2 상의 침전이 생성되게 되는 바, 이는 Fig. 1(b)에 나타낸 바와 같이 반응 벽체의 구성 물질인 Feo의 표면에 부착되어 부동태막(Passivating Film)을 형성하게 되는 것으로 고려할 수 있다.
반응 벽체의 표면에 부동태막이 형성되게 되면 Feo의 산화에 요구되는 과전압(Overpotential)이 상승하게 되어 그 반응이 저해되는 바, 이는 유기화합물로부터의 탈염소반응이 감소됨을 의미한다. 따라서, Feo로 구성된 벽체에 의한 지하수 중의 염소계 유기화합물의 처리반응에 미치는 온도의 영향을 검토하는 과정에서는 산소의 투과 깊이에 따른 Feo의 산화 단계와 이의 결과로 형성되는 부동태막의 생성단계를 구분하여 고려할 필요성이 있으며 각 경우에 대해 반응 벽체에 의한 지하수의 처리 양상이 달라지게 될 것으로 판단할 수 있다.
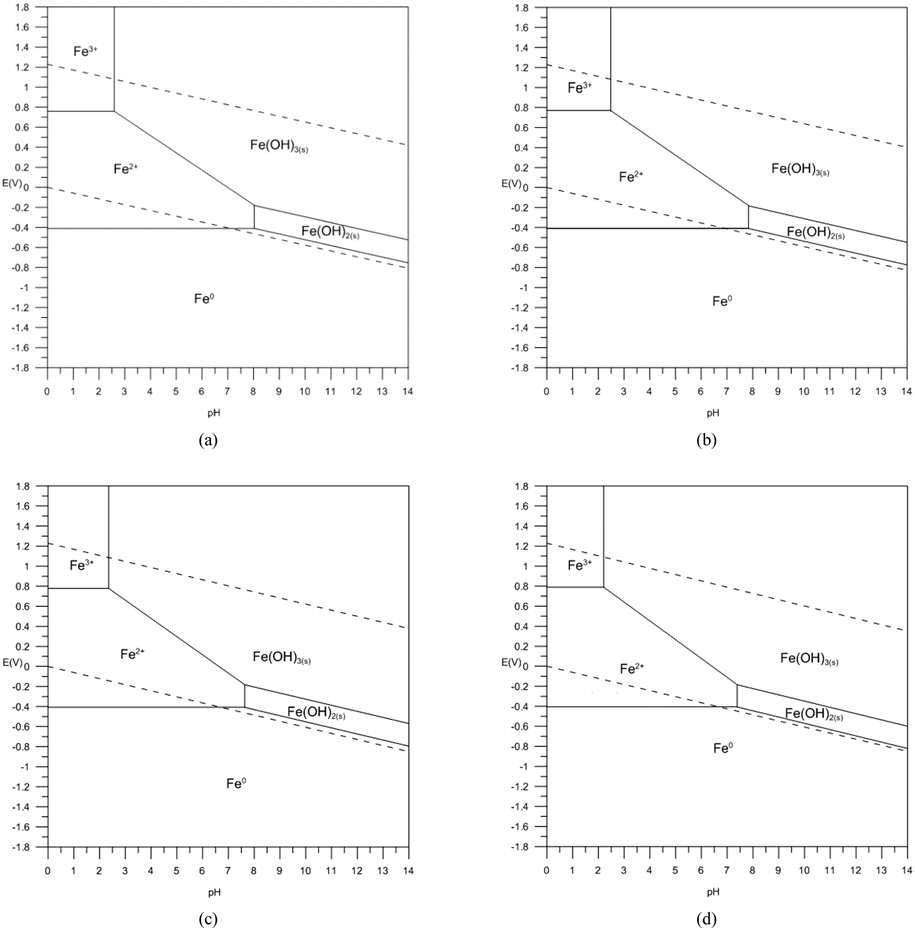
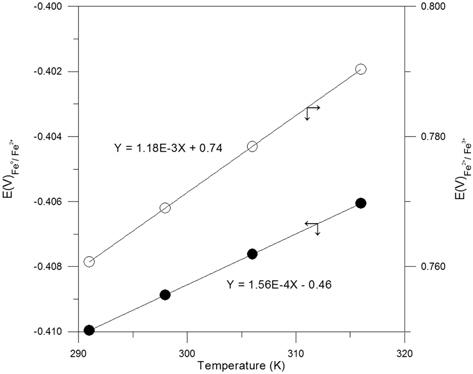
산소의 공급이 원활한 조건에서 Feo는 앞서 제시된 식 (8)과 (9)에서와 같이 Fe2+ 상태를 거쳐 Fe3+ 상태로 산화되는 것으로 생각할 수 있으며, 염소가 결합된 유기화합물에 대해 탈염소 반응이 일어나기 위해서는 이러한 Feo의 산화반응이 원활이 진행되어져야 한다. 호기성 조건에서 Feo 산화반응의 진행 용이성의 정도는 Feo/Fe2+ 및 Fe2+/Fe3+ 간의 반응에 관한 평형 전위값에 의해 판단할 수 있으며 이들 평형 전위값이 낮을수록 Feo의 산화는 더욱 용이하게 진행될 것으로 판단할 수 있다. Fig. 2는 본 연구에서의 일련의 열역학적 산정 과정을 거쳐 291K ~ 316K 범위의 온도에서 Fe-H2O System 에 대한 Pourbaix Diagram 이 변화하는 양상을 검토한 결과이며 이 과정에서 Fe2+ 이온 및 Fe3+ 이온의 Activity 는 각각 1 × 10−4 로 간주하였다. 각 Pourbaix Diagram상에서 점선으로 제시된 경계는 물이 액상으로 존재하는 영역에 대한 것이며 pH 에 따른 이들 경계의 상부 및 하부 전위 조건에서는 액상의 물이 다음의 산화 및 환원반응에의해 각각 기체상의 O2 와 H2 로 전기화학적으로 변환하게 됨을 의미한다. 물의 액상 영역을 나타내는 경계선 역시 각 온도 조건을 반영하는 산정 결과에 의거하여 Pourbaix Diagram 상에서 표현하였다.
Fig. 3은 온도의 변화에 따른 Pourbaix Diagram 상에서의 Feo/Fe2+ 와 Fe2+/Fe3+ 간의 평형전위의 변화를 더욱 명확히 제시한 것으로 이로부터 검토된 온도 범위에서 온도가 증가함에 따라 이들 두 평형전위는 직선적으로 증가하는 것을 알 수 있으며 그 증가 정도는 Fe2+/Fe3+ 평형의 경우가 Feo/Fe2+ 평형의 경우에 비해 더욱 큰 것으로 나타났다. 따라서, 호기성 조건에서 반응성 투과 벽체에 의한 탈염소화 반응은 상기 제시된 식 (8)과 (9)에 대응하는 환원반응에 의해 형성되며 그 진행 정도는 온도가 상승할 경우 저하되게 되는 바, Fig. 3에 제시한 회귀직선들의 기울기를 비교할때 Feo가 Fe2+ 상태로 산화되는 과정에 비해 Fe2+ 가 Fe3+ 상태로 산화되는 과정이 약 7.5 배 정도 크게 온도의 영향을 받는 것으로 파악되었다. 그러므로, 온도에 따른 유체의 점성 변화 및 기체 이전에 대한 확산계수의 변화와 같은 요인들을 배제한 상황에서 지하수와 반응 벽체와의 평형론적 반응 특성만을 고려할 경우 지하수에 함유된 염소계 유기화합물의 독성 저감 효과는 상대적으로 낮은 온도에서 더욱 증대될 것으로 예측할 수 있다. 따라서, 온도 감소 시 반응 벽체의 두께를 상대적으로 감소시킴으로써 벽체 제작에 사용되는 재료의 절감이 가능할 것으로 사료되며 이를 반영한 반응 벽체의 설계 및 운영이 필요할 것으로 판단된다.
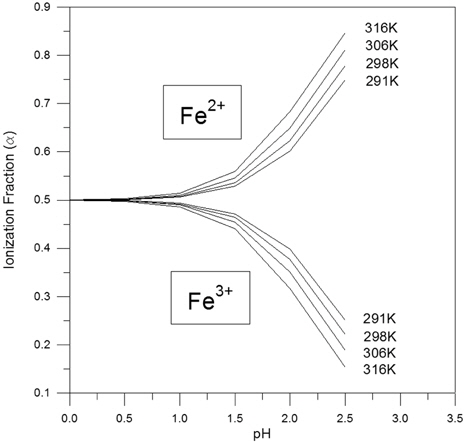
Fig. 2의 Pourbaix Diagram 상에서 Fe2+ 이온과 Fe3+ 이온간의 경계는 pH 0 ~ 2.5 범위에서 수평선으로 제시되어 이들 이온의 평형반응이 pH 의 변화에 대해 독립적임을 제시하고 있다. 그런데, 상기 반응식 (9)에 의거하면 Fe2+/Fe3+ 평형은 H+ 이온의 농도가 달라질 경우 이동하는 바, 이는 pH 에 따라 두 이온의 경계가 변화됨을 의미하는 것으로 해석할 수 있다. 이러한 차이점은 Pourbaix Diagram 구축 과정에서 고려되는 평형 반응식에서는 용존 기체의 농도를 고려하지 않음에 기인하는 것으로서, 즉 Fig. 2에서의 Fe2+/Fe3+ 경계는 다음의 식 (15)에 의거해 수중에 존재하는 용존 산소의 농도를 0 으로 간주하고 도출된 것이기 때문이다.
본 연구에서는 반응식 (9)의 내용을 고려하여 Fe2+/Fe3+ 평형에 미치는 pH의 영향을 검토하고자 Visual MINTEQ Program (Version 3.0)을 사용해 Fe2+ 이온과 Fe3+ 이온만이 존재하는 Fe-H2O System 을 상정하여 조사된 온도 조건에서 pH 0 ~ 2.5 범위에 대한 두 이온의 이온화율(Ionization Fraction) 의 변화 양상을 고찰하였다. Fig. 4는 이의 결과를 제시한 것으로서 pH 가 상승함에 따라 Fe2+의 이온화율은 증가하는 반면, Fe3+의 이온화율은 이에 대칭적으로 감소하는 것으로 파악되었다. pH 상승에 따른 Fe2+ 농도의 상대적인 증가는 식 (9)의 내용과 일치하는 바, 즉 Fe2+와 Fe3+간의 평형에서 H+ 농도가 감소하게 되면 평형은 좌로 이동하게 되어 Fe3+ 이온이 Fe2+ 상태로 전환되게 됨을 예측할 수 있다. 이는 Feo/Fe2+ 평형에 대해서도 고려될 수 있는 사항으로 식 (8)에 의하면 호기성 조건에서 pH 상승 시 평형은 좌로 이동하여 Fe2+ 의 농도가 감소될 것으로 예상할 수 있다. 따라서, 현재 수체에서 진행되는 화학반응의 평형론적 해석에 있어 광범위하게 적용되고 있는 Pourbaix Diagram의 구축 시 검토 대상 반응계의 특성을 반영하는 용존 기체농도의 정량적인 조건 부여는 반응계의 해석 및 관련 공정의 설계와 운영에 있어 더욱 면밀한 자료의 획득에 필요한 고려 사항일 것으로 사료된다. Fig. 4의 결과에서 온도가 증가함에 따라 Fe2+의 이온화율은 동일한 pH 조건 시 상승하는 것으로 제시된 바, 이는 온도별 Pourbaix Diagram의 결과와도 잘 부합되고 있음을 알 수 있다. 즉, Fig. 3에서의 두 회귀직선의 기울기에 의거할 때 온도에 따른 Feo의 Fe2+ 상태로의 전환 정도는 Fe2+의 Fe3+ 상태로의 전환 정도에 비해 더욱 크며 이는 Fe2+ 및 Fe3+ 두 이온만이 존재하는 반응계에 대해서는 전체 농도 중 Fe2+ 이온의 농도가 차지하는 비율이 온도 증가 시 상승함을 의미하기 때문이다.
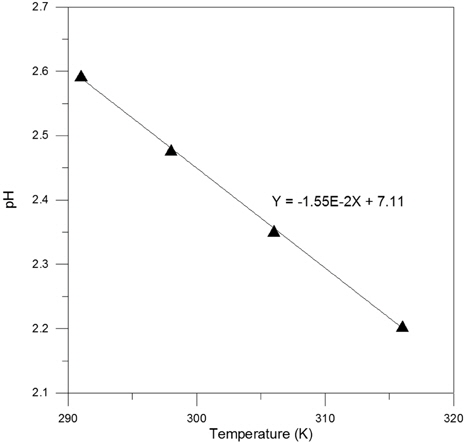
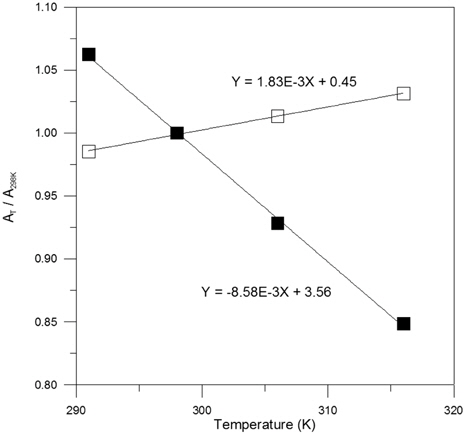
상기 언급한 바와 같이 염소계 유기화합물로부터의 탈염소 반응은 Feo의 산화에 대응하는 반응으로 진행되나 이는 후속 반응으로 형성되는 철수산화물 침전 생성 반응에 의해서도 영향을 받으므로 이 단계에서의 열적 특성 또한 검토되어져야 한다. 호기성 조건에서 Feo의 산화에 의한 최종 산물인 Fe3+ 이온은 실질적으로는 6 개의 물분자의 의해 둘러싸인 [Fe(H2O)6]3+ 형태의 이온으로 이는 식 (11) 에 의해 그 일부가 Fe(OH)3 상의 침전으로 전환된다. Fe3+ 이온이 침전상태로 변환되는 과정에서 온도 및 시효 등의 환경 조건에 따라 Goethite (FeO・OH), 혹은 Hematite (Fe2O3)상이 형성될 수도 있으나 본 연구에서는 반응 벽체에 의한 지하수의 일반적인 처리 조건을 고려하여 Fe3+ 이온에 의한 침전상은 Fe(OH)3 인 것으로 간주하였다. Fig. 5는 온도별 Fe-H2O System 의 Pourbaix Diagram 에서 Fe3+ 이온과 Fe(OH)3 간의 경계에 해당하는 pH 의 온도에 따른 변화 양상을 제시한 것으로 이로부터 온도가 상승함에 따라 두 화학종간의 평형 pH 는 검토된 온도 구간에서 지속적으로 감소됨을 파악할 수 있다. Fig. 1에 나타낸 바와 같이 Fe(OH)3 침전이 Feo표면에 형성되면 이의 전기화학반응에 대한 부동태막으로 작용하여 반응의 과전압이 상승하게 되므로 탈염소 반응은 저하되게 된다. 따라서, 온도 증가에 따른 Fe3+/Fe(OH)3 평형 pH 의 감소는 Fe(OH)3 침전 생성 반응의 조장을 의미하며 이의 결과로 지하수에 함유되어 있는 유기화합물로부터의 염소 분리 반응은 저하될 것으로 예측 할 수 있다. 그러므로, 호기성 조건에서의 Feo 반응 벽체에 의한 탈염소 반응은 Feo의 산화 및 침전 생성 두 단계에 대해 공통적으로 온도 상승에 따라 저하될 것임을 예상할 수 있는 바, 반응속도론적인 측면 및 기타 환경 조건을 이와 함께 고려하여 반응 벽체의 효율을 검토함이 필요할 것으로 사료되며 벽체의 설계 과정에서 이러한 사항을 반영함으로써 공정의 경제적 운영이 가능할 것으로 생각된다.
Pourbaix Diagram 에서 제시되는 바와 같이 수환경에서 일어나는 화학반응에 대한 주된 영향 인자는 특정 온도 조건에서 pH 와 전위라고 간주할 수 있다. 그런데, 온도가 변화함에 따라 화학반응의 평형은 이동하게 되는 바, 이러한 평형의 위치 변화에 대한 온도의 영향을 고려하는 과정에서 초기의 평형에 해당하는 pH 나 전위만의 이동을 고찰하는 경우에는 온도에 따른 평형의 전이 정도를 정량적으로 파악하는데 있어서는 부분적인 해석이라고 할 수 있다. 즉, 수체에서 진행되는 반응에 대한 온도 효과를 정량적으로 조사하기 위해서는 수환경에서의 주된 독립변수들인 평형 조건에 해당하는 pH 와 전위의 온도에 따른 변화를 동시에 고려하는 것이 더욱 객관적인 방안으로 제시될 수 있을 것으로 사료된다. 따라서, 본 연구에서는 이러한 점을 고려하여 호기성 조건에서 Feo 산화반응의 최종 생성물인 Fe3+와 이의 침전반응에 의해 형성되는 Fe(OH)3 와의 평형계를 대상으로 Pourbaix Diagram 상에서 특정 화학종의 안정영역에 해당하는 면적의 온도별 변화 양상을 파악해 투과성 반응 벽체에 의한 염소유기화합물의 무해화 반응에 미치는 온도의 영향을 정량적으로 검토하고자 하였다. 이를 위해 298K 에서의 특정 화학종에 해당하는 Pourbaix Diagram 상에서의 면적을 기준으로 하여 다음의 정의된 식에 의거해 이의 반응성의 변화를 고찰하였다.
where, AT; Area of the Stable Region for a Specific Chemical Species at TA298K; Area of the Stable Region for a Specific Chemical Species at 298K
이렇게 Pourbaix Diagram 에서의 화학종의 안정영역에 해당하는 면적을 산출하는 과정에서 pH 조건은 0 ~ 14 범위로 하였으며 전위 조건은 탈염소 반응이 수체에서 진행되는 반응임을 고려하여 물이 액상으로 존재하는 구간으로 설정하였다. Fig. 6은 Fig. 2에 제시된 결과 및 식 (16)의 정의에 의거하여 Fe3+ 이온 및 Fe(OH)3 침전물의 반응성에 미치는 온도의 영향을 나타낸 것으로 이로부터 온도 상승에 따라 Fe3+의 반응성은 지속적으로 감소하는 반면, Fe(OH)3의 반응성은 직선적으로 증가됨을 알 수 있으며 온도가 상승함에 따른 Fe3+의 반응성 감소는 Fe(OH)3의 반응성 증가에 비해 약 4.7 배 큰 것으로 파악되었다. 온도 상승에 따른 Fe(OH)3의 반응성 증가는 상기 언급한 바와 같이 부동태막 형성의 조장에 기인하는 탈염소 반응의 저하를 의미하는 바, 부동태막의 형성 과정을 Fe3+ 이온의 발생 및 Fe(OH)3 생성 두 단계로 구분하여 고려할 시 각 단계 반응이 부동태막 형성에 의한 반응 벽체의 효율성 감소에 미치는 영향을 정량적으로 고찰함이 가능함으로써 이에 의한 지하수 처리 공정의 보다 면밀한 운영이 이루어질 수 있을 것으로 사료된다.
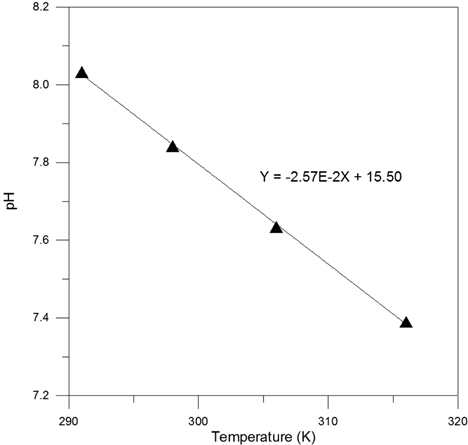
토양층의 깊이가 증가하여 대기 중 산소의 전달이 용이하지 않은 혐기성 상태가 될 경우 Feo의 산화반응은 식 (10)의 단계에서 종결되게 되며 이의 후단계 반응으로 Fe(OH)2 침전 생성 반응이 진행되는 것으로 고려할 수 있다. 혐기성 조건에 대해서도 호기성 조건과 유사한 개념을 적용하여 온도에 따른 Feo/Fe2+ 간의 반응에 대한 평형전위의 변화 양상으로부터 탈염소화 반응에 대응하는 산화반응의 진행 용이성에 미치는 온도의 영향을 검토할 수 있는 바, 이는 Fig. 3에 제시된 온도별 Feo/Fe2+ 평형전위 변화 결과를 동일하게 적용하여 해석할 수 있다. 즉, 혐기성 조건과 호기성 조건에서의 산화반응의 차이점은 Fe2+의 Fe3+ 상태로의 산화 진행 여부인 바, 온도 상승에 따른 Feo/Fe2+ 평형 전위의 증가는 호기성 조건에서와 마찬가지로 혐기성 조건에 대해서도 온도가 상승할 시 탈염소화 반응은 평형론적 측면에서 저하되는 것으로 해석할 수 있다.
혐기성 조건에서의 부동태막 형성에 의한 반응 벽체의 효율성 변화에 미치는 온도 효과는 반응식 (12)에 대한 Fe2+/Fe(OH)2 평형 pH 에 의거해 검토할 수 있는 바, Fig. 7은 온도별 Pourbaix Diagram 에서의 결과에 의거해 온도가 달라짐에 따른 이의 변화 양상을 제시한 것이다. 이로부터 알 수 있는 바와 같이 호기성 조건에서와 유사하게 혐기성 조건에 대해서도 온도가 상승할 경우 유기오염물로부터의 탈염소화 반응은 그 진행 정도가 감소될 것으로 예상할 수 있으며 Fig. 5와 Fig. 7의 두 회귀직선의 기울기를 비교할때 호기성에 비해 혐기성일 경우 그 감소폭이 더욱 큼을 알 수 있다. 이렇게 호기성과 혐기성 조건에서 온도에 따른 부동태막 형성 반응에 대한 평형 pH 변화 양상이 달리 나타나는 원인의 하나로 물의 pH 완충용량(Buffer Capacity)이 pH 조건에 따라 달라지게 되는 현상을 고려할 수 있다. 즉, 물의 pH 변화에 대한 완충용량은 중성 부근에서 가장 낮으며 산성, 혹은 알칼리성이 증대됨에 따라 그 값이 증가하게 되는 바(Snoeyink and Jenkins, 1980), 호기성 조건에서는 검토된 온도 범위에서의 해당 반응에 대한 평형 pH 변화가 2.2 ~ 2.6 구간임에 비해 혐기성 조건일 경우에는 그 변화가 7.4 ~ 8.0 구간이므로 물의 pH 완충용량이 호기성에 비해 상대적으로 작은 pH 조건이라고 할 수 있다. 따라서, 외부 영향 요인의 변화에 따른 pH 변화는 혐기성 조건에서 더욱 크게 반영될 것으로 예상할 수 있는 바, Fig. 7 에서의 회귀직선의 기울기가 Fig. 5의 회귀직선의 기울기에 비해 약 1.7 배 정도 큼은 부분적으로 이러한 이유에 기인하는 결과인 것으로 고려될 수 있다.
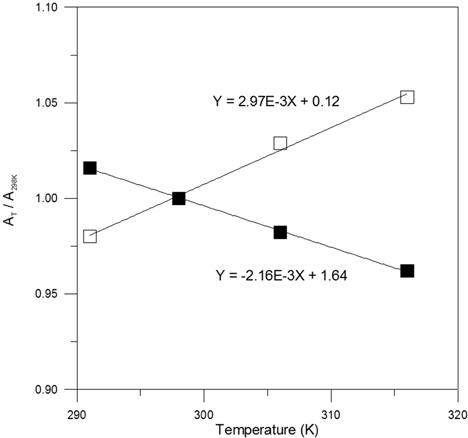
호기성 조건의 경우에서와 같이 혐기성 조건에 대해서도 Feo 산화반응의 최종 생성물인 Fe2+와 이에 의해 형성되는 Fe(OH)2 침전물간의 평형계를 대상으로 식 (16)에 제시된 정의에 의거해 동일한 pH 및 전위 조건에서 Fe2+ 와 Fe(OH)2의 온도에 따른 반응성의 변화를 정량적으로 검토하고자 하였다. Fig. 8은 이의 결과를 제시한 것으로서 온도가 상승할 경우 Fe2+의 반응성은 감소되나 이와는 반대로 Fe(OH)2의 반응성은 증가하는 것을 알 수 있으며 그 증가폭은 Fe2+ 이온의 반응성 감소폭에 비해 약 1.4 배 정도인 것으로 파악되었다. 따라서, 혐기성 조건의 경우에도 온도 상승 시 부동태막 형성이 조장됨으로 인해 탈염소 반응이 저하될 것으로 예상되는 바, 이러한 사항을 고려한 반응 벽체의 설계 및 운영이 필요할 것으로 사료된다.
지하수에 함유되어 있는 염소계 유기화합물을 철 성분으로 구성된 반응성 투과 벽체에 의해 처리하는 과정에서의 온도의 영향에 대하여 열역학적 산정 기법을 적용해 정량적으로 검토한 결과 다음의 결론을 도출하였다.
1) 호기성 조건에서 온도가 상승함에 따라 Feo/Fe2+ 및 Fe2+/Fe3+ 평형전위는 지속적으로 증가하며 그 증가폭은 Fe2+/Fe3+ 평형전위가 Feo/Fe2+ 평형계에 비해 약 7.5 배 정도 큰 것으로 파악되었다. 따라서, 지하수에 함유된 유기오염물로부터의 Feo 반응 벽체에 의한 탈염소화 반응은 검토된 온도 범위에서 상대적으로 온도가 낮을수록 더욱 증대될 것으로 예측되었다.2) Visual MINTEQ Program 을 이용하여 Fe2+ 이온 및 Fe3+ 이온만이 존재하는 Fe-H2O System 에 대해 pH 0 ~ 2.5 범위에서 각 이온의 이온화율의 변화를 검토한 결과, pH 상승 시 Fe2+ 의 이온화율은 증가하고 Fe3+의 이온화율은 이에 대칭적으로 감소하며 그 변화 정도는 온도에 비례하는 것으로 고찰되었다.3) 열역학적 산정에 의해 구축된 온도별 Pourbaix Diagram 상에서 온도 증가 시 Fe3+/Fe(OH)3 반응계에 대한 평형 pH 는 감소되는 것으로 파악된 바, 따라서 호기성 조건에서 온도 상승 시 부동태막 형성에 의한 염소계 유기화합물의 처리 효과 감소는 증대될 것으로 예측되었다.4) Pourbaix Diagram 에서 특정 화학종에 대하여 298K 에서의 이의 안정영역 면적에 대한 임의의 온도에서의 안정영역 면적의 비로 온도에 따른 이 화학종의 반응성 변화를 정량적으로 정의하였으며 이에 의거해 Fe3+/Fe(OH)3 평형계에 대해 온도별 반응성 변화를 조사한 결과, 온도상승에 따라 Fe3+의 반응성은 감소하는 반면 Fe(OH)3의 반응성은 직선적으로 증가하는 것으로 검토되었다.5) 혐기성 조건의 경우 온도 증가 시 Feo/Fe2+ 평형전위는 상승하며 Fe2+/Fe(OH)2 반응계의 평형 pH 는 감소하는 것으로 파악된 바, 따라서 호기성 조건의 경우와 유사하게 혐기성 조건에 대해서도 온도가 상승할 경우 Feo 의 산화반응 저하 및 Fe(OH)2 부동태막 형성 조장에 의해 평형론적 측면에서 유기계 염소화합물로부터의 탈염소 반응 효율은 감소하게 될 것으로 고려되었다.