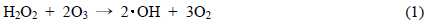High-voltage dielectric discharges are an emerging technique in environmental pollutant degradation, which are characterized by the production of hydroxyl radicals as the primary degradation species. The initiation and propagation of the electrical discharges depends on several physical, chemical, and electrical parameters such as 1st and 2nd voltage of power, gas supply, conductivity and pH. These parameters also influence the physical and chemical characteristics of the discharges, including the production of reactive species such as ・OH, H2O2 and O3. The experimental results showed that the optimum 1st voltage and oxygen flow rate for RNO (N-Dimethyl-4-nitrosoaniline, indicator of the generation of OH radical) degradation were 160 V (2nd voltage of is 15 kV) and 4 L/min, respectively. As the 2nd voltage (4 kV to 15 kV) was increase, RNO degradation was increased and, generated H2O2 and O3 concentration were increased. The conductivity of the solution was not influencing the RNO degradation, H2O2 and O3 generation. The pH effect on RNO degradation was not high. However, the lower pH and the conductivity, the higher H2O2 and O3 generation were observed.
오염된 수중의 난분해성 화학 물질들을 처리하기 위해 여러 가지 처리법들이 연구되고 있다. 예를 들면, 오존을 이용한 산화 공정, 고-에너지 전자빔 조사, 활성탄 흡착 및 고급 산화공정(advanced oxidation processes, AOPs) 등이 오염물질을 처리하기 위한 재래식 공정의 대체 공정으로 여겨지고 있다(Lin and Lai, 2002; Park et al., 2006; Sun et al., 1999).
여러 가지 대체 공정 중 유기물질을 산화시키는 가장 효율적인 방법 중의 하나가 ・OH, ・O, H2O2 및 O3와 같이 산화 전위(oxidizing potential)가 높은 화학물질을 이용하는 것이다. 특히 불소 라디칼 다음으로 높은 산화력을 가지는 ・OH은 수중에서 유기 화합물을 산화시키는데 가장 중요한 반응물 중의 하나이다(Kim et al., 2010). ・OH 생성을 촉진시켜 유기물질을 제거할 수 있는 O3/UV, H2O2/UV, TiO2/UV 및 전기분해 등의 고급 산화공정이 난분해성 물질 처리 공정으로 평가받고 있다(Kim and Park, 2008; Park and Kim, 2007; Park and Kim, 2010).
최근에는 고급 산화공정의 한 종류로 수중에서 플라즈마를 발생시켜 난분해성 물질을 처리하는 연구가 주목받고 있다. 플라즈마는 전기적인 방전에 의해 생긴 전하를 띤 양이온과 전자들의 집단을 말한다(Lee, 2005).
플라즈마는 크게 고온 플라즈마(thermal plasma)와 저온 플라즈마(non-thermal plasma), 저밀도 플라즈마 및 고밀도 플라즈마로 분류할 수 있다. 환경 분야에서는 고온 플라즈마보다 장치가 간단하고 적용하기 쉬운 저온・고밀도 플라즈마가 많이 이용되고 있다(Dendy, 1990).
환경 분야 중 수처리에 많이 이용되는 플라즈마는 저온 플라즈마로 두 전극 사이에 고전압을 인가하여 코로나 방전(아크 방전이 일어나기 직전 상태)을 일으켜 얻어지는 플라즈마로 음극에서 방출되는 전자가 두 전극 사이에 존재하는 가스 분자들에 충돌하여 가스 분자를 이온화시켜 발생한다. 저온 플라즈마의 발생원으로는 electron beam 조사나 electrical discharge이다. 수표면 또는 수중에서 방전시켜 플라즈마를 발생시키면 자외선, shock wave, H2O2 및 O3와 같은 산화제, ・OH, ・H, ・O, ・O2-, ・HO2와 라디칼 등 각종 화학적 활성종들이 생성되는 것으로 알려져 있다(Jung and Locke, 2007; Lukes et al., 2004). 화학적 활성종들의 반감기가 매우 짧기 때문에 기상 방전이 아니라 수중 플라즈마 방전을 활용하면 다양한 화학적 활성종들을 오염물질에 직접 접촉시킬 수 있어 반응의 효율성과 에너지 효율성을 동시에 얻을 수 있다(Yoon, 2008).
본 연구진들은 수중 유전체장벽 방전 플라즈마 반응기에 대한 기초 설계 인자를 찾아내었다(Kim and Park, 2011b). 본 연구의 목적은 기본 플라즈마 반응기의 성능을 개선하기 위한 방법으로 기-액 혼합기를 채택하여 플라즈마에서 발생하는 이온화가스의 용존을 높인 기-액 혼합 플라즈마 시스템에서의 주요 산화제인 ・OH, O3, 및 H2O2 생성에 미치는 인자의 영향을 고찰하였다.
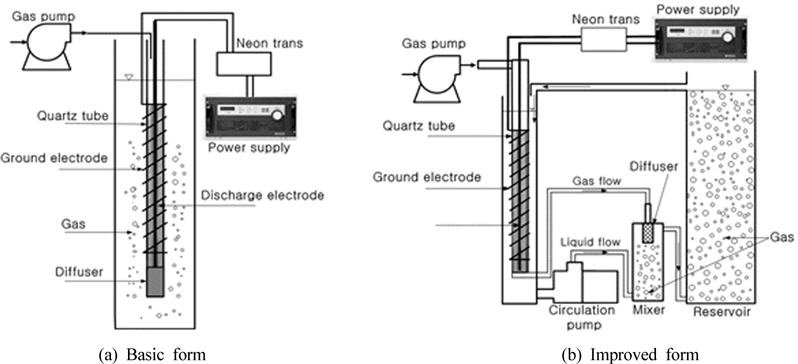
Fig. 1(a)은 기본 형태의 플라즈마 반응기이고, Fig. 1(b)는 기-액 혼합기와 순환 펌프가 설치된 개선된 반응기이다. Fig. 1(a)에 나타낸 바와 같이 기본 플라즈마 반응기 시스템은 방전 전극(내부 전극), 유전체인 석영관, 접지 전극(외부 전극) 및 산기관으로 이루어진 플라즈마 반응기, 220 V의 입력 전압을 변경할 수 있는 슬라이닥스(Slidacs)와 네온트랜스로 이루어진 전원 공급장치 및 산소 공급장치로 이루어져 있다. 기본 반응기(높이, 30.0 cm; 내경, 10.5 cm)는 반응 부피가 2 L인 원통형이며 유리로 제작하였다. 유전체는 두께가 1 mm, 내경이 7 mm인 석영관을 사용하였다. 방전 전극은 직경이 2 mm인 봉 형 전극, 접지 전극은 직경이 1 mm인 전극을 스프링 형태로 만든 후 사용하였으며 두 전극은 모두 티타늄이었다. 반응기에 공급하는 가스로는 산소를 사용하였다. 산소 발생장치에서 발생한 공기를 rotameter를 이용하여 유량을 조절한 뒤 공급하였다. 전원장치는 1차 전원과 2차 전원으로 이루어져 있다. 1차 전원은 슬라이닥스를 이용하여 입력 교류 전압을 220 V까지 조절하여 2차 전원에 공급하였다. 2차 전원은 전극에 고전압을 인가하는 역할을 하며 15 kV이고 주파주가 20 kHz인 네온트랜스를 이용하였다. 네온트랜스는 220 V에서 15 kV의 출력을 나타내며, 1차 전원이 감소하면 출력 전압인 고전압이 직선적으로 감소한다. 180 V는 12.7 kV, 140 V는 9.8 kV, 120 V는 7.8 kV, 100 V는 6.3 kV, 80 V는 4.3 kV에 해당한다(Kim and Park, 2013).
플라즈마 반응기에서 이온화 가스가 발생한 후 산기관을 거쳐 기포형태로 방출되어 수중에서 반응물질과 반응한 후 대기 중으로 방출된다.
Fig. 1(b)에 나타낸 기-액 혼합 반응기 시스템의 플라즈마 반응기 시스템은 기본 플라즈마 반응기의 부피를 줄인 플라즈마 반응기와 기-액 혼합기 및 저장조로 이루어져 있다. 플라즈마 반응기(높이, 30.0 cm; 내경, 8.0 cm)와 저장조(높이, 50.0 cm; 내경, 6.0 cm)는 유리로, 기-액 혼합기는 플라스틱으로 제작하였다. 기-액 혼합 플라즈마 반응기 시스템의 총 반응 부피는 2 L이다. Fig. 1(b)는 기-액 혼합기 중 산기관 형 혼합기가 장착된 모습을 나타내었다. 공기의 공급에 의해 플라즈마 반응기에서 이온화 가스가 발생한 후 기-액 혼합기로 유입된다. 플라즈마 반응기 하부의 용액이 순환 펌프에 의해 기-액 혼합기로 유입되어 이온화 가스와 혼합된 후 저장조로 유입된다. 저장조의 이온화 가스는 상승하여 대기 중으로 방출되고 용액은 저장조에서 다시 플라즈마 반응기로 유입되어 순환하게 된다. 이온화 가스는 기-액 혼합기에서 1차 용해되고 용액과 반응하고 저장조에서 2차 용해하면서 용액과 2차 반응한다. 기-액 혼합기는 산기관 형(높이, 13.5 cm; 내경, 4.5 cm) 혼합기이다. 플라즈마 반응에 의해 이온화된 가스가 기-액 혼합기 외부의 상부에서 내부의 산기관으로 유입되고 순환수는 순환 펌프에 의하여 기-액 혼합기 하부로 유입되어 상부에서 이온화 가스와 혼합된 후 저장조로 유입된다.
기본 플라즈마 반응기는 산소 공급량을 5 L/min으로 유지한 상태에서 1차 전압을 70 ~ 200 V로 실험하였다. 기본 반응기와 개선된 플라즈마 반응기 모두 회분식으로 실험하였다.
플라즈마 반응을 통하여 생성되는 산화제 중 ・OH은 생성량을 직접적으로 측정하기 어려워 ・OH과 선택적으로 반응하는 것으로 알려진 여러 종류의 지표물질을 이용하여 물질의 분해를 통하여 간접적으로 측정하는데, RNO(N, N-Dimethyl-4-nitrosoaniline)가 흡광광도계로 쉽게 측정이 가능하기 때문에 ・OH의 생성 여부를 RNO 분해를 통하여 간접적으로 확인하였다(Li et al., 2009). RNO는 초기농도가 100 mg/L인 용액을 사용하였으며, RNO 농도는 UV-VIS spectrophotometer(Genesis 5, Spectronic)를 사용하여 RNO의 최대 흡수파장인 440 nm를 측정하여 검량선을 사용하여 농도로 나타내었다. 수중의 잔류 O3 농도는 Indigo법을 이용하여 측정하였다. 수중의 잔류 H2O2 측정은 1 M NaOH 50 μL를 첨가하여 phenol red를 알칼리 용액으로 발색시켜 UV-Vis spectrophotometer(Genesysis 5, Spectronic)를 사용하여 596 nm에서 흡광도를 측정하고, 과산화수소 표준용액으로 작성한 검량선과 비교하여 농도를 구하였다.
3.1. 기본 플라즈마 반응기에서 활성종 생성에 미치는 1차 전압의 영향
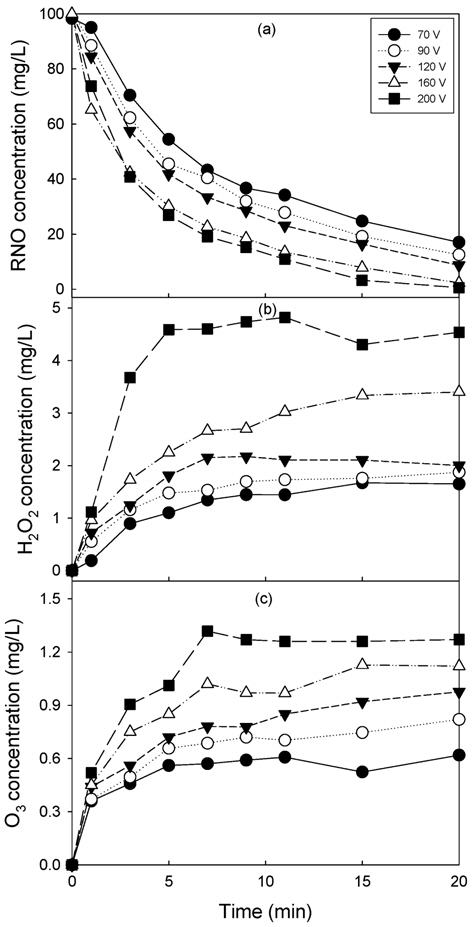
산소 공급량이 5 L/min인 조건에서 ・OH 라디칼의 간접 생성지표인 RNO 분해에 미치는 1차 전압의 영향을 Fig. 2(a)에, 과산화수소와 오존 생성은 Fig. 2(b)와 (c)에 나타내었다. Fig. 2(a)에서 보듯이 기본 플라즈마 반응기에서 RNO는 1차 전압의 증가에 따라 분해율이 증가하여 200 V까지 선형적으로 감소하는 경향을 보였다. 160 V와 200 V에서의 RNO 분해 경향을 보면 전압을 220 V로 증가하여도 RNO 분해율의 증가는 한계에 도달할 것으로 판단되었다.
Fig. 2(b)에서 보듯이 1차 전압이 70 V인 경우 과산화수소는 서서히 생성되어 20분의 반응시간에서 1.62 mg/L의 과산화수소가 생성되었으며, 전압의 증가에 따라 생성되는 과산화수소 농도는 증가하는 경향을 나타내었다. 200 V의 경우 다른 전압과는 다르게 반응 5분 만에 평형 농도에 도달되었으며, 4.3 ~ 4.8 mg/L를 나타내었다.
Fig. 2(c)에 1차 전압의 증가에 따른 오존 생성 농도를 나타내었다. 70 V의 경우 과산화수소 생성 경향과 유사하게 방전 시간의 증가에 따라 생성 오존 농도가 서서히 증가하는 것으로 나타났고 평형 오존 농도는 대략 0.6 mg/L 부근인 것으로 나타났다. 전압의 증가에 따라 생성되는 오존 농도도 증가하는 것으로 나타났다. 전압의 증가에 따른 생성 경향은 과산화수소와 비슷하게 나타났다. 200 V의 경우 7분에 평형에 도달하였으며, 7분 이후 오존 농도는 비슷하게 유지되었으며, 대략 1.27 mg/L로 나타났다.
전압에 따른 과산화수소와 오존의 생성 농도 변화가 RNO 분해보다 큰 것으로 보이지만 RNO의 y축 눈금이 과산화수소와 오존보다 크기 때문에 전압 증가에 따른 활성종 생성에 가장 큰 영향을 받는 것은 RNO 분해에 의한 OH 라디칼이라고 사료되었다. 이는 공기를 이용한 플라즈마 공정을 이용한 산화제 생성 결과와 같은 결과를 나타내었다(Kim and Park, 2012).
Fig. 2 (b)와 (C)에서 160 V와 220 V의 과산화수소와 오존 생성량 차이가 대략 1 mg/L, 0.15 mg/L 정도로 나타나 과산화수소와 오존의 반응에 의한 OH 라디칼 생성은 크지않은 것으로 사료되었다.
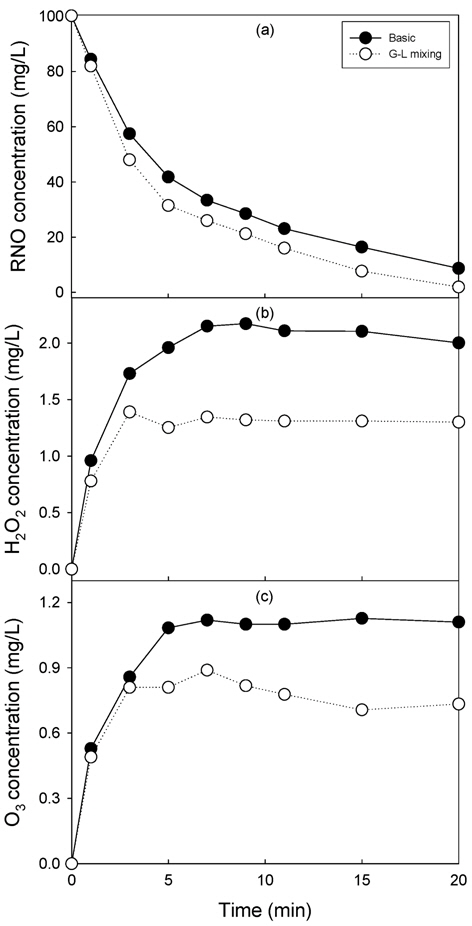
Fig. 3에 1차 전압이 120 V, 산소 공급량이 5 L/min인 조건에서 기-액 혼합기의 설치가 RNO 분해(a), 과산화수소(b) 및 오존(c) 생성에 미치는 영향을 나타내었다. 기-액 혼합기의 설치시 산화제 생성에 대한 최적 전압이 내려갈 것으로 예상하여 기-액 혼합기의 효과를 고찰하기 쉬운 조건을 선택하고자 1차 전압을 120 V로 선정하여 실험하였다.
기-액 혼합기가 없는 기본 반응기의 경우 전압이 120 V인 경우 20분에 RNO가 8.7 mg/L로 나타나 82.6%의 제거율을 나타내었다. 기-액 혼합기를 장착한 경우는 반응 20분에 1.95 mg/L를 나타내어 96.1%의 제거율을 나타내었다. Fig. 2에서 160 V인 경우 반응 20분에서 최종 RNO 농도는 2.3 mg/L로 나타나 같은 120 V에서 13.5%의 RNO 제거율 증가를 나타내었고, 기본 플라즈마 반응기의 160 V보다 높은 RNO 제거 성능을 나타내어 기-액 혼합기의 적용이 RNO 분해에 효과가 있는 것으로 사료되었다.
반면 과산화수소와 오존 농도는 기-액 혼합이 증가할 경우 수중에 더 많이 용존할 것으로 예측되었으나 결과는 반대로 나타났다. 과산화수소의 경우 기본 플라즈마 반응기의 경우 평형 농도에서 2.00~2.17 mg/L이었으나, 기-액 혼합기를 장착한 경우 1.29~1.34 mg/L를 나타내어 36.9%의 과산화수소가 감소하는 것으로 나타났다. 오존의 경우도 과산화수소의 경우와 같이 기-액 혼합기의 적용에 따라 생성되는 오존 농도가 감소하는 것으로 나타났다. 오존은 기본 플라즈마 반응기에서는 평형농도가 1.10~1.16 mg/L이었으나 기-액 혼합기가 장착된 경우는 0.71~0.88 mg/L로 나타나 약 29%의 농도가 감소되었다.
기본 플라즈마 반응기나 기-액 혼합기를 장착한 경우 모두 유전체 내부에서 산화제가 발생되어 반응기로 유출되고 전압과 산소 공급량이 같기 때문에 플라즈마 반응에 의해 생성되는 OH 라디칼과 과산화수소와 오존 농도는 같다고 할 수 있다.
Fig. 3(b)와 (C)에서 나타난 수중에서의 과산화수소와 오존 농도 감소는 용존된 과산화수소와 오존이 기-액 혼합으로 인해 식 (1)과 같이 OH 라디칼 생성에 이용되었기 때문에(Kim and Park, 2009), 용존 과산화수소와 오존 농도가 감소한 것으로 사료되었다.
따라서 과산화수소와 오존은 수중에 용존되어 있는 농도가 감소하지만 이는 OH 라디칼 생성에 사용되어 이것이 Fig. 3(a)에서 보듯이 RNO 농도가 감소되는데 역할을 하는 것으로 사료되었다.
Sugiarto et al. (2003)은 수중 펄스 방전 플라즈마 반응기에서 다양한 분해 메커니즘 중에서 ・OH과 UV 조사가 염료 탈색의 주요 제거 메커니즘이라고 하였다. 그러나 본 연구진들이 실험한 연구에서 220 V에서 자외선 강도를 직접 측정한 결과 산화력이 가장 높은 UV-C가 거의 조사되지 않고 UV-B도 태양광보다 낮은 것으로 나타나 Ac전압을 이용한 유전체 장벽 방전에서는 자외선의 효과는 크지않은 것으로 사료되었다(Kim and Park, 2011a). 또한 생성 되는 과산화수소와 오존의 농도가 상대적으로 낮고 Fig. 3에서 보듯이 기-액 혼합기를 이용하는 경우 OH 라디칼 생성에 기여하기 때문에 과산화수소와 오존은 주요 화학적 활성종이 아닌 것으로 사료되었다. shock wave 등의 효과는 측정하지 못하였으나 주요 메커니즘은 OH 라디칼이며, Fig. 3에서 고찰한 바와 같이 기-액 혼합기를 채택할 경우 OH 라디칼에 의한 산화제 생성이 더 커지는 것으로 사료되었다.
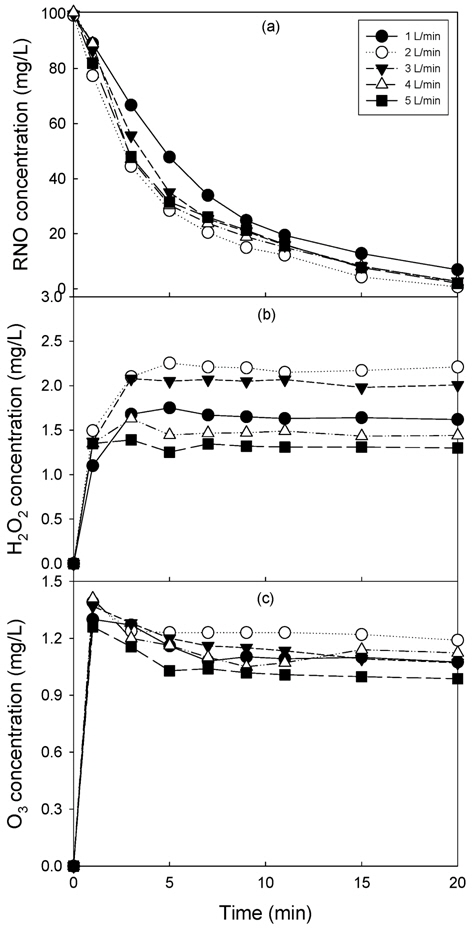
Fig. 4에 1차 전압이 120 V인 조건에서 산소 공급량을 15 kV, 20 kHz 네온트랜스를 이용하고 1차 전압을 160 V로 유지한 조건에서 유전체의 절연을 위해 공급하는 산소의 공급량 변화에 따른 RNO 분해(a), 과산화수소(b) 및 오존(c) 생성을 나타내었다. RNO의 경우 산소 공급량이 1L/min에서 가장 낮은 RNO 제거율을 보였으며, 2 L/min으로 증가하면서 RNO 농도가 가장 낮게 나타났으며 산소 공급량이 3 L/min으로 증가하면서 RNO 농도가 약간 증가하는 것으로 나타났다.
Fig. 4(b)의 과산화수소의 경우는 2 L/min에서 최대의 생성 경향을 나타내었으며, 산소 공급량이 증가하면서 과산화수소 생성량이 감소하는 경향을 나타내었다. Fig. 4(c)의 오존의 경우도 RNO 분해와 과산화수소의 경우와 마찬가지로 2 L/min에서 최대의 오존 생성 농도를 나타내었다. 이는 Fig. 1(a)와 같은 기본 반응기에서 공기를 가스로 공급하였을때 최적 공기량이 4 L/min인 경우보다는 낮은 산소 유량에서 최적인 것으로 나타났으며(Kim and Park, 2012), 산소를 공급한 기본 반응기의 경우도 본 연구의 기-액 혼합 플라즈마 방전 시스템과 같은 2 L/min으로 나타났다. 기본 플라즈마 반응기에서는 90 V, 2 L/min에서 평형 과산화수소 농도는 약 2.2 mg/L, 평형 오존 농도는 약 2.0 mg/L로 나타났는데, 과산화수소 농도는 두 반응기 시스템 모두 유사한 것으로 나타났으나 오존은 기본 반응기가 약 0.9 mg/L 높은 것으로 나타났다. 그러나 기본 반응기는 초기RNO 농도 50 mg/L에서 15분의 49.5 mg/L의 RNO가 제거되고 기-액 혼합 플라즈마 반응기의 경우 초기 100 mg/L에서 15분 동안 87.2 mg/L의 RNO가 제거되기 때문에 발생하는 산화제의 산화력에 대한 비교는 과산화수소나 오존보다는 OH 라디칼 생성의 간접지표인 RNO 제거 경향을 고찰하는 것이 더 중요하다고 사료되었다. 과산화수소나 오존은 UV와의 반응 등에 의해 OH 라디칼로 산화되며 식 (1)과 같이 과산화수소와 오존 반응에 의해 OH 라디칼이 생성되는 등 다른 산화제 생성에 관여하고 남은 산화제이기 때문에 전반적인 산화제 생성 경향을 나타내기 어려운 것으로 사료되었다.
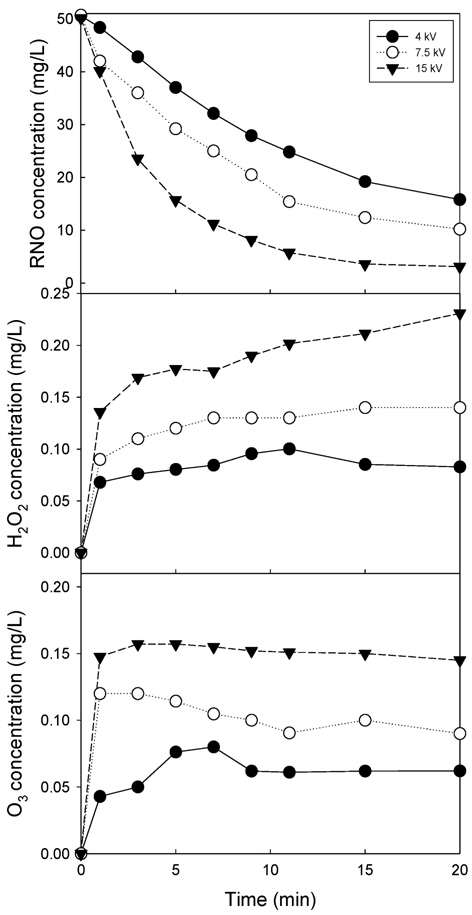
1차 전압에서 전압을 공급하여 출력 전압으로 승압시켜 전극으로 출력하는 2차 전압을 4, 7.5 및 15 kV인 네온트랜스를 교체하여 고전압이 RNO 분해, 과산화수소 및 오존 생성에 미치는 영향을 각각 Fig. 5(a), (b) 및 (c)에 나타내었다.
RNO 분해의 경우 2차 전압이 4 kV에서 거의 직선적으로 분해되어 20분의 반응시간동안 68.7%가 제거되었고, 2차 전압이 증가할수록 곡선의 형태를 나타내어 빠르게 분해되는 것으로 나타났다. 과산화수와 오존의 경우 2차 전압이 증가할수록 과산화수소와 오존 농도가 증가하는 것으로 나타났다. 2차 전압이 증가할수록 전기장 강도를 증가시켜 산화제 생성량이 증가하기 때문에 오염물질의 재거율도 증가할 것으로 사료되었다.
네온트랜스가 여러 개 필요한 2차 전압을 변경시키는 2차 전압 변경대신 Fig. 2와 같이 네온트랜스는 일정한 조건에서 1차 전압을 변경시키면 2차 전압이 변경되기 때문에 이와 같은 실험방법을 사용하는 것이 더 편리하다고 판단되었다.
본 연구 시스템과 유사한 수중 유전체방전 플라즈마 반응기와 15 kV, 20 kHz인 네온트랜스를 이용한 방전실험에서 2차 전압이 낮은 조건에서 코로나 플라즈마가 발생하고, 10 kV 이상의 전압에서 스트리머 방전이 발생하며 12.5 kV 이상에서는 스트리머 안정 상태로 되어 오실로스코프상에서 스트리머 펄스의 크기는 일정하고 밀도만 증가하여 안정된 방전이 발생한다고 보고한 Yoon (2008)의 결과와 본 실험 장치에 관찰된 플라즈마 현상이 유사한 것으로 사료되었다.
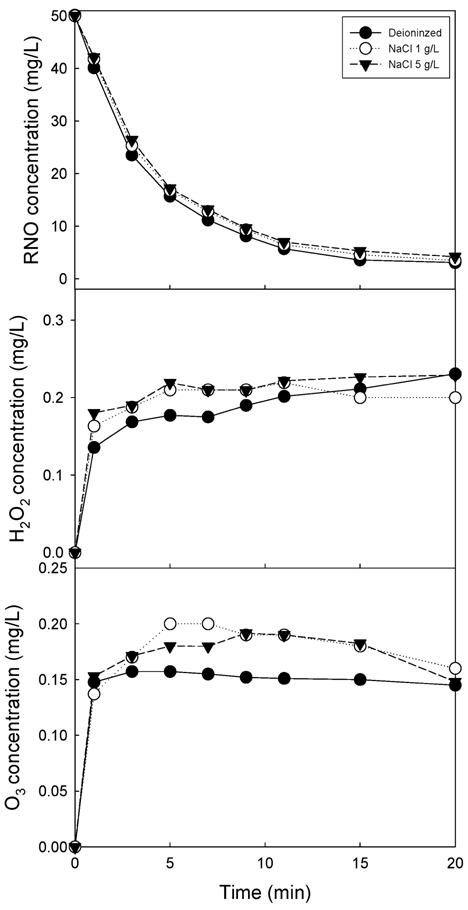
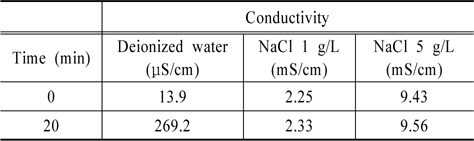
초순수와 초순수(전기전도도 19.3 μS/cm)에 NaCl 1 g/L (전기전도도, 2.25 mS/cm), NaCl 5 g/L (전기전도도, 9.43 mS/cm)을 첨가하여 전기전도도를 변화시켜 전기전도도가 산화제 생성에 미치는 영향을 고찰하여 Fig. 6에 나타내었다.
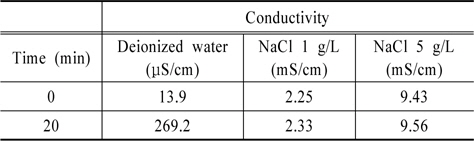
Fig. 6(a)에서 보듯이 전기가 거의 통하지 않는 초순수에서의 RNO 분해와 전기전도도가 증가된 NaCl 첨가수에서의 RNO 분해율을 비교해보았을 때 초순수의 RNO 분해가 조금 높지만 차이는 크지 않은 것으로 나타났다. Fig. 6(b)에 전기전도도에 따른 과산화수소 생성량을 나타내었다. 그림에서 보듯이 초순수의 경우 반응 10분까지 과산화수소 생성량이 적으나 10분 이후부터는 NaCl 첨가 수와 비슷한 농도를 나타내었다. Fig. 6(c)의 오존 생성량의 경우 초순수 의 오존 생성량이 전기전도도가 높은 NaCl 첨가수보다 낮은 것으로 나타났다. Table 1에 초기 전기전도도와 반응 20분 후의 전기전도도 값을 나타내었다. 전기전도도는 초기 전기전도도 값에 관계없이 방전이 진행되면서 전기전도도 값이 증가하는 것으로 나타났고 시간에 따른 전기전도도의 증가는 직선적으로 증가하는 것으로 나타났다. 방전에 따른 전기전도도 증가는 방전의 의해 발생하는 각종 화학적 활성종의 생성 때문인 것으로 사료되었다.
[Table 1.] Variation of conductivity with plasma reaction at different initial conductivity
Variation of conductivity with plasma reaction at different initial conductivity
Wang et al. (2006)은 고전압 펄스 코로나 방전 시스템을 이용하여 acid orange 7 제거를 위해 전기전도도가 10 ~ 400 μS/cm인 조건에서 실험을 수행한 결과 용액의 전도도가 acid orange 7 제거에는 큰 영향을 미치지 않았다고 보고하였다. 반면 Zhang, Zhang et al. (2007)은 2극 펄스 장벽 방전(bipolar pulsed barrier discharge)을 이용한 아조 염료인 amaranth (AR 27)의 제거 실험에서 전기전도도가 200 ~ 1500 μS/cm인 조건에서 실험을 수행한 결과 초기 용액 전기전도도는 반응속도 상수에 영향을 미친다고 보고하였다. 다른 연구자와 본 연구결과를 비교할 때 Wang et al. (2006)의 연구 결과와 유사하게 나타났다. 전기전도도 증가에 따라 반응속도 상수가 감소한다고 보고한 Zhang, Zhou et al. (2007)은 수중에 존재하는 다량의 이온이 수중에서 부분적인 고전압 전기장 형성을 방해하고 스트리머의 형성을 방해하여 화학적 활성종의 생성을 방해한다고 보고하였다. Fig. 6의 결과를 종합하면 전기전도도가 낮은 초순수의 과산화수소와 오존의 생성량이 NaCl 첨가수보다 0.02 ~ 0.05 mg/L 낮은 것으로 나타났으나 RNO 제거율은 유사하게 나타나 화학적 활성종의 생성이 전기전도도에 의해 영향을 받지 않는 것으로 사료되었다.
본 연구와 Zhang, Zhou et al. (2007)의 연구 결과가 다른 것은 반응기 시스템의 차이 때문인 것으로 사료되었다. Zhang, Zhou et al. (2007)의 반응기 시스템도 공기를 공급하지만 유전체의 절연 목적이 아니라 오존이나 과산화수소의 생성을 촉진시키는 목적으로 사용된다. 반면 본 연구에서는 유전체의 절연을 위해 유전체인 석영관 내부로 공기를 지속적으로 공급하고 화학적 활성종들이 공기 중에서 형성된 후 수중에 용존되기 때문에 수중의 이온 상태에의 영향을 적게 받지만 수중의 전기전도도가 영향을 미치지 않기 때문인 것으로 사료되었다.
산화 공정의 성능은 용액의 pH에 영향을 많이 받는 것은 잘 알려진 사실이다(Sugiarto et al., 2003). 광-펜톤 공정이나 전기분해 공정의 경우 산성 영역의 pH가 염기성 영역의 pH보다 ・OH이 많이 발생되는 것으로 알려져 있다(Kim and Park, 2007; Park, 2007).
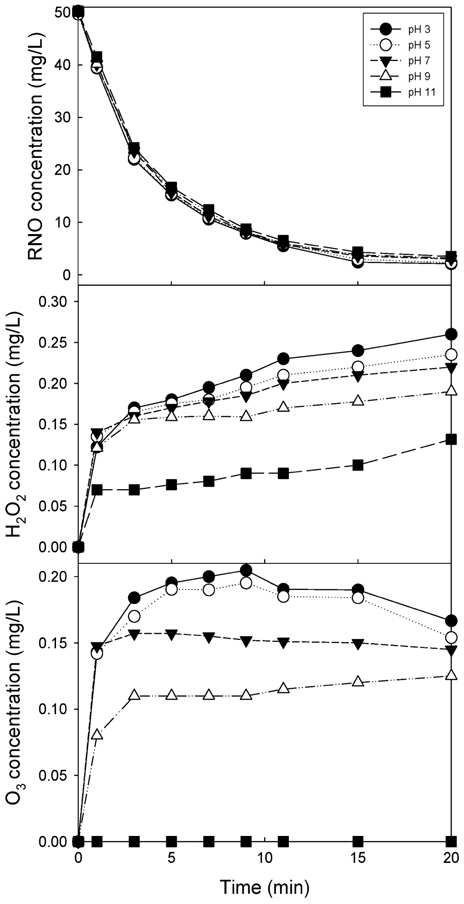
Fig. 7에 RNO 용액의 pH를 3 ~ 11로 변화시켰을 때 RNO 분해(a), 과산화수소(b) 및 오존(c) 생성 농도 변화를 나타내었다. RNO 분해는 pH가 낮을수록 분해가 잘되는 것으로 나타났으나 차이는 오차 범위에 들 정도로 적게 나타났다. 과산화수소 생성은 pH가 낮을수록 생성량이 높아지는 것으로 나타났고 pH 11의 과산화수소 생성량이 다른 pH에서보다 적은 것으로 나타났다. 오존의 경우 pH가 낮을수록 생성량이 증가하는 경향을 나타내었다. pH 3과 pH 5의 오존 생성량 차이는 크지 않았으며 pH가 증가할수록 오존 생성량이 적은 것으로 나타났다. pH 11의 경우 오존이 전혀 검출되지 않는 것으로 나타났다.
산성 영역의 pH에서는 오존은 안정적이지만, 염기성 영역에 pH에서는 빨리 분해되어 OH을 생성시켜 pH 3보다 pH 10에서의 페놀 제거가 높았다고 보고한 Chen et al. (2004)의 보고로 볼 때 pH 11에서 수중의 오존이 검출되지 않은 것은 식 (2)와 같이 오존이 빨리 분해되어 ・OH을 형성하기 때문인 것으로 사료되었다(Shen et al., 2008).
그러나 생성 오존 농도가 중성 pH를 기준으로 볼 때 0.15 mg/L이하로 낮기 때문에 생성되는 OH의 농도가 낮아 RNO 분해에 기여하는 정도가 매우 적어 RNO 분해가 차이를 보이지 않는 것으로 사료되었다. pH 3에서 생성되는 과산화수소가 농도가 높아 과산화수소에 의해 발생하는 ・OH을 고려할 때 오존 농도가 낮아도 RNO 분해가 차이나지 않는다고 사료되었다.
Li et al. (2007)은 기-액 펄스 방전 플라즈마 반응기를 이용한 페놀 분해에서 염기성 영역의 pH의 처리율이 산성영역보다 페놀 처리율이 높으며, 이는 Chen et al. (2004)과 같은 기작을 보고하고 있다. 반면 Sugiarto et al. (2003)과 Wang et al. (2006)은 산성 영역의 pH에서 염료 제거율이 높은데, 7보다 높은 pH에서는 carbonate가 OH의 스캐빈저 역할을 하기 때문에 산성 영역의 pH에서 염료 처리율이 높다고 보고하였다. 따라서 본 플라즈마 반응기와 같은 시스템에서는 OH 라디칼 자체는 pH에 따라 생성되는 농도차이가 크지 않지만 오존 발생량이 높은 플라즈마 시스템과 분해 대상물질의 종류에 따라 pH의 영향이 다르게 나타날 수 있다고 사료되었다.
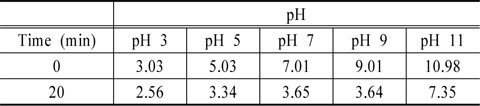
Table 2에 초기 pH와 방전의 진행에 따른 pH 변화를 나타내었다. 실험한 모든 pH에서 방전이 진행될수록 pH가 감소하는 것으로 나타났다. 9이하의 pH에서는 20분의 방전동안 pH가 3부근으로 감소하였으며 pH 11에서만 중성으로 유지되었다. 방전에 따른 pH 감소는 유전체의 절연을 위해 유전체 내부로 공급하는 공기 중의 질소가 질산을 만들기 때문인 것으로 사료되었다(Ryu et al., 2004).
[Table 2.] Variation of solution pH with plasma reaction at different initial pH
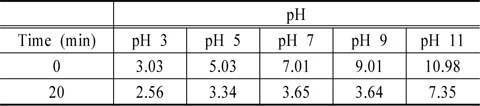
Variation of solution pH with plasma reaction at different initial pH
본 연구는 유전체로 산소를 이용하고 기-액 혼합기가 설치된 플라즈마 방전시스템에서 주요 산화제인 OH와 과산화수소 및 오존의 생성에 미치는 운전인자의 영향에 대하여 고찰하여 다음의 결과를 얻었다 1) ・OH 생성의 간접 지표인 RNO는 1차 전압의 증가에 따라 감소율이 증가하며, 최적 전압은 160 V 인 것으로 사료되었다. RNO 분해는 시간의 증가에 따라 지수적으로 감속하는 것으로 나타났다. 80 V이하의 1차 전압에서는 과산화수소와 오존 생성량이 서서히 증가하는 것으로 나타났고 100 V 이상의 전압에서는 방전 초기에 과산화수소와 오존이 빠르게 생성된 후 일정한 농도를 유지하는 것으로 나타났다.2) 산소 공급량이 증가함에 따라 RNO 분해율이 빠르게 증가하였으며, 최적 산소 공급량은 4 L/min으로 나타났다. 수중에서 발생하는 과산화수소는 산소 공급량 증가에 따라 발생량이 증가하는 것으로 나타났고, 오존의 경우 최적 산소 공급량은 4 L/min으로 나타났다.3) 2차 전압인 고전압은 증가할수록 RNO 분해율이 증가하고 과산화수소와 오존 생성량이 증가하는 것으로 나타났다. 초순수의 과산화수소와 오존의 생성량이 전기전도도가 높은 NaCl 첨가수보다 0.02 ~ 0.05 mg/L 낮은 것으로 나타났으나 RNO 제거율은 유사하게 나타나 화학적 활성종의 생성에 대한 전기전도도의 영향은 거의 없는 것으로 사료되었다.4) pH가 RNO 분해에 미치는 영향은 적은 것으로 나타났다. 반면 pH가 낮을수록 과산화수소와 오존 생성량이 많은 것으로 나타났고, pH 11에서 오존은 검출되지 않았다. 방전이 진행됨에 따라 질산의 형성 때문에 pH가 감소하는 것으로 나타났다.