Our aim was to determine the effects of a citrus by-product (CBP) and CBP fermented by
대부분의 동물들은 체내에서 비타민 C를 합성할 수 있지만 인간, 설치류, 어류는 비타민 C 합성을 위한 효소가 결핍되어 반드시 먹이로부터 섭취해야 한다(Wilson, 1973). 양어사료 내 비타민 C 첨가는 어류의 성장, 콜라겐 합성, 면역활성, 질병저항성 및 스트레스 내성을 향상시키는 것으로 보고되었다(Eo and Lee, 2008; Zhou et al., 2012). 비타민 C는 가격이 비쌀 뿐만 아니라 빛, 수분, 온도와 같은 환경조건에 매우 불안정하여 사료 압출과정 동안 상당량이 파괴된다(El Naggar and Lovell, 1991). 따라서 가격이 저렴하고 안정적인 형태의 비타민 C 원료가 사용되어야 한다.
부산물이란 제품 생산과정에서 발생되는 원료로써, 목적제품에 비해 중요성이 낮아 대부분 땅에 매립되거나 버려져 심각한 환경문제를 유발시킨다. 버려지는 부산물을 양식산업에 이용한다면 경제적이며 효과적인 사료원료로 사용 가능할 것이다. 국내의 경우 감귤주스 가공과정에서 상당량의 감귤착즙박(citrus by-product, CBP)이 발생되고 있다. CBP는 비타민, 미네랄, 당, 지방, 카로테노이드, 플라보노이드 등 여러 생리활성물질을 함유하고 있어(Bampidis and Robinson, 2006), 가공식품의 원료와 한약재로 사용되고 있다(Braddock, 1983). CBP의 사료화 연구는 젖소를 대상으로 시작되었고, 그 후 다양한 영양학적 성분분석을 통해 양계 및 양돈 사료에서도 사료원료로서의 이용가능성이 밝혀졌다(Mead and Guilbert, 1926; Cullen et al., 1986). 하지만 양식사료의 원료이용성에 관해서는 넙치를 대상으로만 연구되었고, 그 외 양식어종에서는 전무한 실정이다(Song et al., 2002; Seo et al., 2010; Lee et al., 2013).
최근 건강에 대한 관심이 높아지면서 발효 및 발효식품에 관한 소비가 늘어나고 있다. 발효(fermentation)란 미생물이 가지고 있는 효소를 이용해 유용물질을 만드는 과정을 의미한다. 본 실험에 사용된
국내의 참돔생산량은 2011년도에 3,498톤으로 국내뿐만 아니라 전세계적으로 매우 중요한 해산양식어종이다. 참돔은 주로 해상가두리에서 양식을 하기 때문에 출하를 위해서는 겨울철 저수온기를 견뎌내야 한다. 참돔의 특성상 겨울철 저수온기에는(10℃ 내외) 사료섭이율과 활동량이 감소한다(Choi et al., 2002). 또한, 급격한 수온변화(냉수대)는 참돔에 스트레스로 작용하여 성장률을 감소시키고 집단폐사와 같은 문제점을 일으킨다. 이러한 스트레스 환경에서 사료 내 고농도의 비타민 C 공급은 어류의 스트레스 내성을 증가시킨다고 많은 연구결과를 통해 보고되었다(Navarre and Halver, 1989; Hardie et al., 1991). 그래서, 본 연구에서는 가공공정에서 발생하는 CBP의 사료원료로써의 이용가능성을 제시하기 위해, 사료 내 일반 CBP와
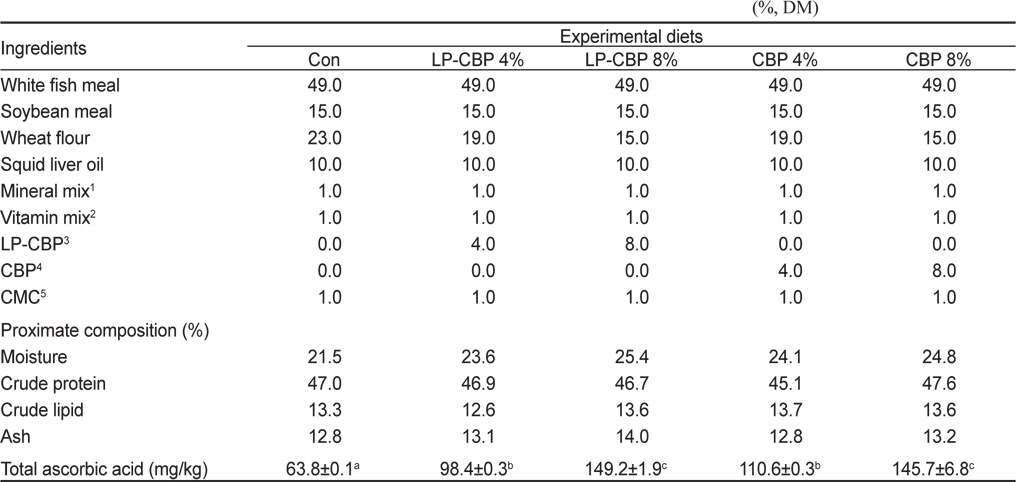
실험사료는 47%의 조단백질과 13%의 조지방이 되도록 제조하였다(Table 1). CBP와 발효 CBP (LP-CBP)의 효능을 알아보기 위하여 비타민 C 요구량을 충족시킨 대조사료에 소맥분 함량을 감소시켜 CBP와 LP-CBP를 각각 4%와 8%씩 첨가한 5종류의 실험사료를 제조하였다(Con, LP-CBP4%, LP-CBP8%, CBP4%, CBP8%). 실험에 사용된 CBP는 제주시 조천읍에 위치한 가공공장에서(주식회사 일해) 주스 착즙 후 배출되는 부산물을 제공받아 실험원료로 사용하였다. 실험사료 제조를 위해서 분말형태의 각 사료원을 사료조성표에 따라 정확히 무게를 측정한 후, 사료원 총량의 30%에 해당하는 증류수를 첨가하여 혼합하였다. 혼합물은 소형초파기(SMC-12, Korea)로 직경 2-3 mm 크기로 압출 성형하였다. 제작된 실험사료는 동결건조기에서 건조시킨 후, 시브(sieve)를 이용하여 적당한 크기로 제작하였으며 사료공급 전까지 -20℃ 냉동고에 보관한 후 실험에 사용하였다.
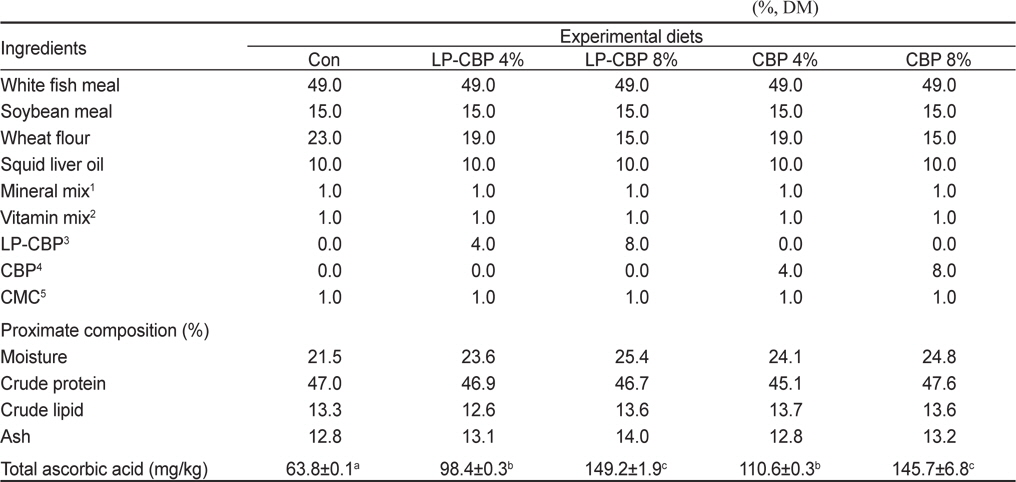
Formulation and proximate composition of experimental diets for red seabream Pagrus major (%, DM)
참돔 치어는 경상남도 고성군에 위치한 종묘장에서 구입하여 제주대학교 소속 해양과환경연구소로 운송하였다. 2주간의 예비사육 후, 실험어(초기평균무게: 55.0±0.5 g)는 총 15개의 150 L 원형 플라스틱 수조에 25마리씩 무작위 배치하였다. 사료공급은 실험구당 3반복구를 두었으며, 사육수는 모래 여과해수를 사용하여 3 L/min의 유수량이 공급되도록 조절하였고 모든 실험수조에 용존산소 유지를 위하여 에어스톤을 설치하였다. 사육실험은 저수온에서 실시하였고(13℃-16℃), 실험사료는 9주 동안 1일 2회로 만복공급을 하였다.
사육실험 종료 후 실험어의 최종무게와 사료공급량을 측정하여 사료전환효율, 단백질이용효율 및 생존율을 계산하였다. 최종무게 측정 후, 각 수조당 8마리의 실험어를 무작위로 선별하여 2-phenoxyethanol 용액(100 ppm)으로 마취시킨 후 8마리 중 4마리는 헤파린이 처리된 주사기로 꼬리 미병부에서 채혈하였다. 채혈된 전혈은 대식세포활성 분석에 이용하였다. 남은 4마리의 혈액은 헤파린이 처리되지 않은 주사기로 채혈하여 상온에서 60분간 방치시킨 후 원심분리기로(5000×g) 혈청을 분리하여 면역분석을 실시하였다.
실험사료의 일반성분 분석은 AOAC (1995) 방법에 따라 수분은 상압가열건조법(125℃, 3 h), 조회분은 직접회화법(550℃, 12 h), 조단백질은 자동조단백질 분석기(Kejltec system 2300, Sweden)로 분석하였고, 지방은 Folch et al. (1957)의 방법에 따라 Soxhelt 추출장치(Soxhlet heater system C-SH6, Korea)로 분석하였다.
실험사료와 실험어 간의 비타민 C 분석은 Dabrowski and Hinterleitner (1989)의 방법으로 분석하였다. 시료와 precipitation solution 을 혼합하여 2분간 균질화한 후 원심분리기(15,000 rpm, 4℃, 30분)를 이용하여 상층액을 추출하였다. 추출된 상층액을(250 ul) 유리튜브에 옮긴 후 0.2% dichlorophenolindophenol (Sigam, USA)과 증류수를 25 μL씩 첨가하여 상온에서 20분간 반응시켰다. 반응시킨 혼합물에 2% thiourea (Sigma, USA)와 5% metaphosphoric acid (Sigm, USA)을 250 μL 넣고 2% 2,4-dinitrophenyhydrazine (Sigma, USA)을 250 μL 넣은 후, 60℃ 항온수조에서 3시간 동안 반응시켰다. 반응시킨 혼합물을 냉각시켜 18 M H2SO4를 넣고(500 μL) 524 nm에서 흡광도를 측정하였다. 콜라겐 함량은 Wilson and Poe (1973)의 방법으로 분석하였다. 전어체 시료를 끓는 물에 12분간 담근 후 척추주변의 근육을 제거하여 남아있는 뼈를 0.1 M NaOH용액에 24시간 반응시켜 건조하였다. 그 후 0.5 M EDTA 용액(pH 7.5)에 반응시켜 남아있는 무게를 측정하여 collagen 함량을 계산하였다.
혈액 내 대식세포 활성은 Kumari and Sahoo (2005)의 분석 방법을 토대로 Nitro-blue tetrazolium (NBT)분석방법을 통해 호중구의 oxidative radical 생성량을 측정하였다. 전혈과 NBT solution (0.2%)을 50 μL씩 유리튜브에 옮긴 후, formazon 생성을 감소시키기 위해 1 mL의 dimethyl formamide를 첨가하여 2000×g 에서 5분동안 원심분리하였다. 이때 형성된 상층액을 수집하여 spectrophotometer (Genesys 10UA, USA)로 540 nm에서 NBT의 감소 범위를 측정하였다. Blank는 dimethyl formamide를 사용하였다.
혈청 내 lysozyme 활성은 Sankaran and Gurnani (1972)의 방법으로 분석하였다. Sodium citrate buffer (0.02 M, pH 5.52)에 동결건조된
혈청 내 myeloperoxidase (MPO)활성은 Kumari and Sahoo (2005)의 방법으로 분석하였다. HBSS (Hanks balanced salt solution)용액을 96-well plates에 80 μL씩 분주한 후 혈청 20 μL를 넣고 20 mM TMB (3,3’5,5’-tetramethylbenzidine hydrochloride) 용액과 5 mM H2O2용액을 넣었다. 2분간 반응시킨 후 4 M H2SO4용액을 35 μL 첨가하여 microplate reader (Thermo, USA)로 450 nm에서 흡광도를 측정하였다.
혈청 내 anti-protease 활성은 Ellis (1990)의 방법으로 분석하였다. 혈청 20 μL를 trypsin 용액 20 μL와 혼합한 후 22℃에서 10분간 반응하였다. 그 후 200 μL phosphate buffer (0.1 M, pH 7.0)와 250 μL azocasein (2%)을 혼합하여 22℃에서 30분간 반응시킨 후 원심분리 하였다(6,000×g). 원심분리 후 상층액 100 μL를 100 μL NaOH (1 N)와 함께 96 well-plate에 분주하고 430 nm에서 흡광도를 측정하였다.
혈청 내 superoxide dismutase (SOD)활성은 SOD assay kit (Sigma, USA)로 분석하였다.
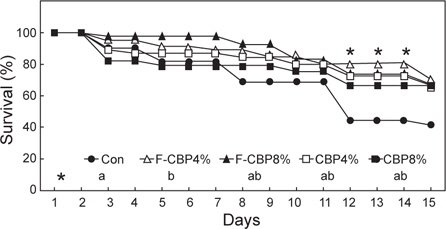
9주간의 성장실험 종료 후, 총 15개의 100 L 사각 플라스틱 수조에 각 수조당 15마리씩 무작위로 배치하였다. 스트레스 자극은 순환여과시스템에서 실험구당 3반복구를 두었고, 수온조절장치(SunCool DA-1500B, Korea)를 이용하여 수온을 12℃에서 6℃까지 하루에 0.4℃씩 저하시켜 15일간 폐사율을 측정하였다. 폐사는 실험어가 수면에 힘없이 떠올라 6시간 동안 뒤집혀있는 개체까지 포함하였다.
실험구의 배치는 완전확률계획법(Completely randomized design)으로 실시하였고, 성장 및 분석결과는 SPSS (Version 12.0) 프로그램을 이용하여 One-way ANOVA로 통계 분석하였다. 데이터 값의 유의차는 Tukey’s HSD로 비교하였다. 데이터는 평균값±표준편차(mean±SD)로 나타내었다.
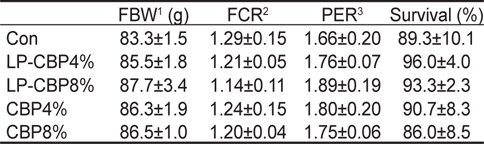
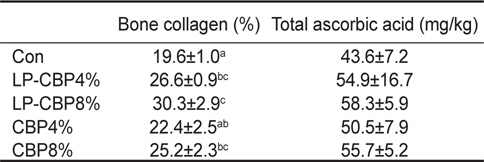
사료 내 감귤착즙박 첨가에 따른 참돔의 성장결과는 Table 2에 나타내었다. 9주간의 사료공급 후 최종무게, 사료전환효율, 단백질이용효율, 생존율은 모든 그룹에서 유의적인 차이가 없었다. 콜라겐 함량은 CBP 또는 LP-CBP가 첨가된 모든 그룹이 대조구에 비해 유의적으로 높은 함량을 보였다(
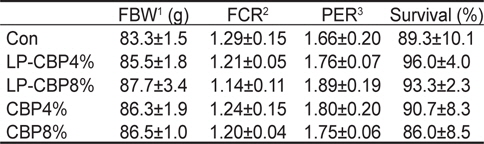
Growth performance of red seabream Pagrus major (initial body weight, 55.0±0.5 g) fed five experimental diets containing two different levels of either citrus by-product (CBP) or citrus by-product fermented with Lactobacillus plantarum (LP-CBP) for 9 weeks
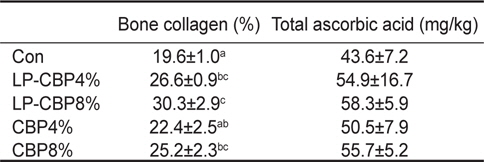
Bone collagen and total ascorbic acid concentration in the liver of red seabream Pagrus major fed experimental diets containing two different levels of either citrus by-product (CBP) or citrus by-product fermented with Lactobacillus plantarum (LP-CBP) for 9 weeks
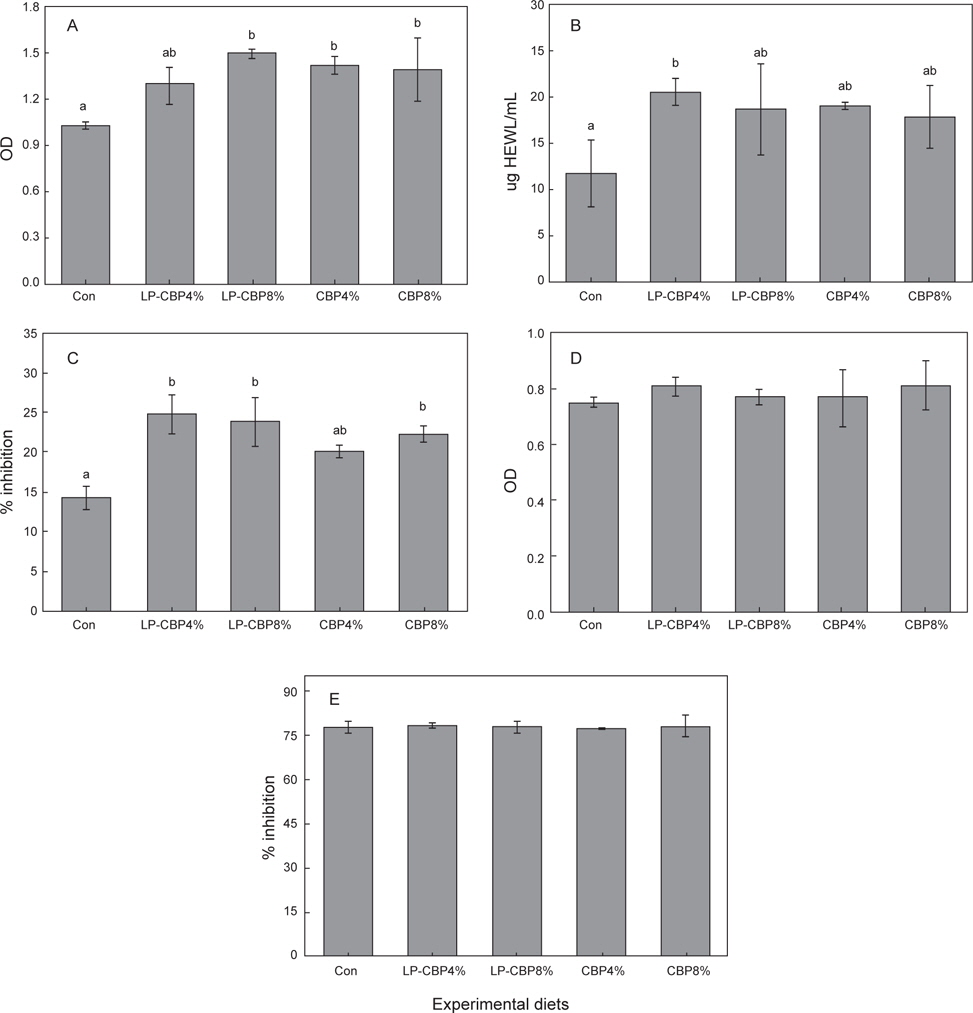
실험사료 공급에 따른 참돔의 비특이적 면역반응 결과는 Fig. 1에 나타내었다. MPO와 SOD활성에서는 CBP 또는 LP-CBP가 첨가된 그룹이 대조구에 비해 유의적으로 높은 활성을 보였다(
수온 저하에 따른 실험구별 폐사율 측정 결과는 Fig. 2에 나타내었다. 스트레스 자극 2일째(11.6℃) 대조구가 10%, LP-CBP를 첨가한 그룹은 5%, CBP를 첨가한 그룹은 12-18%의 폐사율을 보였다. 스트레스 자극 12-14일째(7.6-6.8℃)에는 대조구에서 급격한(55.7%) 폐사율이 관찰되어 4% LP-CBP (19.8%)를 첨가한 그룹에 비해 유의적으로 높은 폐사율을 보였다.
본 연구에서 참돔의 성장은 CBP 및 발효 CBP 첨가에 영향을 받지 않았다. 넙치를 대상으로 한 Lee et al. (2013)의 연구에서도
비타민 C는 동물의 콜라겐 합성에 중요한 필수 영양소이다(Chatterjee, 1978). 비타민 C가 부족하면 콜라겐 합성과정이 차단되어 출혈 및 뼈의 연화와 같은 괴혈병 증상이 나타난다(Lovell, 1973; Wilson, 1973). Yellow croaker와 자주복을 대상으로 사료 내 비타민 C 함량을 농도별로 공급한 후 뼈의 콜라겐 함량을 분석하였을 때, 20-30%의 함량을 보여 참돔과 유사한 함량을 보였다(Ai et al., 2006; Eo and Lee, 2008). 따라서 본 연구에 사용된 감귤착즙박은 참돔 체내에서 콜라겐 합성에 효율적으로 이용되는 것으로 사료된다. 사료를 통해 공급된 비타민 C는 장을 통해 간에 저장된다(Xiao et al., 2010). 간은 비타민 C 대사에 매우 중요한 역할을 하며, 어류의 건강상태 지표로 이용된다(Dabrowski et al., 1994; Gouillou-Coustans et al., 1998). Cobia를 대상으로 비타민 C (35% ascorbic acid equivalent, China)를 농도별(0, 10, 30, 90, 270, 810 mg/kg)로 첨가한 사료로 10주간 사육한 결과, 간 내 비타민 C 함량도 유의하게 증가하는 결과를 보였다(Xiao et al., 2010). 반면, 본 실험에서는 감귤착즙박 첨가에 따른 간 내 비타민 C 함량에서는 유의한 차이는 없었지만 증가하는 경향을 보였다. 따라서 감귤착즙박에 함유된 비타민 C가 참돔의 장에서 효율적으로 흡수되어 간에 저장되었을 것으로 판단된다.
MPO는 호중구, 호염기구, 호산구에 존재하는 과산화효소이며, 과산화수소를 hypochlorus acid (HClO)로 전환시켜 병원성 미생물을 사멸시킨다(Palić et al., 2005). 그러므로 생체 내 MPO활성 증가는 병원체에 대한 항균효과를 증폭시켜 면역반응을 증가시키는 역할을 한다. Lysozyme은 다양한 균에 항균작용을 나타내는 효소로서, 세균 세포벽의 구성성분인 peptidoglycan의 β-1,4 결합을 가수분해하여 항균작용을 나타낸다(Grinde, 1989). Cobia를 대상으로 사료 내 비타민 C를 농도별(0, 12.5, 25.0, 50, 100, 200, 400 mg/kg)로 8주간 공급하여 lysozyme 활성을 측정하였을 때, 적정농도(100 mg/kg)까지는 무첨가 그룹인 대조구에 비해 유의적으로 높은 활성을 보여 본 실험과 동일한 경향을 보였다(Zhou et al., 2012). 또한 넙치를 대상으로 유자(
SOD는 과산화이온을 산소와 과산화수소로 바꿔주는 효소로서, 항산화 활성뿐만 아니라 여러 질병에 대한 감염률을 감소시켜 면역력을 알아보는 지표로서 이용되고 있다(Fattman et al., 2003). 비타민 C는 대표적인 항산화 물질로 hydroxyl radical, superoxide, singlet oxygen과 직접 반응하면서 항산화제로 작용한다(Vatassery et al., 1989; Padh, 1990). 감귤착즙박은 비타민 C 뿐만 아니라 항산화 활성에 영향을 미치는 비타민 E와 플라보노이드 같은 물질을 다량 함유하고 있다(Cha and Cho, 2001). 자주복과 cobia을 대상으로 사료 내 비타민 C 함량을 농도별로 공급한 후 SOD 활성을 측정하였을 때, 무첨가 그룹인 대조구에 비해 첨가그룹에서 유의적으로 높은 활성을 보였다(Eo and Lee, 2008; Zhou et al., 2012). 본 실험에서도 감귤착즙박이 첨가된 그룹은 대조구에 비해 많은 양의 비타민 C와 항산화 물질을 함유하고 있어 SOD활성이 증진된 것으로 사료된다.
냉수대 현상은 국내에 자주 발생하고 있으며 이에 따른 피해도 속출하고 있다. 본 연구에서도 참돔 사료 내 감귤착즙박 첨가는 사료 내 비타민 C 함량을 증가시켜 저수온 스트레스에 대한 내성을 증가시킨 것으로 판단된다. 하지만, 감귤착즙박 효과에 대한 정확한 원인은 밝혀지지 않았으며 이와 관련된 연구도 미비한 실정이다.
생균제(probiotic)는 살아있는 미생물로서 적절한 양으로 투여되었을 때 성장률, 비특이적 면역반응 및 질병저항성에 긍정적인 영향을 미친다고 보고되었다(Nayak, 2010; Cha et al., 2012). 본 실험에서 CBP 또는 LP-CBP가 첨가된 그룹은 대조구에 비해 유의적으로 높은 MPO, lysozyme 및 SOD 활성과 저수온 스트레스 저항력이 증명되었지만, CBP와 LP-CBP 그룹을 비교하였을 때에는 발효균주에 의한 효능은 없었다. 발효균주가 증식하기 위해서는 수온, 수질, 삼투압, pH 등 외부환경에 영향을 받는데, 어류에 있어서는 수온이 가장 중요한 요인으로 작용한다(Panigrahi et al., 2007; Das et al., 2008).
이상의 결과로 볼 때, 비타민 C가 다량 함유된 감귤착즙박 및 발효 감귤착즙박을 첨가한 사료의 공급은 저수온에서 사육된 참돔의 비특이적 면역반응 및 저수온 스트레스 저항력을 높이는 효과를 보여 효율적인 첨가제로써의 사용이 가능할 것으로 판단된다. 또한 감귤착즙박이 첨가될수록 실험사료 내 비타민 C 함량이 증가하여 양어사료 내 비타민 C 대체원료로써의 이용가능성이 밝혀졌다. 하지만, 감귤착즙박의 성분분석 결과(비타민 C 함량)는 가공공정, 품종 및 수확시기에 따라 달라질 수 있으므로 정기적인 분석이 진행되어야 한다. 또한 과다한 수분함량(80%)으로 저장 및 취급이 어렵고 겨울철에 일시적으로 생산되고 있어서 년중 균형적인 이용이 어렵다. 따라서 감귤착즙박의 건조 및 저장과 같은 합리적인 연구방안이 개발된다면 양어사료 내 합성비타민 C 대체원료 및 면역 증강제로 사용 가능할 것으로 판단된다.