Pythium blight occurred by
병원균은 토양 속에 있거나 토양과 닫는 부분에 생존하 면서 잎, 뿌리 및 지하경에서 병을 일으킨다(Dick, 1990; Matthews, 1931). 초기증상은 노란색과 괴사된 patch를 형성하고 점차 넓은 지역으로 확대된다. 감염된 식물은 뿌리, 근부 및 번식체에 짙은 갈색으로 퇴화되고 잔디는 죽는다(Couch, 1995). 발병 증상은 마름증상과 뿌리썩음으로 인하여 patch로 나타나는데, 온도가 높고 습도가 높은 봄철부터 가을철까지 잔디가 생육하는 기간에는 흔하게 나타난다(Feng and Dernoeden, 1999; Hodges and Coleman, 1985). Patch의 크기는 보통 2-5 cm이나 가끔은 15 cm까지 크게 나타나지만. 잎마름병 증상은 30-35℃ 조건에서는 갑자기 나타나고, 특히 밤 온도가 20도 이상이고, 비 오는 날이나 습도가 90%이상으로 14시간 유지가 되면 잘 나타난다. 이른 아침에는 잔디 잎은 수침상이 나타나며, patch는 어두운 색으로 보이고, 그 모양이나 크기는 불규칙적이고 일정하지 않다(Abad et al., 1994; Couch, 1995; Dick, 1990; Matthews, 1931).
Pythium에 의한 병은 생육기에 잔디를 주로 짧게 예초를 할 경우에 잘 나타나는데, 이때 나타나는 증상은 작게 나타나서 온도와 습도가 알맞으면 빠르게 크게 확대되며, 봄철과 가을철은 습한 조건에서 증상은 작고, 점차 갈색의 patchs로 확대가 되며, 보통 직경의 크기는 4-7 cm가 된다(Couch, 1995; Saladini et al., 1983).
병원균은 2010년과 2011년에 경상북도 대구대학교 시험 포장과 상주시 골프장 러프 잔디에서 6월 상순과 7월 하순에 전형적인 피시움잎마름 증상을 보이는 chewing fescue “Jamestowm II” 품종과 Kentucky bluegrass의 3종 혼합 품종에서 이병식물의 잎과 줄기가 포함된 것을 채집하였다. 병원균 분리를 위하여 이병 잎과 줄기의 감염 조직을 잘라 1% sodium hypochlorite에서 1분간 표면 살균 후, 70% ethanol에서 다시 30초간 살균하였다. 표면 살균한 이병 조직은 멸균수로 세척하여, 멸균된 거름종이(Whatman No. 1)에 올려놓아 수분을 제거하고, water agar(WA)에 항생제 용액(살균증류수 100 ml에 pimaricin 100 mg과 ampicillin 1000 mg 함유)을 1%을 첨가하여 만든 배지에 치상 하여 25℃ 항온기에서 24일간 배양하였다. 치상한 이병 조직에서 자라나온 균사는 선단 부분의 균사를 떼어서 PDA(potato dextrose agar) 배지로 옮겨 25℃ 항온기에서 배양한 20개 균주 중 생리적 반응이 동일한 균주인 40-1을 대표 균주로 보관하면서 본 실험을 수행하였다. 공시 균주의 보관은 25℃ 항온기에서 계대 배양을 하면서 시험하거나, 24시간 배양한 균총의 선단부에서 직경 5 mm의 균사 조각을 떼어내어 cap tube(직경: 1 cm; 높이: 10 cm)에 5조각씩 넣고, 보관용액 5 ml(살균수: 5 ml; streptomycin (3,000 μg): 0.5 ml)를 넣어 25℃ 항온기에 보관하며 실험에 사용하였다.
형태적인 관찰을 위하여 공시 균주를 CPA(carrot potato agar)배지에 접종하여 25℃ 항온기에 7일간 배양한 후 균사를 조사한 결과 lobulate sporangia(Fig. 1C)를 관찰할 수 있었고, 영양생장 균사로부터 가는 실 같은 포자낭(filamentous sporangia)을 관찰할 수 있었다(Fig. 1D). 그리고 온도 별(20℃, 25℃, 28℃, 30℃)로 배양한 결과, 균사생장에 차이를 보였다. 균사는 격막(septum) 없었고, 균총은 형태적으로 차이를 보이지 않았지만, 솜털처럼 왕성하게 생장하는 것을 볼 수 있었다(Fig. 1E).
모든
분자생물학적 동정을 위하여 25℃ 항온기에서 2일간 배양한 후 DNA를 추출하여 rDNA의 ITS1-ITS4 프라이머을 쌍으로 증폭하였다(White et al., 1990). DNA의 증폭을 위하여 universal primer인 ITS5(5'-GGAAGTAAAAGTCG TAACAAGG-3)와 ITS4(5'-TCCTCCGCTTATTGA TAT GCG-3')를 사용하였다(White et al., 1990). PCR산물은 2% agarose gel을 만들어 50V에서 120분 동안 전기영동 하여 밴드를 확인하고, PCR 산물은 PCR purification kit를 사용하여 순화하여, Eugentech(대전)에 sequencing을 의뢰하였다. 리보소옴 ITS 지역의 DNA 염기서열을 분석하기 위하여 ITS1(5'-TTCGTAGGTGAACCTGCGG-3')와 ITS4(5'-AACATGCGTGAGATTGTAAGT-3') primers 사용하여 분석하였다(White et al., 1990).
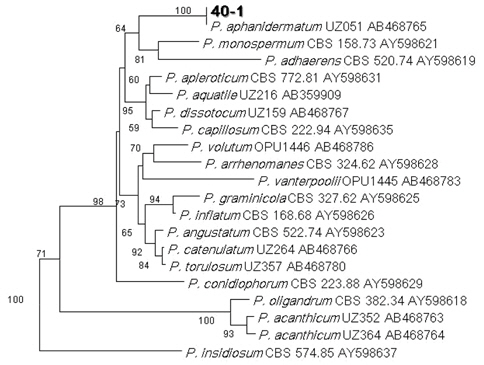
공시 균주인 40-1을 ITS 염기서열을 분석한 결과, 증폭한 rDNA-ITS지역의 크기는 800-960bp이었다. Phylogenetic tree는 MEGA version 4를 사용하여
공시 균주인 40-1을 rDNA의 ITS 지역을 분석을 한 결과
분리 동정한 병원균을 PDA배지에 접종 후 25℃ 항온기에서 24시간 자란 균사조각을 떼어내어 광학현미경하에서 격막 등을 관찰하였고, 생리적인 특성은 생육 온도와 배지종류에 대한 반응을 조사하였다.
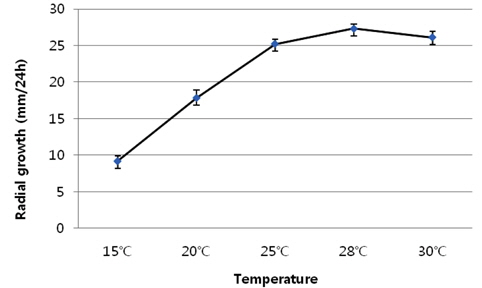
공시 균주 인 40-1은 생육 온도에 대한 반응을 조사하기 위하여 PDA배지에서 24간 배양한 균총의 가장자리 부분을 직경 5 mm 크기의 균사 조각을 떼어내어 PDA배지에 접종 후 15℃, 20℃, 25℃, 28℃ 및 30℃에서 24시간 배양하여 균총 직경을 조사하였다.
공시 균주 인 40-1은 생육은 온도에 따라서 큰 차이를 보였다(Fig. 3). 28℃에서 가장 왕성한 생장을 보였다. 본 시험에서는 온도의 차이를 28℃와 30℃로 세분화한 것은 구체적으로 생육 적온을 조사하기 위하여 생육이 왕성한 25℃와 30℃ 사이인 28℃에서 균사 생장량을 조사한 결과, 24시간 동안 균사가 28 mm 생장하는 것을 볼 수 있었다.
Kageyama et al. (1998)에 의하면 7종의
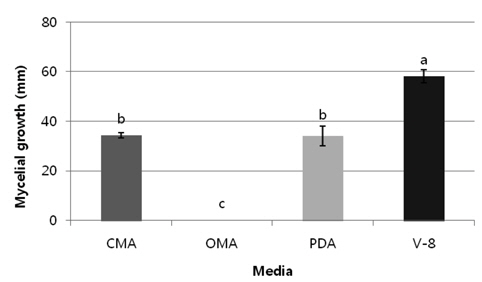
배지의 종류에 대한 균사생장 반응을 조사하기 위하여 생육온도와 같은 방법으로 공시 균주를 CMA (corn meal agar), OMA (oat meal agar), PDA 및 V-8 (V-8 juice agar) 배지에 접종한 후 25℃에서 24시간 배양 후 균사 생장량을 측정하였다(Fig. 4). V-8배지에서 가장 왕성한 성장을 보였다. 균사의colony 형태관찰이나, 형태적인 동정을 위한 난포자나 포자낭생산을 위해서는 CMA배지, CPA 및 V-8배지에서 배양하는 것이 좋다고 한다(Abad et al., 1994).
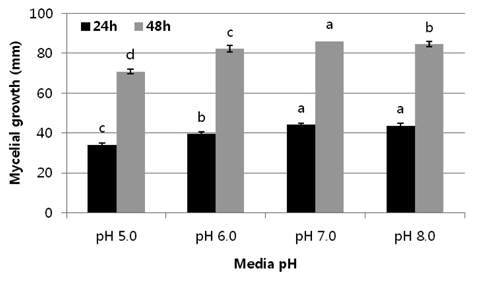
배지의 pH에 따른 균사의 생육을 조사하기 위해서는 PDA배지에 KOH와 HCl을 이용하여 pH를 5, 6, 7 및 8로 조절하고 공시 균을 접종한 후 25℃에서 24시간과 48시간 배양 후 균사 생장량을 측정하였다(Fig. 5). pH7에서 균사 생육이 자장 좋은 것으로 조사되었다.
병원성을 검정하기 위하여 포장에서 병이 발생한 chewing fescue 품종인 “Jamestowm II”, Kentucky bluegrass 혼용 품종(Midnight 33%, Moonlight 33%, prosperity 33%) 및 creeping bentgrass 품종인 “Penn Cross” 에서 병원성 시험을 실시하였다. 잔디는 관행 관리에 의해 1년 이상 자란 시험포장 잔디를 홀 컷터로 잘라내어 화분에 옮긴 후 온실에서 20일간 관리한 잔디에 병원균을 접종하였다(Chang, 2011; Chang and Lee, 2013). PDA 배지에서 자란 활력이 양호한 균총의 가장자리 균사를 지름 5 mm의 크기로 자른 균총 1조각을 PDB (Potato Dextrose Broth) 배지에 접종 한 뒤 25±1℃ 암 상태에서 5일간 배양하였다. 배양된 균사는 수확하여 멸균된 거름종이에 올려놓아 수분을 제거하고 동일한 량의 균사를 다시 멸균수에 넣고 30초간 균일하게 균사를 마쇄하였다. 접종원은 균사 생체 중 0.1 g· ml-1가 함유된 1 ml를 포트당 접종을 하고, 미리 준비한 플라스틱 상자 바닥에 1 cm 높이로 물을 채운 접종한 포트를 넣고 뚜껑을 닫고 밀봉하여 3일간 25±1℃ 암 상태의 생장상(growth chamber)에서 배양한 후 온실로 옮겨 발병 정도를 조사하였다.
인공 접종한 병원균은 3종류의 잔디에서 병원성을 나타내었다(Fig. 6). 감염 초기에 잎의 선단부가 갈변하고 이병 부위가 수침상으로 변하면서 점차 갈색이 퇴화하고 시간이 경과됨에 따라 patch 형태를 유지하면서 잎과 줄기는 고사하여 최종 회갈색이 되었다(Fig. 6A, B ,C). 인공접종하여 발병된 병반부에서 다시 병원균을 재 분리하여 PDA배지에서 배양한 후 병원균의 특성과 광학현미경에서 균사의 격막과 균사모양을 관찰한 결과 동일한 균으로 확인되었다(Fig. 1D).
따라서 본 병은 한지형 잔디인 chewing fescue 종에서