The continuous experiments were carried out using fixed-bed column packed with strong-acid cation exchange resin for the removal of lithium ions from aqueous solution. The parameters such as bed height, flow rate and inlet concentration wer e investigated. Breakthrough time (t0.05), saturation time (t0.95), and total amount of lithium ion removed (mtotal) were obtained from the breakthrough curves. The results showed that t0.05 and t0.95 decreased with decreasing bed height, and decreased with increasing inlet concentration and flow rate. mtotal increased with increasing inlet concentration and bed height, but decreased with increasing flow rate. Thomas model and Yoon-Nelson model equations were applied to the experimental data, the results showed that the breakthrough data gave a good fit to Thomas model equation.
최근 산업의 발달에 따라서 리튬 및 리튬 화합물은 21 세기의 신소재로 주목을 받고 있으며, 리튬전지, 냉매흡착제, 컴퓨터, 휴대폰, 의약품, 합금원소, 리튬전지, 유기합성 촉매 등의 많은 분야에서 다양한 용도로 쓰이고 있다. 리튬은 주로 광석, 염수나 해수에 포함되어 있으며, 육상의 리튬 매장량은 약 400만 톤으로 추정되나, 지역적으로 편중이 심하다[1]. 반면에 해수 중에 존재하는 리튬의 양은 2,300억 톤으로 육상 매장량의 약 6만 배[2]에 달하는 막대한 것으로 알려져, 최근에는 해수 중의 리튬 회수에 대한 연구들이 많이 이루어지고 있다.
해수 중의 금속이온을 회수하기 위한 방법으로 공침법[3], 용매추출법[4], 이온교환법[5-7] 등이 널리 이용되고 있다. 이중에서 공침법은 금속이온의 선택성에 제한을 받으며, 용매 추출법은 많은 양의 유기 용매를 필요로 하고 유기용매가 손실되게 되면 환경오염, 불쾌한 악취 및 화재의 원인이 된다[8]. 반면에 제올라이트나 이온교환수지를 이용한 이온교환법은 슬러지가 발생되지 않고, 공정운영비용이 저렴하며, 화학적으로 안정할 뿐만 아니라 재생하여 재사용 할 수 있다는 장점이 있다.
이온교환수지를 이용하여 수중의 금속 이온을 제거하는 연구는 많은 연구자들에 의해 수행되고 있다. Wang et al.[5]은 염산 (HCl) 과 수산화나트륨 (NaOH) 으로 처리한 강산성 양이온교환수지 (001 × 7)를 사용하여 카드뮴을 제거하는 연구를 수행하였고, Rafati et al.[7]은 Na+형 이온교환수지 (Lewatit FO36)를 사용하여 수중의 Cr6+를 제거하는 연구를 행하였으며, Alyuz and Veli[9]은 Na+형 양이온교환수지 (Dowex HCR S/S)를 이용하여 Zn2+과 Ni2+을 회수하는 연구를 수행한 바 있다. 이처럼 다양한 이온교환수지를 이용하여 수중의 중금속이온을 제거하는 연구들에서 이온교환수지가 중금속이온제거에 우수한 성능을 보인다고 하였다. 최근 Navarrete-Guijosa et al.[6]은 강산성 양이온교환수지 (Amberlite IR 120) 를 Na+형과 H+형으로 치환한 경우에 리튬이온의 제거특성을 비교하였으며, H+형보다는 Na+형으로 치환한 경우에 더 높은 이온교환능을 보인다고 하였다. 본 연구자들은 선행연구[10]에서 -SO3H의 기능기를 가진 겔(gel) 형 및 다공성(porous) 형인 두 종류의 강산성 양이온교환수지와 -COOH 의 기능기를 가진 다공성 형 약산성 이온교환수지를 사용하여 각각의 이온교환수지의 양이온 형태를 K+, Na+ 그리고 H+ 형으로 달리한 경우에 리튬이온의 교환능을 비교 검토한 결과, 양이온의 형태가 K+ 인 다공성 형 강산성 양이온교환수지가 가장 높은 리튬이온 교환능을 가지는 결과를 얻었다.
따라서 본 연구에서는 리튬이온교환능이 가장 높게 나타난 양이온 형태가 K+ 인 다공성 형 강산성 양이온교환수지를 이용하여 수중의 리튬이온 제거실험을 연속식으로 수행하였다. 유입 농도, 층 높이, 유입 유량 변화에 따른 파과특성을 비교하고 얻어진 파과 곡선을 토마스(Thomas) 모델식과 윤-넬슨(Yoon-Nelson) 모델식에 적용하여 비교하였다.
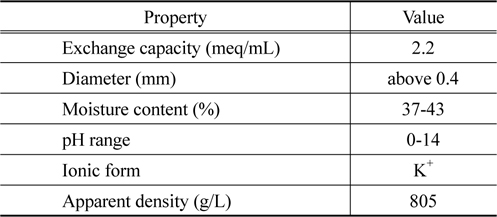
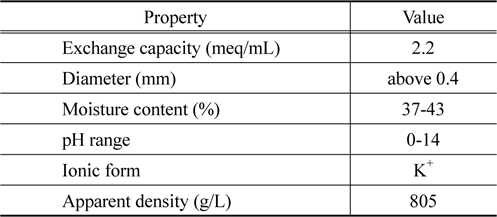
본 연구에서 이온교환수지는 국내 S사에서 생산한 다공성 형인 강산성 양이온교환수지를 K+ 형으로 치환하여 사용하였으며, 이온교환수지의 물성은 Table 1에 나타내었다. 이온교환수지의 양이온 형태를 K+ 형으로 치환하는 방법은 선행 연구[10]와 동일하게 실행하였다. 1 M 염화칼륨 (KCl, Junsei, EP) 용액 200 mL 에 이온교환수지 2 g 을 넣은 후 24 hr 동안 교반하고 이상의 과정을 3회 반복하여 이온교환수지를 K+ 형으로 치환하였다. 그리고 리튬이온용액은 염화리튬 (LiCl, Shinyo, EP)을 초순수 (Milli-Q Millipore 18.2 Mcm-1 conductivity) 에 녹여 1,000 mg/L 의 모액을 제조한 다음에 실험에 필요한 용액의 농도로 희석시켜 사용하였다.
[Table 1.] Properties of cation exchange resin used in this study
Properties of cation exchange resin used in this study
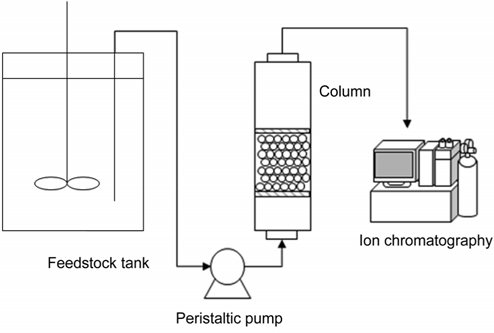
고정층 실험 장치의 구성은 Figure 1과 같이 하였으며, 직경 1.2 cm, 길이 20 cm의 유리 컬럼에 일정량의 이온교환수지를 채우고 상향류식으로 운전하였다. 페리스탈틱펌프 (Master- flex ® , USA)를 사용하여 일정 농도의 리튬이온용액을 일정 유량으로 조절하여 컬럼에 유입시켰으며, 컬럼 상단으로부터 유출되는 용액을 채취하여 이온크로마토그래피 (DX-120, USA)로 농도를 분석하였다.
이온교환수지를 충전한 고정층에서 처리되는 용액의 총 부피는 다음과 같다. 여기서 Veff는 고정층에서 처리되는 용액의 총 부피(mL), ttotal은 전체 운전시간 (min), Q는 유입 유량 (mL/min) 이다.
고정층에서 제거된 리튬이온의 총량은 다음과 같다. 여기서 mtotal은 고정층에서 제거된 리튬이온의 총량(mg), C0는 유입 농도(mg/L)이다.
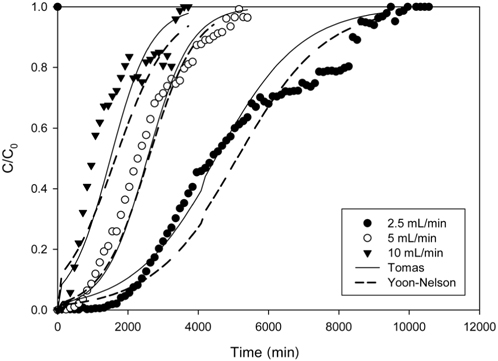
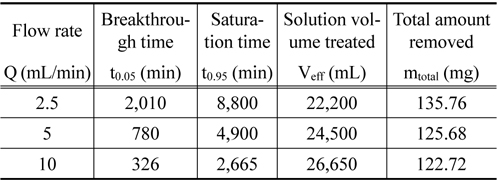
Figure 2는 층 높이를 8.8 cm, 유입 농도 10 mg/L로 일정하게 유지하고, 유입 유량을 2.5 mL/min, 5 mL/min 및 10 mL/ min로 달리한 경우에 얻어진 파과곡선을 나타낸 것이다. 파과곡선으로부터 파과시간 (C/C0=0.05)과 포화시간 (C/C0= 0.95)을 구하고, 식 (1)과 (2)로부터 처리된 용액의 부피 Veff와 제거된 리튬이온의 총량 mtotal을 구하여 Table 2에 나타내었다. Table 2에서 보듯이 2.5 mL/min일 때는 완만한 파과곡선이 얻어졌으나, 유입 유량이 5 mL/min 및 10 mL/min로 증가함에 따라 점차 가파른 파과곡선이 형성되었다. 또한 유입 유량이 2.5 mL/min, 5 mL/min, 10 mL/min으로 증가함에 따라 파과시간은 2,010 min, 780 min, 326 min으로 감소하였으며, 포화시간도 8,800 min, 4,900 min, 2,665 min으로 감소하였다. 이는 유입 유량이 증가할수록 물질전달영역이 증가하여 리튬이온이 이온교환수지에 빠르게 제거되어 포화되기 때문으로 생각된다. 그리고 유입 유량이 증가함에 따라 제거된 리튬이온의 총량은 135.76 mg, 125.68 mg, 122.72 mg로 감소하였는데, 이는 유입 유량이 증가함에 따라 리튬이온이 이온교환수지와 접촉할 수 있는 시간이 감소하기 때문으로 사료된다.
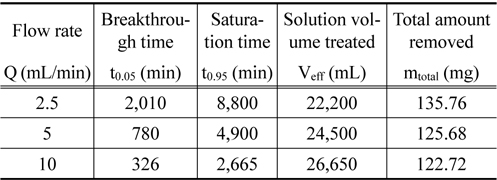
Characteristic parameters obtained from breakthrough curves for different flow rates (inlet lithium ion concentration : 10 mg/L, bed height : 8.8 cm)
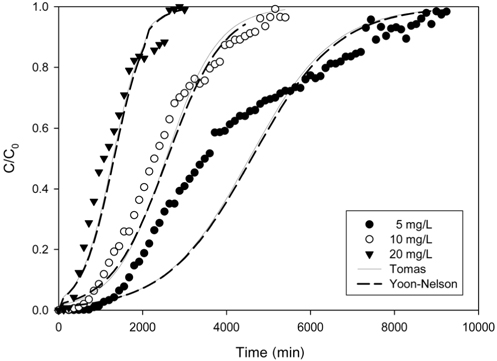
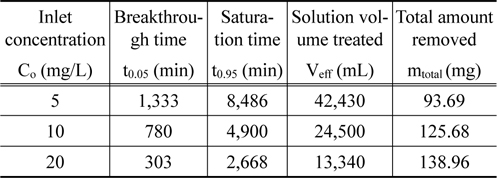
Figure 3은 리튬이온의 유입 유량을 5 mL/min 으로 일정하게 하고 리튬이온의 유입 농도를 변화시키면서 얻은 파과곡선들을 나타낸 것이며, 이로부터 얻어진 변수들을 Table 3에 나타내었다. 유입 농도가 5 mg/L, 10 mg/L 및 20 mg/L로 증가할수록 파과시간은 1,333 min, 780 min, 303 min으로 감소하였으며, 포화시간은 8,486 min, 4,900 min, 2,668 min으로 감소하였다. 이는 유입 농도가 증가함에 따라 흡착 구동력인 농도차가 커져 컬럼내 이온교환수지의 활성점들이 더 빨리 포화되기 때문으로 생각된다. 또한 유입 농도가 증가함에 따라 처리된 용액의 부피는 42,430 mL, 24,500 mL, 13,340 mL로 감소하였으나, 농도가 증가함에 따라 흡착 구동력인 농도차가 커지므로 리튬이온의 제거량은 93.69 mg, 125.68 mg, 138.96 mg으로 증가하였다.
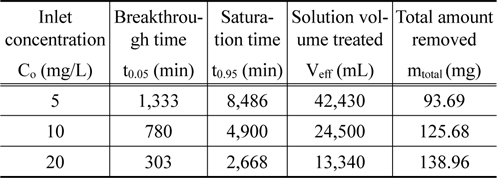
Characteristic parameters obtained from breakthrough curves for different inlet concentrations (flow rate : 5 mL/min, bed height : 8.8 cm)
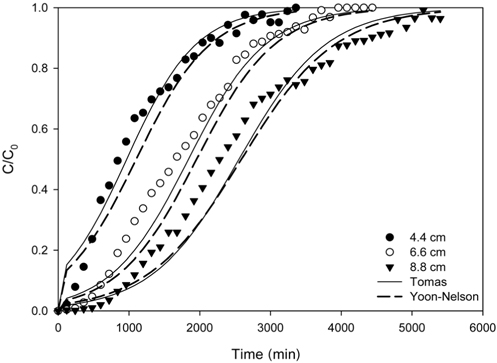
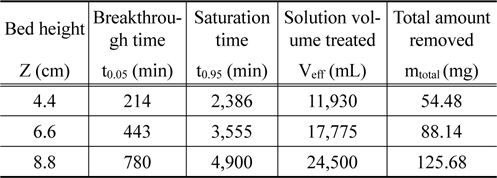
Figure 4는 리튬이온의 유입 농도를 10 mg/L, 유입 유량을 5 mL/min으로 일정하게 하고 층 높이를 4.4 cm, 6.6 cm 및 8.8 cm로 변화시키면서 운전하여 얻은 파과곡선들을 나타낸 것이며, 이로부터 얻어진 변수들을 Table 4에 나타내었다. 층 높이가 4.4 cm, 6.6 cm 및 8.8 cm으로 증가함에 따라 파과시간은 214 min, 443 min, 780 min으로 증가하였으며, 포화시간도 2,386 min, 3,555 min, 4,900 min으로 증가하였다. 또한 층 높이가 증가함에 따라 처리한 용액의 부피는 11,930 mL, 17,775 mL, 24,500 mL로 증가하였으며, 리튬이온의 제거량도 54.48 mg, 88.14 mg, 125.68 mg으로 증가하였다. 이와 같이 리튬이온의 제거량이 층 높이에 따라 증가하는 것은 층 높이에 비례하여 이온교환수지의 양이 증가하고 , 이에 따라 리튬이온을 처리할 수 있는 활성점들이 증가하기 때문으로 사료된다[11].
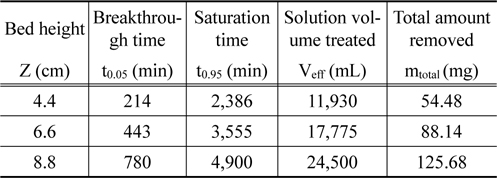
Characteristic parameters obtained from breakthrough curves for different bed heights (inlet lithium ion concentration : 10 mg/L, flow rate : 5 mL/min)
연속식 고정층 이온교환실험으로 얻어진 파과곡선 자료를 Thomas 모델식과 Yoon-Nelson 모델식에 적용하여 해석하였다 .
Thomas 모델식은 다음과 같다[12]. 여기서 M 은 이온교환수지 중량(g), Q는 유입 유량(L), t는 운전 시간 (min), C0는 유입 농도 (mg/L), C는 시간 t에서의 농도 (mg/L), kT는 Thomas 속도 상수 (mL/mg ・ min), qe는 제거량 (mg/g) 이다 .
여기서 kY는 속도 상수 (L/min)이며, τ는 리튬이온의 파과가 50% (C/C0=0.5) 되는데 걸리는 시간(min)이다.
검토된 모델식들을 평가하기 위하여 다음과 같은 평균 상대 표준 오차 (average relative standard error, ε) 를 사용하였다[13]. 여기서 N은 자료의 개수, (C/Co)cal 은 계산값, (C/Co)exp은 실험 값이다.
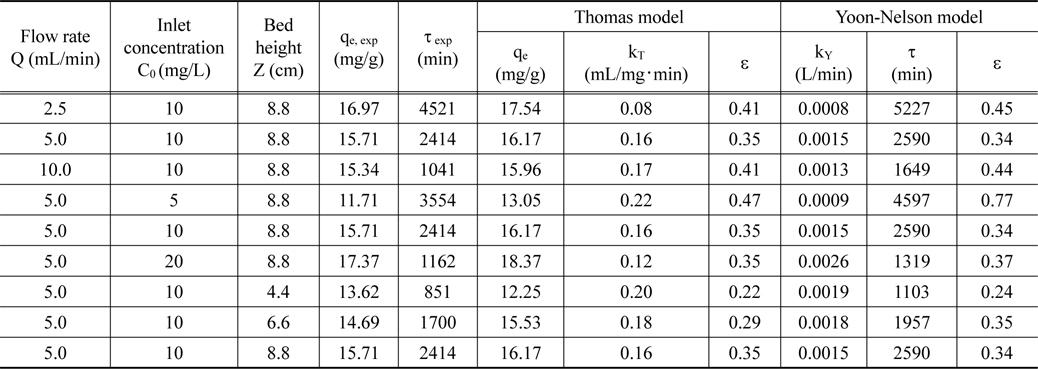
유입 유량, 리튬 농도 및 층 높이를 달리한 실험에서 얻은파과곡선 결과를 식 (3)~(5)에 적용하여 얻어진 파라미터들을 Table 5에 나타내었다 . Table 5에서 보는 바와 같이 Thomas 모델식의 경우를 보면 유입 농도와 층 높이가 증가함에 따라 제거량 qe는 증가하고 속도상수 kT는 감소하였으며, 유입 유량이 증가함에 따라서는 qe가 감소하고 kT는 증가하였다. 이러한 결과는 Juang et al.[14]의 강산성 양이온교환수지에 의한 니켈 이온을 연속식으로 제거한 연구에서도 유사한 경향을 보였다. 한편, Yoon-Nelson 모델식의 경우에는 유입 유량과 유입 농도가 증가함에 따라 속도상수 kY는 증가하고 τ는 감소하였다. 그러나, 층 높이가 증가함에 따라서는 kY는 감소 하고, τ는 증가하였다. Table 5에서 Thomas 모델식의 경우 ε 값은 0.22~0.47이고, Yoon-Nelson 모델식의 경우 ε 값은 0.24~ 0.77 로 Yoon-Nelson 모델식보다는 Thomas 모델식이 파과곡선을 더 잘 모사하였으며, 실험에서 구한 리튬이온 제거량 qe, exp와 Thomas 모델식으로 계산한 제거량 qe는 거의 유사한 결과를 보였다.
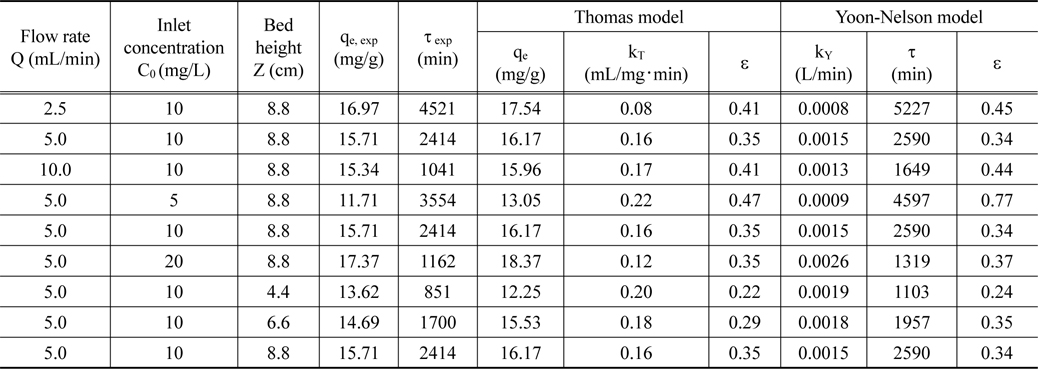
Parameters calculated from Thomas model and Yoon-Nelson mode l for different bed heights, flow rates and concentrations
강산성 양이온교환수지를 충전한 고정층 컬럼에서 리튬이온 제거실험을 연속식으로 수행하고 유입 농도, 유입 유량 및 층 높이에 따른 파과특성을 검토하였다. 유입 유량이 증가함에 따라 처리할 수 있는 용액의 부피는 증가하였으나, 파과시간과 제거된 리튬이온의 총량은 감소하였다. 또한 유입 농도가 증가함에 따라 파과시간과 처리할 수 있는 용액의 부피는 감소하였고, 제거된 리튬이온의 총량은 증가하였다. 층 높이가 증가함에 따라서는 파과시간, 처리할 수 있는 용액의 부피와 제거된 리튬이온의 총량도 증가하였다. 한편, 실험으로부터 구한 파과곡선은 Thomas 모델식에 잘 부합하였으며, Thomas 모델식으로부터 계산한 리튬이온 제거량은 실험에서 구한 제거량과 거의 유사한 결과를 보였다. 또한 Thomas 속도상수 kT는 유입 유량이 증가함에 따라 증가하였으나, 유입 농도와 층 높이가 증가함에 따라서는 감소하였다.