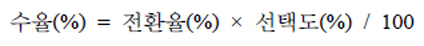Hydrogenolysis of glycerol to propylene glycol was performed over binary and ternary metal oxide catalysts. The conversion of glycerol and selectivity to propylene glycol were increased on Cu/Zn and Cu/Cr mixed oxides compared to pure CuO and ZnO oxides. The addition of alumina into Cu/Zn mixed oxide very highly increased the conversion of glycerol and selectivity to propylene glycol. The conversion of glycerol was increased with increasing the reaction temperature but the selectivity to propylene glycol was shown to have maximum value at 200℃ and then decreased at 250℃. The conversion of glycerol and selectivity to propylene glycol were decreased with increasing the glycerol concentration.
21세기에 접어들면서 원유 값의 폭등과 지구온난화로 인해 환경 친화적이며 공해 발생이 적은 바이오디젤의 공급이 급증하고 있다. 바이오디젤은 유지 트리글리세라이드와 메탄올의 에스테르 교환 반응 후 글리세린을 분리하여 제조된다. 현재 바이오디젤은 디젤자동차의 경유에 혼합해서 쓰거나, 100% 순수 연료로 사용되고 있는데, 미국 및 유럽연합 등에서는 이미 품질기준이 마련되어 있다. 따라서 바이오디젤 생산 시 부수적으로 생산되는 글리세롤의 경우 생산량 급증에 따른 새로운 용도 마련을 위한 많은 연구가 진행되고 있다[1].
또한, 글리세롤은 독성이 없고 식용이 가능하며 생분해성이기 때문에 환경 친화적인 원료라는 장점이 있다. 또한 가격이 아주 저렴하기 때문에 고분자물질이나 에테르 등 여러 화합물로의 변환 공정이 많이 연구되어 지고 있다. 글리세롤은 3개의 히드록시기를 가지고 있으므로 이들의 선택적인 전환기술의 개발이 대단히 중요하다. 또한 특정 히드록시기를 선택적으로 제거하여 프로필렌 글리콜과 1,3-프로페인다이올 등을 생산하는 기술의 개발도 매우 중요하게 다루어지고 있다. 특히 프로필렌 글리콜은 불포화폴리에스터수지, 부동액, 윤활제, 계면활성제, 보습제, 화장품, 음식첨가제, 유화안정제, 방부제, 공기의 살균, 품질보호 유지제, 합성보존료 및 착색료의 용해제, 의약품 등으로 용도가 광범위하여 그 활용성이 매우 큰 편이다[2,3].
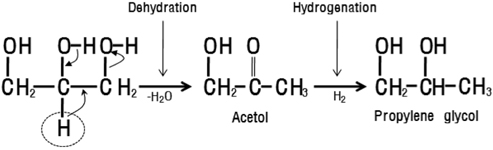
글리세롤로부터 프로필렌 글리콜의 선택적 수소화 분해 (hydrogenolysis)반응은 글리세롤 분자의 C-C 결합을 공격하지 않고 수소에 의해 C-O 결합을 절단해야 한다. 이와 같은 반응을 효과적으로 진행시키기 위해 많은 불균일 촉매들이 사용되었다. 예를 들면, CuO/ZnO[4], Raney Ni[5], sulfide Ru[6], Ru/C[7] 및 copper chromite[8] 등이 연구되었다. 이들 촉매 중에서 구리산화물을 포함한 촉매가 가장 높은 활성을 나타내는 것으로 알려져 있다.
또한 프로필렌 글리콜의 글리세롤의 전환반응은 Scheme 1에서와 같이 두 단계의 반응으로 진행되는 것으로 알려져 있는데[4,8], 글리세롤의 탈수 반응에 의한 아세톨의 생성반응과 수소화 반응에 의한 프로필렌 글리콜의 생성반응으로 나누어 진다. 따라서 위의 탈수 및 수소화 반응에서 동시에 활성을 보여주는 촉매의 개발보다는 각각 활성을 나타내는 촉매를 조합하여 사용하는 연구가 많이 행해져 왔다[4,8,9].
본 연구에서는 각각의 반응에서 활성을 보여주는 이원계 및 삼원계 금속산화물 촉매를 공침전법 및 마이크로파 공정을 이용하여 제조하였다. 또한 제조한 촉매들을 XRD, SEM 및 XRF 등을 사용하여 물리적 특성을 조사하였다. 또한, 직접 제조한 고압 반응기에서 수소 존재 하에 글리세롤의 프로필렌글리콜의 전환반응에 대한 촉매 활성을 조사하였다.
2원계 혹은 3원계 금속산화물 촉매를 제조하기 위한 과정은 공침전법을 사용하였다. Cu(NO3)2•2.5H2O, Zn(NO3)2•6H2O 및 Al(NO3)3•9H2O (>98%, Sigma-Aldrich) 등 금속 질산염을 원하는 조성에 맞게 몰농도(M)를 계산하여 증류수에 완전히 용해시킨다. 이어 탄산나트륨 수용액과 2.0 N 수산화나트륨용액으로 pH가 9~10 정도가 되도록 조절한다. 그리고 2시간 동안 교반 후 상온이나 60 ℃에서 24시간 동안 숙성시킨다. 한편 마이크로파 공정에서는 증류수에 용해된 금속질산염 용액에 능금산을 첨가하여 15 분간 교반시킨 다음 600 W, 2.45 GHz의 마이크로파를 조사하여 제조한다. 숙성된 용액은 증류수를 이용하여 pH 값이 7 이하가 될 때까지 여과 및 세척하였으며, 여과된 생성물은 120 ℃에서 24시간 동안 건조 다음, 450 ℃에서 5시간 동안 공기 분위기에서 소성하여 최종적인 혼합 금속산화물 촉매를 얻을 수 있었다.
제조된 촉매들의 결정 구조를 확인하기 위해서 X선 회절기(X-ray diffraction, XRD, Philips X'pert diffractometer/Cu-Kα radiation)를 사용하여 결정성을 확인하였으며, 제조된 촉매들의 금속 성분의 조성을 알아보기 위해 X선 형광분석기(X-ray fluorescence spectrometer, XRF)를 이용하여 측정하였다. 촉매의 미세구조 관찰 및 모양, 크기분포 등은 주사 전자현미경(scanning electron microscope, HITACHI S-2400, Japan)을 사용하여 관찰하였다.
글리세롤의 수소화 분해반응은 반응기 내부를 유리로 하여 제작된 스테인레스 스틸 고압반응기(Hanwool Co., Korea)를 사용하였다. 또한, 150 mL의 용량을 가진 반응기는 교반기와 가열기 및 온도조절기가 장착되어 있다.
반응물과 촉매를 넣은 반응기는 질소가스로 주입하면서 압력 차이를 이용하여 내부에 남아있는 공기를 제거하는 작업을 4 ~ 5회 반복한다. 계속해서 수소가스를 주입하면서 위와 동일한 방법으로 내부 용기내의 질소가스를 제거하고 반응기의 압력을 200 ~ 250 psi로 가압한다. 반응이 진행되는 동안 교반속도를 700 rpm으로 유지시켜주었고, 온도조절기를 이용하여 온도를 200 ~ 250 ℃ 범위의 원하는 온도로 유지시켰다. 반응이 끝나고 나면 상온에서 자연 냉각시킨 다음 생성물을 채취하여 13,000 rpm에서 40분간 원심분리를 실시하여 혼합되어 있는 혼합 금속산화물 촉매를 침전시켜 생성물과 분리하였다.
생성물의 분석은 불꽃 이온화 검출기(flame ionization detector, FID)가 장착된 VARIAN 3800 Gas Chromatography (U.S. A)에 의해 이루어졌으며, 반응물과 생성물은 Agilent HP-FFAP capillary column (25 m × 0.32 mm × 0.5 um)을 사용하여 분리하였다. 검출된 액상 생성물은 대부분 프로필렌 글리콜 및 에틸렌 글리콜이었고, 1.3-프로페인 다이올, 1-프로판올, 메탄올 및 에탄올과 같은 알코올이 미량 검출되었다.
글리세롤의 전환율과 각 생성물들의 선택도는 아래와 같이 계산되었다.
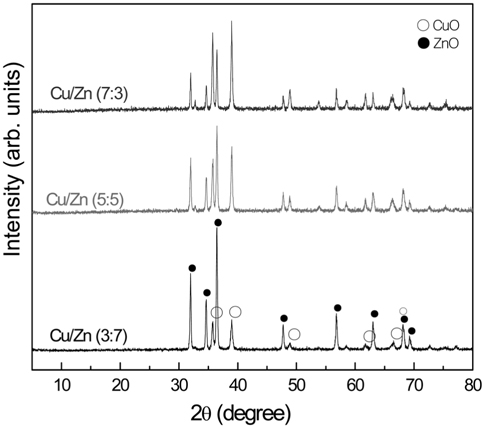
공침전법과 마이크로파 공정으로 제조한 혼합 금속산화물들의 결정성을 알아보기 위해 XRD 측정을 행하여 그 결과를 Figure 1에 나타내었다. Figure 1에 나타나듯이 금속 산화물의 혼합비에 관계없이 CuO 및 ZnO 결정성이 잘 나타나는 것을 볼 수 있다. CuO 산화물의 특성 결정구조가 2θ = 35.5° 및 38.5°에서의 피크는 tenorite CuO의 강한 회절선과 잘 일치하고 있다[10]. 또한, 2θ = 32.2°, 34.7° 및 36.5°에서의 특성피크는 ZnO의 결정구조를 잘 나타내고 있다.
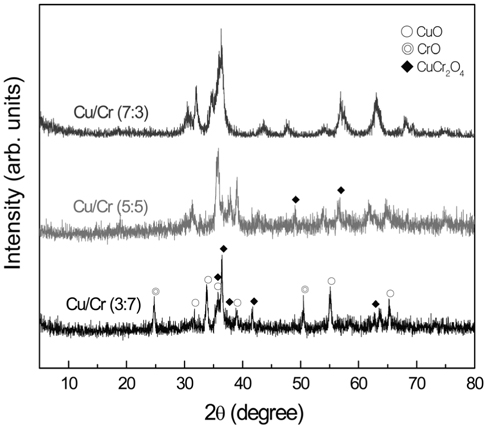
Figure 2에 CuO와 CrO 혼합산화물의 XRD 결과를 나타내었다. 그림에서 나타나듯이 CuO/CuO + CrO의 비율이 0.5에서 는 각각 CuO 및 CrO 산화물 특성피크와 복합산화물의 형태인 CuCr2O4의 결정구조를 보여주고 있다. 하지만 CuO의 비율이 증가할수록 혼합산화물의 결정성이 낮아지며 CuCr2O4 의 결정구조가 없어지는 것을 볼 수 있다. 이와 같은 결과는 혼합산화물의 금속성분에 따라 금속산화물의 결정성 및 결정의 형태가 달라지는 것을 보여주고 있다.
공침전법으로 제조한 혼합 금속산화물들의 형태를 SEM으로 측정하여 그 결과를 Figure 3에 나타내었다. Figure 3에서 나타나듯이 금속 성분과 관계없이 수 µm 크기의 침상모양을 가진 입자들이 나타내는 것을 볼 수 있으며, Cu/Cr 촉매에서는 입자의 크기가 균일한 것을 볼 수 있다.
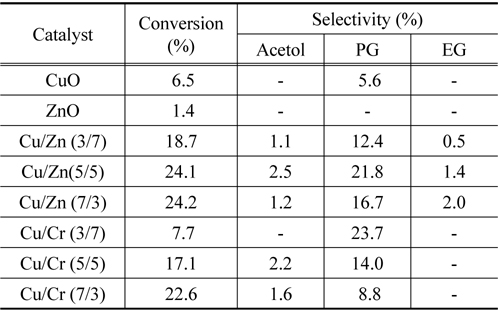
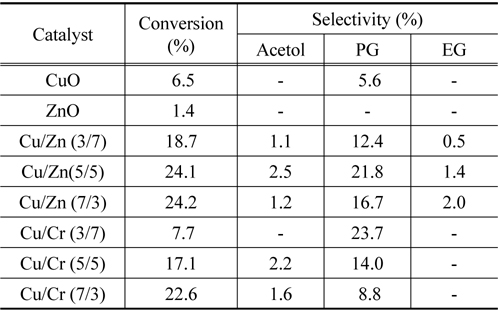
Table 1에 단원계 및 이원계 금속산화물 촉매에서 글리세롤의 수소화분해 반응의 전환율과 아세톨, 프로필렌 글리콜 및 에틸렌 글리콜의 선택도에 대해 나타내었다.
[Table 1.] Catalytic activity of Cu/Zn and Cu/Cr mixed oxides prepared using co-precipitation method
Catalytic activity of Cu/Zn and Cu/Cr mixed oxides prepared using co-precipitation method
순수한 ZnO는 글리세롤의 수소화분해 반응에서 매우 낮은 활성을 나타내었으며, 반면에 CuO는 낮은 전환율과 소량의 프로필렌 글리콜을 생성시키는 것을 볼 수 있다. 글리세롤의 수소화분해 반응은 앞에서도 언급하였던 바와 같이 탈수반응에 의한 아세톨의 생성반응이 먼저 일어나고 계속해서 아세톨의 수소화 반응에 의해 선택적으로 프로필렌 글리콜이 생성되는 반응으로 나누어져 일어나는 것으로 알려져 있다[4,8,9]. 일반적으로 알코올의 탈수반응에서는 Lewis 산점이나 Brφnsted 산점을 가진 촉매에서 진행된다. 따라서 ZnO 산화물은 프로필렌 글리콜을 생성시키지 않고 글리세롤의 탈수반응에서만 활성을 보여주고 있는 반면에 CuO 산화물은 프로필렌 글리콜을 생성시키는데, 이것은 CuO 산화물은 수소화 반응에서 활성을 보여준다는 것을 의미한다.
Cu/Zn 및 Cu/Cr 혼합산화물 촉매에서는 단일 금속 산화물에 비해 글리세롤의 전환율과 프로필렌 글리콜의 선택도가 크게 증가하는 것을 볼 수 있다. 이것은 CuO와 ZnO 및 CrO 산화물의 상승효과(synergy effect)에 기인하는 것으로 생각되며, 각 금속산화물이 Scheme 1에서 보여준 두 반응에 대해 각각 서로 다른 촉매 작용을 하기 때문으로 생각된다. 즉 Table 1에 나타나듯이 Cu/Zn 촉매나 Cu/Cr 촉매 둘 다 구리의 비율이 증가할수록 전환율이 증가하는 것을 볼 수 있다. 이와 같은 결과는 구리산화물이 글리세롤의 탈수반응에 활성점으로 작용한다는 것을 의미한다. 특히 Cu/Cr 2원계 촉매에서는 Cu의 비율이 증가할수록 전환율은 증가하는 반면 선택도가 낮아지는 것을 관찰 할 수 있다. 이 결과 역시 Cu의 조성이 커짐에 따라 글리세롤이 아세톨로의 반응이 많이 진행되지만 상대적으로 Cr의 비율이 줄어듦으로 인해 수소화 반응에 대한 선택도는 감소하게 된다. 따라서 ZnO나 CrO 산화물은 글리세롤의 탈수반응보다 아세톨의 수소화 반응에 활성점으로 작용하는 것으로 생각된다.
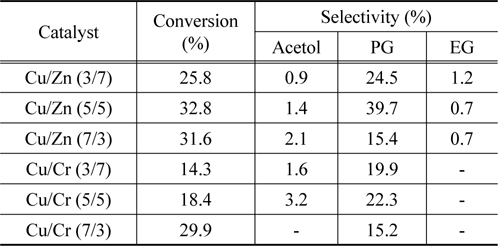
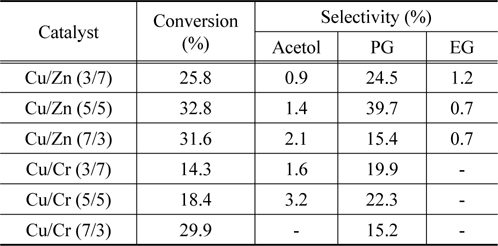
금속산화물의 제조방법은 합성된 물질의 물리적 화학적 성질을 변화시켜 촉매 활성에 영향을 미치는 것으로 알려져 있는 데, 마이크로파 공정은 금속산화물이나 무기재료를 결정화에 유용한 방법으로 알려져 있는데, 이것은 기존의 수열합성법에 비해 높은 수율로 짧은 시간에 결정화를 진행시키는 장점을 가지고 있기 때문이다. 따라서 Table 2에 마이크로파 공정으로 제조된 Cu/Zn 및 Cu/Cr 이원계 금속산화물 촉매에서 글리세롤의 수소화분해 반응의 전환율과 아세톨, 프로필렌 글리콜 및 에틸렌 글리콜의 선택도에 대해 나타내었다.
Table 2에 나타나듯이 Cu/Zn 및 Cu/Cr 촉매 둘 다 마이크로파 공정으로 제조한 촉매에서 글리세롤의 전환율과 프로필렌 글리콜의 선택도가 증가하는 것을 볼 수 있다. 본 연구실에서 이미 페롭스카이트형 금속산화물을 마이크로파 공정으로 제조하면 높은 결정성과 큰 비표면적으로 인해 촉매 활성을 증가시킨다고 보고한바 있다[11]. 따라서 본 실험에서 사용된 혼합 금속산화물이 높은 촉매 활성을 보여주는 것은 마이크로파 공정에 의해 촉매의 물성이 크게 향상되었기 때문으로 생각된다.
Catalytic activity of Cu/Zn and Cu/Cr mixed oxides prepared using microwave-assisted process
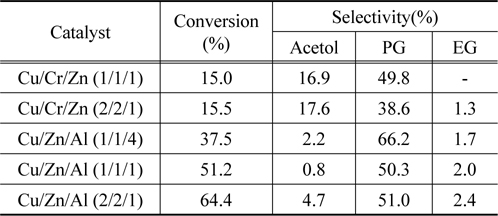
Table 3에서 비교적 높은 활성을 보여준 Cu/Zn 혼합산화물에 Cr 혹은 Al이 첨가된 3원계 혼합 금속산화물 촉매에서 글리세롤의 수소화분해 반응의 전환율과 아세톨, 프로필렌 글리콜 및 에틸렌 글리콜의 선택도에 대해 나타내었다.
Table 3에서 나타나듯이 Cr이 첨가된 3원계 촉매에서는 Cu/Zn 혼합산화물에 비해 글리세롤의 전환율은 오히려 감소하는 반면에 아세톨의 선택도는 크게 증가하는 것을 볼 수 있다. 이것은 Cr의 첨가에 따라 글리세롤의 첫 번째 생성물인 아세톨로의 전환율을 증가시키기 때문으로 생각된다. 또한 Cu/Zn 혼합산화물에 Al이 첨가된 혼합산화물 촉매에서는 글리세롤의 전환율과 프로필렌 글리콜의 선택도가 크게 증가하는 것을 볼 수 있다. 이것은 Cu/Zn 혼합산화물이 첨가된 알루미나표면에 잘 분산되어 글리세롤의 탈수반응과 수소화 반응에 필요한 촉매의 활성점의 수를 증가시켜주기 때문으로 생각된다. 또한 Cu/Zn 혼합산화물의 비가 증가할수록 글리세롤의 전환율과 프로필렌 글리콜의 선택도가 증가하는 것을 볼 수 있다. 이와 같은 결과는 Dalai 등이 보고한 결과와 잘 일치하고 있는데, 즉 Cu/Zn/Al 혼합산화물에서 Cu/Zn의 비율을 변화시키면 촉매의 산점과 수소화 반응에서의 활성점을 변화시켜 글리세롤의 수소화분해 반응의 활성에 영향을 준다고 보고하고 있다[3]. 따라서 Table 3에 나타나듯이 Cu/Zn/Al의 비가 2/2/1로 혼합된 촉매가 가장 높은 활성을 나타내었다.
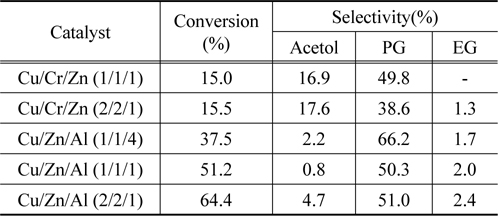
Catalytic activity of Cu/Cr/Zn and Cu/Zn/Al mixed oxides prepared using co-precipitation method
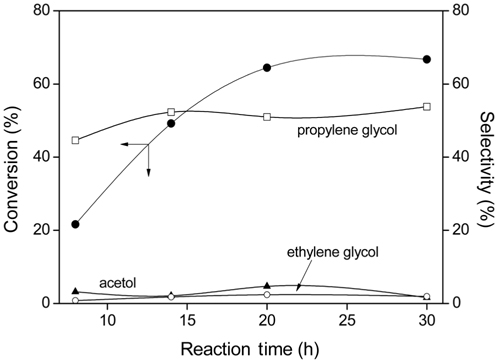
공침전법으로 제조한 Cu/Zn/Al (2/2/1) 촉매를 사용하여 250 psi의 수소기압, 반응온도 200 ℃에서 반응시간에 따른 글리세롤의 전환율과 아세톨, 프로필렌 글리콜 및 에틸렌 글리콜의 선택도를 Figure 4에 나타내었다.
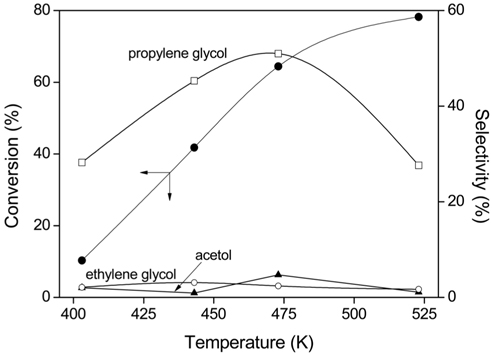
Figure 4 나타나듯이 글리세롤의 전환율은 반응시간이 길어짐에 따라 점점 증가하다가 20시간의 반응에서 62% 전환율을 나타내었다. 그러나 반응시간을 30시간으로 증가시켜도 더 이상 전환율이 증가하지 않는 것을 볼 수 있다. 또한 반응시간에 따른 프로필렌 글리콜을 포함한 생성물의 선택도는 거의 일정한 값을 나타내었다. 따라서 본 연구에서는 20시간 내에 최대수율을 얻을 수 있는 것으로 생각되어 모든 반응을 20시간으로 하여 글리세롤의 수소화 분해반응을 진행하였다.
반응온도는 프로필렌 글리콜의 수율에 큰 영향을 주는 것으로 알려져 있는데[4], 공침전법으로 제조한 Cu/Zn/Al (2/2/1) 촉매를 사용하여 250 psi의 수소압력 하에서 130, 170, 200 및 250 ℃의 온도에서 글리세롤의 수소화 분해 반응을 행하여 글리세롤의 전환율과 생성물에 대한 선택도를 Figure 5에 나타내었다. 반응온도가 증가함에 따라 글리세롤의 전환율은 점차 증가하지만 프로필렌 글리콜의 선택도는 200 ℃에서 최대값을 보이다가 250 ℃에서는 오히려 감소하는 것을 볼 수 있다. 이것은 250 ℃ 이상의 고온에서는 탈수된 글리세롤의 중간체들이 높은 반응온도로 인해 그들의 C-C 결합이나 C-O 결합을 절단시킴으로써 과도한 수소화 분해반응이 일어나 분자량이 낮은 저급 알코올로의 전환되기 때문으로 생각된다.
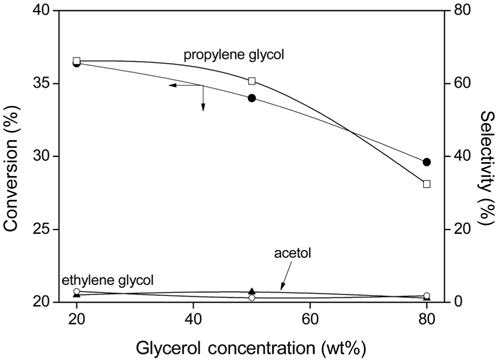
공침전법으로 제조한 Cu/Zn/Al (2/2/1) 촉매를 사용하여 200 ℃에서 250 psi 수소 압력에서 글리세롤의 농도를 20~80 wt% 로 변화시키면서 글리세롤의 수소화 분해 반응을 행하여 글리세롤의 전환율과 생성물에 대한 선택도를 Figure 6에 나타내었다.
글리세롤의 농도가 커질수록 글리세롤의 전환율은 감소하는데, 이것은 일정한 수의 촉매 활성점에 대해 반응물의 양이 증가함에 따라 전환율이 낮아지는 것으로 생각된다. Miyazawa 등[12]에 의하면 10 wt% 농도일 때 가장 높은 전환율을 보여주며 농도가 커질수록 전환율이 낮아진다는 보고와 잘 일치하고 있다. 또한 글리세롤의 농도가 증가할수록 프로필렌 글리콜의 선택도도 감소하는 것을 볼 수 있는데, 이것은 글리세롤의 농도가 증가함에 따라 프로필렌 글리콜이 다른 화합물로 전환되기 때문으로 생각된다.
공침전법 및 마이크로파 공정으로 이원계 및 삼원계 금속산화물 촉매를 합성하였다. 제조된 촉매들의 물리화학적 특성을 XRD, XRF 및 SEM을 이용하여 조사하였으며 프로필렌 글리콜의 글리세롤의 전환반응에서 촉매활성을 측정하였다. Cu/Zn 및 Cu/Cr 혼합산화물 촉매에서는 단일 금속 산화물에 비해 CuO와 ZnO 및 CrO 산화물의 상승효과에 의해 글리세롤의 전환율과 프로필렌 글리콜의 선택도가 매우 크게 증가하였다. Cu/Zn 촉매에 Al이 첨가된 혼합산화물 촉매에서는 글리세롤의 전환율과 프로필렌 글리콜의 선택도가 크게 증가하였다. 또한 반응온도가 증가함에 따라 글리세롤의 전환율은 점차 증가하지만 프로필렌 글리콜의 선택도는 200 ℃에서 최대값을 보이다가 250 ℃에서는 오히려 감소하였다. 글리세롤의 농도가 커질수록 글리세롤의 전환율과 프로필렌 글리콜의 선택도가 감소하였다.