구리-제올라이트 촉매와 Fe-제올라이트 촉매로 과잉산소 분위기에서 일산화질소의 암모니아 선택적 촉매환원반응을 체계 적으로 조사하였다. 촉매는 디젤엔진에서의 SCR기술의 적용을 위하여 구리와 철을 NH4-BEA와 NH4-ZSM-5 제올라이트에 이온교환법과 함침법으로 담지시켜 제조하였다. 촉매의 특성은 BET, XRD, FE-TEM과 SEM/EDS를 사용하여 조사하였다. 고정된 반응조건에서 선택적 촉매환원반응의 활성을 조사한 결과에서 구리를 BEA 제올라이트에 이온교환시켜 제조한 촉 매가 200~250 ℃의 저온영역에서 탁월한 성능을 나타내었다. 250 ℃ 이하의 저온에서 구리-제올라이트 촉매가 Fe-제올라이 트 촉매보다 높은 반응활성을 나타내었다. BEA 제올라이트에 담지된 촉매가 ZSM-5 제올라이트에 담지된 촉매보다 250 ℃ 이하의 저온에서 우수한 반응활성을 나타내었다.
국제해사기구(international maritime organization, IMO)는 국제해양오염방지협약(MARPOL Convection) Annex VI를 채택하여 선박에서 배출되는 대기오염물질을 규제하기로 하였다. IMO가 요구하는 대형 선박용 디젤기관의 NOx배출량 규제는 앞으로도 계속 강화될 것이므로 선박용 NOx 제거기술 개발이 필요하다. 디젤엔진의 NOx 제거를 위한 방법으로 암모니아를 사용한 선택적 촉매환원(selective catalytic reduction, SCR)반응이 효과적이라고 알려져 있다[1]. 암모니아는 추가적인 용기에 의한 우레아의 가수분해나 분해에 의하여 바로 생산되어 사용 가능하다. 우레아-SCR은 상용 디젤엔진의 NOx 후처리 방법으로 가장 효율적으로 알려져 있다[2]. 우레아는 암모니아와 달리 취급, 저장과 운반이 용이하고 안전하다.
가스 중의 NOx 제거를 위하여 암모니아를 환원제로 사용한 촉매환원공정은 1970년대에 일본에서 처음 개발되었으며 오늘날 세계적으로 널리 사용되고 있다[3]. 암모니아-SCR 반응의 초기의 공정에서는 공업적인 촉매로 담지된 V2O5에 바탕을 두고 있으며 Fe2O3, CuO, MnOx와 CrOx를 포함하는 촉매들이 사용되었다[3]. 암모니아-SCR 반응의 촉매는 기본적으로 3가지로 구분될 수 있으며, 담지된 귀금속 촉매[4], 바나듐을 포함하는 금속산화물 촉매, 금속을 이온교환 시킨 제올라이트로 나눌 수 있다[5]. 암모니아-SCR 반응에서 제올라이트에 이온교환시킨 Fe, Cu, Mn과 Ce의 금속촉매가 우수한 활성을 나타내는 것으로 보고되고 있다[6]. 특히 제올라이트에 담지된 철 촉매가 많이 연구되어 왔으며, 담체로는 제올라이트 ZSM-5와 제올라이트 BEA가 많이 사용되어 왔다[1]. Rahkamaa-Tolonen et al.[2]은 제올라이트에 기초한 촉매가 NH3-SCR 반응에 매우 가능성이 큰 것으로 보고하였다. Fe를 포함하는 혼합 산화물과 Fe 이온교환 촉매 특히 Fe-BEA와 Fe-ZSM-5촉매가 SCR 반응에 탁월한 활성을 나타내었으며, Fe-BEA는 다른 금속이온교환 촉매에 비하여 우수한 활성과, N2 선택성 및 노화 특성을 나타내었다[7,8]. Cu2+ 이온교환 ZSM-5 촉매는 산소 존재 하에서 암모니아에 의한 NO의 환원반응에 활성적인 촉매로 알려져 있다[7].
일반적으로 산소 존재 하에서 암모니아를 사용하는 SCR의 반응은 다음 (1)과 같이 알려져 있다[5].
이 반응은 저온에서 촉매에 의하여 촉진된다. SCR 촉매로 많은 형태가 사용되었으며 새로운 촉매도 계속 개발되고 있다. 공업적 연도가스와 디젤엔진의 배출가스중의 NOx의 암모니아에 의한 SCR 반응을 위한 저온(100~300 ℃)에서의 촉매개발이 중요하며, 특히 200 ℃ 이하에서의 NOx의 SCR 촉매는 아직도 달성해야 할 과제이다[6].
본 연구에서는 과잉산소 분위기에서 일산화질소의 암모니아 선택적 촉매환원반응을 구리-제올라이트와 Fe-제올라이트 촉매를 이용하여 체계적으로 조사하였다. 디젤엔진의 NOx제거를 위한 NH3-SCR반응에 적용하기 위하여 구리와 철을 NH4-BEA와 NH4-ZSM-5 제올라이트에 이온교환법과 함침법으로 담지시켜 촉매를 제조하였다.
촉매의 담체로는 제올라이트 NH4-BEA (Alfa Aeser, SiO2/Al2O3 = 38, S.A. = 710 m2/g)와 제올라이트 NH4-ZSM-5 (Alfa Aeser, SiO2/Al2O3 = 30, S.A. = 400 m2/g)를 사용하였으며, 활성금속성분은 Fe(NO3)3?9H2O (Aldrich Chemical Co., 99.99%)와 Cu(NO3)2?2.5H2O (Aldrich Chemical Co., 99.99%)를 사용하였다. 금속성분은 이온교환법(ion exchange)과 건식 함침법(incipient wetness impregnation)을 사용하여 담지시켰다. 이온교환법은 Fe성분의 최대 이온교환 농도의 용액에 제올라이트를 넣고 상온에서 24 h 동안 교반하여 이온교환 시켰으며, Cu성분은 최대 이온교환 농도의 용액에 제올라이트를 넣고 상온에서 24 h 동안 2회 반복하여 교반시키며 이온교환 시켰다. 제올라이트는 사용하기 전에 120 ℃에서 2 h 동안 건조하여 사용하였다. 이온교환된 제올라이트는 여과와 세척을 하고 80 ℃에서 2 h 동안, 120 ℃에서 6 h 동안 건조시키고, 550 ℃에서 2 h 동안 소성하여 촉매로 제조하였다. 건식 함침법은 120 ℃에서 2 h 건조시킨 제올라이트에 환산된 양의 금속성분을 함침시키고 120 ℃에서 8 h 동안 건조시키고, 550 ℃에서 4 h 동안 소성시켜 촉매로 제조하였다. 촉매명에서 이온교환법은 (IE), 함침법은 (IM)으로 나타내었으며, 금속의 담지량, 담지방법-담체 순으로 구분하여 표기하였다. Fe1(IE)-BEA는 제올라이트 BEA에 1 wt%의 Fe를 이온교환법으로 담지시켜 제조한 촉매를 나타낸다.
NO의 NH3-SCR 반응의 활성을 조사하기 위하여 촉매는 0.05 g을 기본적으로 사용하였고, 반응온도는 150 ℃에서 400 ℃까지 5 ℃/min로 온도를 올리면서 50 ℃ 간격으로 반응온도를 변화시키며 각 반응온도에서 1 h 동안 반응활성을 조사하였다. 반응가스는 기본적으로 200 mL/min (NO 500 ppm, HN3 500 ppm, O2 10%, CO2 5%, N2 base)의 속도로 MFC (mass flow controller)를 사용하여 가스의 유량을 조절하고 혼합하여 공급하였다. 반응기는 내경 20 mm, 높이 70 mm인 U자형 석영 미분반응기를 사용하였다. 반응 후 가스 분석은 가스분석기(Saxon-Junkalor Gas Analyzer)를 사용하여 NDIR법을 사용한 NO와 CO2의 분석과, electro chemical법을 사용한 NO2의 분석을 하였다. NH3의 분석은 GC (Agilent Technologies 7890A)의 TCD로 Porapak Q (80/100, 1/8 in.SS × 8 ft)와 Porapak N (80/100, 1/8 in.SS × 10 ft)의 분리관을 사용하였다. NO와 NH3의 전환율은 다음식 (2), (3)과 같이 정의하였다.
촉매의 표면적과 세공분포의 측정은 BET (Quantachrome Autosorb-1)의 질소흡착법을 사용하였다. 반응 전후의 생성성분을 확인하기 위하여 XRD (Philips X'pert MPD 3040)를 사용하였고, 촉매표면에서의 금속성분의 상태는 FE-TEM (JEM 2100F)과 SEM/EDS (JEOL JSM-5610)를 사용하여 조사하였다.
제올라이트 BEA에 Cu와 Fe를 이온교환법과 함침법으로 제조한
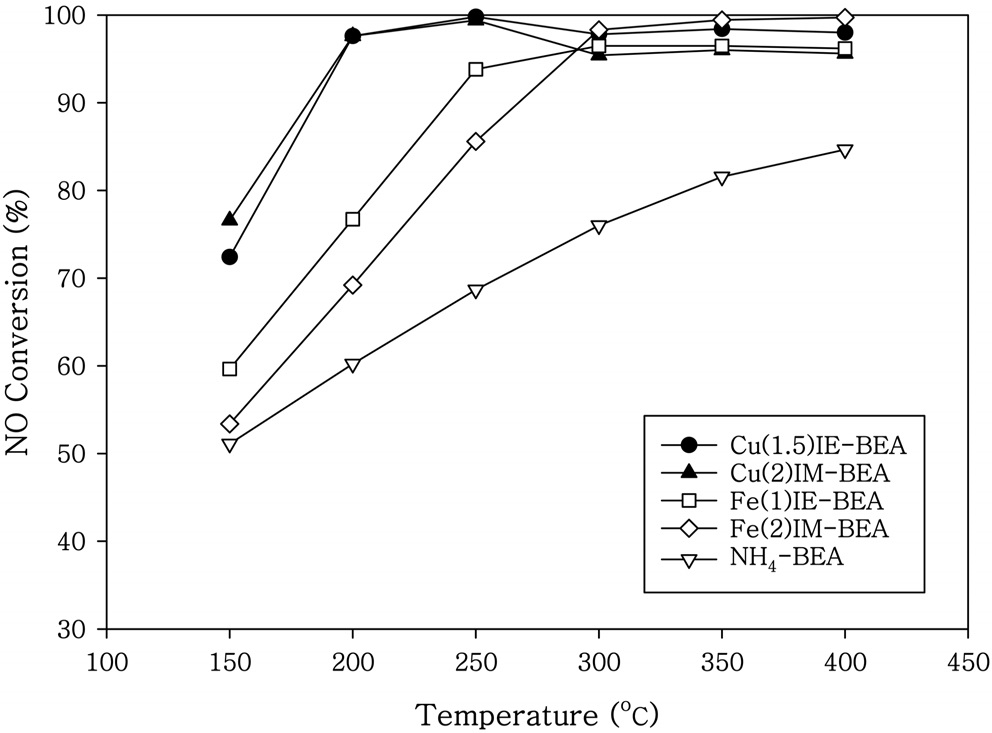
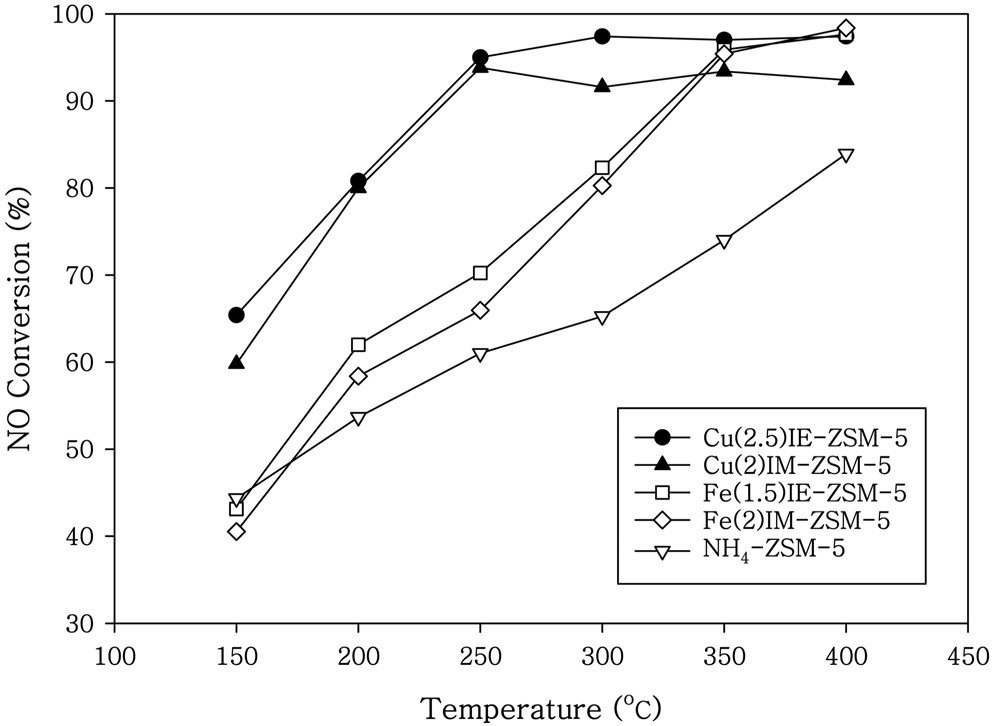
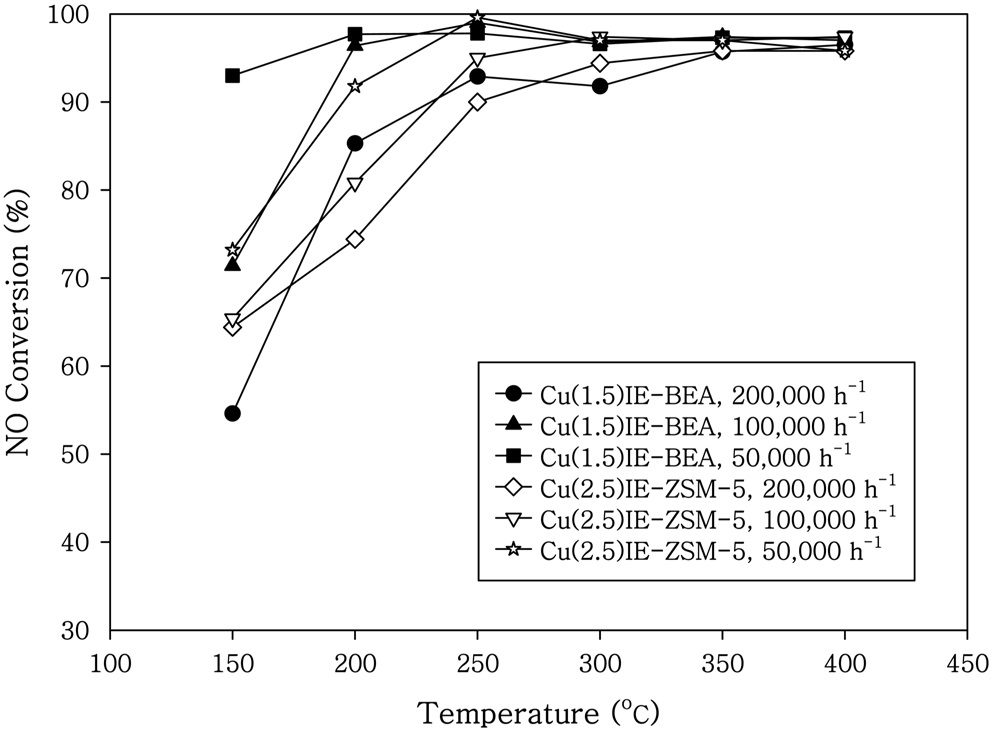
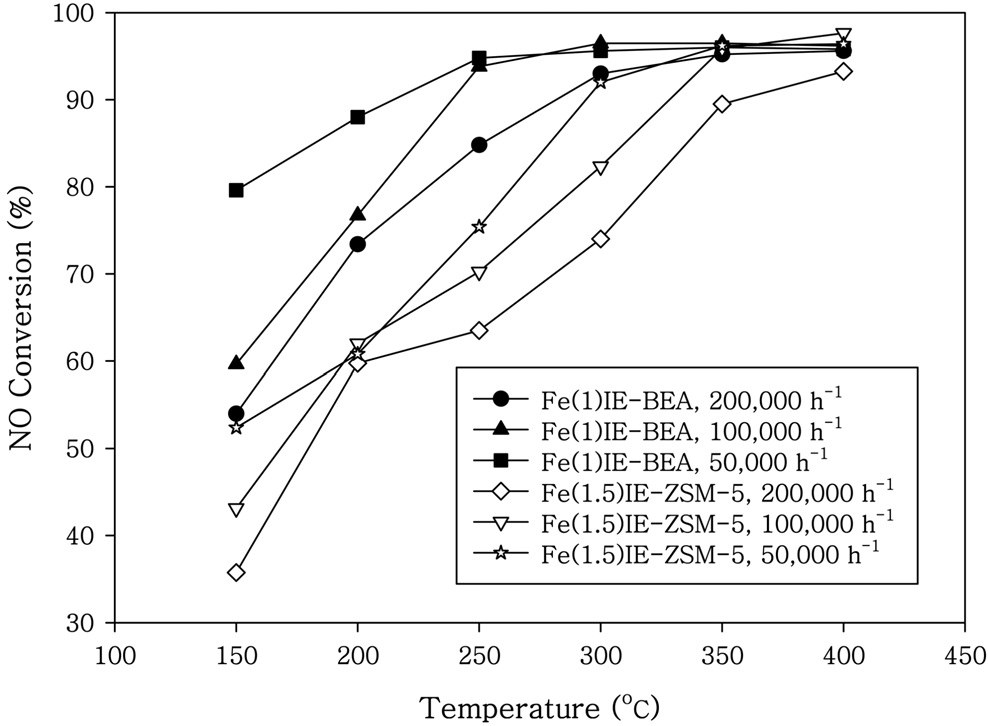
촉매의 NO 전환율을 Figure 1에 나타내었다. 200-250 ℃의 저온영역에서 Cu를 담지시킨 촉매가 Fe를 담지시킨 촉매보다 높은 전환율을 나타내었다. Cu를 담지시킨 Cu(1.5)IE-BEA와 Cu(2)IM-BEA에서는 200 ℃ 이상의 온도에서 95% 이상의 NO 전환율을 얻을 수 있었다. 제올라이트 ZSM-5에 Fe와 Cu를 이온교환법과 함침법으로 제조한 촉매의 NO 전환율은 Figure 2에 나타내었다. Cu를 담지시킨 촉매는 250 ℃ 이상의 온도에서 90% 이상의 NO 전환율을 얻을 수 있었다. Hong et al.[4]은 귀금속 담지촉매를 이용한 탄화수소 선택적 촉매환원반응에서 NOx전환율을 55% 정도로 보고한 바 있다. Cu와 Fe를 담지시킨 제올라이트 촉매에서의 SCR 반응 후의 자유 NO2의 생성은 거의 무시할 수 있었다. Fe-ZSM-5 촉매를 사용하여 150-600 ℃의 영역에서 조사한 NO의 NH3-SCR 반응에서 NO의 산화반응은 NO의 환원반응보다 아주 느리게 일어나서 NO의 산화에 의한 NO2의 생성은 거의 무시할 수 있는 것으로 주장하였다[9]. Figure 1과 2를 비교하면 Fe와 Cu를 담지시킨 촉매에서 제올라이트 BEA가 제올라이트 ZSM-5보다 우수한 담체특성을 나타내었다. 상업적인 Cu-제올라이트와 Fe-제올라이트 촉매의 체계적인 연구에서 Fe-제올라이트 보다는 Cu-제올라이트 촉매가 더욱 큰 암모니아 저장 능력을 보였으며, 암모니아산화반응과 표준 SCR 반응에서 더 큰 활성을 나타내는 것으로 나타났다[10]. Fe-제올라이트 촉매에서는 저온의 SCR 반응에서 NH3에 의한 방해효과가 강하게 나타나는 것으로 보고된 바 있으나, Cu-제올라이트 촉매에서는 NH3에 의한 방해효과가 나타나지 않는 것으로 조사되었다[10]. Fe-ZSM-5 촉매를 이용한 200~300 ℃ 영역의 NO의 표준 NH3-SCR반응은 NO에는 1차이고 O2에는 0.5 차이며 NH3에는 -0.3로 관찰되었으며, NH3에 의한 속도 방해작용은 표준 SCR반응에 필요한 단계인 NO의 산화반응 활성점을 차단하기 때문이라고 하였다[11]. Fe와 Cu로 이온교환된 제올라이트 촉매에서 Fe-제올라이트와 Cu-제올라이트를 비교하면 저온에서는 Cu-제올라이트가 더욱 우수한 반응활성을 나타내는 것으로 나타났다[6]. Fe-제올라이트 중에서는 Fe-BEA가 큰 활성을 나타내었으며, 디젤엔진에 적용시에는 탄화수소의 코크스 생성이 문제로 나타났다[6]. Fe-제올라이트는 저온에서의 활성증대가 요구되었으며, Cu-제올라이트는 고온에서의 활성증대가 요구되었다[6].
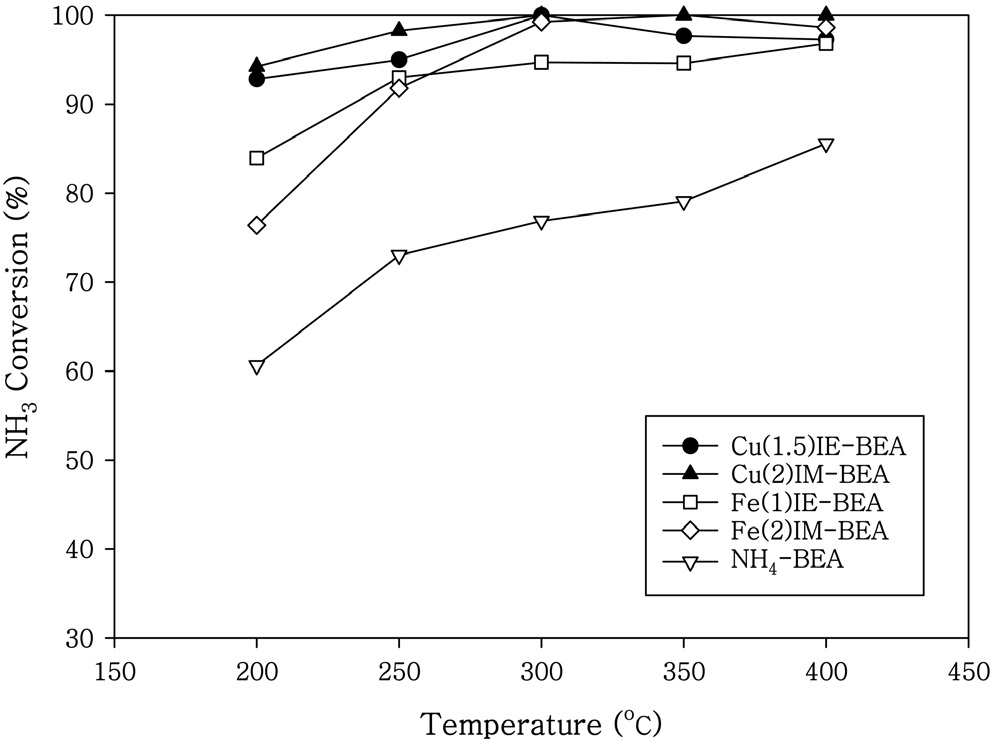
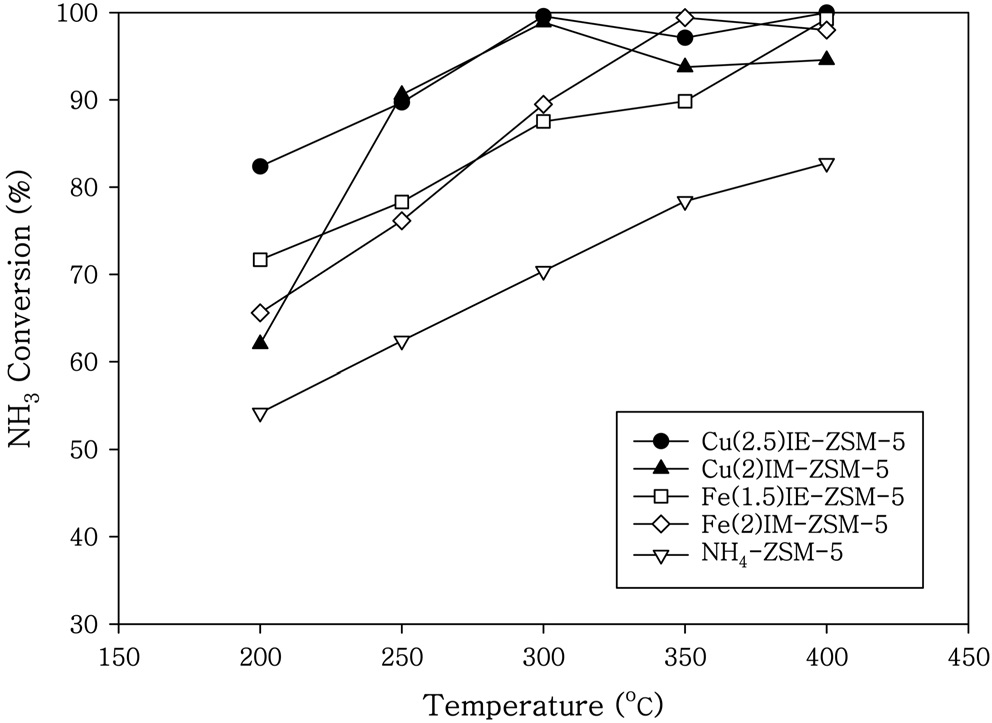
제올라이트 BEA에 Cu와 Fe를 담지시킨 촉매에서의 NH3 전환율을 Figure 3에 나타내었다. 제올라이트 ZSM-5에 Cu와 Fe를 담지시킨 촉매에서의 NH3전환율은 Figure 4와 같다. NO의 전환율과 같이 Cu를 담지시킨 촉매가 Fe를 담지시킨 촉매보다 높은 NH3의 전환율을 나타내고 있다. 제올라이트 BEA에 Cu를 담지시킨 촉매에서는 200 ℃ 이상의 온도에서 95% 이상의 NH3의 전환율을 얻을 수 있었다. 제올라이트 ZSM-5에 Cu를 담지시킨 촉매에서는 250 ℃ 이상의 온도에서 90% 이상의 NH3의 전환율을 나타내고 있다.
Cu를 제올라이트에 담지시킨 촉매의 공간속도 변화에 따른 NO 전환율 특성을 Figure 5에 나타내었다. 저온 영역에서는 GHSV의 증가에 따라 NO 전환율이 감소하는 일반적인 특성을 나타내고 있다. Cu를 이온교환법으로 제올라이트 BEA에 담지시킨 촉매는 100,000 h-1이하의 공간속도인 경우 200 ℃에서도 95% 이상의 NO 전환율을 나타내고 있다.
금속으로 촉진시킨 제올라이트 특히 Cu-제올라이트 촉매는 저온에서 바나듐계 촉매보다 더욱 활성이 우수하여 엄격해지는 NOx배출 규제를 충족시키기에 도움이 된다. 그리고 제올라이트는 PM (particulate matter)배출을 방지하기 위하여 현재 사용되는 디젤입자 필터의 재생에 따른 배출가스 온도의 상승조건에서 더욱 안정적이다[12]. NOx의 NH3-SCR반응에서 3.5Cu/0.6NaZSM-5를 2.6Cu/HZSM-5와 비교하였을 때 3.5Cu/0.6NaZSM-5이 우수한 반응활성을 나타내었다. 이는 3.5Cu/0.6NaZSM-5에 존재하는 더욱 많은 Cu+종 때문이며, 3.5Cu/0.6NaZSM-5에 존재하는 Cu+종은 쉽게 환원될 수 있어 산소를 활성화하여 NO와 반응에 의한 NO2의 형성에 기인하며 NOx의 전환율을 향상시키는 것으로 주장하였다[13]. 촉매표면의 격리된 Cu2+와 Cu-O-Cu 이합체가 NH3-SCR 반응에서 주요 역할을 하는 것으로 일반적으로 받아들여지고 있다[14]. Cu-ZSM-5 촉매의 SCR 반응 비활성화는 제올라이트 구조의 변화, Cu-aluminate의 형성, Cu2+의 CuO로의 전환에 의한 반응활성점의 감소, Cu2+의 이동에 의한 반응활성점의 재분산, 또는 이들 메커니즘들의 결합 때문으로 관찰하였다[6]. Iwamoto and Yahiro[15]는 Cu를 이온 교환시킨 제올라이트에 의한 NO의 분해반응을 폭넓게 연구하였으나, Cu-ZSM-5 촉매에 의한 NO의 분해는 350 ℃ 이상에서 일어나고 550~600 ℃에서 최대 활성을 나타내고 있어 엔진의 후처리용으로 적용하기에는 고온 영역이다. Cheng et al.[16]은 NO의 분해를 위한 Cu의 촉매성능은 Cu+-Cu2+ 환원산화 순환에 기인하고 ON-Cu2+-NO2-의 형성이 필수적으로 요구되며, Cu+와 Cu2+종의 상대적인 안정성이 중요하다고 주장하였다.
Figure 1에서 보면 Cu를 담지시킨 촉매의 경우 300 ℃ 이상에서는 NO의 전환율이 다소 감소하는 것으로 나타났으나 Figure 3에서 보면 NH3의 전환율은 300 ℃ 이상의 온도에서도 크게 감소하지 않는 것으로 나타났다. 이는 300 ℃ 이상에서는 암모니아 산화반응이 시작되기 때문으로 보인다. 이온교환법으로 제조된 Cu-ZSM-5 촉매로 100~500 ℃의 온도영역에서 단계적으로 온도를 증가시키면서 암모니아에 의한 NOx SCR 반응을 조사한 결과 초기의 15분 동안에 전체 암모니아의 흡착이 일어났고 200 ℃ 정도에서 NO의 전환율이 100% 가량으로 증가하였으며, 350 ℃에서는 전환율이 감소하기 시작하였는데 이는 350 ℃에서 암모니아의 산화반응이 빠르게 일어나기 때문이라고 하였다[17]. Cu-ZSM-5 촉매로 100~500 ℃의 온도영역에서 단계별로 온도를 증가시키면서 조사한 암모니아 산화반응은 300 ℃에서 시작되어 350 ℃에서 빠르게 가속화되는 것으로 나타났다[17].
Fe를 제올라이트에 담지시킨 촉매의 공간속도 변화에 따른 NO 전환율 특성은 Figure 6과 같다. Fe를 이온교환법으로 제올라이트 BEA에 담지시킨 촉매는 100,000 h-1이하의 공간속도인 경우 250 ℃ 이상에서 95% 이상의 NO 전환율을 나타내었다. ZSM-5에 Fe를 함침법과 액상 이온교환법으로 담지시킨 촉매의 경우 암모니아 SCR 반응에서 높은 NOx 전환율을 나타내었다[18]. HBEA에 Fe를 함침법으로 담지시킨 촉매보다는 이온교환법으로 제조한 촉매가 더 큰 활성과 선택성을 나타내었으며, 이는 이온교환점에서 형성된 독립된 Fe성분이 암모니아에 의한 NOx 환원에서 활성을 나타내었기 때문이며 Fe산화물 입자는 전 온도영역에서 암모니아 산화에 관여하였다[19]. 함침법으로 제조된 Fe-HBEA 촉매의 표면에는 Fe 질산염과 [Fe2+(NO)]와 [Fe2+(NO)2]가 동시에 흡착되어 있는 것이 DRIFTS 분석에 의하여 확인되었다. 200 ℃에서는 [Fe2+(NO)]가 SCR 반응의 주요 중간체이었으며, [Fe2+(NO3)2]는 SCR 반응에 관여하지 않는 것으로 나타났다[19]. Fe-BEA 제올라이트 촉매에서
SCR 반응활성이 큰 촉매일수록 Fe의 부분적인 환원이 더 잘 일어나는 것으로 관찰되었으며, 이것은 Fe나 NO의 산화가 SCR 반응의 율속단계라는 반응기구를 지지하는 결과라고 주장하였다[19]. 0.25Fe/HBEA 촉매에 의한 SCR 반응에서의 높은 활성은 인접한 Fe3+활성점에서의 NO와 NH3의 흡착과 반응을 포함하는 이중의 활성점 반응기구 때문으로 제안하였다[20]. Fe/ZSM-5 촉매에서 Fe의 3가지 형태인 집합체 α-Fe2O3, FexOy 소중합체, 이온교환된 oxo-Fe3+점이 관찰되었으며, oxo-Fe3+점이 활성점이며 NO2-TPD로 정확한 양을 측정한 것으로 보고하였다[21]. Brandenberger et al.[22]의 DRIFT분석에서 이온 교환시켜 제조한 Fe-ZSM-5 촉매에서 Fe/Al의 비가 감소함에 따라 단핵 Fe의 수가 증가하는 것으로 나타났다. Fe-ZSM-5 촉매에서의 NO의 NH3-SCR 반응에서 다양한 Fe 종들의 활성을 TOF를 조사하여 비교하였다[23]. 300 ℃ 이하에서는 SCR 반응은 단량체 Fe점이 활성점으로 나타났고, 300 ℃ 이상에서는 이량체 Fe종이며, 400 ℃ 이상에서는 소중합체 Fe종이고, 500℃ 이상에서는 Fe 산화물입자의 외부의 부분적으로 비결합된 Fe점에 기인하는 것으로 주장하였다[23]. Fe-BEA 촉매에 의한 저온에서의 NH3-SCR 반응속도는 단량체 Fe종의 밀도 감소에 매우 민감한 것으로 나타났다[24]. 담지량이 적은 Fe 촉매(≤1.2wt% Fe)에서는 대부분이 Fe 단량체로 존재하며, 특히 이온교환된 Fe 촉매는 암모니아에 의한 NOx의 SCR 반응에서 우수한 성능을 나타내었다[19]. Figure 1과 2에서 Fe-제올라이트 촉매의 활성을 비교하면, 250 ℃ 이하의 저온영역에서는 이온교환법으로 제조한 Fe(1)IE-BEA와 Fe(1.5)IE-ZSM-5의 반응활성이 함침법으로 제조한 촉매보다 크게 나타나고 있으며 이는 Fe 단량체의 존재량에 의한 영향으로 보인다. 이온교환법으로 제조한 Fe-제올라이트 촉매에서 담지량을 줄인 Fe(0.7)IE-BEA와 Fe(1.0)IE-ZSM-5의 촉매에서도 최고 활성을 보이는 온도에서는 Fe(1.0)IE-BEA 및 Fe(1.5)IE-ZSM-5에서의 촉매활성과 거의 유사한 반응활성을 얻을 수 있었다.
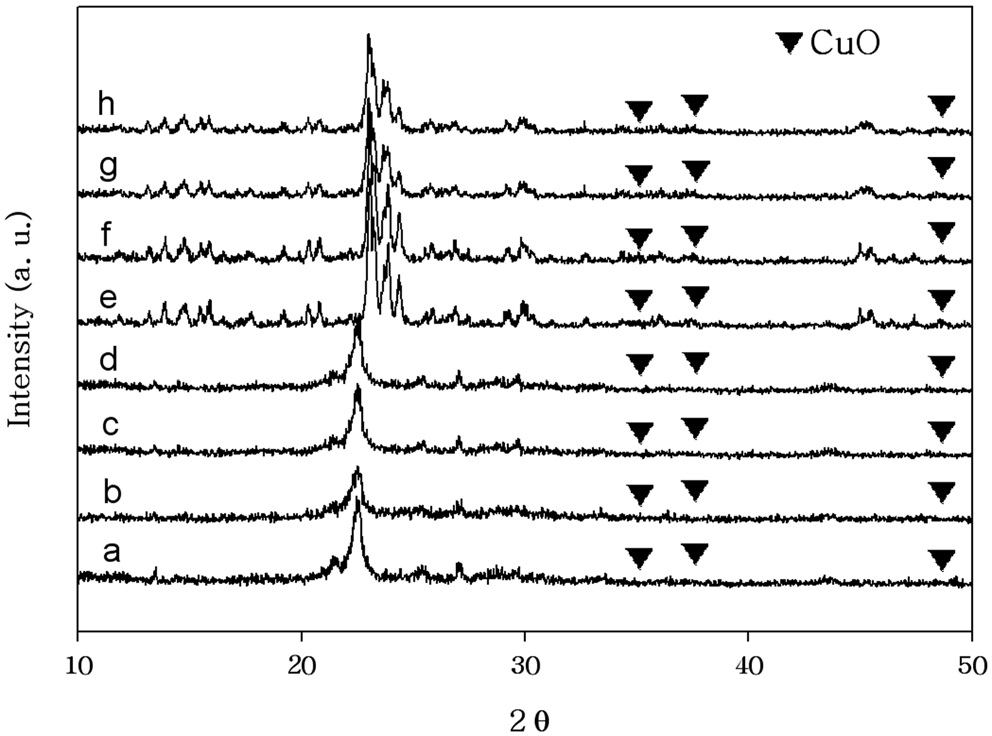
Cu를 제올라이트 BEA와 제올라이트 ZSM-5에 담지시켜 제조한
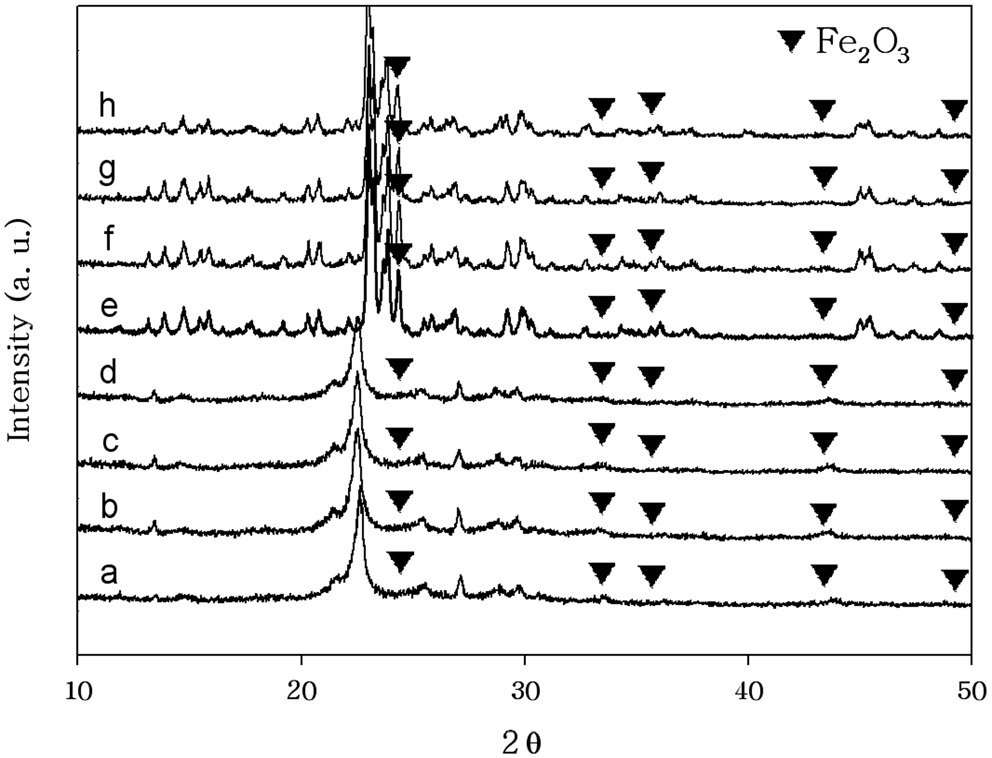
촉매에서 반응 전후의 XRD피크들을 Figure 7에 나타내었다. Fe를 제올라이트 BEA와 제올라이트 ZSM-5에 담지시켜 제조한 촉매의 반응 전후의 XRD피크들은 Figure 8에 나타내었다. 제법에 따른 XRD 피크에서의 Cu와 Fe성분의 차이는 거의 나타나지 않았으며 모든 촉매에서 반응 전후에 뚜렷한 차이도 관찰되지 않았다. 제올라이트 구조는 550 ℃의 소성온도와 550 ℃의 반응에서도 열적으로 안정한 것을 나타내고 있다.
SEM/EDX에 의한 Fe(1)IE-BEA와 Fe(1.5)IE-ZSM-5의 분석결과를 Figure 9와 10에 나타내었으며, Cu(1.5)IE-BEA와 Cu(2.5) IE-ZSM-5의 SEM/EDX 분석결과는 Figure 11과 12에 나타내었다.
SEM/EDX와 FE-TEM의 분석결과 Cu와 Fe 성분은 잘 분산되어 있었으며, 반응 전후에도 분산도에서 큰 차이가 없이 잘 분산되어 있는 것으로 나타났다. BET 분석결과 Cu와 Fe를 BEA 제올라이트에 담지시킨 촉매는 반응 전후에 큰 변화없이 600~780 m2/g 영역의 표면적을 나타내었으며, Cu와 Fe를 ZSM-5 제올라이트에 담지시킨 촉매에서는 반응 전후에 큰 변화없이 400~460 m2/g 영역의 표면적을 나타내었다.
BEA제올라이트와 ZSM-5제올라이트에 Fe와 Cu를 이온교환법과 함침법으로 담지시켜 제조한 촉매로 고정된 반응조건의 150~400 ℃ 온도영역에서 NO의 NH3-SCR 반응특성을 조사하여 다음과 같은 결론을 얻었다.
구리를 BEA 제올라이트에 이온교환시켜 제조한 촉매가 200~250 ℃의 저온영역에서 탁월한 성능을 나타내었다. 250 ℃ 이하의 저온에서는 구리-제올라이트 촉매가 Fe-제올라이트 촉매보다 높은 반응활성을 나타내었다. BEA 제올라이트에 담지된 촉매가 ZSM-5 제올라이트 담지된 촉매보다 250 ℃ 이하의 저온에서 우수한 반응활성을 나타내었다.
XRD 분석결과 반응 전후에 XRD 피크의 변화가 거의 나타나지 않았고, SEM/EDX 분석결과 반응 전후에 Fe및 Cu성분이 잘 분산되어 있는 것으로 나타났다.