Entomopathogenic fungi have been studied to develop for biological control agents as an alternative to chemical control agents in insect pest management. This investigated to determine the optimal culture conditions in ceramic balls for maximal sporulation of entomopathogenic fungi
METHODS AND RESULTS: A culture of entomopathogenic fungi for 12day on rice bran extract(1:8, w/v) incubated in ceramic matrix at 28℃. Natural zeolite ceramic ball was high production of 4.2×108 conidial/mL. The culture condition optimized initial pH, temperature, rice bran extract concentration, adhesives substance and concentration of NaCl, respectively. The high production of spore optimal conditions were temperature 28℃, initial pH 3, rice bran extract 3 mL, starch 33 g, 5 % NaCl and sopre suspension 7 mL, respectively.
This study was carried out for the mass production of entomopathogenic fungi conidia recover rate 65% in matrix of natural zeolite ceramic ball, and to develop ingredient-used formulation of
최근 화학농약의 사용으로 인한 농산물의 안전성에 대한 문제점이 야기되고 이로 인하여 국내 농산물에 대한 소비자들의 신뢰가 낮아지고 있다. 대부분의 국민들은 깨끗하고 안전한 농산물을 선호하기 때문에 친환경농산물에 대한 관심이 높아지고 있다. 하지만 친환경농산물을 재배하기 위해서는 경제적 독약과도 같은 화학농약의 사용량을 줄여야하고, 필수적으로 친환경농산물 재배에 필요한 병충해방제용 자재의 산업화가 필요하다. 하지만 친환경농산물 재배에 필요한 병충해 방제용 농자재 생산을 위해서는 원제의 공급이 매우 중요하다(Kim and Kim, 2009).
현재 사용하는 화학 살충제의 일부를 미생물농약으로 대체한다면 화학농약 사용량을 상당히 줄일 수 있을 것으로 예상된다. 해충방제에는 세균과 곰팡이가 일반적으로 많이 이용되는 미생물이며, 가루이류의 방제에 사용되는 병원성 곰팡이로는
곤충병원성 곰팡이가 액체 배양에 의해 포자생산의 가능성에도 불구하고 액체배양에서 생산되는 포자는 친수성이고 기름에 쉽게 제제화되지 않는다. 사출포자들도 액체 발효에서 비슷한 게 생산되지만 역시 친수성이고 저장하는 동안 상대적으로 빨리 생존능을 잃는다. 이러한 문제 뿐 만 아니라, 곰팡이 포자 살충제의 성공적인 상용화의 걸림돌은 포자에 의한 병발생의 속도가 느리다는 점과, 포자의 살충력이 온도, 습도 등과 같은 경작지 환경에 영향을 받아 그 살충효과가 변동이 크다는 점이다(Burges, 1998; Inglis
곤충병원성 곰팡이를 생물자재로서 이용 시 통상적인 이러한 문제점들이 해결되며, 내구성의 포자를 저렴하면서 대량생산할 수 있는 기술이 요망되고 있다(Silman
농업용 부산물 중 미강(rice bran)은 현미에서 정백미로 도정하는 과정에서 생기는 과피, 종피, 호분층 등의 분쇄혼합물을 말하며 영양소 및 유효성분 등에 대한 효능이 규명되어 다양한 산업적 이용가치가 매우 높아지고 있는 실정이다(Oh
미강은 미생물 배양에 있어 대량배양에 적합하다고 알려져 있으며, 미강 뿐 만 아니라 여러 농업부산물 또한 다양한 미생물을 배양하는 배지 또는 영양소 첨가제로 이용되고 있다.
본 연구의 목적은 최근 친환경 농자재의 사용가능한 곤충 병원성 곰팡이
>
곤충병원성곰팡이의 세라믹볼(천연제오라이트, 합성제 오라이트, 천연활성탄)에서의 생육 유무
곤충병원곰팡이
>
곤충병원성곰팡이의 세라믹볼(천연제오라이트, 합성제오라이트, 천연활성탄)에서의 포자 생산
곤충병원곰팡이를 담체(matrix)을 이용하여 고체배양의 가능성 여부를 확인한 후, 천연제오라이트, 합성제오라이트와 활성탄 담체별 포자 생산량을 조사하였다. 각각의 세라믹볼 100 g을 세척 후 121℃ 조건에서 30분 동안 멸균 하였고, 준비된 포자현탁액이 함유된 (미강추출물 3 mL + 포자현탁액 7 mL)을 각각의 세라믹볼과 혼합 표면처리한 후 거즈가 깔린 petridish에 일정량을 펼친 후 항온항습기(28℃, 40%)에서 12일간 배양하였다.
>
곤충병원성곰팡이의 세라믹볼 고체배지의 포자현탁액이 함유된 교착물질 내의 미강추출물에 따른 포자 생산
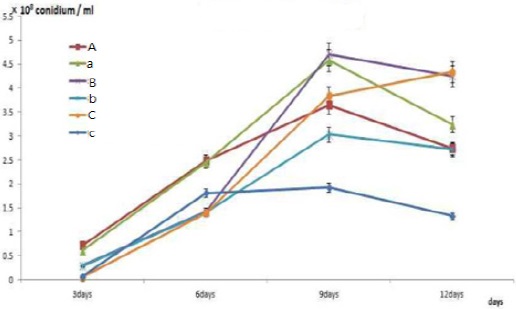
곤충병원성 곰팡이를 세라믹볼 담체(matrix)에 고체배지 흡착시키기 위해 일반적으로 고체배지에 사용하는 agar를 이용하여, 일반배지 agar 함유량인 1.8%와 starch 이용한 배양시 탄소원 및 질소원의 공급원인 미강추출물 함량에 따른 포자 생산성을 조사하였다. 세라믹볼 100 g을 세척 후 121℃ 조건에서 30분 동안 멸균 하였고, 준비된 포자현탁액이 함유된 각각의 교착물질을 스프레이 처리하여 세라믹볼에 코팅한 후 거즈가 깔린 petridish에 일정량 펼친 후 항온항습기(28℃, 40%)에서 12일간 동일한 배양조건으로 실험을 진행 하였다.
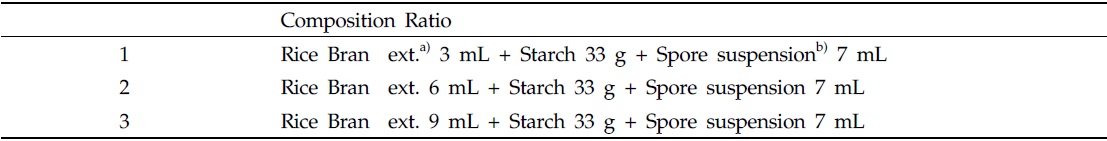
[Table 1.] Adhesives substance of composition ratio
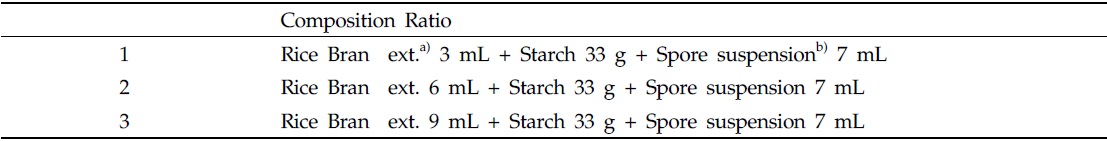
Adhesives substance of composition ratio
>
곤충병원성곰팡이의 천연제오라이트 세라믹볼 고체배지에 있어서 포자 유도 조절인자
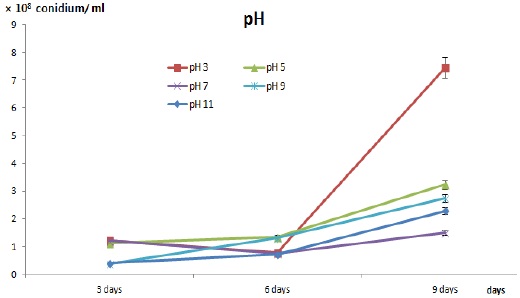
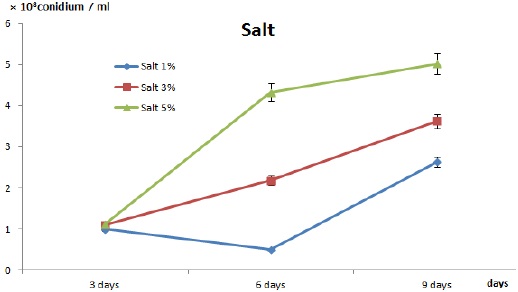
일반적으로 모든 곰팡이의 생육적 특징 중 하나로 외부환경(영양원고갈, 물리적 충격손상, 화학적 변화, 온도, 빛, 습도)의 변화에 따라 포자 유도를 조절할 수 있다. 곤충병원성 곰팡이의 천연제오라이트 세라믹볼 고체배지에서 포자 유도를 통해 포자 생산성을 높이기 위하여 pH와 NaCl을 조절인자로 조사하였다. 천연제오라이트 세라믹볼 100 g을 세척후 121℃ 조건에서 30분 동안 멸균 하였고 준비된 포자현탁액이 함유된 교착물질(미강추출액 3 mL + 전분 33 g + 포자현탁액 7 mL)을 pH 3, 5, 7, 9, 11과 NaCl 1%, 3%, 5%를 각각의 세라믹볼과 혼합 표면처리한 후 거즈가 깔린 패트리 디쉬에 일정량 펼친 후 항온항습기(28℃, 40%)에서 12일간 배양하였다.
>
곤충병원성곰팡이의 천연제오라이트 세라믹볼 고체배지에서 대량 생산된 포자의 분리
천연제오라이트 세라믹볼 2 Kg 을 세척 후 121℃ 조건에서 30분 동안 멸균하였고 준비된 포자현탁액이 함유된 교착물질(미강추출액 60 mL + 전분 330 g + 포자현탁액 150 mL)을 pH와 NaCl을 조정하여 천연제오라이트 세라믹볼과 혼합 표면처리한 후 거즈가 깔린 petridish에 펼친 후 항온항 습기(28℃, 40%)에서 12일간 배양하였다. 배양 후 30℃에서 충분히 음건 시킨 후 포자분리 회수기(M-tech, 미상용제품)를 이용하여 물리적 방법을 통해 천연제오라이트 세라믹볼 표면에 붙어 있는 균체와 포자를 밀링커터기로 절단 후 사이클론 흡인방식에 의해 절단된 균체와 포자만을 회수하는 방법으로 포자를 회수하였다.
>
곤충병원성 곰팡이의 세라믹볼(천연제오라이트, 합성제오라이트, 천연활성탄)에서의 생육
세라밀볼 담체 종류에 따라
>
곤충병원성 곰팡이의 세라믹볼(천연제오라이트, 합성제오라이트, 천연활성탄)에서의 포자 생산
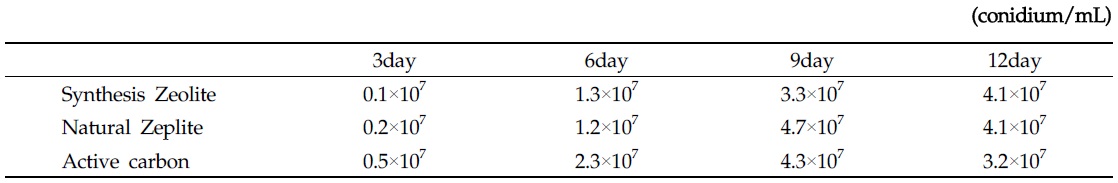
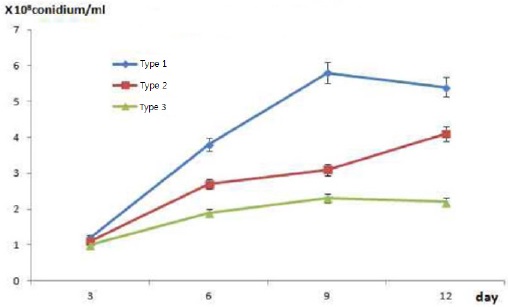
담체종류에 따른 곤충병원성 곰팡이의 생육 여부를 확인 후 담체에서 경시적 변화에 따른 최적 배양 시간을 조사하기 위해 각각의 담체를 배양 시기 별 포자의 생산량을 조사 한 결과 Table 2에서와 같이 각각의 담체별로 차이를 보이는 것으로 조사되었다. 천연제오라이트볼이 배양 9일이 되는 시기에 4.7×107 conidium/mL, 합성제오라이트볼은 0.1~4.1×107, 천연제오라이트볼은 0.2~4.7×107과 활성탄볼은 0.5~4.3×107 conidium/mL로 각각 조사되었으나,
[Table 2.] B. bassiana M130 spore count of growth in ceramic ball matrix
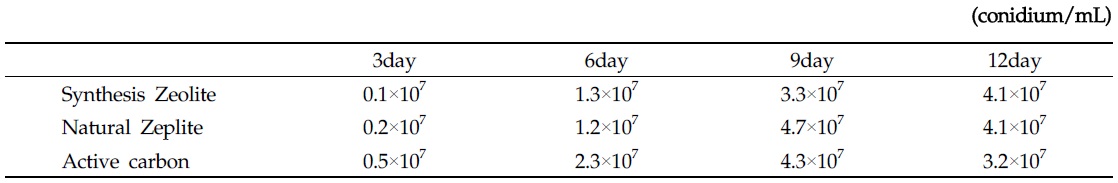
B. bassiana M130 spore count of growth in ceramic ball matrix
천연소재의 세라믹볼의 포자 생성능은 거의 비슷한 포자수가 확인 되었으며, 합성제오라이트 세라믹볼과 다소 차이를 보이는 것으로 조사되었다. 이러한 포자생성능 차이는 합성제오라이트 세라믹볼 경우 소성시 높은 온도(800℃ 이상)에 의해 합성물질인 벤토나이트, 규소, 고령토 성분(Mondragon
>
곤충병원성곰팡이의 세라믹볼 고체배지의 포자현탁액이 함유된 교착물질 내의 미강추출물에 따른 포자 생산
>
곤충병원성곰팡이의 천연제오라이트 세라믹볼 고체배지에 있어서 포자 유도 조절인자
천연제오라이트 세라믹볼을 이용하여
NaCl의 농도 조건에 따른 조사 결과 Fig. 5에서와 같이 5%의 염농도 조건에서 가강 많은 포자 4.8×108 conidium/mL을 생산하는 것으로 조사 되었다. 이러한 결과는
>
곤충병원성곰팡이의 천연제오라이트 세라믹볼 고체배지에서 대량 생산된 포자의 분리
포자 대량생산을 위해 천연제오라이트 세라믹볼 2 kg을 이용하여 최적화된 조건인 미강추출물 3 mL, 전분 33 g, 포자현탁액 7 mL, NaCl 5%를 세라믹볼 용량비율에 맞춰 증가시킨 후 pH 3으로 조정하여 온도 28℃, 습도 40%로 배양 후(Fig. 6), 사이클론회수 방법을 통한 포자회수 결과