



Seahorse Hippocampus abdominalis a marine teleost fish, has long been used as one of the essential materials in traditional Chinese medicine. However, the uses of seahorse have been limited due to its high cost, despite its beneficial biological activities. Seahorse has not been widely explored for its biofunctional properties and active components. In the present study, the enzymatic hydrolysates of seahorse were prepared by using two digestive enzymes (trypsin and pepsin) and five food grade enzymes (neutrase, protamex, alcalase, kojizyme, and flavourzyme). The enzymatic hydrolysates indicated higher hydrolysis yields than its water extract. Among them, the distilled water-pepsin hydrolysate (DP) which was obtained by distilled water extraction followed by pepsin hydrolysis, showed the highest yield and protein content as well as the highest alkyl radical scavenging activity. Also, it provided protective effects against oxidative stress induced by AAPH in vero cell and zebrafish. Further fractionation based on the molecular weight was carried out to identify it’s active components, and < 5 kDa (less than 5 kDa) molecular weight fraction was confirmed to have the highest antioxidant activity. In conclusion, this study suggests that DP of seahorse has antioxidant properties, and might be a novel and useful material from the marine origin for healthy functional foods and cosmetics.
해마는 실고기과에 속하는 경골어류로서 실고기목(Syngnathiformes), 실고기과(Syngnathidae)에 속하는 52속 215종 중에 해마속(Hippocampus) 어류 32종이 분류되며 열대에서 아한대의 광범위한 해역에 분포하고 있는 것으로 보고되어 있고, 이 중 70% 정도가 인도-태평양해역에 분포한다(Myers, 1979; Vari, 1982; Lourie et al., 1999). 우리나라에는 해마(
해마의 이전 연구에서 밝혀진 약학적 연구로는 항암(Zhu, 2005), 항노화(She et al., 1995; Zhang et al., 1994), 항혈전(Xu and Xu, 1997), 항관절염(Ryu et al., 2010a; Ryu et al., 2010b), 항산화(Chen et al., 2011; Qian et al., 2008), 발기부전 완화(Xu et al., 2003), 신경보호작용(Himaya et al., 2012)과 같은 많은 연구가 밝혀졌지만
이 연구에서 사용한 빅벨리해마(
본 실험에서 사용한 해마는 제주에 위치한 한국해수관상어종묘센터(CCORA)에서 약 20 cm 크기의 빅벨리해마(Fig. 1)를 제공 받았고, 동결건조 된 해마는 분쇄 후 사용되었다. 단백질 효소가수분해에사용된소화효소 2종(trypsin, pepsin)은 Sigma Chemical Co. (USA)에서 구입하였으며 식품용 가수분해 효소 5종(neutrase, protamex, alcalase, kojizyme, flavourzyme)은 Novozyme Co. (Denmark)에서 구입하였다. 2,2-azobis-(2-amidinopropane) dihydrochloride (AAPH), α-(4-Pyridyl-1-oxide)-N-tert-butylnitrone (4-POBN), 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), 2,7-dichlorofluorescein diacetate (DCF-DA), sodium dodecyl sulfate (SDS), dimethyl sulfoxide (DMSO), bovine serum albumin (BSA)는 Sigma-Aldrich (St. Louis, MO, USA)에서 구입하여 사용하였다. Pierce® BCA protein assay kit는 Thermo Scientific™ (Rockford, IL, USA)에서 구입하여 사용하였고 RPMI 1640 배지와 fetal bovine serum (FBS)는 Gibco/BRL (Canada)에서 구입하여 사용하였다. 이 밖에 모든 기타 시약은 분석용 특급시약을 사용하였다.
해마 건조 시료의 일반성분은 AOAC (Helrich, 1990) 방법에 준하여 측정하였다. 수분함량은 105℃ 건조기에 24시간 유지하여 측정하였으며, 회분은 직접회화법으로 회분기를 이용하여 550℃에서 3시간 동안 회화한 뒤 측정하였다. 조단백은 Kjeldahl 법으로 측정 하였으며, 조지방은 Soxhlet 추출법을 이용하여 측정하였다.
해마의 단백질 효소 가수분해물은 Ko et al. (2013)의 방법에 따라 제조되었고, 가수분해 효소 7종을 이용하여 해마의 효소적 가수분해물을 제조하여 물(distilled water, DW) 추출물과 비교하였다. 해마 동결건조물을 이용하여 효소 대 기질비를 1:100으로 하였으며, 각 효소별 최적온도 및 pH 조건에 따라 24시간 가수분해를 진행하였다. 한편 가수분해 수율을 높일 목적으로 DW 24시간 추출을 먼저 진행 한 후 pepsin과 trypsin을 각각 12시간 가수분해를 진행하여 DW-pepsin 가수분해물(DP)와 DW-trypsin 가수분해물(DT)를 추가적으로 제조하였다. 가수분해를 정지시키기 위해 100℃에서 10분간 효소의 반응을 불활성화시킨 후 pH를 7.0으로 조정해 주었다. 이 후 20분간 원심분리한 뒤 잔사를 제외한 상층액을 pore size 7 μm의 여과지를 사용하여 추출물을 여과하고 동결건조 후 분말화하여 최종적으로 7종의 단백질 효소가수분해물을 얻었다.
각 추출조건에 따른 효소가수분해물의 수율은 단백질 효소가수분해 후 얻어진 가수분해물 일부의 무게를 100℃ 드라이오븐에서 수분을 제거한 나머지 고형분 함량을 기준으로 수율을 측정하였다. 7종의 단백질 효소 가수분해물의 총 단백질의 함량은 Pierce® BCA protein assay kit를 사용하여 측정하였고, 단백질의 정량의 표준물질은 BSA를 사용하였다.
가수분해물들의 alkyl radical 소거능은 Kang et al. (2013)의 방법에 따라 측정하였다. 즉, 시료 20 µL, DW 20 µL, 40 mM AAPH 20 µL, 40 mM 4-POBN 20 µL를 혼합 후 37℃에서 30분간 반응시킨 다음 capillary tube에 옮겨 전자스핀공명; Electron spin resonance (JES-FA ESR, JEOL, Tokyo, Japan)을 사용하여 signal 값을 구하였다. 대조구는 시료 대신 용매인 DW를 사용하였으며 분석조건은 다음과 같이 하였다.
Power: 1 mW, Amplitude: 1000, Modulation width: 0.2 mT, Sweep width: 10 mT, Sweep time: 30 s, Time constant : 0.03 s
Vero cell은 10% FBS, 1% antibiotic을 포함하는 RPMI 1640 배지를 사용하여 배양 하였다. Cell culture flask에 적정농도로 37℃, 5% CO2 조건에서 세포상태에 따라 2-3일간 계대 배양하여 실험에 사용하였다.
시료에 대한 세포독성을 확인하기 위해 Ko et al. (2012)의 방법을 따라 MTT assay 방법으로 측정하였다. 먼저 Vero cells(1×105 cells/mL)으로 96 wellplate에 190 µL를 분주하고, 37℃, 5% CO2 조건에서 24시간 배양하여 시료들을 농도 별로 처리하였다. 이 후 37℃ 인큐베이터에서 24시간 배양하였으며 2 mg/mL 농도의 MTT를 50 µL처리하였다. 그리고 37℃에서 3시간 배양하고 형성된 불용성 결정을 dimethylsufoxide (DMSO)로 완전히 녹인 후에 빛을 차단시켜 12시간 보관 후에 ELISA reader를 사용하여 540 nm 흡광도에서 측정한 뒤 값을 구하였다.
산화적 스트레스를 유도하였을 때 해마 가수분해물에 의한 ROS 소거능을 확인하기 위해 Ko et al. (2012)의 방법을 따라 AAPH 자극을 주어 ROS의 변화를 측정하였다. 먼저 1×105 세포농도의 vero cells을 만들어 96 wellplate에 180 µL를 분주하였고, 37℃ 인큐베이터에서 24시간 배양하여 시료들을 농도별로 처리하였다. 이 후 37℃ 인큐베이터에서 30분 배양하여 4 mM AAPH 10 µL를 처리하였고, 37℃ 인큐베이터에서 30분간 반응시켜 0.05% DCF-DA 에탄올용액을 10 µL 처리하고 빛을 차단시킨 후 37℃ 인큐베이터에서 10분간 반응시킨 후 ELISA reader를 사용하여 측정하였다.
>
Vero cells에서 AAPH에 의한 산화적 손상에 대한 보호효과 측정
AAPH로 세포에 산화적 스트레스를 유도하였을 때의 해마 가수분해물의 보호효과에 대한 활성을 확인하기 위해 Ko et al. (2012)의 방법을 따라 AAPH 자극을 주어 시료처리에 대한 세포 생존력을 측정하였다. 먼저 1×105 세포농도의 vero cells을 만들어 96 wellplate에 180 µL를 seeding하였고, 37℃ 인큐베이터에서 24시간 배양하였으며 시료를 농도 별로 처리하였다. 이 후 37℃ 인큐베이터에서 1시간 배양하였으며 4 mM AAPH 10 µL를 처리하였다. 그 다음 37℃ 인큐베이터에서 24시간 배양하였으며 2 mg/mL 농도의 MTT를 50 µL 처리하였다. 이후 37℃ 인큐베이터에서 3시간 반응시키고, 37℃에서 3시간 배양한 후 형성된 불용성 결정을 DMSO로 완전히 녹여 빛을 차단시키고 12시간 보관 후에 ELISA reader를 사용하여 540 nm 흡광도에서 측정한 뒤 값을 구하였다.
대조구는 시료처리 없이 산화적 스트레스만 유도시킨 실험군과 산화적 스트레스를 유도시키지 않은 실험군으로 구분하였다.
>
Zebrafish embryo에서의 AAPH 산화 보호효과 측정
Zebrafish (
실험결과의 통계처리는 각각의 시료에 대한 평균±표준편차로 나타내었다. SPSS 프로그램(SPSS Inc. Ver. 12.0)을 사용하여 Oneway ANOVA-test를 실시하여 조사 항목들 간의 유의성 검증은 Turkey’s multiple range test로
해마의 일반성분 분석 결과는 Table 1에 나타냈으며, 수분, 회분, 조단백질, 조지방을 건조무게를 기준으로 확인하였다. 해마의 조단백질의 함량으로 58.47%을 확인하여 해마의 대부분이 조단백질로 이루어짐을 확인하였다.
[Table 1.] Chemical compositions of seahorse Hippocampus abdominalis
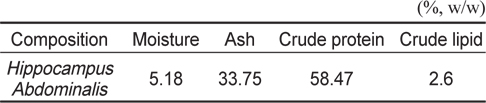
Chemical compositions of seahorse Hippocampus abdominalis
>
해마의 단백질 효소 가수분해물들의 수율 및 단백질 함량
단백질 가수분해 효소는 아미노산 또는 펩타이드 혼합물을 만드는 효소이며, 일반적으로 단백질 가수분해 효소를 이용해 시료를 가수분해 하였을 때 효소 양과 가수분해 시간에 비례하여 DW 추출물에 비해 높은 수율과 단백질 함량을 나타냄을 확인할 수 있다(Tsai et al., 2006). DW로 24시간 추출한 추출물의 수율은 1 g의 건조해마로부터 374.5±3.54 mg였으나, 7종의 단백질 효소 가수분해를 이용하여 효소 가수분해물을 제조한 경우, 증가된 수율을 확인할 수 있었다. DP에 경우 다른 단백질 효소 가수분해물에 비해 가장 높은 786.67±15.28 mg의 수율을 확인하였고, DT의 경우 이보다 낮은 520.00±25.17 mg의 수율을 확인할 수 있었다(Table 2). 식품용 가수분해 효소 5종을 이용한 효소 가수분해물에서는 전반적으로 높은 수율을 확인할 수 있었다. 이 중 DP와 대등하게 높은 수율을 보인 효소 가수분해물은 neutrase로 가수분해한 효소 가수분해물과 alcalase로 가수분해한 효소 가수분해물로 확인 되었으며, 각각 783.33±20.0 mg, 780.00±10.0 mg의 수율을 확인할 수 있었다(Table 2). 또한 동결건조된 해마 조시료 1 g으로부터 얻을 수 있는 총 단백질은 DW로 24시간을 추출한 추출물이 93.38±3.04 mg으로 확인되었으며, 그 외 모든 효소 가수분해물들에서는 DW로 24시간을 추출한 추출물 대비 약 2배 가량 높은 총 단백질을 얻을 수 있는 것으로 확인되었다(Table 2). 소화효소를 이용하여 가수분해한 효소 가수분해물에서는 DP 효소 가수분해물이 221.21±7.02 mg의 총 단백질을 얻을 수 있는 것으로 확인되었고, 식품용 가수분해 효소 5종을 이용한 효소 가수분해물에서는 전반적으로 높은 총 단백질을 얻을 수 있는 것으로 확인되었다(Table 2). 이와 같은 결과는 가수분해물의 수율이 높을 수록 단백질 함량도 높은 것이 확인되어 DW 추출물에 비해 수율과 단백질 함량이 높았던 DP와 DT, 식품용 가수분해 효소 5종에서 가수분해가 많이 진행되었고 그에 따라 많은 양의 저분자 펩타이드가 함유되어 있을 것으로 사료된다.
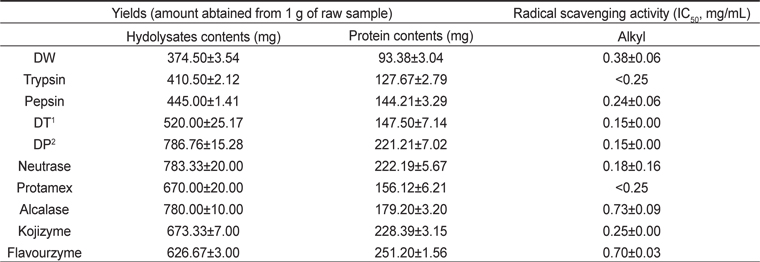
Yields and alkyl radical scavenging activity of enzymatic hydrolysates prepared from seahorse Hippocampus abdominalis by seven proteinases
>
해마 단백질 효소 가수분해물들의 Alkyl radical 소거능
Alkyl radical 소거활성에 대한 해마 단백질 효소 가수분해물들의 효과를 평가하였다. 이 중 우수한 활성을 가진 추출물의 IC50값(mg/mL)을 산출한 결과 DP가 0.15±0.00 mg/mL, DT가 0.15±0.00 mg/mL, Neutrase로 가수분해한 효소 가수분해물이 0.18±0.16 mg/mL으로 확인되었으며, DP와 DT가 전체 가수분해물 중 가장 우수한 alkyl radical 소거활성을 나타내는 것을 확인하였다(Table 2). 이 결과는 앞에 수율과 단백질 함량의 결과와도 관련이 있다. 수율과 단백질 함량이 높았던 DP가 활성 저분자 펩타이드의 양이 많이 함유한다는 것을 암시하며, 따라서 수율과 단백질 함량이 높고, alkyl radical 소거능이 우수한 DP를 이용하여 이후 실험에 사용하였다.
MTT assay 법은 MTT 시약이 세포 내로 흡수된 후 미토콘드리아의 숙신산탄수소효소(succinate dehydrogenase)에 의해 보라색의 불용성 포르마잔(formazan)을 형성하는데 이 물질의 세포 내 축적은 미토콘드리아의 활성, 넓게는 세포의 활성을 의미하므로 세포의 생장율 및 살아있는 세포수의 측정에 사용되는 대표적인 방법이다(Yang and Boo, 2013). DP의 세포 독성은 Fig. 2A에 나타내었다. 시료를 50 μg/mL, 100 μg/mL, 200 μg/mL의 농도로 각각 처리하여 독성이 없음을 확인하였고, 독성이 없는 농도를 이용해 4 mM AAPH로 산화적 스트레스를 유도하여 세포생존률을 확인하였다. DP는 농도의존적으로 AAPH 산화에 의한 세포 보호효과를 확인할 수 있었으며(Fig. 2B), AAPH로 세포에 자극을 주고 세포 내 AAPH 산화에 의한 ROS 생성 정도를 측정한 결과, 농도의존적으로 AAPH에 의한 세포의 ROS 생성을 줄여 주는 것을 확인하였다(Fig. 2C).
이와 같은 결과는 DP에 의해 다른 효소의 작용이나 생리적인 변화없이 단분자적으로 변성되는 AAPH 산화로 인한 세포 보호효과와 ROS 생성 감소로 항산화 활성이 있음을 시사한다. 단분자적으로 변성된 AAPH는 두 carbon radical과 질소로 분해되는데, 이 carbon radical은 다른 carbon radical과 다시 결합하여 안정적인 구조를 취하기도 하지만 대부분은 산소와 반응하여 peroxy radical을 생성하게 되며, 이 peroxy radical은 세포의 손상을 유발하고, 생체 내 단백질, 지질 등에 산화적 스트레스를 주는 요인으로 작용하게 된다(Niki, 1990).
>
DP 및 분자량 별 분획물의 SDS PAGE를 이용한 분석 및 각 분자량 분획물의 Alkyl radical 소거 활성
DP의 각 분자량 별로 분획물을 나누는 것은 각각 다른 크기의 한외여과막을 사용하여 나누었다. DP를 5 kDa과 10 kDa의 크기 막으로 가수분해물을 ≥ 10 kDa, 5-10 kDa, ≤ 5 kDa의 각 분획물로 분배하였고, Fig. 3A의 SDS-PAGE 전기영동 결과를 통해 해마 펩신 가수분해물과 가수분해물의 각 분자량별 분획물의 분자량 크기에 따라 다양한 밴드 패턴이 나타나 분자량별로 분획물이 잘 분리된 것을 확인하였다. 각 분획물들 중, ≤ 5 kDa 분획물이 가장 강한 alkyl radical 소거능을 확인할 수 있었고 IC50 값은 0.15±0.01 mg/mL으로 확인되었다(Fig. 3B).
이와 같은 결과는 DP의 각 분자량별 분획물 중 저분자 분획물에 뛰어난 alkyl radical 소거능이 확인되어 DP의 저분자 펩타이드가 활성을 나타냄을 제시한다. 다른 연구들에서도 이와 비슷한 결과들을 확인할 수 있었으며(Ko et al., 2012, Je et al., 2005, Ren et al., 2008, Zhao et al., 2009), 이들 연구에서도 저분자 분획물의 우수한 활성을 확인할 수 있다.
>
DP 분자량 별 분획물의 세포독성 및 AAPH에 의해 산화된 Vero cells의 보호효과
DP 분자량별 분획물들의 세포 독성은 Fig. 4A에 나타내었다. MTT assay를 통하여 세포생존율을 측정한 결과 ≥10 kDa, 5-10 kDa, ≤5 kDa의 각 분획물을 50 μg/mL, 100 μg/mL의 농도로 처리하였을 때, Vero cells에 대한 세포독성은 나타나지 않았다. 4 mM AAPH의 산화적 스트레스를 유도하였을 때 각 분획물을 50 μg/mL, 100 μg/mL의 농도로 처리하여 Vero cells에 세포생존률을 측정한 결과, Vero cells의 생존률이 농도 의존적으로 증가하는 경향을 확인하였다. 펩신 가수분해물이 저분자화 됨에 따라 세포생존률이 증가하는 경향을 확인하였고, ≤5 kDa의 Fration의 100 μg/mL 농도 처리에 의해 세포생존률이 77.17±2.12%로 증가하였다(Fig. 4B). 4 mM AAPH로 산화적 스트레스를 유도하여 분자량별 분획물을 50 μg/mL, 100 μg/mL 농도로 처리하였을 때, Vero cells에서 Total ROS 생성이 농도의존적으로 감소하는 경향이 확인되었고, ≤5 kDa의 분획물의 100 μg/mL 농도 처리에 의해 Total ROS 생성이 61.01±0.49%로 감소하였다. 또한 펩신 가수분해물이 저분자화 됨에 따라 ≤5 kDa의 분획물이 Total ROS 생성을 가장 많이 감소시키는 것을 확인하였다(Fig. 4C). 세포에서의 결과도 앞에 ESR을 이용한 alkyl radical 소거능 결과와 마찬가지로 저분자 분획물이 항산화 활성을 갖음을 확인했고, DP의 우수한 항산화 활성을
>
DP 5 kDa 이하 분획물의 AAPH에 의해 산화된 Zebrafish embryo의 보호효과
Zebrafish 모델은 다른 동물모델들에 비해 많은 이점들을 지닌다. 예를 들면, 작은 크기이고 투명한 embryo, 낮은 비용, 쉽게 다룰 수 있는 실험 모델로써 zebrafish는 약학 관련 연구에서 사전 독성평가나 유전기능의 연구형태 등으로 사용되어 아주 인기 있는
70% epiboly 단계의 zebrafish embryo에 15 mM AAPH의 산화적 스트레스를 유도하여 경과시간에 따른 zebrafish embryo의 생존율을 측정한 결과, 산화적 스트레스 유도 후 3시간이 경과하여 DP를 50,200 μg/mL 농도 처리했을 때 생존율이 농도의존적으로 증가하는 경향이 확인 되었으며, 24시간, 48시간, 72시간으로 경과함에도 이러한 경향은 유지되었다. 산화적 스트레스를 입지 않은 대조구와 산화적 스트레스를 입은 대조구를 비교하였을 때 200 μg/mL의 농도처리는 약 50%에 가까운 생존율을 유지시켜 주는 것으로 확인되었으며 이로부터 펩신 가수분해물의 ≤ 5 kDa 분획물이 AAPH로 유도된 산화적 스트레스로 인한 보호효과가 확인되었다. 이와 같은 결과는
따라서 본 연구에서는 해수관상어센터로부터 기증받은 빅벨리해마를 다양한 효소를 사용해 가수분해 하여 각 가수분해물의 수율, 단백질 함량과 alkyl 라디칼 소거능 측정을 통해 우수한 효소 가수분해물을 선정하여 기능성소재 응용가능성을 검토하였다. 효소 가수분해물 중 우수 효소 가수분해물인 DP는 Vero Cells에 대한 세포독성이 없이 농도의존적으로 ROS 생성을 감소시켰고, AAPH에 대한 산화반응을 억제 함으로서 항산화 효능을 가진다는 것을 확인하였다. DP를 한외여과막을 통해 각 분자량 별로 분획물을 나누고, alkyl 라디칼 소거능을 확인하였을 때, 저분자량인 ≤ 5 kDa의 분획물이 가장 우수한 라디칼 소거능을 보였고, vero cells에 대한 세포독성을 보이지 않는 농도들에서 농도의존적으로 ROS 생성과 AAPH에 대한 산화억제 효과를 보임으로 저분자량의 DP 분획물이 항산화 효능을 가진다는 것을 확인하였다. 또한, ≤ 5 kDa의 분획물은 AAPH가 감소시킨 zebrafish embryo의 생존율을 향상시켰다는 것을 확인하였다. 이 모든 결과로부터, 빅벨리해마 유래 DP 가수분해물은 항산화 효과를 가지며, 향후 기능성 화장품 소재나 식품으로 활용하기 위한 매우 효과적인 재료가 될 수 있다고 판단된다.







