최근 수산업은 무분별한 포획으로 인한 어족자원의 고갈로 생산량이 감소하고 있으며, 지속적인 생산량 감소는 잡는 어업에서 기르는 어업으로 구조적인 변화를 요구하게 되었고, 이로 인하여 연근해 양식업이 수산물 시장에서 차지하는 비율이 점점 증가하고 있다(Kim et al., 2008). 양식 수산업의 목적은 짧은 시간 내 최소한의 비용으로 최대 생산량을 획득하는 것이기 때문에 대부분 양식장에서는 양식생물을 고밀도로 사육하는 경향이 있으며, 이로 인하여 양식생물의 스트레스 증가와 사육환경의 오염 등에 의한 질병의 감염 기회 및 발생 빈도가 증가하고 있다(Kim et al., 2008; Kim et al., 2014).
1990년도 이후부터 양식수산생물의 대량 폐사가 매년 빈번하게 보고되고 있으며, 양식어민들은 이러한 피해를 줄이기 위하여 다양한 종류의 항생제 및 화학물질을 사용하게 되었다(Kim et al., 2014). 그러나 항생제의 잦은 사용은 오남용을 초래하고 이로 인하여 양식생물 체내축적 및 항생제 내성균주 발생 등 다양한 부작용이 발생하고 있다(Hill et al., 2009; Kim et al., 2014). 또한 항생제 사용은 약제 처리 가격 및 제반 인력 투입 등의 문제를 야기시켜, 전체 양식비용의 증가라는 악순환이 되풀이 되고 있다(Hill et al., 2009; Song et al., 2012; Kim et al., 2014). 따라서 많은 국가에서는 사료첨가제용 항생제를 전면 금지하고, 치료용 항생제의 사용을 엄격히 통제하고 있다(Hill et al., 2009; Kim et al., 2014).
최근에는 항생제를 대체할 수 있는 물질을 확보 및 개발하기 위하여 다양한 연구가 진행되고 있으며, 항생제 단점을 극복하기 위한 프로바이오틱스, phytobiotics, bacteriophage 및 효소제 등의 천연물 유래의 항균 물질개발 연구가 많이 보고되고 있다(Ravi et al., 2007; Tom et al., 2007; Aditya et al., 2008; Rijkers et al., 2011; Jeong et al., 2014; Reverter et al., 2014). 그러나 대다수의 천연물 유래 항생제 대체물질은 원료물질의 원활한 공급, 원료물질로부터 균일한 목적성분의 추출, 목적물질의 순수정제 및 유효성분의 유기합성 등에 어려움이 있으며, 이러한 문제점은 천연물 유래 항생제 대체재의 대량생산 또는 산업화를 가로막는 원인으로 알려져 있다(Jeong et al., 2014). 따라서 다양한 천연물 유래 항균물질 중에서 미생물이 생산하는 항균 물질 또는 원균의 독성 및 안전성만 검증 된다면 효과적으로 안정적 공급과 활용이 가능하기 때문에 중요성과 가치가 매우 높다(Jeong et al., 2014).
항균활성, 면역력 증가 등 숙주의 몸에 유익한 효과가 있는 균주들을 프로바이오틱스(probiotics)라고 하며, 다양한 연구를 통해 많은 종의 미생물이 밝혀졌고 산업적으로 이용되고 있다(Rijkers et al., 2011). 그러나 수산업에서 이용되는 프로바이오틱스의 경우 사람에게 사용하는 프로바이오틱스 종을 그대로 사용하거나, 육상에서 분리된 미생물을 주로 사용하고 있으며, 상용화된 미생물은 대부분 외국에서 수입하여 사용하고 있는 실정이다(Aditya et al., 2008). 따라서 육상 환경에서 분리한 균주나 외국에서 개발한 균주가 아닌 우리나라의 연근해 양식장 환경에 알맞은 토종 미생물의 분리 및 선정이 중요하며, 이를 위하여 본 연구에서는 우리나라 남해안 갯바위 지역에서 분리한 미생물들의 타당성을 검토해 보았다.
다양한 해양환경 중, 조간대에 포함되지 않는 갯바위(Rocks on the seashore) 지역에 존재하는 해수 웅덩이는 밤낮 기온변화 차가 크고, 해수 또는 빗물의 유입과 증발현상으로 인한 염분 농도 변화의 폭이 크며, 태양광에 바로 노출되는 등의 특징이 있어 특이한 환경 및 생태계 군집을 지닌 곳으로 알려져 있다(Margrét et al., 2014). 그러나 이러한 갯바위 지역에 존재하는 미생물에 대한 연구는 그 결과가 매우 부족한 실정이며, 분리된 미생물 중에서 항균활성을 갖는 균주에 대한 연구는 전무한 실정이다. 따라서 본 연구에서는 양식생물에 대량폐사를 유발하는 병원성 균주를 포함한 다양한 병원성 균주들에 대하여 항균 활성이 있는 유용한 미생물을 확보하였으며, 분리 균들의 동정을 통하여 미생물의 다양성과 항균 활성을 분석하여 국내 양식 환경에 적합한 항생제 대체재로의 개발 가능성을 검토하였다.
갯바위 지역 해수가 고인 웅덩이의 미생물을 수집하기 위하여 갯바위가 잘 발달한 남해안 일대의 갯바위에 존재하는 해수를 각각 채집하였다. 시료 채집을 위하여 수 주 동안 비가 오지 않고 풍랑이 거세지 않았던 날을 선택하였으며, 조간대 지역에 포함되지 않는 갯바위 위치에 고여 있어 외부 해수 유입이 적고 오랫동안 고립된 장소만을 선정하여 채집하였다. 수집한 해수시료는 무균상태에서 각각 marine agar (Difco, USA), R2A agar (Difco, USA), 1/10 marine agar (Difco, USA) 그리고 1/10 R2A agar (Difco, USA) 배지에 평판 도말 하였다. 각각의 시료를 도말한 평판배지는 20℃에서 배양하며 생겨나는 미생물 군락(colony)을 12시간 단위로 분석 및 분리 후 획선 평판법으로 순수 균체를 분리하여 각각의 액체 배지에 순수 배양하였다. 분리한 각각의 균주는 glycerol을 이용한 보존방법으로 −80℃에서 보관하며 분석하였다.
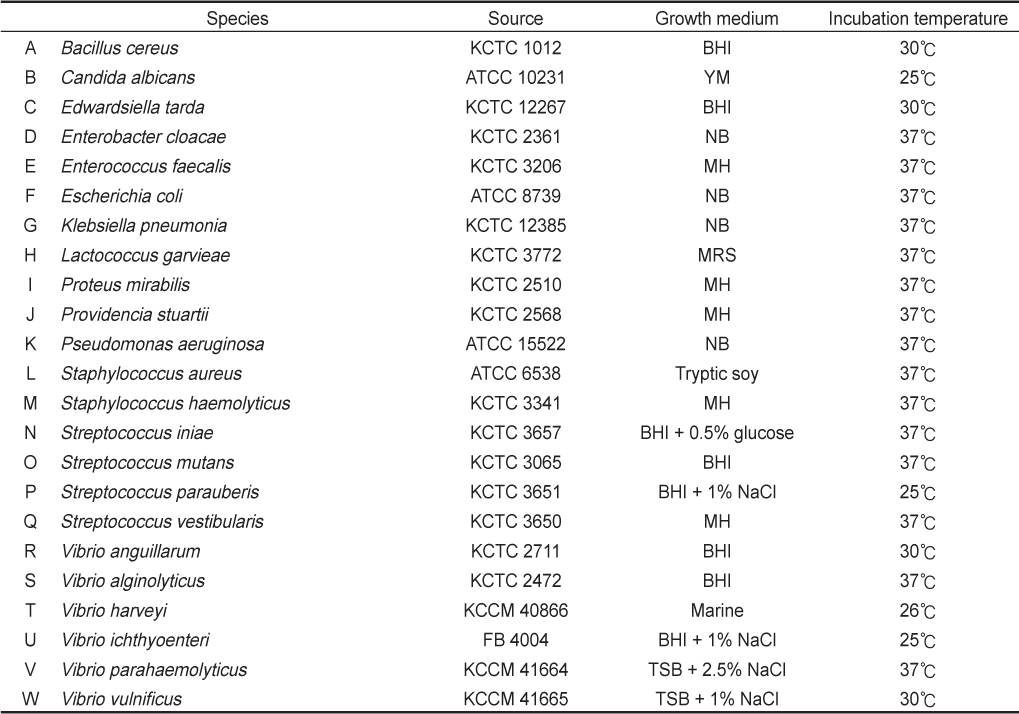
분리한 미생물은 순수 군락을 이루는지 확인한 뒤, 각각 분리한 액체배지에 접종하여 20℃에서 1-4일간 배양한 뒤 항균활성을 평가하였다. Table 1에 명기된 23종의 다양한 병원성 균을 피검균으로 하여 disc diffusion assay (Klancnik et al., 2010) 방법으로 갯바위 분리균주의 항균활성을 확인하였다. 23종의 병원성 균주들은 보고된 최적 액체배지에서 각각 배양한 후 600 nm에서 optical density (OD600 nm) 값 0.1로 희석하여 평판배지 위에 도말 하였고, 갯바위 분리균주들은 각각의 marine 또는 R2A 등의 분리된 액체배지에서 48시간 동안 20℃에서 배양한 뒤 paper disk (ADVANTEC, 8 mm)에 60 µL 흡수시켜 피검균이 도말된 평판배지 위에서 배양하여 항균활성을 측정하였다. 24 시간동안 피검균의 배양조건에서 배양 후 paper disk 주위에 생육저해로 인하여 생성되는 투명환의 유무와 직경의 크기로써 항균 활성을 평가하였다(8-12 mm: *, 12-16 mm: **, 16 mm 이상: ***). 그리고 10% acetic acid를 대조구로서 항균 활성을 비교 및 평가하였다.
[Table 1.] List of pathogenic bacteria species used in this study
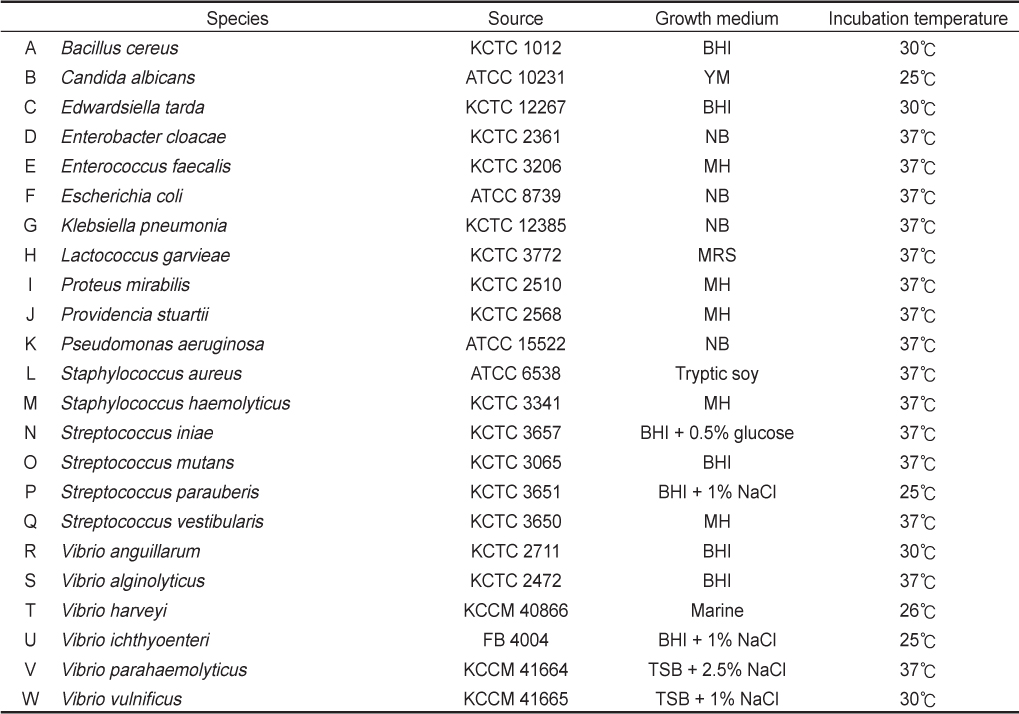
List of pathogenic bacteria species used in this study
갯바위에서 분리한 미생물 중 항균활성을 보이지만 용혈작용을 유발하는 물질을 생산하는지 밝히기 위하여 혈액한천평판배지(Micromedia Co. Ltd, Korea)을 이용하여 용혈활성의 유무 및 활성의 종류(type)를 평가하였다. 혈액한천평판배지에 구멍을 내고 분리한 미생물의 배양액을 떨어뜨리는 방법으로 분리 균주들이 알파(α), 베타(β) 또는 감마(γ) 용혈활성을 보이는지 평가하였다. 그리고 관찰된 항균활성이 분리미생물에서 생산된 유기산에 의한 활성인지를 평가하기 위하여 분리균주들의 배양액을 pH를 7-8 사이의 중성 값으로 보정 한 뒤 paper disk를 이용한 방법으로 항균활성의 여부 및 변화를 평가하였다.
>
항균활성 균주의 genomic DNA (gDNA) 추출 및 16S rDNA의 증폭
순수 분리한 균주들 중에서 피검균에 항균 활성을 보이는 균주만을 선별하여 marine 또는 R2A 등의 각각 분리된 액체배지에 접종하여 배양한 뒤 원심분리를 통하여 집균하였다. 수거한 균체들은 magnetic isolation kit (TNT, Japan)를 사용하여 충분히 lysis 시킨 후, 핵산추출자동화기기(MFX-6100, TOYOBO, Japan)을 이용하여 gDNA만을 순수하게 추출하였다. 추출한 gDNA는 분광광도계를 이용하여 순도 및 농도를 측정하였으며, Weisburg et al. (1991)의 방법을 통하여 균주의 동정에 필요한 16S ribosomal DNA를 증폭하였다(Weisburg et al., 1991). 순수 분리한 gDNA를 주형으로 27F forward primer (5'-AGAGTTTGATCCTGGCTCAG-3')와 1492R Reverse primer (5’-ACGGTTACCTTGTTACGACTT-3’)를 이용한 PCR을 수행하여 16S rDNA를 증폭하였다. PCR 증폭 반응의 mixture는 0.1 μg의 gDNA, 10 pM primer set, 2.5 mM deoxynucleoside triphosphate (dNTPs), 10X reaction buffer, ExTaq polymerase (Takara, Japan)와 distilled water로 최종 부피가 50 μL가 되도록 하였으며, 94℃에서 5분간 초기변성단계(initial denaturation)를 수행한 뒤, 94℃에서 1분간 변성(denaturation), 55℃에서 1분간 결합반응(annealing), 72℃에서 1분간 증폭반응(extension)을 30회 반복한 뒤 마지막으로 72℃에서 5분간 최종신장반응(final extension) 과정을 수행하였다.
>
분리균주 16S rDNA의 염기서열분석 및 다양성 분석
각 분리균주들의 16S rDNA 증폭반응 결과 유무와 정확한 크기를 확인하기 위하여 ethidium bromide (EtBr)를 포함하는 1% agarose gel을 이용한 전기영동을 통하여 PCR 반응산물의 유무와 증폭된 크기를 확인하였다. PCR 반응 결과물은 QIAquick PCR purification kit (QIAGEN, German)를 사용하여 증폭된 16S rDNA를 순수하게 분리 정제한 뒤 순도와 농도를 분석하였으며, 3130XL PRISM genetic analyzer (Applied Biosystems, USA) 염기서열분석 기기를 이용하여 16S rDNA 염기서열을 결정하였다. 각각의 16S rDNA 정보는 BioEdit sequence alignment editor (version 7.2.3)의 ClustalW multi alignment 분석 프로그램을 이용하여 획득하였으며, 염기서열 정보는 NCBI (National Center for Biotechnology Information)의 BLAST (Basic Local Alignment Search Tool) 검색을 통하여 가장 유사한 미생물종과 비교하여 분리한 항균활성 미생물들을 분석하였다.
>
갯바위 유래의 항균 물질 생산 미생물 분리 및 종 다양성 분석
남해안 지역 갯바위 유래 해수들을 수거하여 marine, R2A, 1/10 marine 및 1/10 R2A 평판배지에 각각 도말 후 배양하고, 배양된 각각의 미생물 군락들은 streaking과 peaking 과정을 수행하여 하나의 순수한 colony로 분리하였다. 순수 분리된 균주들은 액체배지에서 배양 후 paper disk법을 이용하여 23종의 병원성 피검균에 대한 생육저해 활성 여부를 관찰하였다. 또한 항균 활성을 보이는 균주들의 16S rDNA 정보를 해독하여 항균활성을 보이는 갯바위 유래의 해양 미생물 다양성을 분석하였다. Table 1에 명기한 병원성 균주들을 피검균으로 paper disk를 이용한 항균 활성 검사법을 통하여 64점의 분리균주가 항균물질을 생산함을 확인할 수 있었다. 64점의 분리균주를 산업적으로 활용하기 위하여 용혈활성과 같은 세포독성의 유무와 미생물이 생산하는 유기산 등으로 항균 활성을 보이는 효과를 평가하기 위하여 혈액한천평판 배지를 이용하여 베타 또는 알파 용혈 활성을 평가 하고, 배양액의 pH를 7-8사이의 값으로 보정하여 항균 활성을 관찰하였다. 그 결과 64점의 분리균주들 중에서 31점의 분리균주만이 알파 또는 베타 용혈활성을 보이지 않았고, pH 보정에 따른 항균 활성의 변화는 모든 분리균주에서 발견할 수 없었다. 특이하게도 분리균주들의 반수 이상이 용혈활성을 보였지만 배양액 대부분은 중성의 pH 값을 기록하여 분리균 중 유산균은 없음을 판단 할 수 있었는데 이러한 결과는 미생물 분리에 사용된 배지가 marine 또는 R2A 계열의 배지였기 때문에 수집한 샘플 내에 존재하는 유산균 계열의 미생물이 생육하기에는 적합한 조건이 아니기 때문이라고 판단된다.
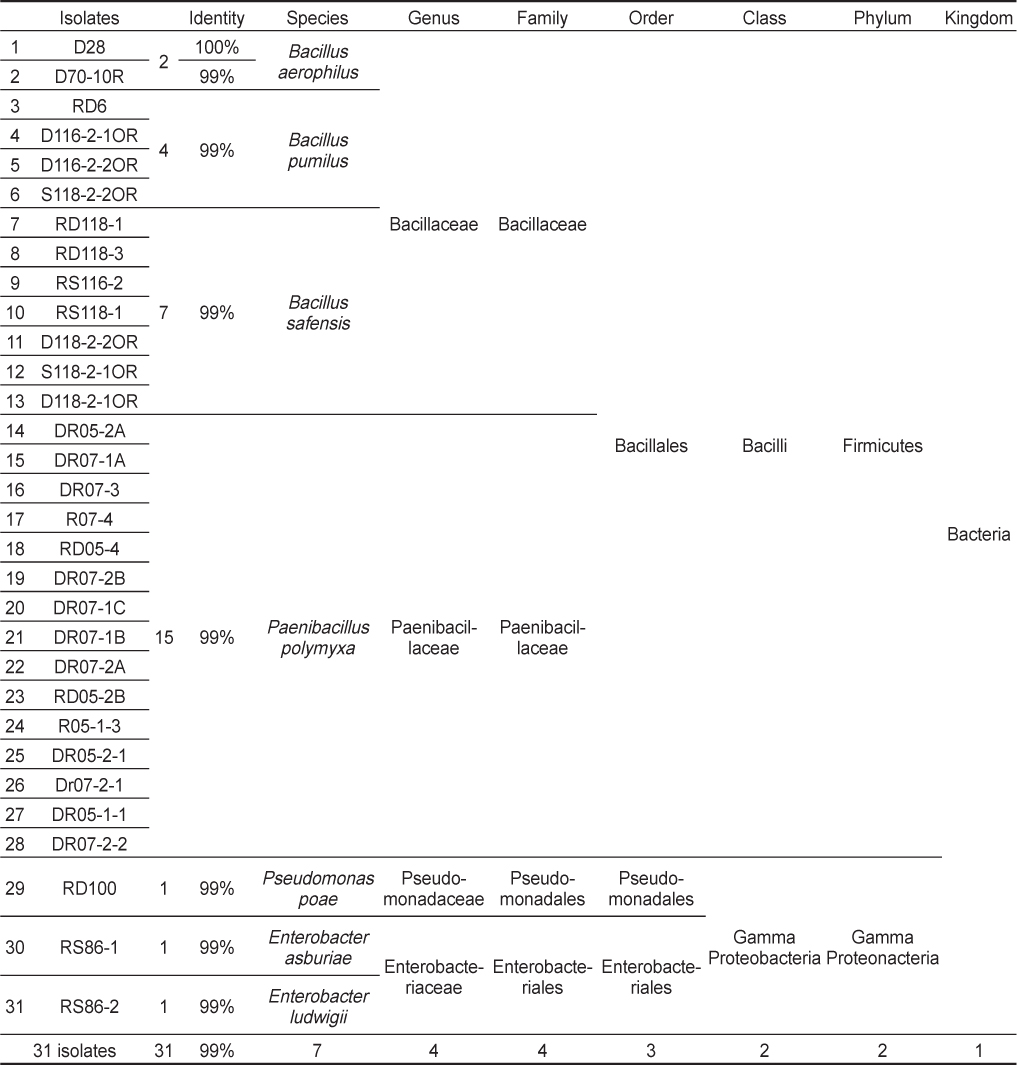
분리한 31점의 균주는 약 1.5 kbp 크기의 16S rDNA 염기서열분석을 통하여 4개의 속(genus)에 속하는 7종(species)의 미생물들과 가장 근연종들로 밝혀졌다(Table 2). 분리균들은
[Table 2.] List of isolated strains and results of BLAST search with 16S rDNA sequences
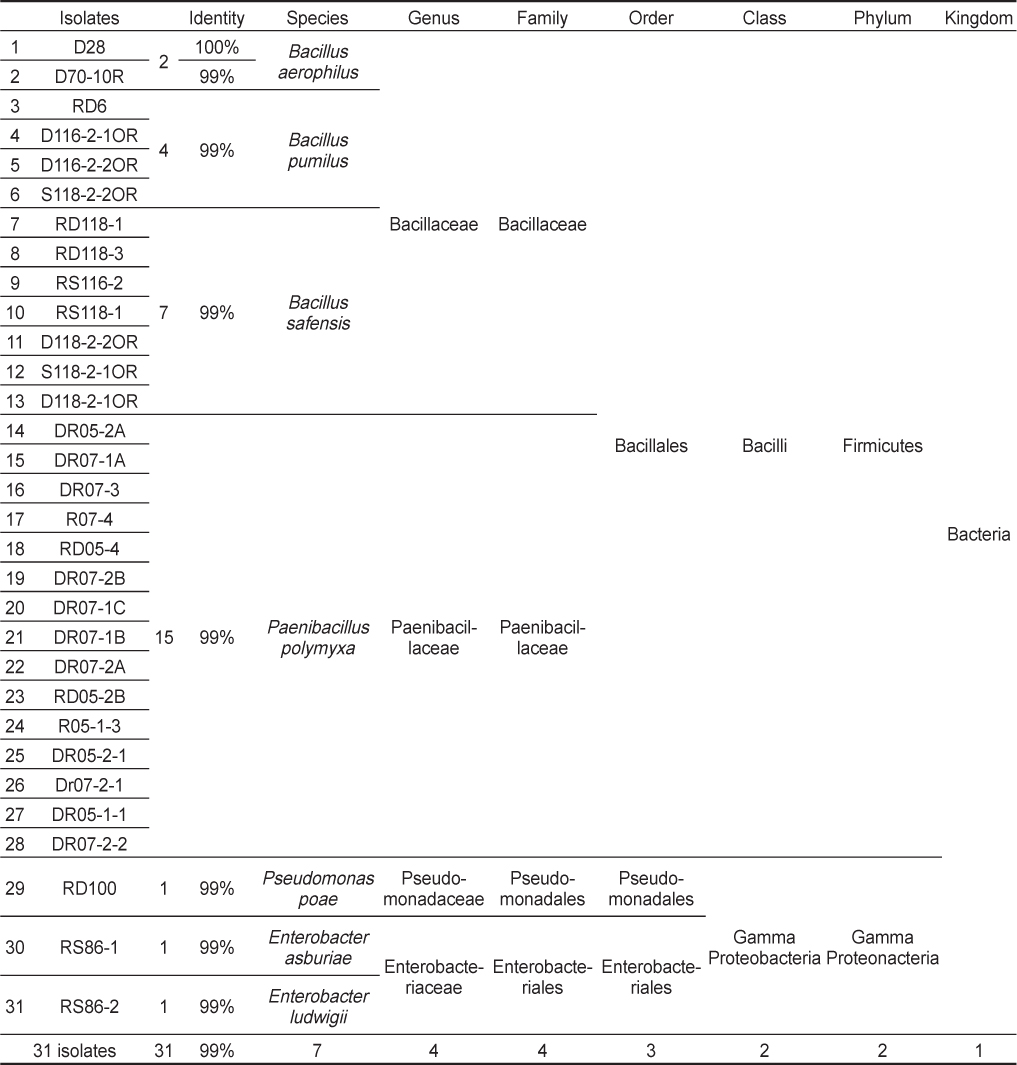
List of isolated strains and results of BLAST search with 16S rDNA sequences
본 연구에서 가장 많은 수의 분리균을 기록한
1/10 marine 배지에서는 단 하나의 균주를 분리할 수 있었으며, 16S rDNA의 유사도를 분석한 결과
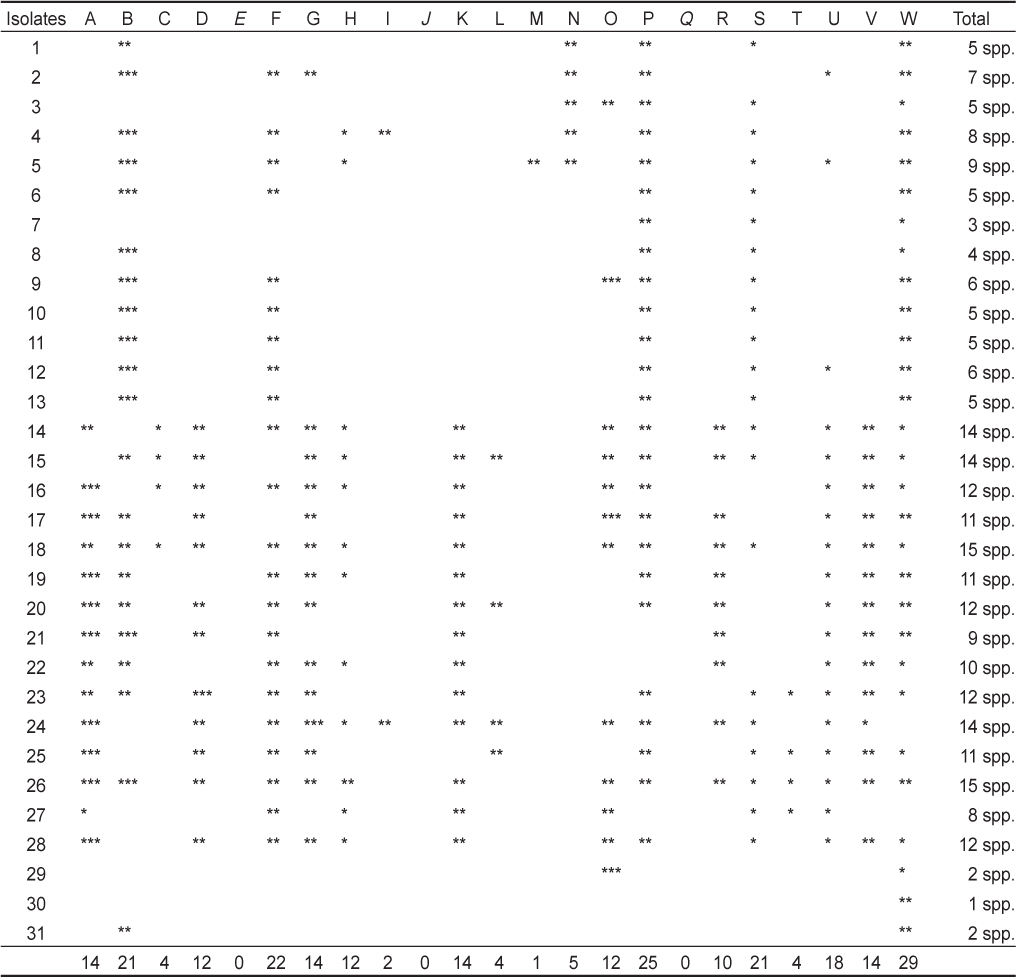
[Table 3.] Antibacterial activities of isolates against 23 pathogenic strains
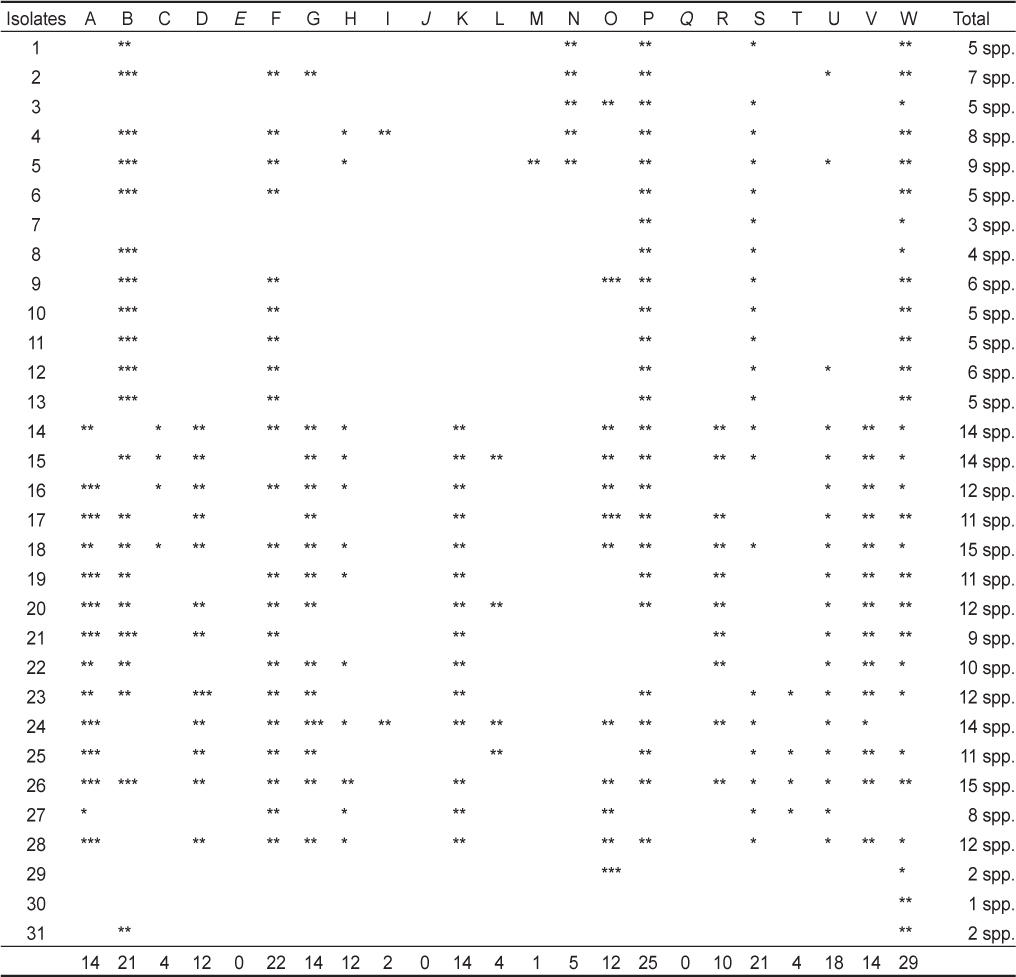
Antibacterial activities of isolates against 23 pathogenic strains
항균활성을 보이는 미생물 중
본 연구에서 분리한 두 종의
본 연구에서 분리된 항균활성을 보이는 균주들은
분리균주들의 항균활성은 대부분 2일 이상 배양해야만 관찰할 수 있었으며, 병원성 균주의 생육을 저해하여 생성된 투명환의 유무 및 크기를 통하여 분리균주의 항균활성을 평가하였다(Table 3). 그 결과
분리한 31점의 미생물 중에서
본 연구에서는 항균활성 범위가 좁은
항생제를 대체할 수 있는 물질을 탐구하기 위해서는 병원성 균주를 제어할 수 있는 미생물 또는 미생물이 생산하는 물질의 발견이 중요하다(Kim et al., 2008). 그리고 사용할 균주는 우리나라의 연근해 양식 환경에 알맞은 균주를 선별해야 하며, 양식생물의 장관 내에서 내산성, 정착성 및 적응력이 중요하다(Aditya et al., 2008; Hill et al., 2009). 또한 기존에 밝혀진 항균물질을 생산하거나 다양한 활용성이 보고되어 있어도 분리원과 항균 활성에 대한 평가가 다르다면 활용 가능성이 매우 크며, 본 연구에서 알 수 있듯이 항균활성의 범위가 다른 여러 균주들을 혼합하여 사용한다면 어병세균에 의한 대량폐사 등의 피해를 크게 줄일 수 있을 것으로 사료된다.
본 연구 등을 통하여 우리나라 수산양식 환경에 적합한 다양한 유용균주의 확보 및 평가가 지속적으로 수행되어야 할 것이며, 이러한 결과는 우리나라 실정에 맞는 항생제 대체용 미생물 유래 제어물질의 개발에 매우 유용한 결과 및 자료를 제공할 것으로 사료된다. 차후의 연구를 통하여 본 연구에서 분리한 균주들의 어류에 대한 안정성, 독성평가, 항균 메커니즘, 미생물학적 및 생화학적 분석 후 다양한 수산분야에 활용을 한다면 어류 병원성 균주들의 제어할 수 있는 항생제 대체제의 역할과 함께 사료효율 증가 등의 부수적인 다양한 효과를 얻을 수 있을 것으로 사료된다.