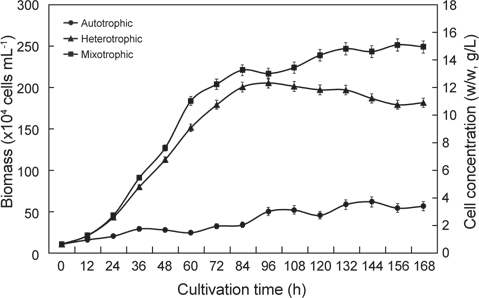
The quality and quantity of live food sources strongly influence the success of fish production in farming operations. Thus, critical studies of live forage species are a crucial element for progress in fish aquaculture. The fat content of food is an especially important determinant of growth in marine fish. Omega-3 highly unsaturated fatty acids (HUFA) are essential components of diet that determine the nutritional value of larval fish. Euglena is a protist that has potential as a forage species. These single-celled organisms have plant and animal characteristics they are motile, elliptical in shape and 15–500 μm in diameter. Their nutritional content is excellent, but most studies have focused on cells raised in autotrophic culture. We therefore examined differences in the lipid and fatty acid contents, and the growth of Euglena cells grown under autotrophic, heterotrophic, and mixotrophic conditions. Biomass production reached 15.03 g/L, 12.28 g/L, and 3.66 g/L under mixotrophy, heterotrophy, and autotrophy, respectively. The proportional n-3 HUFA content differed among culture methods: 10.04%, 5.80% and 10.01% in mixotrophic, heterotrophic and autotrophic cultures, respectively. Mixotrophy was to be the best form of cultivation for improving the growth and nutritional content of Euglena.
유글레나(euglenoids)는 직경 15-500 μm 크기의 나사선 모양으로 꼬인 길쭉한 방추형인데 매우 자유롭게 변형하며, 체내에 엽록체를 가지고 광합성을 하는 점으로 보아 식물에 속한다고 하지만, 세포벽이 없고 편모로 유영생활을 하므로 원생동물의 편모충류로 취급하기도 한다(Rodríguez-Zavala et al., 2010). 즉, 식물과 동물의 중간에 위치한다고 볼 수 있는데 엽록소를 가지고 광합성을 하는 것은 식물적 특성이며, 입이나 수축포를 가지고 자유롭게 움직이는 것은 동물적 특성에 속한다(Ruiz et al., 2004). 대부분 담수에서 살며 작은 연못이나 도랑에서 흔히 볼 수 있고 내만의 염수역에서도 볼 수 있다. 현재, 유글레나를 함유하는 조류에 의한 유용물질 생산의 가능성에 관해서 각종 산업계가 주목하고 있으며(Hayashi et al., 1994; Chisti and Yan, 2011), 유글레나 분말은 식품으로서의 실용화가 이미 수행되고 있으며(Choi et al., 2004), 고등식물에 비하여 석유화학 대체원료, 혹은 연료의 원료 등 유용물질을 고수율로서 생산할 수 있는 능력을 가지고 있다(Ishikawa et al., 2008; Lira-Silva et al., 2011). 또한 수많은 미세조류 중에서도 여러 분야에서 유용성이 기대되고 있는 유글레나는 광합성을 통해 대기 중 이산화탄소를 섭취해 고정하고 산소를 배출하므로 이를 이용한 하폐수의 영양염류 제거 및 회수된 바이오매스를 Bio-fuel로 생산하는 시스템 개발을 위한 연구가 진행되고 있다(Navarro et al., 1997; Ramalho et al., 1998; Tucci et al., 2006; Jasso-Cha´ vez et al., 2010). 현재 유글레나의 배양방법으로는 자가영양 배양방법과 타가영양 배양방법으로 이루어지고 있으나, 대부분의 배양방법은 자가영양(autotrophic) 배양방법이 주를 이루고 있다(Chae et al., 2006). 타가영양 배양방법은 제한적이기는 하지만, 유글레나는 자가영양배양과 타가영양배양이 모두 가능한 것으로 알려져 있다(Dos et al., 2007). 타가영양배양방법은 자가영양배양방법과 달리 광조사가 필요하지 않으며, 성장률이 높다는 장점이 있다(Regnault et al., 1995). 유글레나는 여러 가지 기능성물질을 생산하는 것으로 알려져 있으며, β-1,3 glucan으로 구성된 파라밀론(paramylon)은 천연플라스틱을 만드는 원료로도 사용되어지고 있다 (Barsanti et al., 2000ab; Choi et al., 2013). Vitamin E 를 포함한 영양소가 높기 때문에 식품첨가물로도 사용되고 있으며, 지질함량이 15-24% (dry weight)로 높기 때문에 바이오연료 생산에 관한 연구도 이루어지고 있다(Navarro et al., 1997). 유글레나 자체의 바이오매스(Biomass)는 일반적으로 식품(Food), 섬유(Fiber), 사료(Feed), 비료(Fertilizer), 연료(Fuel)의 순서로 부가가치가 높다(Rocchetta et al., 2006; Courchesne et al., 2009).
본 실험에 사용된 유글레나는 한국 해양미세조류은행으로부터
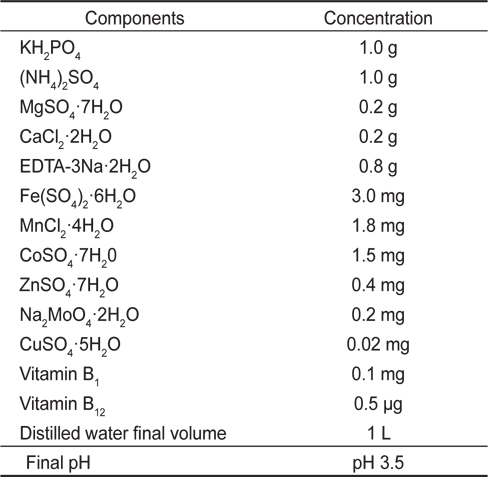
[Table 1.] Composition of Cramer-Myers (C&M)1 medium
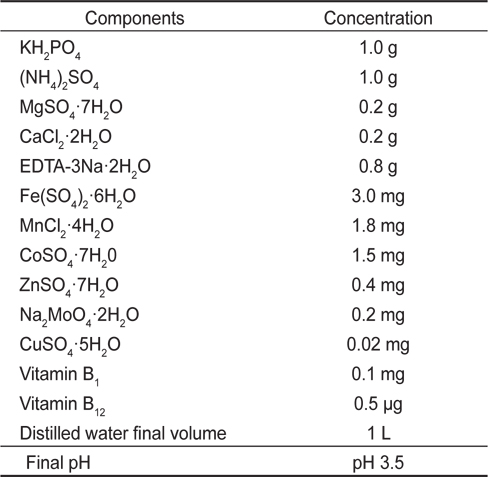
Composition of Cramer-Myers (C&M)1 medium
배양방법은 자가영양배양(Autotrophic culture), 타가영양배양(Heterotrophic culture) 그리고 혼합영양배양(Mixotrophic culture)으로 하였다. 자가영양배양방법은 1 L 둥근플라스크에 500 mL 용량으로 배양하였으며, 광주기는 18L:6D, 주간의 조도는 3,000 lx로 유지하였고, Air는 0.20 μm sterilized air filter (Advantec mfs, Inc., Japan)를 통해 공급하였다. 타가영양배양 방법은 500 mL 삼각플라스크를 이용하여 200 mL 용량으로 배양하였으며, 광주기는 0L:24D로 하였으며, 교반은 진탕배양기 (KSI-200L, Koencon Co., Ltd)를 이용하여 120 rpm으로 하였다. 혼합영양배양방법은 500 mL 삼각플라스크를 이용하여 200 mL 용량으로 배양하였으며, 광주기는 18L:6D, 주간의 조도는 3,000 lx로 유지하였다. 이 때 모든 실험구의 배양온도는 25±0.5℃로 유지하였다. 초기 접종밀도는 10×104 cells/mL로 7일간 3반복으로 배양하였고, 2회/일 동일한 시간에 Haemacytometer로 3회 반복 계수하여 평균 세포수를 측정계수하였으며, 배양이 완료된 배양액은 4℃의 고속원심분리기(UNION 32R, Hanil Science Industrial Co., Ltd. Korea)에서 3,000 rpm으로 25분간 원심분리한 후, 배양액은 버리고 세포만 회수하여 동결 건조하여 분석에 사용하였다.
총 지질 추출은 Bligh and Dyer방법(1959)에 준하였다. 비커에 균체 5 g을 취하여 세포분쇄기(homogenizer AM-12, Nihonseiki Kaisha Co. Ltd., Tokyo, Japan)에서 15,000 rpm로 5분간 분쇄한 후, Chloroform과 Methanol을 2:1로 혼합한 추출 용매를 시료의 2 배량 넣어 하루 동안 방치한 다음 chloroform 층만을 분리하기 위하여 둥근 플라스크 위에 깔때기를 놓고, 그 위에 Na2SO4를 넣어 서서히 chloroform층만 흘러내리게 하였다. 분리된 chloroform 층은 진공회전농축기(Rotavapor R-114, BUCHI)를 사용하여 40℃이하에서 용매를 완전히 증발시킨 후, 추출된 총 지질의 무게를 측정하였다. 모든 작업은 질소 기류 하에서 행하였다.
지질의 classes 는 TLC/FID와 Iatrorecorder TC-21 intergrator가 장착된 Iatroscan New MK-5 (Iatron Laboratory Inc., Tokyo, Japan)를 이용하여 분석하였다. 분석조건에서 공기의 유속은 2 L/min이며 detector 수소량은 160 mL/min으로, scanning speed는 0.30 cm/s로 하였다. 분석 과정은 먼저 Rod S-Ⅲ (0.9×150 mm, 석영봉 규산 코팅)를 5분간 수세한 후, 다시 증류수 10 mL로 헹군 다음 수분을 증발시키기 위하여 아세톤 10 mL로 씻고 50℃로 조정한 Rod-Dryer (TK-5 Iatron Lab. Inc., Tokyo, Japan)에서 5분간 건조시킨 후 Iatroscan내에서 수소염 이온화불꽃상에서 3회 이상 반복하여 유기물을 완전히 제거시켰다. Rod에 시료 1 μL를 Microdispenser (Drummond Scientific Co., Bromall, PA, USA)로써 점적하여 전개조 (NaCl로포화시킴)에서 10분간 포화시켰다. 전개용매는 n-hexane : diethyl ether : acetic acid = 97:3:1 (v/v)를 이용하여 약 10 cm까지 전개시킨 후, Rod를 전개조에서 꺼내고 Rod-Dryer에서 5분간 건조시켜서 Iatroscan으로 분석하여 지질 획분의 조성비를 구하고 그 함량을 산출하였다. 동정은 표품인 cholesterol ester, free fatty acid, triglyceride, cholesterol 및 phospholipid에 의하여 동정하였다.
지방산 methyl ester 유도체化는 시료 일정량과 내부표준물질(C23:0 methyl ester) 1 mL (1 mg)를 cap tube에 취하고, 0.5 N NaOH-methanol 용액 1.5 mL를 가하여 질소를 충진한 다음, 100℃에서 8분간 가열하여 검화하였다. 방냉 후 12% BF3-methanol 2 mL를 가한 후 tube의 뚜껑을 닫고, 100℃에서 11분간 가열하여 methyl화 하였다. 약 30℃로 냉각한 후 Iso-octane 1 mL를 첨가하고 30초간 vortex mixer로 혼합하였다. 즉시 3 mL의 포화식염수를 가한 다음 흔들어 방치하여 iso-octane층이 분리되도록 하였다. Iso-octane층을 시료 병(4 mL)에 옮긴 후, 다시 Iso-octane 1 mL를 첨가한 다음 흔들어 재추출하여 시료 병에 모으고 이를 지방산 methyl ester 시료로 하였다. 지방산 분석에 사용하는 GLC는 OmegawaxTM-320 fused-silica capillary column (30 m×0.32 mm×0.25 μm, i.d., Supelco Co., Bellefonte, PA, USA)를 장착한 Clarus 600 (Perkin Elmer Co. Ltd., USA)를 이용하였다. 분석조건으로 Column은 185℃에서 8분간 유지하고 3℃/min씩 230℃까지 상승시킨 후, 10분간 유지하였다. 이 때 주입기는 250℃, 검출기는 270℃ 그리고 carrier gas는 He (1.0 kg/cm2)을 사용하였다. 지방산의 분석은 동일조건에서 분석한 표준품의 ECL과 비교하여 동정하였고, 지방산 표준품은 14:0, 16:0, 18:1, 18:2, 18:3, 20:0, 22:1, 24:0 (Sigma Chemical Co., St. Louis, MO, USA)과 GC-MS로 동정된 menhaden oil을 사용하였다.
모든 자료는 SPSS (16.0) 프로그램을 이용하여 분산분석(one-way ANOVA)과 회귀분석(Regression Analysis)을 실시하여 Duncan's multiple range test (Duncan, 1955)로 평균간의 유의성(
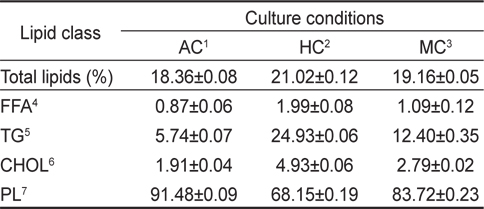
배양방법에 따른 총 지질의 변화는 Table 2에 나타낸 바와 같이 자가영양배양방법 18.36%, 타가영양배양방법 21.02%, 혼합영양배양 19.16%으로 타가영양배양방법이 자가영양배양방법에 비하여 총 지질의 함량이 높은 것으로 나타났다(
[Table 2.] Lipid classes in cells cultivated under different culture conditions
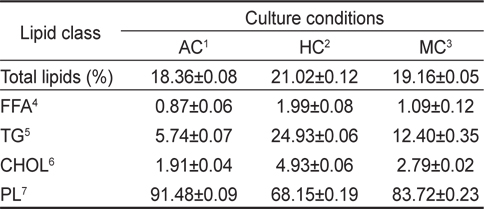
Lipid classes in cells cultivated under different culture conditions
비극성지질의 조성에서는 모든 실험구에서 triglycerols (TG)가 가장 높게 나타났으며 그 정도는 타가영양배양밥법 24.93%, 혼합영양배양방법 12.40%, 자가영양배양방법 5.74%의 순으로 나타났다(
배양방법에 따른
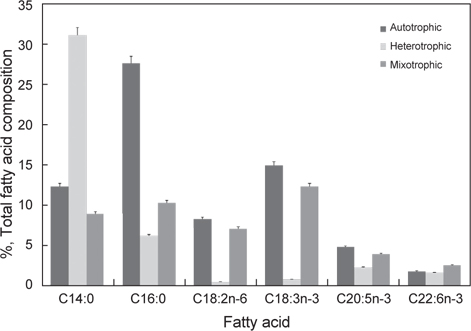
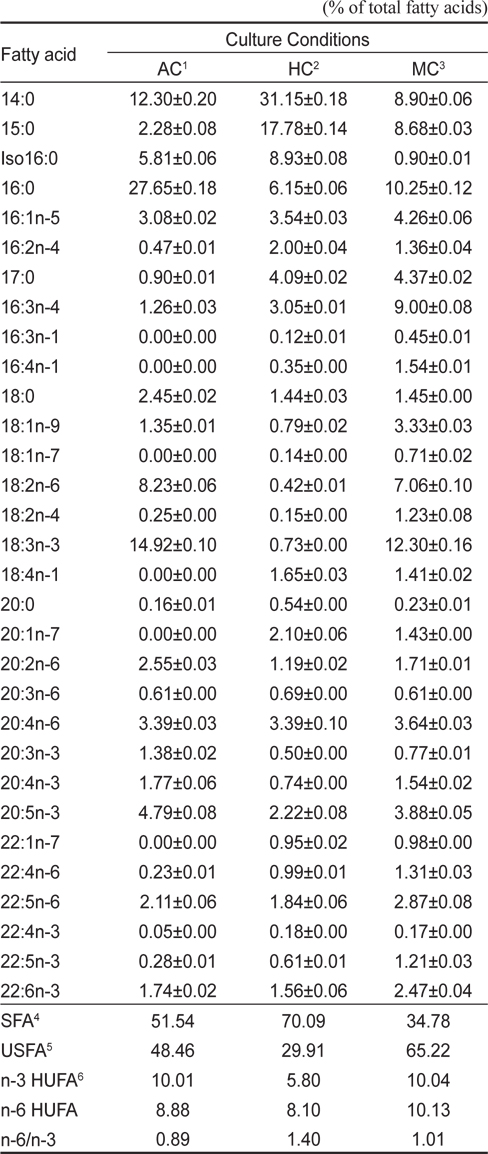
[Table 3.] Fatty acid compositions of Euglena gracilis grown in different culture conditions
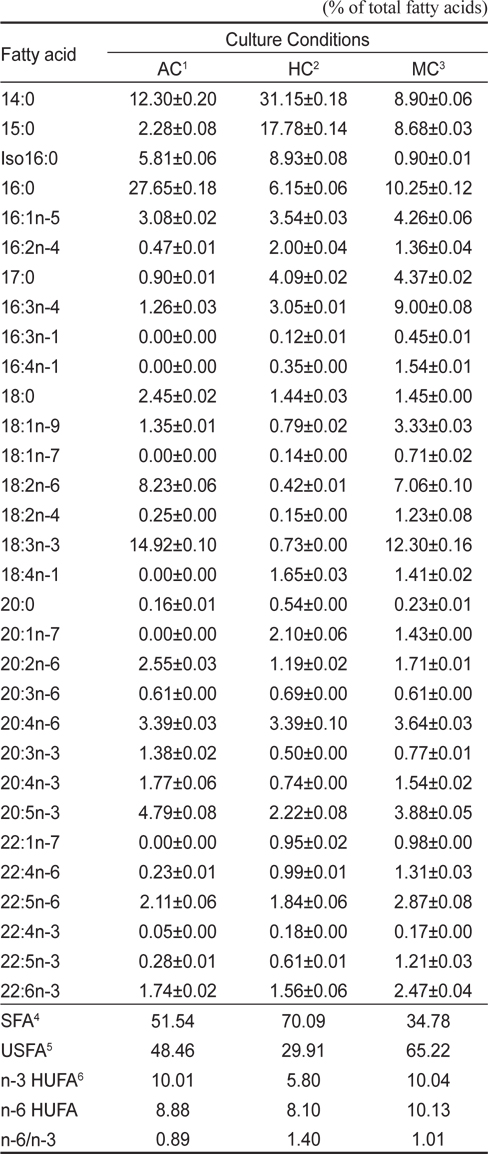
Fatty acid compositions of Euglena gracilis grown in different culture conditions
이상의 결과를 종합해 보면 유글레나의 지방산조성은 배양방법에 따라서 현저히 달라지는 특징을 나타낸다. 현재 미세조류의 분류 biomarker로서 지방산이 주요한 도구로 사용되고 있으며(Volkman et al., 1998), 유글레나조류는 엽록체의 유무를 기준으로 독립영양군과 종속영양군으로 구분된다. 녹색 유글레나류는 엽록체와 안점(stigma)이 있고, 광합성을 하며, 무색 유글레나는 오랜 진화적 역사를 통해 엽록체를 잃은 것으로 추정된다고 하였으나(Walne 1980), 이번 실험을 통해서 종에 따른 차이보다 광 조사의 유무에 따라 극성지질이 현저히 변동하므로 극성지질의 많은 부분을 차지하고 있는 엽록체의 생성의 차이로 종 분류하는 것은 문제점이 있는 것으로 사료된다. 이처럼 배양방법과 환경조건에 따라 지질 생합성 형태가 달라지므로(Coleman et al., 1988; Girotti 2001), 유글레나를 냉암소에서 starvation 시키면서 지속적으로 관찰한 결과 분류학적으로 중요한 엽록체나 파라밀론의 형태적인 변이가 일어나는 점에서(Kim and Boo, 1998; Watanabe and Suzuki, 2002) 향후 여기에 대한 세밀한 연구가 요구된다. 배양방법에 따른 지방산의 변동은 포화지방산의 경우 자가영양배양방법보다 타가영양배양방법에서 높은 함량을 나타내는 반면에 Σn-3 HUFA의 경우에는 타가영양배양보다 자가영양배양과 혼합영양배양에서 높게 나타났다(