We investigated physiological changes in the freshwater cichlid, fish Maylandia lombardoi in response to different calcium concentrations in rearing water. Four different calcium concentrations (0, 2, 4 and 8 mM) were prepared in rearing water by the addition of ionized calcium (CaO) to examine the effect of various calcium concentrations in rearing water on physiological changes in the cichlid fish, M. lombardoi. Total calcium concentrations in plasma and body increased in a calcium concentration-dependent manner and reached the maximum at 8-mM calcium concentration. Stress-related cortisol was significantly decreased in the 8-mM group compared to the control group (0 mM). Lysozyme activity also significantly decreased in the 8-mM group. These results suggest that CaO in rearing water increases calcium uptake in fish and affects the body by decreasing stress and improving immunity in fish.
칼슘이온은 다양한 생리학적 시스템의 중요한 구성요소이며, 생명체의 기능과 생존을 위해 매우 중요한 역할을 담당한다(Herberger and Loretz, 2013). 경골 어류의 주요 칼슘흡수 기관은 아가미이며, 아가미에 존재하는 염류세포가 세포 내 칼슘수송을 조절하는 역할을 하는 것으로 알려져 있다(Payan et al., 1981; Perry and Flik, 1988; Perry et al., 1992). 어류는 성장과 번식을 위하여 지속적으로 수중에 존재하는 칼슘을 섭취하며, 담수어의 경우 사육수 또는 먹이와 같은 주변 매개체로부터 칼슘을 획득하여 혈중 칼슘량을 약 2-4 mmol로 유지한다(Flik and Verbost, 1993).
일반적으로 수중에는 충분한 양의 칼슘이 녹아있으며 어류는 살아가는 동안 필요한 양의 칼슘을 수중으로부터 체내로 흡수하는 것으로 알려졌으나 아메리칸 시클리드(
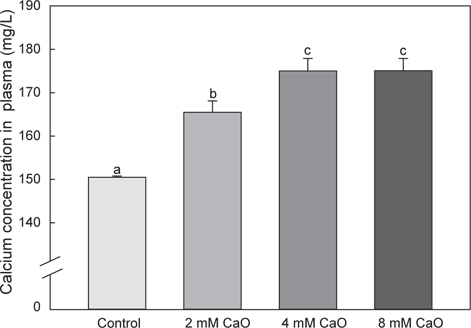
경골 어류는 체내 칼슘량의 약 95%가 뼈와 비늘에 포함되어 있는 것으로 알려졌으며(Flik et al., 1986), 담수어의 경우 금붕어(
따라서 본 연구에서는 사육수 내의 칼슘 농도에 따른 변화를 관찰 하기 위하여 담수어인 시클리드(
칼슘 농도가 다른 환경수에서 사육한 실험동물의 생리적 변화를 관찰하기 위하여 인공적으로 사육수를 제조하여 실험에 사용하였다. 사육수 제작은 Chen et al. (2003)의 연구를 참고하여 1차 증류수에 MgSO4, NaCl, K2HPO4, KH2PO4 및 CaO를 각각 첨가하여 제조하였다. Ca2+이 첨가된 실험군은 총 세 그룹으로 22 L의 사육수 안에 CaO를 2 mM, 4 mM 및 8 mM의 농도로 첨가하여 실험에 사용하였다. 모든 그룹의 Mg2+, K+ 및 Na+은 동일한 양으로 각각 첨가하였으며(Mg2+, 0.1 mM; Na+, 0.5 mM; Ka+, 0.02 mM), control군은 Ca2+을 첨가하지 않았다.
본 연구에 사용된 실험어는 대만에서 종묘 생산된 4-6개월령 시클리드(
어체 내 총 칼슘 함량 측정을 위하여 실험종료 후 각 그룹당 6 마리의 실험어를 무작위로 선별하여 실험어의 두부 신경을 빠르게 절단한 뒤, −80℃에 동결하였다. 이후 동결 건조기(PVTFD 10A)를 이용하여 건조 후 분말 형태로 분쇄하였다. 이후 분쇄된 샘플 각각 0.2 g을 질산 10 mL와 과산화수소(electronic grade) 1 mL를 사용하여 PTFE digestion vessel에 옮긴 뒤, 100–180℃에서 가수분해 시켰다. Blank solutions으로는 10 mL 질산과 1 mL 과산화수소를 혼합하여 사용하였다.
칼슘분석은 Agilent 7700s ICP-MS (Agilent, USA)를 사용하여 측정하였다. 무선주파수는 1500 W로 설정하였으며, 아르곤 가스의 속도는 0.5 L min1−1로 조정하였으며, 데이터 수집은 Agilent mass hunter software for ICP-MS (Version A.01.02)를 사용하여 실시하였다.
사육 실험 종료 후, 각 그룹당 14마리의 실험어를 2-Phenoxy-Ethanol 200 μL/L를 이용하여 3분 동안 마취 후, heparine을 처리한 1 mL 주사기를 이용하여 미부 정맥에서 혈액을 채혈하였다. 이후 3,000 g에서 3분간 원심분리 후, 상층액을 분리하여 −80℃에서 동결하여 분석 전까지 보관하였다.
혈액 내 칼슘 함량 분석은 자동 분석기용 Ca2+ 측정용 시약(아산제약)을 사용하여, 제조사의 분석 방법에 따라 생화학 분석기(CH 100 PLUS)로 측정하였다.
칼슘이 스트레스 호르몬인 cortisol에 미치는 영향을 확인하기 위하여 혈액 내 cortisol분석을 시행하였다. Cortisol 분석은 cortisol kit (R&D system)에 포함된 시약들을 사용하여 제조사의 분석 방법에 따라 진행되었다. 우선 RD5-43을 이용하여 혈액샘플을 400배 희석 시킨 뒤, conjugation 시약을 50 μL 첨가한 후, antibody를 50 μL 분주하여 2시간 동안 상온에서 shaking (300 rpm)하며 반응 시켰다. 이후 plate를 wash한 후, 발색 시약인 color regent를 200 μL씩 각 샘플에 첨가하여 빛을 차단한 상태에서 30분간 반응 시켰다. 이후 반응을 멈춰주는 stop solution을 50 μL첨가한 뒤 ELISA (enzyme-linked immunosorbent assay) reader를 이용하여 450 nm에서 측정하였으며, Soft max pro 프로그램을 이용하여 분석하였다.
칼슘이 비특이적 면역계인 lysozyme활성에 미치는 영향을 확인하기 위하여 lysozyme 분석을 실시하였다. 각 실험군의 혈청 15 μL를 96 well plate에 분주한 후 150 μL
모든 분석 결과는SPSS version 21 (SPSS Inc., USA)을 활용하여 통계적 분석을 실시하였다. One-way ANOVA-test로 통계 분석 하였으며, 데이터 값의 유의차는 Duncan’s multiple test 사후분석을 실시하였다. 모든 통계 결과 값은
본 연구에서는 수용성 칼슘인 CaO를 이용하여 사육수 내에 인공적으로 칼슘 농도를 조절하였을 때 시클리드(
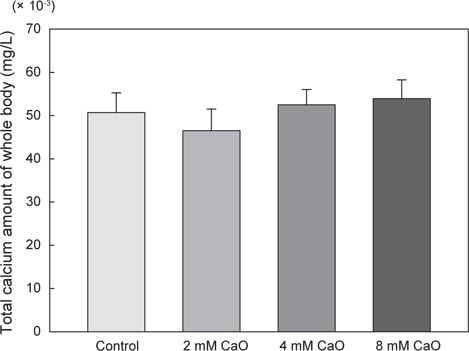
어체 내 총 칼슘 함량의 변화를 측정한 결과, control군에서의 총 칼슘 함량은 50.71±4.5 mg/L이었으며, 2 mM 칼슘 첨가 실험군에서는 46.52±4.98 mg/L, 4 mM 칼슘 첨가 실험군에서는 52.5±3.54 mg/L, 8 mM 칼슘 첨가 실험군에서는 53.92±4.36 mg/L로 8 mM칼슘 첨가 실험군에서 가장 높은 수치를 나타내었으나 각 그룹간에 유의적인 차이는 없었다(Fig. 1,
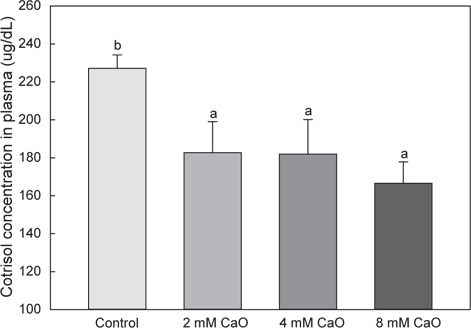
스트레스를 받은 어류의 경우 혈중 cortisol 분비가 증가 되기 때문에 스트레스 평가지표로서 주로 cortisol이 사용되어지고 있다(Barcellos et al., 1999; Nakano et al., 2013; Wendelaar Bonga, 1997). 일반적으로 어류는 수중에 살고 있기 때문에 다양한 스트레스 요인들에 항상 노출되어 있으며, 스트레스는 어류의 생리기능에 변화를 주어 면역기능을 저하시키는 것으로 알려졌다(Espelid et al., 1996; Pickering, 1998). 그러나 스트레스를 주지 않으면서 어류를 취급하는 것은 매우 어렵기 때문에 최근에는 어류의 스트레스 자극 최소화 및 안정화 유도에 관한 연구가 진행되고 있다(Volpato and Barreto, 2001).
칼슘은 체내의 항상성을 유지시켜주는 물질로서, 스트레스를 받을 경우 체내의 칼슘 항상성에 불균형이 초래되며 이로 인해 항산화 스트레스 및 세포사멸을 가져오는 것으로 알려졌다(Ermak and Davies, 2001). 따라서 본 연구에서는 칼슘이 어체 내 스트레스에 미치는 영향을 파악하기 위해 cortisol 분석을 실시하여 그 변화를 비교하였다. 본 실험 결과 칼슘이 첨가되지 않은 control군의 경우 227.14±7.11 μg/dL, 2 mM칼슘 첨가 실험군에서 182.66±16.41 μg/dL, 4 mM 칼슘 첨가 실험군에서 182.00±18.13 μg/dL 그리고 8 mM 칼슘 첨가 실험군에서 166.54±11.31 μg/dL으로 나타나 모든 칼슘 첨가 실험군에서 control 군에 비해 유의적으로 낮은 수치를 나타내었다(Fig. 3,
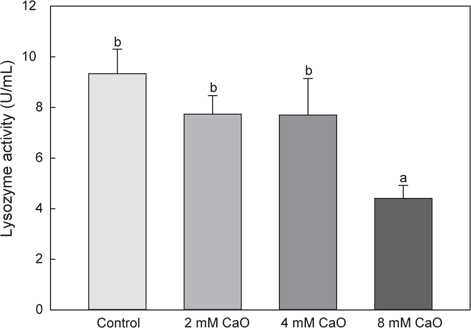
혈액 내의 lysozyme activity의 변화는 control군의 경우 9.33±0.97 U/mL으로 나타났으며, 2 mM칼슘 첨가 실험군에서는 7.73±0.73 U/mL, 4 mM칼슘 첨가 실험군에서는 7.7±1.44 U/mL 그리고 8 mM칼슘 첨가 실험군에서는 4.4±0.52 U/mL로 각각 나타났다(Fig. 4). Lysozyme은 외부 물질에 초기 방어역할을 하고 비특이적 면역활성을 하는 것으로 알려진 비특이적 면역계로, 그 중 어류에 존재하는 lysozyme으로 알려진 calcium-binding lysozyme (c-type lysozyme)은 칼슘과 결합하는 특징을 가지고 있다(Saurabh and Sahoo, 2008). 이전의 보고에 따르면, 무지개송어(
이상의 연구 결과를 요약해보면 수중 환경에서의 CaO가 담수어인 시클리드(