Residual organochlorine pesticides (OCPs) are chemical substances that persist in the environment, bioaccumulate through the food web, and pose a risk of causing adverse effect to human health and the environment. They were designated as persistent organic pollutants (POPs) by Stockholm Convention. Greenhouse strawberry is economic crop in agriculture, and its cultivation area and yield has been increased. Therefore, we tried to investigate the POPs residue in greenhouse soil and strawberry.
Extraction and clean-up method for the quantitative analysis of OCPs was developed and validated by gas chromatography (GC) with electron capture detector (ECD). The clean-up method was established using the modified quick, easy, cheap, effective, rugged, and safe(QuEChERS) method for OCPs in soil and strawberry. Limit of quantitation (LOQ) and recovery rates of OCPs in greenhouse soil and strawberry were 0.9-6.0 and 0.6-0.9 μg/kg, 74.4-115.6 and 75.6-88.4%, respectively. The precision was reliable sincerelative standard deviation (RSD) percentage (0.5-3.7 and 2.9-5.2%) was below 20, which was the normal percent value. The residue of OCPs in greenhouse soil was analyzed by the developed method, and dieldrin, β-endosulfan and endosulfan sulfate were detected at 1.6-23, 2.2-28.4 and 1.8-118.6 μg/kg, respectively. Those in strawberry were not detected in all samples.
Dieldrin, β-endosulfan and endosulfan sulfate in a part of investigated greenhouse soil were detected. But those were not detected in investigated greenhouse strawberry. These results showed that the residue in greenhouse soil were lower level than bioaccumulation occurring.
잔류성유기오염물질(POPs, persistent organic pollutants)은 독성, 생물농축성, 잔류성 및 장거리 이동성으로 인하여, 이들의 감소를 목적으로 지정 물질의 제조, 사용, 수×출입 금지 또는 제한하는 스톡홀름 협약이 2001년 5월에 채택되어 2004년 5월에 발효되었다. 우리나라는 2007년에 이를 비준하여 현재 잔류성유기오염물질 관리법에 의해 POPs 물질을 관리하고 있다(Shin 등, 2010). 현재 POPs로 지정된 것은 22종으로 이들 중 polychlorinated dibenzodioxins (PCDDs), polychlorinated dibenzofurans (PCDFs), polychlorinated biphenyls (PCBs), hexachloro benzene (HCB), aldrin, dieldrin, endrin, mirex, heptachlor, chlordane, dichloro diphenyl trichloro ethane (DDT), toxaphene 등 12종이 2004년 발효 당시 POPs로 지정되었다(Rodan
이들 중 HCH, aldrin, dieldrin, endrin, heptachlor 및 DDT는 1950-1960년대에 농경지에 살충제 농약으로 광범위하게 사용되다(Namiki
장미과에 속하는 딸기는 전세계적으로 중요한 원예작물의 하나로 시설재배 농가의 주요 소득 작물로 자리하고 있다 (Park
잔류성유기염소계 농약 α-hexachloro cyclohexane (α-HCH, purity 98.0%), β-HCH (purity 97.7%), γ-HCH (purity 99.0%), δ-HCH (purity 98.5%), hexachloro benzene (purity 99.5%), heptachlor (purity 98.5%), heptachlor epoxide (purity 98.5%), aldrin (purity 99.0%), dieldrin (purity 98.3%), endrin (purity 99.0%), α-endosulfan (purity 97.0%), β-endosulfan (purity 99.5%), endosulfan sulfate (purity 98.5%), 2,4-dichloro diphenyl dichloro ethylene (DDE, purity 97.0%), 4,4-DDE (purity 98.5%), 2,4-dichloro diphenyl dichloro ethane (DDD, purity 99.5%), 4,4-DDD (purity 99%), 2,4-dichloro diphenyl trichloro ethane (DDT, purity 98.0%) 및 4,4-DDT (purity 98.0%)는 Dr. Ehrenstorfer GmbH (Augsburg, Germany)로부터 구입하였고, 시료 전처리를 위한 activated carbon, magnesium sulfate, sodium chloride 및 sodium citrate는 Sigma-Aldrich (Saint Louis, USA), Q-sep® QuEChERS dSPE Tube (150 mg magnesium sulfate, 50 mg primary secondary amine, 50 mg C18, 2mL, Pennsylvania, USA)는 Restek 제품을 사용하였다.
토경으로 재배되고 있는 딸기 시설재배지의 토양 및 작물시료는 우리나라 딸기 주산지인 전라남도 담양군과 충청남도 논산군에서 각각 27과 33점을 채취하였다. 토양시료는 토양시료채취기를 이용하여 10 cm 깊이로 10개 지점에서 각각 100-200 g 채취하여 혼화한 다음 500 g 정도를 취하여 음건하고, 2 mm 체를 통과시켜 분석 시료로 사용하였다. 작물시료는 10개 지점에서 100-200 g 채취한 다음 1 kg을 믹서기로 분쇄하여 혼화한 후 분석시료로 사용하였다.
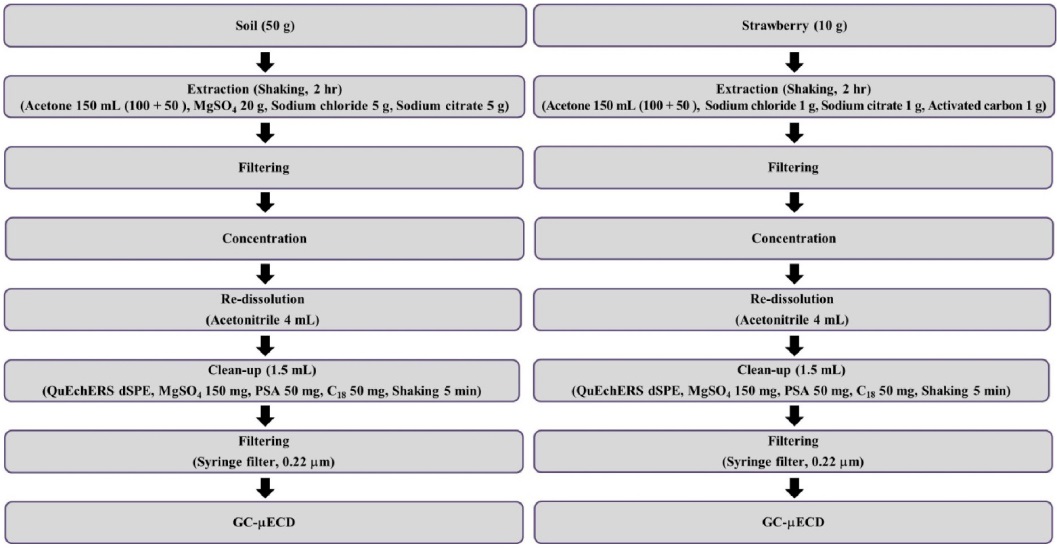
딸기 시설재배지 농경지 토양 중 시험대상 19종 잔류성유기염소계 농약의 잔류량 분석을 위한 전처리는 QuEChERS 방법을 다소 변형하여 수행하였고, 이를 Fig. 1에 나타냈다(Park
[Table 1.] Analytical conditions for residual organochlorine pesticides
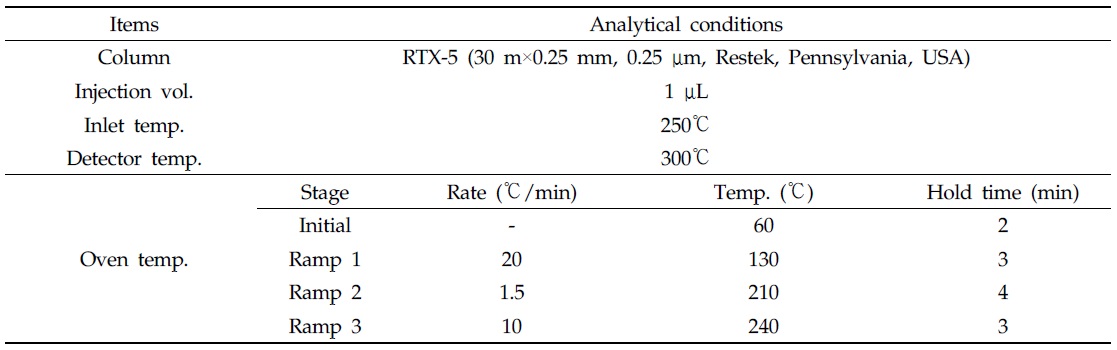
Analytical conditions for residual organochlorine pesticides
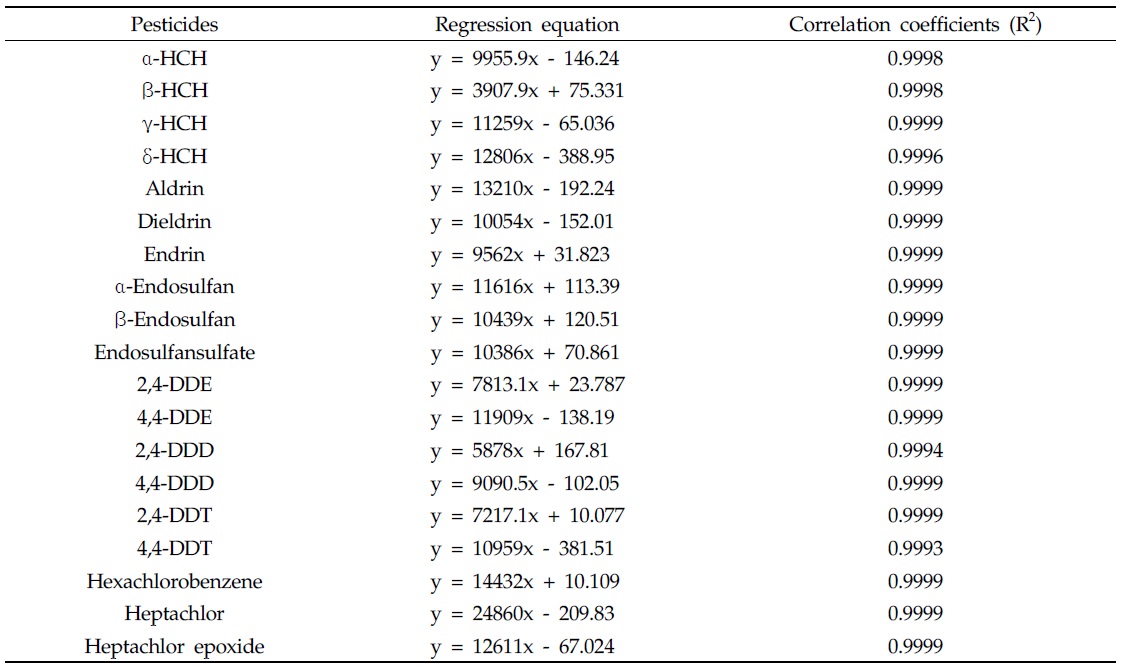
시험대상 19종 잔류성유기염소계 농약 α-HCH, β-HCH, γ-HCH, δ-HCH, hexachloro benzene, heptachlor, heptachlor epoxide, aldrin, dieldrin, endrin, α-endosulfan, β-endosulfan, endosulfan sulfate, 2,4-DDE, 4,4-DDE, 2,4-DDD, 4,4-DDD, 2,4-DDT 및 4,4-DDT의 정량분석을 위한 시험방법의 유효성은 검량선의 직선성, 정량한계(limits of quantitation, LOQ), 회수율 및 상대표준편차를 사용하여 검증하였다. 검량선의 직선성은 효율적인 분석을 위하여 2개의 그룹(Group I 10종, Group II 9종)으로 분류하여 검증하였다(Fig. 2). 19종의 잔류성유기염소계 농약을 각각 100 mL acetone에 용해하여 100 mg/L의 stock solution을 제조하고, 각 그룹에 해당하는 stock solution을 혼합하여 1-5000 μg/L의 혼합표준품을 제조한 다음 검량선을 작성하였고, S/N비(signal to noise ratio)가 10이 되는 농도를 분석대상 19종 잔류성유기염소계 농약의 LOQ로 정하였다.
두 그룹에 대한 토양 중 회수율 시험은 토양 50 g에 분석대상 19종 잔류성유기염소계 농약을 4, 20 및 40 μg/kg 수준으로 처리한 다음 상기의 분석방법에 따라 3회 반복 수행하였다. 작물 중 회수율 시험은 딸기 10 g에 토양시료에서 검출된 dieldrin, b-endosulfan 및 endosulfan sulfate를 10 및 20 μg/kg 수준으로 처리한 다음 상기의 분석방법에 따라 3회 반복 수행하였다. 회수율은 각 물질의 검량곡선에 대입하여 얻은 농도와 첨가농도의 비를 통해 산출하였다. 실험실 내 정밀성(intermediate precision)은 5반복 수행한 값을 상대표준편차(relative standard deviation, RSD, %)로 나타냈다.
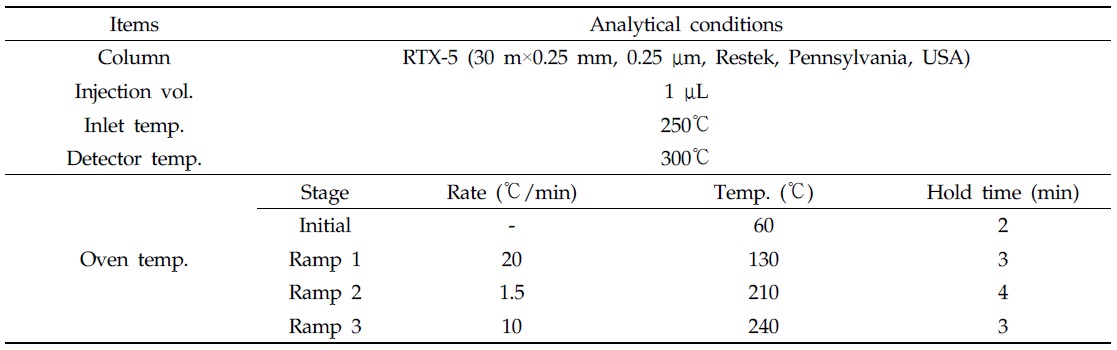
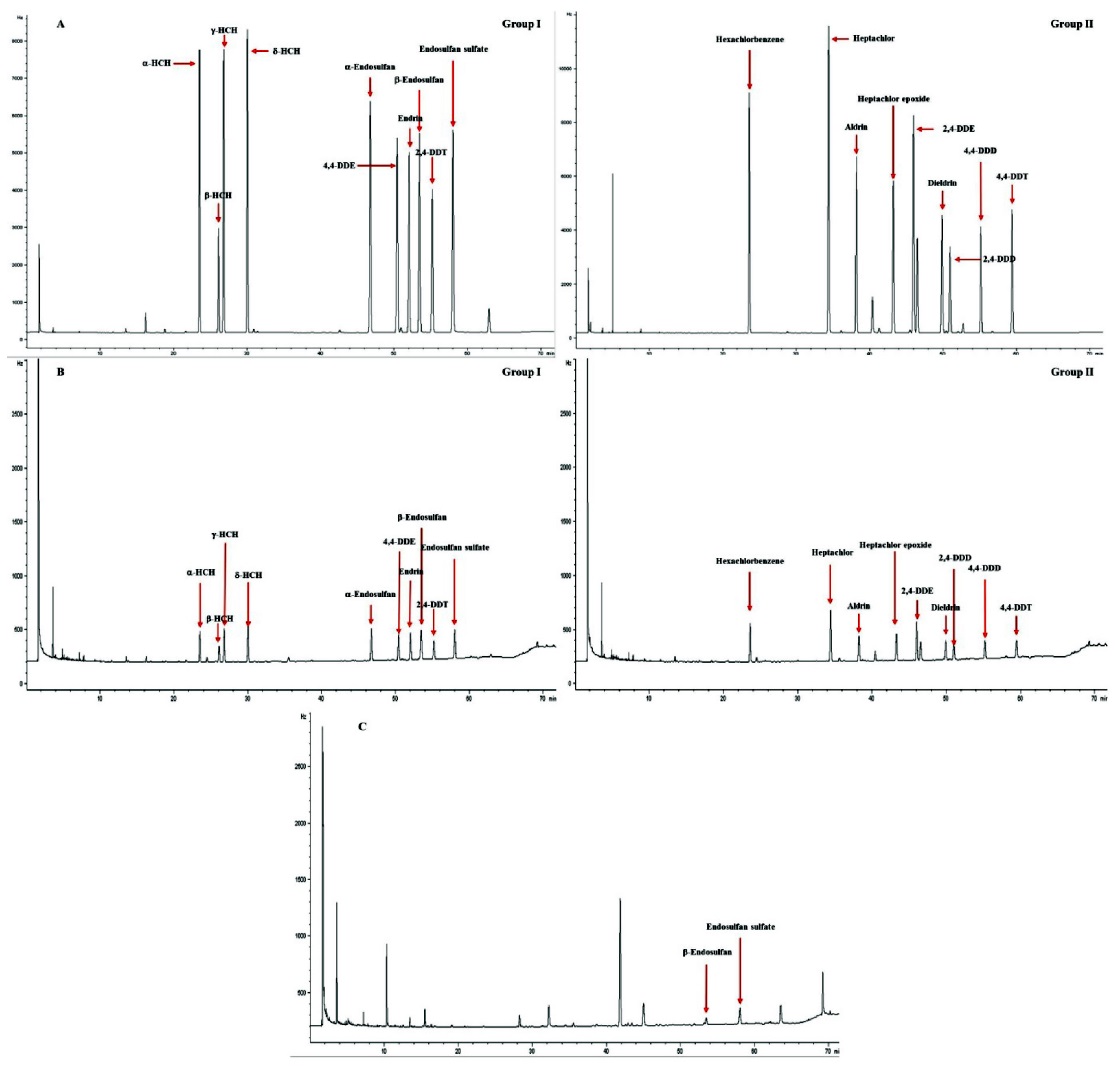
분석대상 19종 잔류성유기염소계 농약의 머무름 시간은 α-HCH 23.55, β-HCH 26.12, γ-HCH 26.85, δ-HCH 30.07, hexachloro benzene 23.63, heptachlor 34.46, heptachlor epoxide 43.26, aldrin 38.22, dieldrin 50.99, endrin 52.06, α-endosulfan 46.79, β-endosulfan 53.52, endosulfan sulfate 58.05, 2,4-DDE 46.53, 4,4-DDE 49.92, 2,4-DDD 50.45, 4,4-DDD 55.18, 2,4-DDT 55.25 및 4,4-DDT 59.45분으로 나타났다(Fig. 3). 분석대상 19종 잔류성유기염소계 농약의 검량선 직선성과 결정계수(R2)는 모두 양호하였다(Table 2).
[Table 2.] Linearity and correlation coefficient of residual organochlorine pesticides

Linearity and correlation coefficient of residual organochlorine pesticides
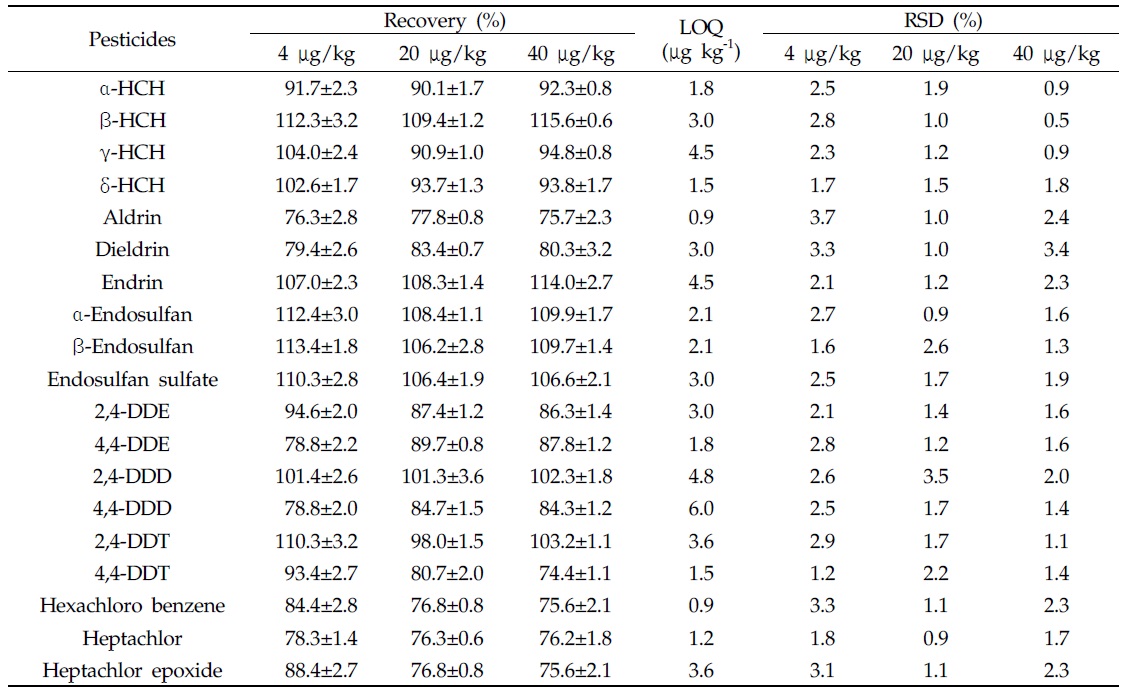
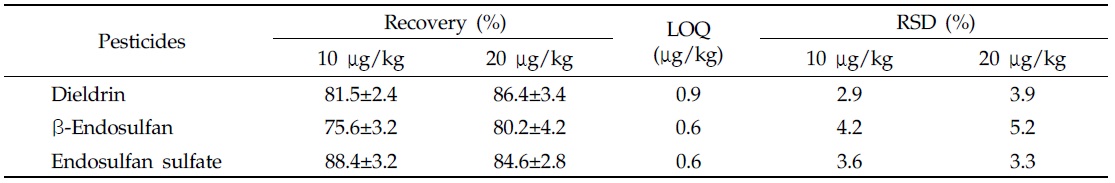
토양 중 분석대상 19종 잔류성유기염소계 농약의 회수율 시험결과는 74.4-115.6%, 상대표준편차(relative standard deviation, RSD) 0.5-3.7% 이었으며, 정량한계는 0.9-6.0 μg/kg이었다(Table 3). 딸기 중 dieldrin, β-endosulfan 및 endosulfan sulfate의 회수율 시험결과는 75.6-88.4%, 상대 표준편차 2.9-5.2% 이었으며, 정량한계는 0.6-0.9 μg/kg이었다(Table 4). 이상의 결과는 EU 가이드라인의 회수율 70-120%, RSD 20% 이하의 잔류분석법 기준에 적합한 결과를 나타냈다(SANCO/10684/2009 document).
[Table 3.] Recovery ofresidual organochlorine pesticides in soil
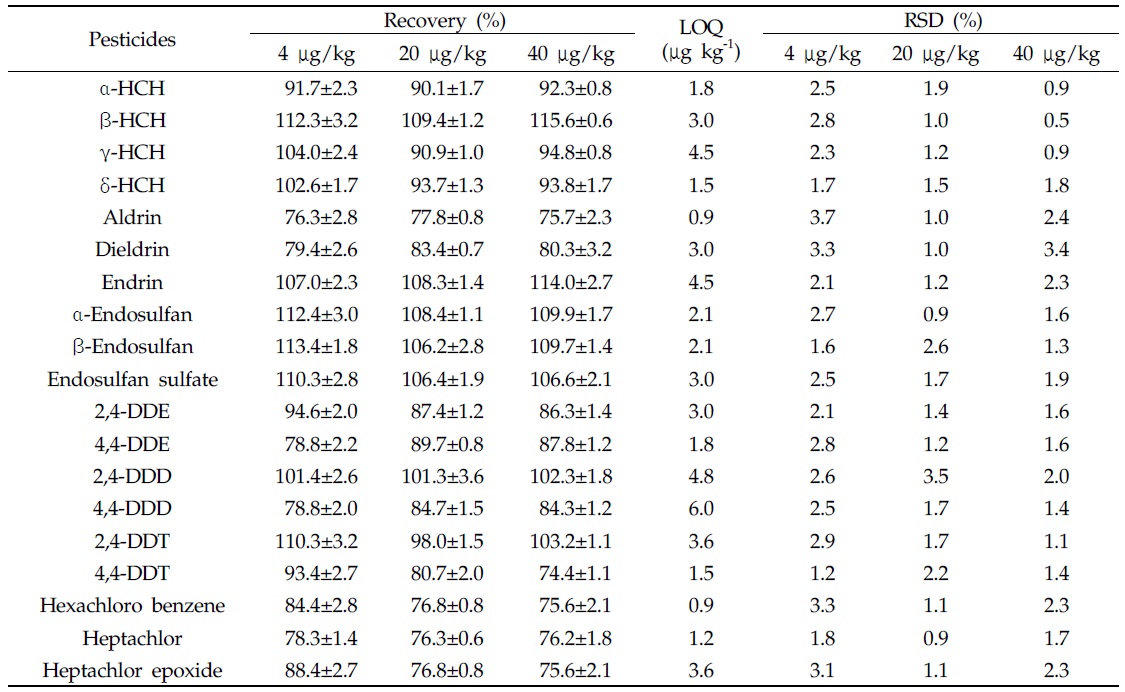
Recovery ofresidual organochlorine pesticides in soil
[Table 4.] Recovery of dieldrin, β-endosulfan, and endosulfan sulfate in strawberry
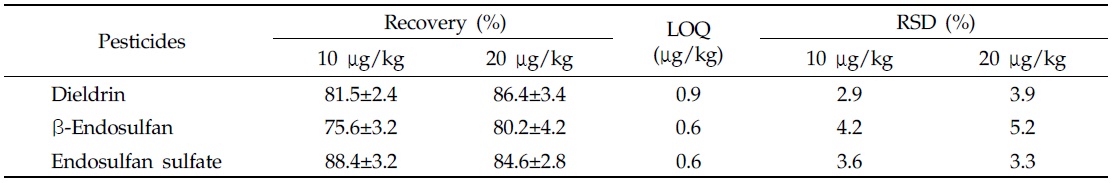
Recovery of dieldrin, β-endosulfan, and endosulfan sulfate in strawberry
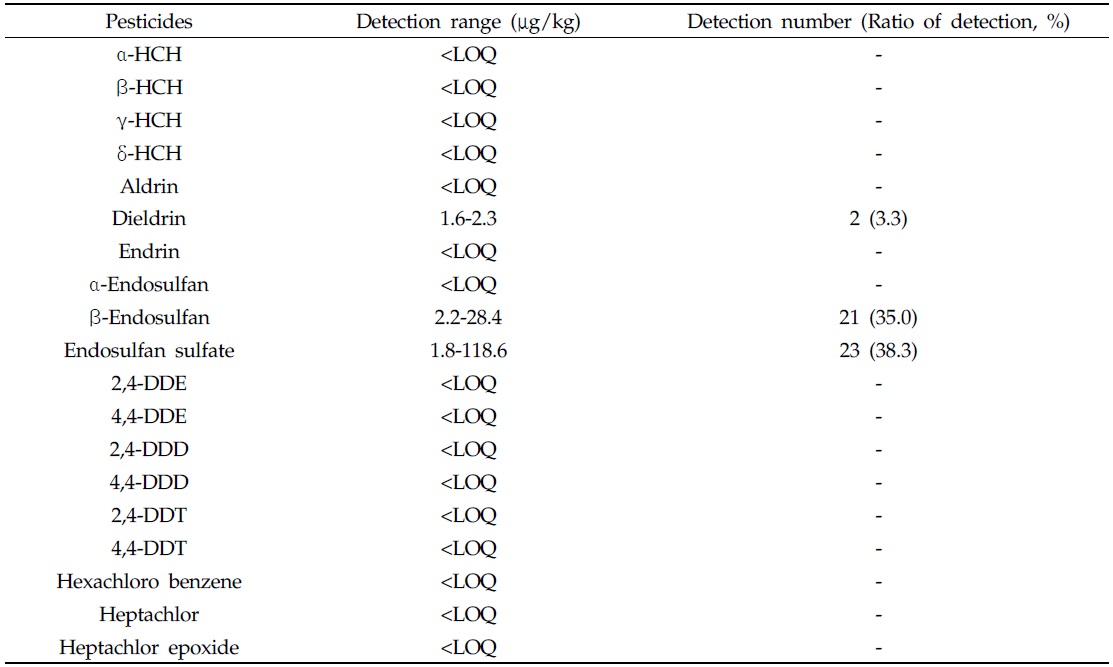
우리나라 딸기주산지 2개 지역의 시설재배지 토양(60지점)에 대한 잔류성유기염소계 농약류의 잔류수준 결과를 Table 5에 나타냈다. 조사대상 딸기 시설재배지 토양 중 잔류성유기염소계 농약류의 잔류수준은 Table 5에서 보는 바와같이 dieldrin, β-endosulfan 및 endosulfan sulfate만이 각각 2, 21 및 23지점에서 검출되었고, 이들의 검출범위는 각각 1.6-2.3, 2.2-28.4 및 1.8-118.6 μg/kg이었다. GC-μECD 분석을 통해 딸기 시설재배지 토양에서 검출된 dieldrin, β-endosulfan 및 endosulfan sulfate 성분에 대해서 GCMS 질량스펙트럼의 대표적 이온분자량 (
[Table 5.] Residue of residual organochlorine pesticides in soil
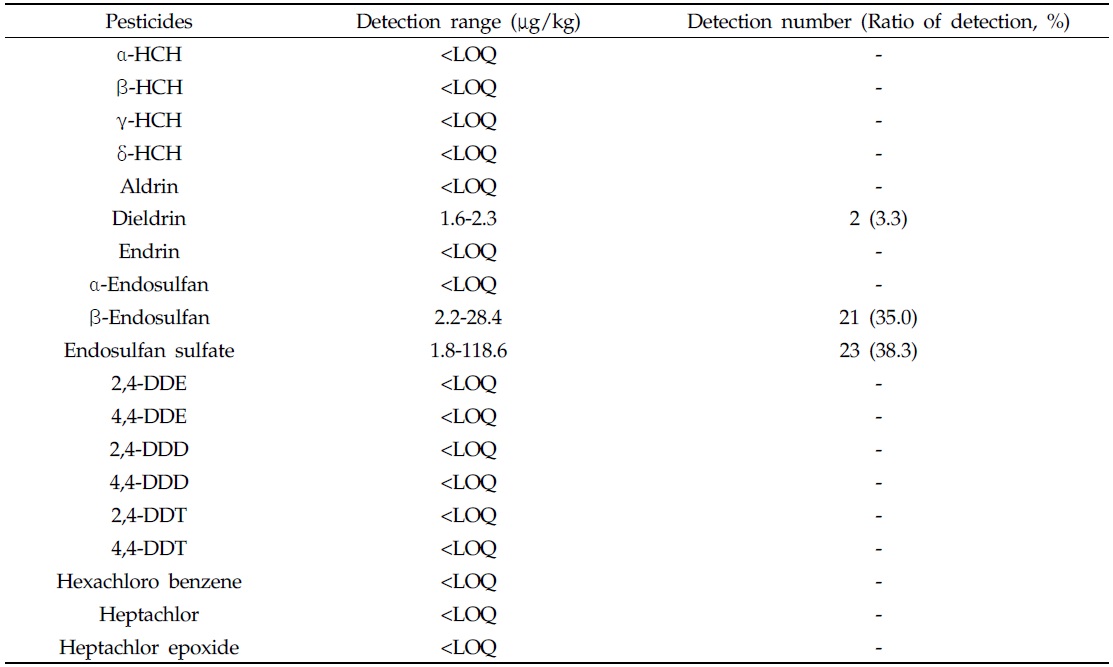
Residue of residual organochlorine pesticides in soil
우리나라 시설재배지 토양 중 잔류성유기염소계 농약의 잔류수준에 대해서는 dieldrin (1999년 금지) 등 잔류성유기염소계 농약 중 일부(Park and Ma, 1981; Suh
우리나라 딸기주산지 2개 지역의 시설재배 딸기(60점)에 대한 잔류성유기염소계 농약류의 잔류수준 결과를 Table 6에 나타냈다. 시설재배 딸기 중 잔류성유기염소계 농약류 잔류수준은 Table 6에서 보는 바와 같이 dieldrin, β-endosulfan 및 endosulfan sulfate는 검출되지 않았다. 따라서 본 연구결과는 우리나라 딸기 시설재배지 토양에서 dieldrin, β-endosulfan 및 endosulfan sulfate 3종의 잔류성유기염소계 농약이 낮은 농도수준(시설재배지 토양 중 최대치, 각각 2.3, 28.4 및 118.6 μg/kg)으로 검출되었으나 시설재배지 토양 중 이들 3종의 잔류수준에서는 딸기의 과실부위로 흡수×이행되지 않는 결과를 나타냈다.
[Table 6.] Residue of residual organochlorine pesticides in strawberry
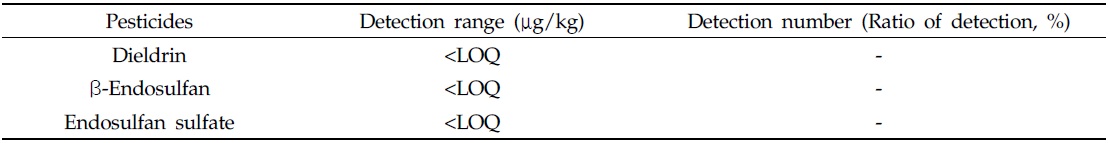
Residue of residual organochlorine pesticides in strawberry