The objective of this study is to develop a taeeumin animal-experimental model induced lung fibrosis with Bleomycin and evaluate the effect on obesity in this animal-experimental model.
The subjects were divided into 3 groups : normal group, high fat diet(HFD) control group, and HFD group administered with bleomycin(n=10 per group). To develop taeeumin animal-experimental model with reduced respiratory metabolism, 8-week-old C57BL/6 mice were administered with 0.03ml solution of bleomycin 1U/ml dissolved in distilled water, intratracheal(IT), once. Then, the HFD control group and the experimental group were fed with high fat diet for 6 weeks. Airway hyperresponsiveness(AHR) to methacholine was measured at the 1st and 3rd week after bleomycin was administered. Food intake and body weight were measured at regular time weekly. After the final experiment, blood was gathered by cardiac puncture for bloodchemical examination and organs(liver, fatty tissue) were remoed, weighted, and mRNA was analyzed.
Through the experiment, it was found that Bleomycin induced Taeeumin animal-experimental models have leptin resistace. In the experimental group administered with Bleomycin, fatty acid synthesizing gene expression increased and energy metabolizing gene expression decreased. As mRNA expression of adiponectin decreased, it was found that Taeeuim animal-experimental model is susceptible to metabolic syndrome and cardiovascular diseases.
사상체질의학은 조선후기 동무 이제마가 창안한 것으로, 사람의 체질을 體形氣像, 容貌詞氣, 性質材幹, 病證藥理를 기준으로 나눠 질병의 예방과 치료, 양생을 달리하는 의학이다1. 이제마는 肺와 肝은 氣液을 呼吸하는 門戶로, 脾와 腎은 水穀을 出納하는 府庫라고 하였다. 태양인‧태음인은 肺肝의 大小와 관련된 氣液之氣의 관계로, 소양인‧소음인은 脾腎의 大小와 관련된 水穀之氣의 관계로 설명하였다2.
사상체질의학에서의 肺는 四象 중 事의 속성으로서 肺氣는 直而伸하고 氣液을 呼散하는 기능을 주관하는 장기이며, 胃脘에서 氣液을 呼할 때 肺가 그것을 衛한다고 하였다. 頭腦의 膩海는 肺의 근본이 되는데 肺는 事務之哀力을 가지고 膩海의 精汁을 吸得하여 肺元을 자양케 하고 안으로는 津海를 擁護하여 그 氣를 鼓動시키고 津을 생성시킨다. 또 肺는 心善學하여 正直中和한즉 津이 充하게 된다. 만일 偏倚過不及하게 되면 津이 爍한다. 哀性이 遠散하면 氣主肺하여 肺가 더욱 盛하나, 樂情이 促急하면 氣激肺하여 肺가 더욱 衰한다 하였다3. 이러한 肺는 呼散之氣의 주체가 되고, 胃脘은 肺의 통제 하에 氣液을 上達而呼散하는 기능을 수행한다. 반면, 肺와 함께 氣液을 관장하는 기관인 肝은 吸聚之氣의 주체가 되며, 小腸은 肝의 통제 하에 氣液을 中執而吸聚하는 기능을 수행한다.
사상체질 중 太陰人은 肝大肺小한 臟局 특징을 가진 체질로, 肺局은 太陰人의 偏小之臟으로 本元에 해당이 되고, 肺局의 呼散之氣는 太陰人의 保命之主가 된다. 태음인 병증분류에 관한 연구에 의하면 太陰人 表裏病證 중 表病證은 胃脘寒을, 裏病證은 肝熱을 그 기본병리로 하여 결국에는 모두 偏小之臟의 本元인 肺局의 呼散之氣 손상 病證으로 귀결되며, 이를 넓은 의미에서 ‘肺燥證’이라 할 수 있다고 하였다4.
人稟 臟理가 肝大肺小하여 呼散之氣가 부족하고 吸聚之氣가 강한 태음인은 쉽게 비만해지는 경향을 보이는데, 이와 관련하여 태음인과 비만의 상관성에 대한 연구들이 많이 이뤄지고 있다5-8.
한의학 표준 확립 및 보험적용 확대를 위해서는 한방 의약품의 임상시험 수행과 품목허가를 위한 연구들이 활발히 행해져야 한다. 사상체질별 病證이나 藥理 메커니즘을 연구하기 위해서 비임상시험이 진행되어야 하나, 현재까지 각 체질별 동물 모형이 개발되지 않았다. 이에 체질별 동물 모형 개발을 위한 연구를 진행하게 되었고, 그 시작으로 폐약 태음인 동물 모형을 개발하게 되었다. 그리고 폐약 태음인 동물 모델을 대상으로 태음인에게 가장 취약한 질환인 비만에 대한 영향을 평가해보기로 하였다.
1) 동물
수컷 C57bl/6 생쥐를 대한바이오링크(Korea)로부터 수입하여 사용하였다. 분양 받은 실험동물을 2주간 기본사료(AIN-76A diet)와 물을 자유롭게 공급하면서 실험실 환경에 적응시킨 후, 건강상태가 양호한 8주령의 생쥐를 사용하였다. 동물 사육실의 환경은 항온(25±2℃), 항습(50±5%) 및 12시간 간격의 광주기(light on 07:00~19:00)로 명암으로 조절되는 SPF 환경에서 유지 실험에 사용하였다. 실험동물은 10마리씩 정상대조군(ND), 비만대조군(고지방식이군, HFD), 실험군(Bleomycin+HFD)으로 분리하여 사육하였으며, 식이와 식수는 자유롭게 섭취하도록 하였다. 동물실험의 윤리적, 과학적 타당성 검토 및 효율적인 관리를 위하여 대전대학교 동물실험윤리위원회 (Institutional Animal Care and Use Committee: IACUC)의 승인을 받았다.
2) 폐섬유화 유발 약물
기관지내 투여(intratracheal instillation, IT) 방법으로 Bleomycin 1U/ml를 증류수 0.03ml에 녹인 용액을 폐 속에 주입하였다. 항암제로 흔히 쓰이는 bleomycin은 폐손상 및 폐섬유화의 부작용을 일으키며 이를 이용하여 실험동물에서 급성 폐손상과 폐섬유화의 모델로 널리 사용하고 있다9.
1) 폐섬유화 유발 방법
C57BL/6J계 생쥐에게 티오펜탈소디움(thiopental sodium) 0.08ml를 복강 내 주사하여 마취시킨 상태에서, 전경부의 피부를 절개하고 근육을 정리하여 기관을 노출시킨 다음 안과용 수술가위로 기관을 조금 절개하였다. 앞을 둥글게 만든 30gauge 주사 바늘을 장착한 0.5ml 인슐린 주사기를 사용하여 Bleomycin 1U/ml를 녹인 증류수 용액 0.03ml를 절개된 기관을 통하여 직접 폐 속으로 단번에 주입하였다. 주입 직후 곧 바로 절개한 전경부의 피부를 봉합 하고 일반 사육 케이지에 담아 사육하였다.
2) 메타콜린 기관지 유발 검사
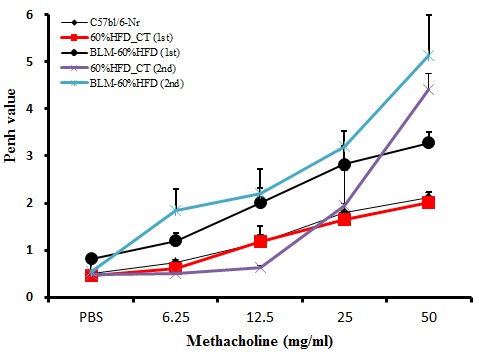
C57bl/6 마우스에 Bleomycin을 IT로 단회 투여하고, 1‧3주 후에 동물폐용적측정기(one chamber plethysmograghy, All medius, Seoul)를 이용하여 기도 저항의 지표인 Penh 등을 포함한 다양한 호흡지표들의 변화를 측정하였다. 메타콜린 기관지 유발검사는 3분간 연무기를 통해 메타콜린 농도를 6.25, 12.5, 25, 50mg/mL의 농도로 점차 증가시켜 흡입시킨 후 폐용적측정기에 3분 동안 기록하되 Penh을 평균하여 측정하였다10.
2) 동물 시험군 분류
C57bl/6 마우스를 2주간 기본사료(AIN-76A diet)로 적응시킨 후 10주령부터 Diet Induced Obesity Diet Formulas(D12451 & D12492) Bleomycin 투여 후 대조군과 시험군에게 고지방식이(HFD) 섭취를 6주간 진행하였다.
정상군과 고지방식이(HFD)군을 비교하여 정상 장부 상태의 쥐에게 고지방식이가 미치는 영향을 알아보았으며, HFD 식이군과 Bleomycin+HFD 투여군을 비교하여 정상 폐기능 동물군과 Bleomycin에 의한 폐약 태음인 동물 모델에서의 비만에 대한 영향 차이를 알아보았다.
3) 체중 및 식이효율 측정
체중 및 식이섭취량은 매주 일정한 시간에 측정하여 기록하였다.
4) 혈액생화학 검사
최종 실험 종료 후 희생 전 3시간 동안 절식시킨 후 심장천자법으로 채혈하여 혈액생화학적 검사를 실시하기 위하여 채혈 후 30분 이내에 3,000rpm, 4℃에서 15분간 원심분리하여 혈장(plasma)을 분리하여 -70℃에 보관하였다가 분석하였다. 각 실험동물로부터 분리한 혈장(plasma)에서 간 기능의 지표인 ALT 및 AST를, 신장기능 지표인 BUN, creatinine을, 혈장 및 간의 지질함량의 지표인 총콜레스테롤, HDL(High-density lipoprotein)-cholesterol, LDL(Low-density lip-oprotein)-cholesterol, 중성지방(triglyceride), 그리고 혈중 Leptin, Insulin, Adiponectin, 혈당의 함량을 생화학 자동 분석기(Hitachi-720, Hitachi Medical, Japan)를 이 용하여 측정하였다.
5) 부검 및 장기조직 검사
각 실험동물의 장기조직(간, 지방조직)은 혈액 채취 후 즉시 적출하여 칭량하였다. 적출한 간과 지방조직들의 유전자 발현 양상을 알아보기 위해 간과 지방조직에서 RNA를 추출한 뒤 One-step SYBR Green PCR kit(AB science)를 사용하여 cDNA 및 real-time PCR 분석을 하였다.
각 실험군 결과 값은 unpaired student's T-test 통계프로그램을 사용하여 통계 처리하였으며, p<0.05 이하의 수준에서 유의성 검정을 실시하였다.
메타콜린에 대한 기도과민성은 Bleomycin을 IT로 단회 투여하고 1‧3주 후에 측정하였다. 대조군에 비해 Bleomycin을 투여한 실험군에서 기도과민성이 증가한 것으로 보아, 급성 폐손상과 폐섬유화가 일어났을 것이라고 간접적으로 확인할 수 있었다(Figure 1).
1) 체중 비교
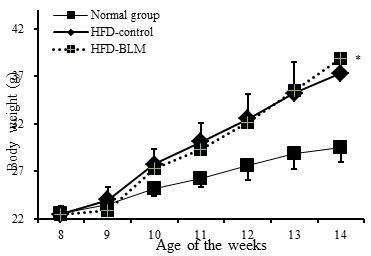
최종 14주에서 비만대조군은 정상군에 비하여 평균적으로 10g의 체중이 증가하였다. 실험군에서는 비만대조군에 비하여 큰 차이는 볼 수 없었지만, 14주부터 실험군이 비만대조군에 비해 1.4 g의 체중 증가량 차이를 보였다(Figure 2). 하지만 체중의 뚜렷한 차이를 보여주는 결과가 없어 14주 이후 추가적으로 실험 기간을 늘려야 할 것으로 사료된다.
2) 식이효율 비교
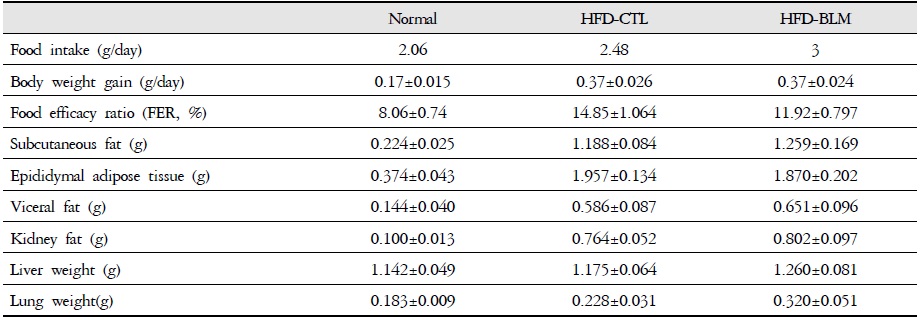
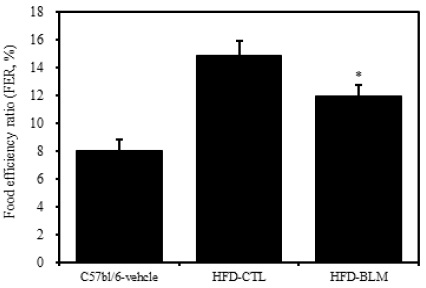
식이효율 (feeding efficiency ratio: FER%) =체중증가량(g) / 사료섭취량(g) ×100)의 공식에서 의미하는 바와 같이 사료를 섭취하는 양이 많음에도 불구하고 체중의 증가가 적다는 것은 비만조절효과가 있는 것으로 생각할 수 있다. 따라서 식이효율은 비만 가능성을 나타내는 하나의 척도로 사용할 수 있고, 식이효율의 수치가 적을수록 비만 조절 효과가 있다고 할 수 있다. 이번 연구 결과에서 비만대조군의 식이효율이 14.8%이었으며, 이에 비하여 실험군에서는 비만대조군에 비하여 통계학적으로 유의성 있게(p<0.05) 식이효율이 감소된 추이를 보였다(Table 1, Figure 3).
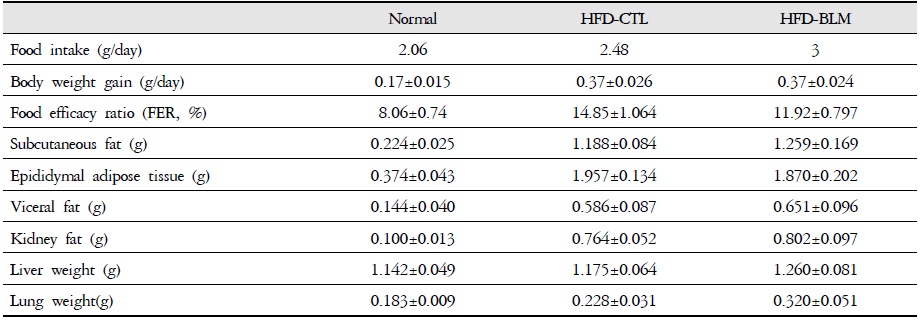
The Effect of BLM on Food Intake, Body Weight Gain, Food Efficiency Ratio and Tissue Weights in HFD-fed Obese Mice
이러한 결과는 Bleomycin으로 유도된 폐약 태음인 동물 모델에서 식이섭취량 대비 체중 증가 정도가 다소 억제되었음을 알 수 있었다.
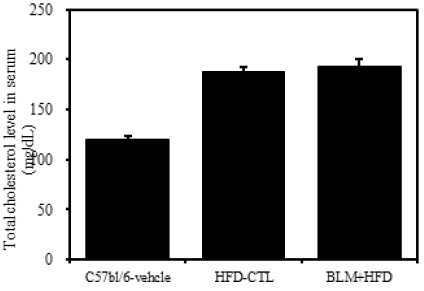
1) 혈청 내 총콜레스테롤
비만대조군의 혈청 내 총콜레스테롤(total cholesterol) 수준은 정상대조군의 혈청내 총콜레스테롤(total cholesterol)에 비하여 약 36.0% 이상 증가를 나타내었다. 하지만 실험군에서는 비만대조군과 차이를 보이지 않았다(Table 2, Figure 4).
[Table 2.] The Effect of BLM on Blood Biochemistry Prameters in HFD-fed Obese Mice
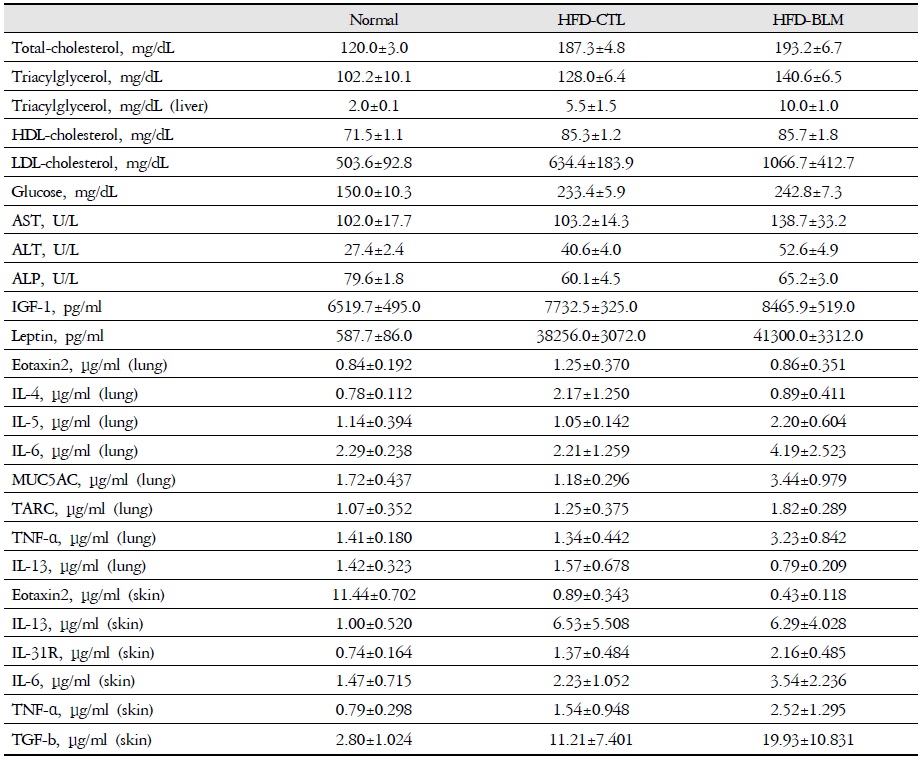
The Effect of BLM on Blood Biochemistry Prameters in HFD-fed Obese Mice
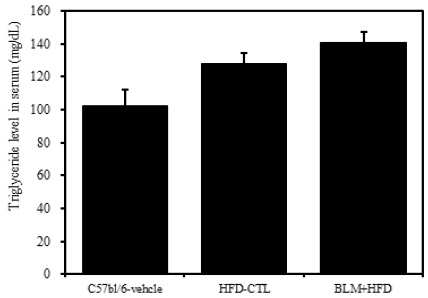
2) 혈청 내 중성지방
비만대조군의 혈청 내 중성지방(triglyceride) 수준은 정상대조군의 혈청 내 중성지방에 비하여 약 20.4%이상 증가를 나타내었다. 그리고 실험군에서는 비만대조군에 비하여 8.6%이상 증가를 보였다(Table 2, Figure 5).
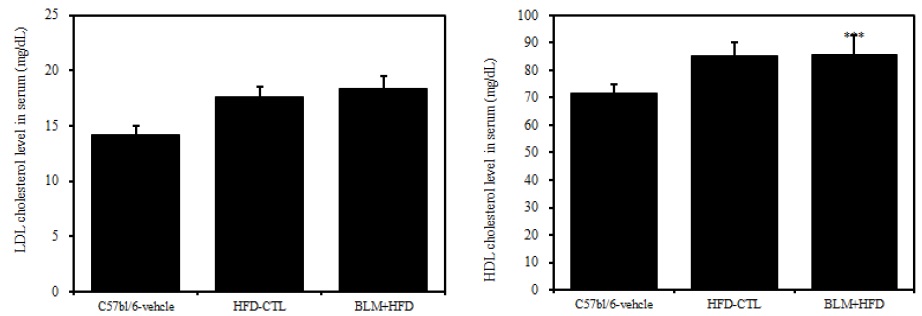
3) 혈청 내 고밀도 콜레스테롤 및 저밀도 콜레스테롤
비만대조군의 혈청 내 고밀도 콜레스테롤(HDL-cholesterol) 수준은 정상대조군의 혈청 내 고밀도 콜레스테롤(HDL-cholesterol)과 비교하여 약 16.2%이상 증가를 나타내었고, 실험군에서 비만대조군에 비하여 큰 차이를 보이지 않았다(Table 2, Figure 6). 혈청 내 저밀도 콜레스테롤(LDL-cholesterol)의 수준을 나타내는 그래프로, 비만대조군의 혈청 내 저밀도 콜레스테롤(LDL-cholesterol) 수준은 정상대조군의 혈청 내 저밀도 콜레스테롤(LDL-cholesterol)에 비하여 약 20.7% 이상 증가를 나타내었다. 실험군에서 비만대조군에 비하여 차이가 없었고 이는 통계학적으로 유의성을 띄었다(p<0.001). 따라서 Bleomycin으로 유도된 폐섬유화 모델 생쥐는 고지방식이에 따른 차이를 볼 수 없었다.
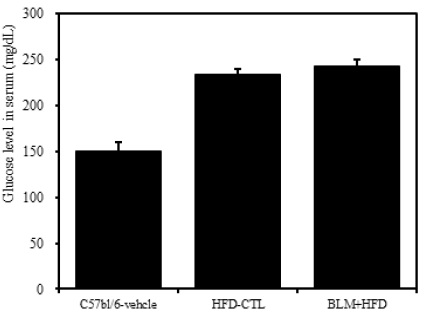
4) 혈청 내 혈당
비만대조군의 혈청 내 혈당(Glucose) 수준은 정상대조군의 혈청 내 혈당에 비하여 약 29.3%이상 증가를 나타내었다. 실험군에서는 비만대조군과 차이를 보이지 않았다(Table 2, Figure 7).
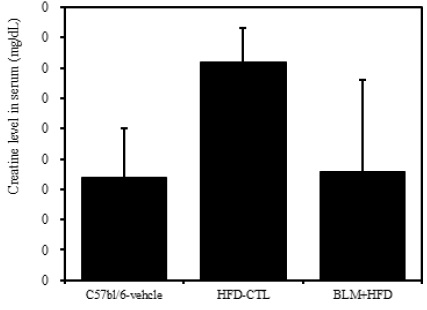
5) 혈청 내 크레아틴
비만대조군의 혈청 내 크레아틴(creatine) 수준은 정상대조군에 비하여 증가를 나타내었다. 하지만 실험군의 혈청 내 크레아틴은 정상대조군 수준으로 관찰되었다(Table 2, Figure 8). 따라서 실험군은 정상대조군과 큰 차이가 없어 신장독성은 나타나지 않았다고 생각된다.
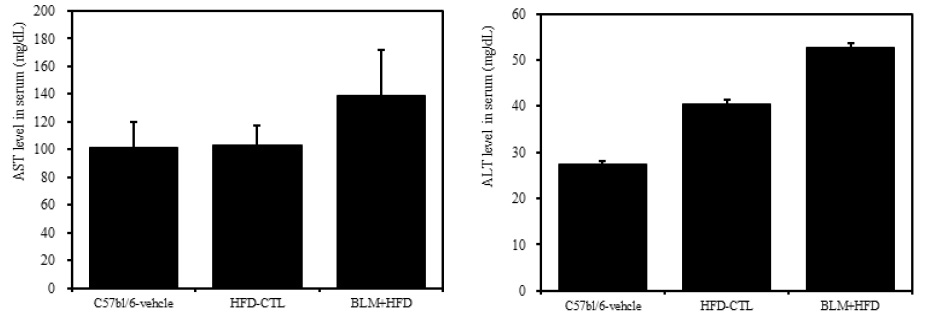
6) 혈청 내 AST 및 ALT
비만대조군의 혈청 내 AST 수준은 정상대조군의 혈청 내 AST와 차이가 없었고, 실험군에서 비만대조군에 비하여 약 25.4%이상 증가를 나타내었다. 또한 비만대조군의 혈청 내 ALT 수준은 정상대조군에 비하여 약 32.5%이상 증가를 나타내었다. 실험군에서 비만대조군에 비하여 약 23.0%이상 증가를 나타내었다(Table 2, Figure 9).
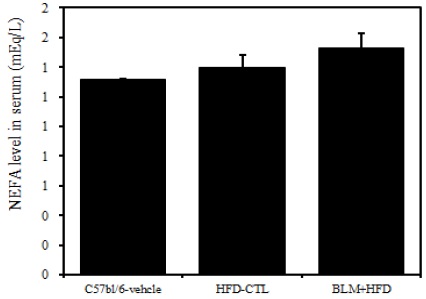
7) 혈청 내 NEFA
비만대조군의 혈청 내 NEFA 수준은 정상대조군의 혈청 내 NEFA에 비하여 약 7.2%이상 증가를 나타내었다, 실험군에서 비만대조군에 비하여 약 6.7%이상 증가를 나타내었다(Table 2, Figure 10).
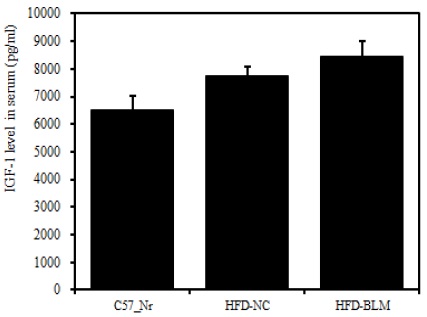
8) 혈청 내 IGF-1
비만대조군의 혈청 내 IGF-1 수준은 정상대조군의 혈청 내 IGF-1에 비하여 약 15.7% 이상 증가를 나타내었다. 실험군에서 비만대조군에 비하여 약 8.7%이상 증가를 나타내었다(Table 2, Figure 11).
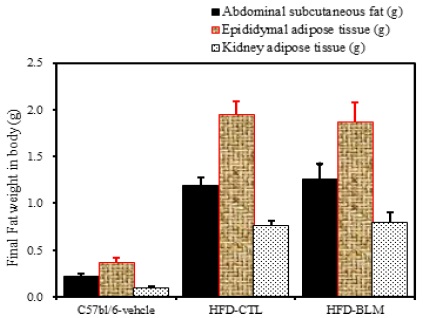
1) 피하 및 복부 지방량 분석
비만대조군의 총피하지방량(total abdominal subcutaneous fat)은 정상대조군의 총피하지방량(total abdominal subcutaneous fat)에 비하여 4.5배 이상 증가를 하였다. 반면 실험군에서 비만대조군에 비하여 차이를 보이지 않았다(Table 1, Figure 12).
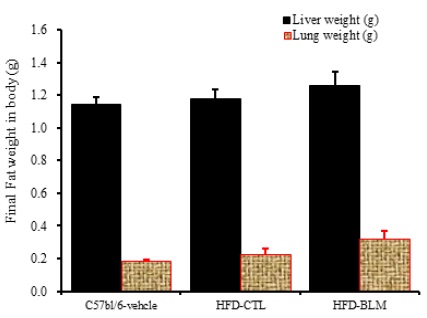
2) 간, 폐무게 분석
비만대조군의 간무게(liver weight)은 정상대조군의 간무게(liver weight)에 비하여 약 2.9% 이상 증가를 나타내었다. 실험군에서 비만대조군의 간무게에 비하여 약 6.8%이상 증가를 나타내었다. 또한 비만대조군의 폐무게(Lung weight)는 정상대조군의 폐무게(Lung weight)에 비하여 약 19.8% 이상 증가를 나타내었다. 실험군에서 비만대조군의 간무게에 비하여 약 28.8% 이상 증가를 나타내었다(Table 1, Figure 13).
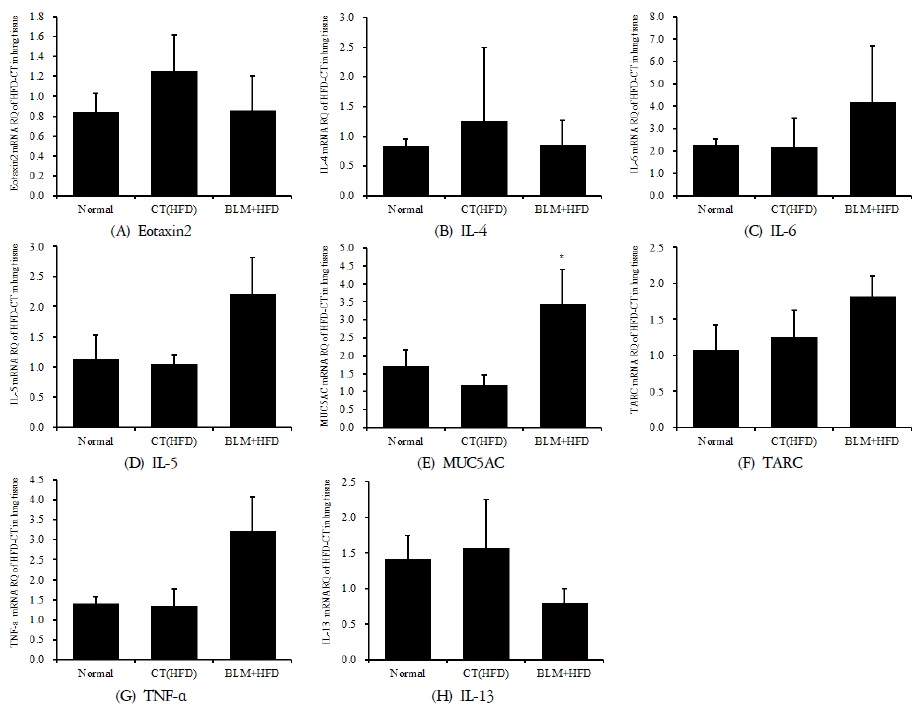
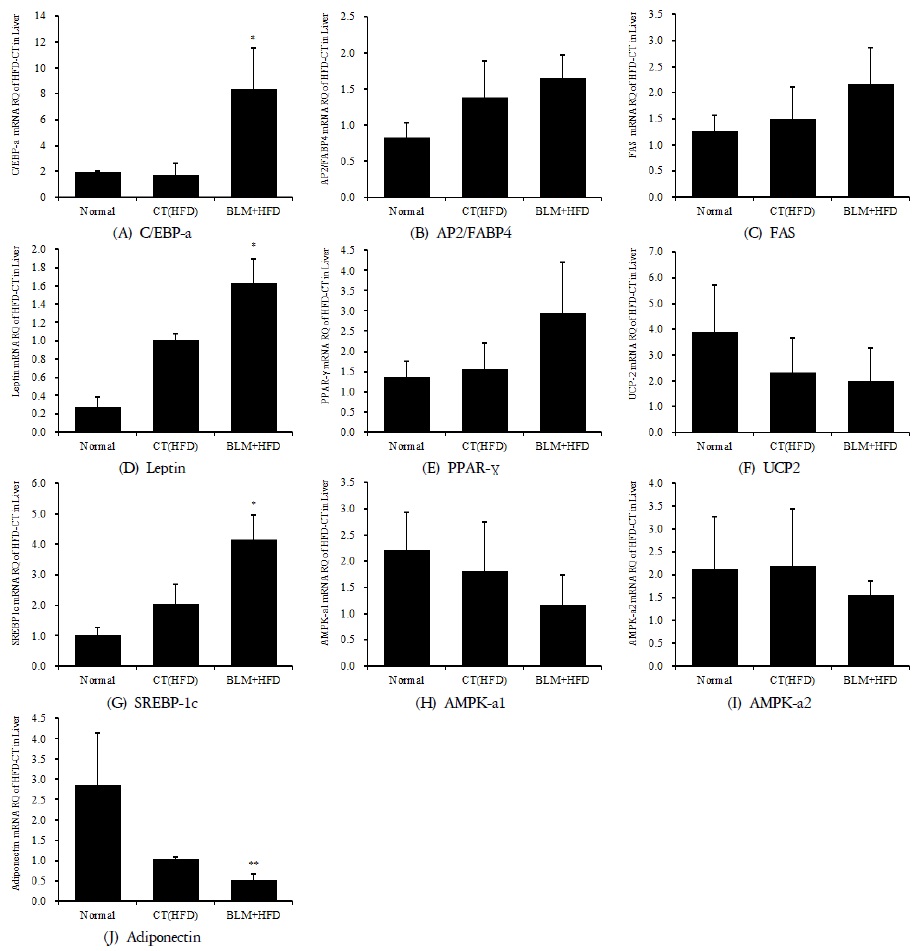
3) 폐 조직의 mRNA 분석
적출한 폐에서 real-time PCR 증폭법을 사용하여 천식과 면역조절에 관련 있는 유전자 발현 양상을 확인해보았다. 폐섬유화와 비만이 연관성이 있는지, 그리고 폐기능과 면역 저하에 어떤 영향을 미치는지 알아보고자 하였다. 호산구가 활성화되는 과정에서 T helper(Th)세포에서 분비하는 cytokine 이 중요한 역할을 한다. Th세포는 cytokine 분비양상에 따라 Th1세포와 Th2 세포로 나누어지는데 Th1세포에서는 IL-2, IFN-
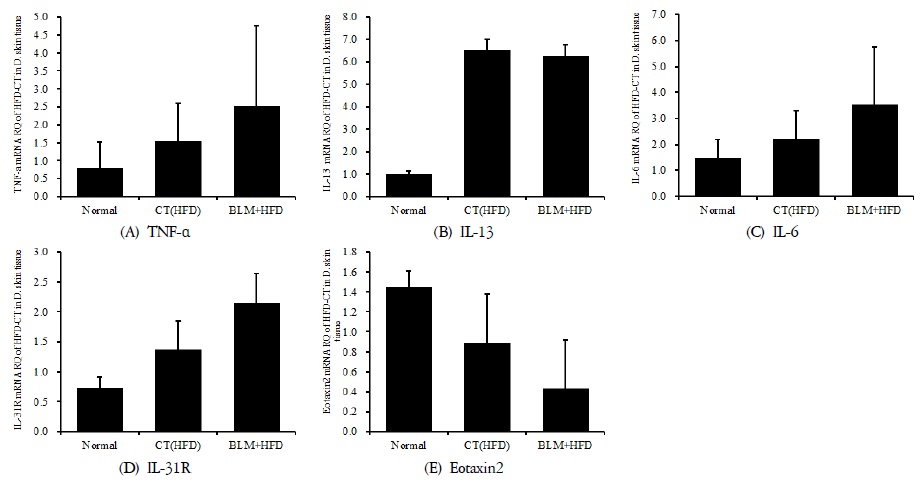
4) 피부 조직의 mRNA 분석
적출한 피부에서 real-time PCR 증폭법을 사용하여 천식과 면역조절에 관련 있는 유전자 발현 양상을 확인해보았다. 실험결과 피부조직에서의 TNF-
5) 간 조직의 mRNA 분석
적출한 간에서 real-time PCR 증폭법을 사용하여 비만과 에너지 소비에 관련 있는 유전자 발현 양상을 확인하여 폐섬유화와 비만이 연관성이 있는지, 그리고 폐기능의 저하가 비만에 어떤 영향을 미치는지 알아보고자 하였다.
실험결과 간조직에서의 지방산 합성관련 유전자인 SREBP-1c, FAS, aP2의 유전자 발현은 비만대조군에서 정상대조군에 비하여 증가를 나타내었다. 실험군에서 비만대조군에 비하여 증가를 나타내었다.
또한 간조직에서의 에너지 소비(thermogenesis activity)와 관련된 단백질들(PPAR
또한 비만과 대사증후군에 핵심적 역할을 하는 렙틴(leptin)과 아디포넥틴(adiponectin) 중 렙틴 유전자 발현은 비만대조군에서 정상대조군에 비하여 증가를 나타내었다. 실험군에서 비만대조군에 비하여 증가를 나타내었다. 반면 아디포넥틴 유전자 발현은 비만대조군에서 정상대조군에 비하여 감소를 나타내었다. 실험군에서 비만대조군에 비하여 감소를 나타내었다. 따라서 렙틴과 아디포넥틴 사이에 유의한 역 상관관계를 나타내었다(Figure 16).
체질 동물모델 개발에 있어서 가장 큰 문제점은 인간의 사상체질분류의 기원과 같이 性情에 따른 장부편차를 구현할 수가 없다는 것이다. 이에 본 연구에서는 실현이 힘든 性情보다는 장부 자체에 치우친 체질모델을 가정하고 실험을 하게되었다.
태음인 병증분류에 관한 연구4에서 언급되었듯 결국에는 表裏病 모두 偏小之臟의 本元인 肺局의 呼散之氣 손상 病證으로 귀결된다고 하여, 太陰人 동물모델의 특징으로 太陰人의 偏小之臟인 肺小의 동물모델을 개발하게 되었다. 이에 肺小의 의미에 대한 고찰이 필요하였다.
太陰人의 偏小之臟인 肺小의 의미와 관련하여 사상체질과 폐기능 간의 연관성 연구들이 있었는데, 이14는 BMI 정상군(18.5≤BMI<23)에서 태음인의 경우 FVC%pred와 FEV1%pred가 다른 체질에 비해 낮은 것을 확인하였다. 또 다른 연구로 박15은 다른체질에 비해 태음인이 FVC%pred가 유의하게 낮은 것을 확인하였다. 또한 태음인과 소양인에서 소음인보다 폐기능 장애의 위험도가 높았는데, 소양인은 FVC만 유의하게 관계가 있었고 태음인은 FVC와 FEV1에서 모두 유의하게 관계가 있었다고 하여 폐기능장애의 양상이 다른 체질에 비해 태음인에서 보다 뚜렷하게 나타나고 있음을 알 수 있다고 하였다. 또한 같은 연구에서 대사증후군의 구성요소 중 이상지질혈증군이 폐기능장애(FVC, FEV1)와 모두 유의한 관계가 있었고, 복부비만군과 공복혈당상승군은 각각 FEV1, FVC의 폐기능장애와 관계가 있었다고 하여 태음인이 폐기능 저하로 인해 비만 및 대사증후군 질환에 취약할 수 있음을 증명하였다. 이에 太陰人의 肺小가 폐기능 저하와 유의한 관계가 있는 것으로 판단하여 Bleomycin을 이용하여 인위적으로 폐기능 저하를 유발한 쥐 모델을 폐약 태음인 동물 모델로 개발하게 되었다.
렙틴(leptin)은 지방세포에서 분비되는 아디포카인(adipokine) 중 하나로, 뇌의 시상하부에 작용하여 음식 섭취를 억제하고 교감신경을 활성화하여 에너지 소비를 촉진시킨다14,15. 최근 연구에서 렙틴이 염증 전 매개물로 작용하며16, 만성 폐쇄성 폐질환, 천식, 알레르기성 비염, 비용종 등의 염증성 호흡기 질환에서 혈청 내 렙틴 수치가 증가한다고 하였다16-19. 또한 렙틴이 폐포 대식세포의 수용체에 결합하여 Phospholipase D1(PLD1)을 활성화시켜 TNF-
본 연구에서 비만대조군에 비해 실험군의 식이효율이 유의하게 낮았으나, 오히려 실험군의 체중이 대조군에 비해 유의하게 높은 양상을 보였다. 이는 실험군의 일일 평균 섭취량이 비만대조군에 비해 20% 이상 많았기 때문인데, 이러한 결과는 식이 섭취를 억제하는 기능을 하는 렙틴의 mRNA 발현이 비만대조군에 비해 실험군에서 유의하게 증가된 결과와 상반된 내용이다.
렙틴이 b형 렙틴수용체(LRb)와 결합하면서 식욕 억제 신경펩티드인 proopiomelanocortin(POMC)의 발현은 증가하고, 식욕 증진 신경펩티드인 Neuropeptide Y(NPY)의 발현은 억제된다. 한편, 렙틴과 LRb의 결합은 suppressor of cytokine signaling-3(SOCS3)와 protein tyrosine phosphatase 1B(PTP1B)를 증가시켜 LRb로부터의 과도한 신호를 억제하는 역할을 한다. SOCS3와 PTP1B의 증가는 렙틴 과다로 유도되는 렙틴 저항성의 기전이 된다21. 실험군에서 렙틴 mRNA의 발현이 증가되었음에도 불구하고 일일 평균 섭취량이 많았던 것은 렙틴 저항성 때문인 것으로 사료된다.
렙틴 저항성과 관련된 과거 선행 연구로 렙틴 저항성과 관련하여 쥐나 비만인에게 고지방 식이를 공급했을 때 근육조직의 렙틴 저항성이 증가하였다는 결과를 보여준 연구가 있었다22,23. 최근의 연구를 통해 렙틴 저항성의 원인이 시상하부의 염증이나 소포체 스트레스에 있다고 알려졌는데, 고지방식이와 같은 과도한 영양섭취, TNF-
아디포넥틴(adiponectin)은 지방조직에서 가장 많이 분비되는 아디포카인으로, 지방‧당 대사, 인슐린 감수성 등을 조절한다26. 또한 선행 연구들을 통해 인슐린 저항성과 관련하여 아디포넥틴의 낮은 농도가 대사증후군 및 심혈관계 질환 발생의 독립적인 인자임이 밝혀졌다27,28. 아디포넥틴의 분비량은 카테콜아민, 글루코코르티코이드, TNF-
SREBPs는 인슐린의 역할을 매개하여 지방산 생합성에 중요한 효소인 acetyl-CoA carboxylase (ACC)와 fatty acid synthase (FAS) 유전자의 발현을 활성화 시키는 중요한 전사인자이다30. SREBP는 1a, 1c, 2의 세 가지 종류로 나뉘는데, SREBP-1a와 SREBP-1c는 지방산과 중성지방의 합성에 관여하고, SREBP-2는 콜레스테롤의 대사 및 합성을 조절한다고 알려져 있다31. 이번 연구에서 SREBP-1c를 제외한 다른 결과에서 비록 유의성은 없었지만, 다른 대조군들에 비해 실험군에서의 AST, ALT가 증가하였고, 지방산 합성관련 유전자인 SREBP-1c, FAS, aP2의 활성이 증가하는 경향성을 보였다. 또한 혈청과 간조직 내 중성지방이 다른 대조군들에 비해 증가된 결과를 얻었다. 이를 통해 실험군에서 지방간 병변을 의심할 수 있었다.
성정의 편급과 선천적인 장부대소로 인해 체질의 구분 및 소증과 병증의 차이가 발생하기 때문에 후천적으로 혹은 인위적으로 장기 기능의 불균형을 유발하는 것이 특정 체질의 대표 동물모델이라고 이르기에는 무리가 있다. 하지만 향후 체질별 취약 질환에 대한 연구나 체질 약물에 대한 연구를 위하여 체질 동물 모델의 개발이 꼭 필요하며, 이에 본 연구는 인위적인 장부 기능의 저하를 유도한 새로운 관점으로 체질 동물 모델의 개발을 시도하였다는 것에 의의가 있다.
Beomycin으로 유발한 폐약 태음인 동물 모델의 비만에 대한 영향에 대하여 다음과 같은 결과를 얻을 수 있었다.
1. Bleomycin을 IT로 단회 투여한 1‧3주 후, 실험군의 기도과민성이 증가하여 급성 폐손상 및 폐섬유화를 간접적으로 확인하였다.
2. 실험군에서 비만대조군에 비해 유의하게 식이효율이 감소하였으나 식이섭취량이 증가하였다.
3. 실험군과 비만대조군에서 정상군에 비해 혈청 내 총콜레스테롤 및 중성지방, 저밀도 콜레스테롤, 혈당이 증가하였으나 유의성이 없었다.
4. 실험군과 비만대조군에서 정상군에 비해 고밀도 콜레스테롤이 증가하였다. 실험군과 비만대조군 사이에 차이가 없었고 이는 통계학적으로 유의성이 있었다.
5. 간조직에서의 지방산 합성 관련 유전자인 SREBP-1c, FAS, aP2의 유전자 발현이 실험군, 비만대조군, 정상대조군 순으로 증가하였고, 에너지 대사 관련 유전자인 AMPK-a1, AMPK-a2, UCP2의 유전자 발현은 실험군에서 정상군과 비만대조군에 비해 감소하였다. PPAR-
6. leptin 유전자 발현은 실험군, 비만대조군, 정상군 순으로 증가하였고, adiponectin 유전자 발현은 정상군, 비만대조군, 실험군 순으로 증가하여 leptin과 adiponectin사이에 유의한 역 상관관계를 나타냈다.
이상으로 Bleomycin으로 유발한 폐약 태음인 동물 모델에서 렙틴 저항성의 가능성을 확인하였다. 또한 실험군에서 염증 유발 유전자와 지방산 합성 유전자 발현이 증가하고 에너지 대사 유전자의 발현이 감소하는 경향성을 확인하였다. 아디포넥틴 mRNA의 활성 저하로 Bleomycin으로 유발한 폐약 태음인 동물 모델이 대사증후군과 심혈관계질환에 취약함을 확인하였다.