The emission of SO2 is inevitable in case of combustion of most fossil fuels except LNG in commercial power plant which has a bad effect on the durability of SCR catalyst. To develop a low temperature SCR catalyst which has a high NOx removal performance and excellent durability to SO2, V2O5/TiO2 catalysts were prepared by coating on the metal foam substrate with the impregnation amount of Sb2O3 as promotor. This study has evaluated the NOx removal performance and the durability to SO2 on a laboratory scale atmospheric reactor and analyzed the properties of the prepared catalysts by means of porosimeter, BET, SEM (scanning electron microscope), EDX (energy dispersive x-ray spectrometer), XPS (X-ray photoelectron spectroscopy). It was found that the surface area of catalyst increased with the impregnation amount of Sb2O3 and the NOx removal performance showed the highest value at the 2 wt% impregnation of Sb2O3. This results was considered to be due to the optimum active site on the catalyst surface. And also, Sb2O3 impregnated catalysts presented that NOx removal performance was maintained despite the exposure to SO2 for 5 hours. Therefore it was confirmed that metal foam SCR catalyst for low temperature could be manufactured with the optimum control of Sb2O3 impregnation according to the SO2 presence or not.
석탄화력 발전소 및 중유 발전소 등에서 배출되는 배기가스에는 대기오염의 주범인 질소산화물, 황산화물, 일산화탄소 및 다이옥신류 등과 같은 유해한 물질이 다량 포함되어 있는바, 이들 유해물질 중에서 NOx를 특정적으로 제거하기 위한 방법으로 제거효율 및 경제성이 우수한 선택적 촉매 환원법(SCR)이 널리 적용되고 있다[1-3].
특히 발전소에서 다량으로 발생하는 질소산화물은 대도시나 공장지대의 공해를 유발시키는 가스성분으로서 시정장애, 온실효과 그 외에도 산성비의 원인으로 작용하며, 각종 산화제를 생성하여 2차 오염을 유발시키고, 광화학 smog를 발생시킨다. LNG를 제외한 대부분의 황 함유 연료의 연소시 SO2의 배출은 필연적으로써 SCR 공정의 촉매 활성저하 및 장치를 부식시키거나 막힘을 유발하고 촉매의 내구성에 문제를 가져 오기 때문에 일반적인 발전소 내 SCR 공정은 탈황설비(flue gas desulfurizer, FGD)를 전후로 설치하게 된다. 전단에 설치될 경우 촉매의 열적피로와 dust에 의한 마모 및 수명 단축 등의 문제가 발생하며, 후단에 설치될 경우 탈황공정이 습식으로 이루어지므로 배가스의 온도가 급격히 감소하여 최적의 효율을 얻기 위해서는 부가적인 열원을 필요하기 때문에 막대한 양의 에너지 사용이 불가피하다[4-7]. 또한 저온영역에서 NH3의 미 반응으로 인한 NH4NO3, NH4HSO4 등의 염의 생성으로 탈질효율이 저하되고 후단 장치에 부식을 초래한다[8,9]. 국내ㆍ외에서 저온 탈질촉매 개발을 위한 여러가지 시도가 이루어지고 있으나, SO2에 의한 촉매의 활성저하와 이에 대한 내구성을 갖는 촉매의 연구는 아직 미비한 실정이다.
현재 상용화 SCR 촉매는 V2O5-WO3/TiO2 계열로 촉매재료 전체를 바인더와 함께 교반하여 허니컴 형태로 압출성형하여 주로 사용되고 있다[10-15]. 압출 성형된 촉매는 열적 안정성이 우수하고 세공이 발달하여 표면적이 넓다는 장점이 있다[16]. 그러나 압출 성형된 촉매는 촉매 전체가 촉매성분으로 재료 특성상 고가이고, 내구성이 낮기 때문에 경제적이고 내구적 특성이 우수한 지지체 적용이 필요한 실정이다. 따라서 본 연구에서는 이러한 상용 촉매의 단점을 보완하기 위해 기계적 강도가 우수하고 열전도도가 높으며 높은 비표면적을 갖는 금속재질의 지지체인 metal foam이라는 지지체를 사용하였다. Metal foam은 체적필터이기 때문에 배기량에 비해 상대적으로 적은 부피를 유지 하고, 제조 특성상 경제적인 면에서 유리하다. 또한 세라믹이나 유기 고분자 재료의 다공질 재질에 비해 고온에서 사용이 가능하고 인성이 있으며 금속으로써 재활용이 가능한 특성을 가지고 있기 때문에 환경문제를 줄일 수 있는 장점이 있다[17].
본 연구에서는 이러한 환경 및 경제적인 문제점을 해결하고 보다 효율적인 공정적용을 위하여 저온 영역인 160~180 ℃에서 고 활성을 갖는 탈질 촉매를 개발하고자 metal foam을 지지체로 한 V2O5-Sb2O3/TiO2 촉매를 대상으로 하였다. TiO2를 담체로 하여 촉매의 주 활성성분인 소량의 V2O5와 저온영역에서 발생되는 SO2로 인한 촉매 피독 및 활성도 저하를 억제하기 위한 Sb2O3 그리고 촉매의 워시코팅 안정성을 위해 바인더를 첨가물로 혼합 담지하여 대상 촉매를 제조하였으며, Sb2O3의 함침량에 따른 저온 영역에서의 NOx 전환활성을 확인하고자 하였다.
본 연구에 사용된 metal foam 지지체는 (주)알란텀사의 alloy metal foam 3,000 μm이며, 코팅 slurry 시료는 Cristal Global사의 순도 99% TiO2와 대정화금사의 순도 99% V2O5, 대정화금사의 순도 98.5% Sb2O3, 바인더는 (주)에스켐텍 Colloidal Silica (30% solution), 분산제는 독일의 BASF사의 순도 83%인 dispexA40, 증류수 이다. 증류수, V2O5, Sb2O3를 온도 50 ℃로 유지시켜 녹인 후 TiO2를 넣는다. 그 후, 15분 동안 교반하여 코팅 slurry를 제조한 후 관례적인 워시코팅 방식(dip-sipping)으로 코팅을 하였다.
상압반응기 sample 조건에 따라 metal foam을 3.1 cm × 3.1 cm × 0.45 cm 크기로 24개를 재단한 후 TiO2 기준으로 V2O5 8 wt%, Sb2O3 0, 1, 2, 3 wt%로 각각 slurry를 제조하여 코팅량 180 g L−1로 정해 각각 6개씩 코팅을 하였으며, 제조한 촉매 (시료명 : MVSb0, MVSb1, MVSb2, MVSb3)를 건조 오븐에서 120 ℃로 1시간 동안 건조하였고, 500 ℃에서 3시간 동안 소성하였다.
샘플의 물리적/화학적 표면분석을 위하여 촉매 코팅하기 전에 slurry를 소성한 것으로 기공율 측정기(Porosimeter, Micromeritics사의 Autopore IV-9510), BET (Bell Japan사의 Belsorp mini), 표면성분 Ti, V, Sb 등을 중점적으로 분석하기 위해 SEM-EDX (Jeol사의 JSM-7,500F), XRF (Bench top model SEA2220A) 그리고 XPS (Ulvac사의 PHI 5000 VersaProbe)분석을 진행하였다. 기공율 측정은 0~60,000 psia 범위에서 측정하였고, 촉매의 비표면적 변화 유무를 알아보기 위한 BET 분석은 질소 분위기하에서 350 ℃에서 전 처리한 후 행하였다.
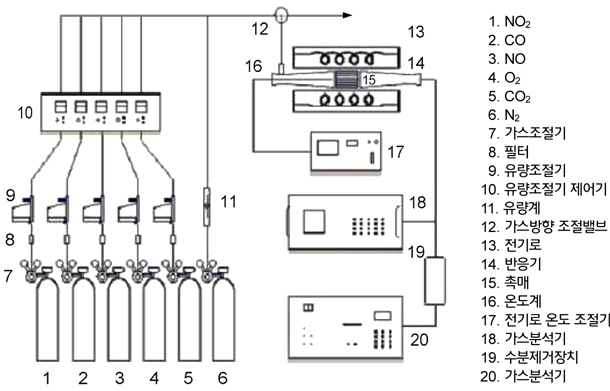
NOx 전환반응 실험 장치는 Figure 1과 같이 구성하였다. 반응 실험에 사용된 장치는 연속 흐름식 상압 반응기로서 촉매의 부피는 26 cm3이고, 발전소의 상용 SCR촉매 반응기의 배출가스를 모사하여 반응실험에 사용되는 모든 가스의 흐름은 MFC (Mass Flow Controller) [F-100C, Bronkhorst Co.]로 제어를 하였고, PID 제어기를 사용하여 반응 온도는 150~230 ℃의 범위로 조절하였으며, 공간속도는 5,000 hr−1 및 10,000 hr−1로 설정하였다. 반응가스의 조성은 Eurotron사의 Gas Analyzer [Greenline D max. II, 9000] 및 Teledyne사의 Chemiluminascent NO/NOx Analyzer를 사용하여 분석하였다. NO gas (Sung kang specaility gas, 10% in N2)는 350 ppm (v/v)을 정량적으로 흘려주었으며, NH3 gas (Sung kang specaility gas, 10% in N2)는 NO 의 농도와 일정하게 맞추도록 MFC를 이용하여 유입시켰다. O2 (Sung Kang specialty gas, 99.9%)의 농도는 15% (v/v)를 유지하였으며, SO2 gas (Sung kang speciality gas, 10% in N2)는 0 ppm 및 200 ppm의 두 가지에 대하여 진행하였고, N2 gas (Sung Kang specialty gas, 99.9%)로 총 유량을 유지하도록 하였다. 정확한 활성측정을 위하여 해당 반응조건에서 일정 시간 동안 안정화되었음을 확인한 후 반응실험을 수행하였다.
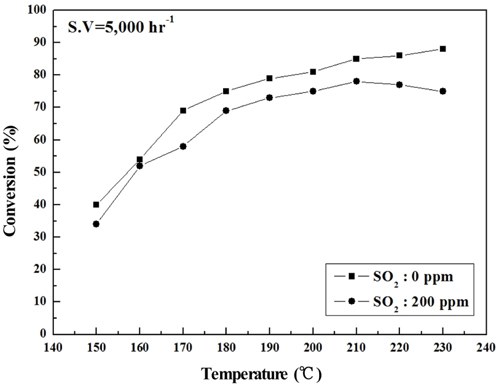
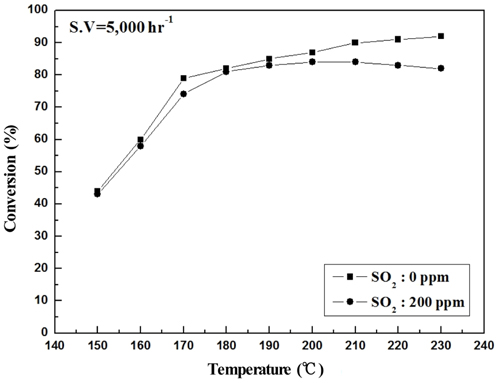
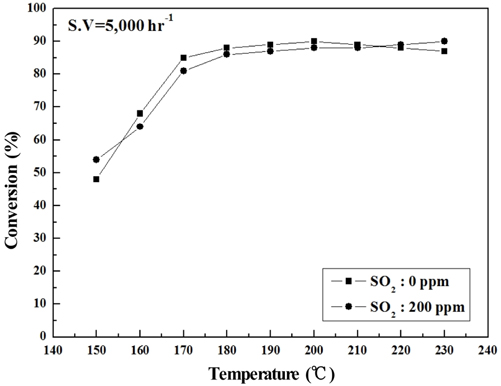
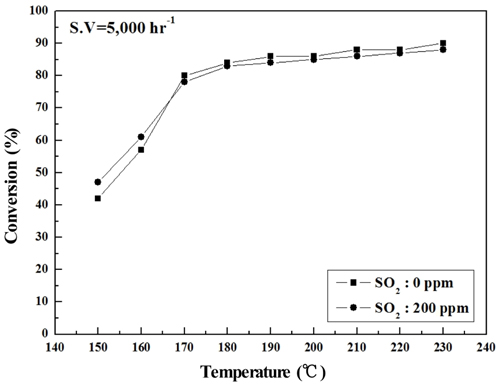
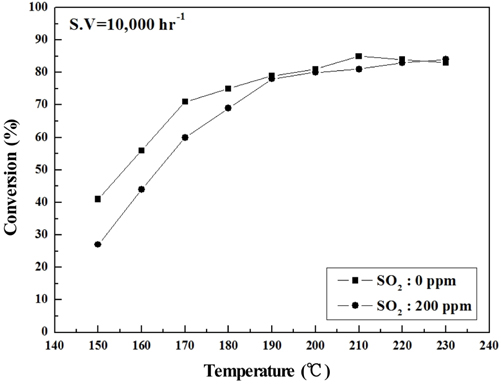
Sb2O3 함침량을 0~3 wt%로 달리하여 제조한 metal foam 촉매를 대상으로 하여 반응가스조건에서 SO2의 유무와 S.V. 조건에 따른 NOx 전환활성 측정 결과를 Figure 2~9에 나타내었다. Figure 2~5는 Sb2O3의 함침량 별로 S.V 5,000 hr-1에서 SO2의 유무에 따른 NOx 전환활성 측정결과로써 Sb2O3를 함침하지 않은 MVSb0 촉매 상에서는 SO2에 존재에 따른 촉매 피독에 의한 NOx 전환활성 저하가 반응온도 전 구간에 걸쳐 나타났으며, 고온으로 갈수록 차이가 점점 커지는 경향을 보였다. 한편, Sb2O3를 함침한 촉매들에서는 함침량이 증가함에 따라 저온영역(160~180 ℃)부터 이러한 NOx 전환활성 저하 현상이 회복되어 MVSb2, MVSb3 촉매에서는 활성온도 전 영역에서 SO2의 유무에 따른 NOx 전환활성 값의 차이가 거의 없었는데 MVSb2 촉매의 NOx 전환활성이 가장 우수하였다. 이러한 결과로부터 SO2 존재에 따른 NOx 전환활성 저하를 방지하기 위해서는 일정량 이상의 Sb2O3가 요구됨을 확인할 수 있었으며, SO2 200 ppm, S.V 5,000 hr−1 조건에서의 Sb2O3 함침량은 2 wt% 이상은 되어야하는 것으로 나타났다.
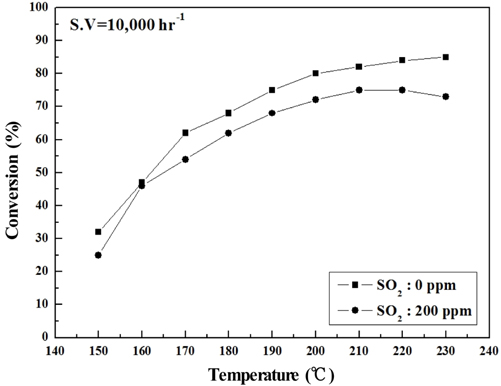
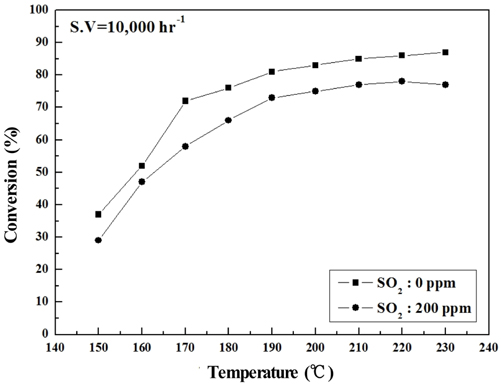
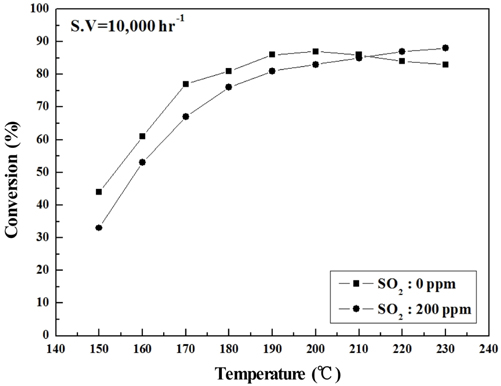
Figure 6~9에는 S.V 10,000 hr−1에서의 NOx 전환활성 측정 결과를 나타내었는데, 전체적으로 S.V 5,000 hr−1보다 NOx 전환활성도 낮아졌고. Sb2O3 함침에 따른 NOx 전환활성 회복도 상대적으로 미미하였다. 보다 상세하게 반응온도 구간별로 살펴보면 저온영역에서는 Sb2O3 함침량을 증가시켜도 NOx 전환활성 저하 폭이 그대로 유지되었으나, 200 ℃ 이상에서는 MVSb2, MVSb3 경우 NOx 전환활성이 회복된 결과를 보였다. 또한 S.V 10,000 hr−1에서도 MVSb2 촉매의 NOx 전환활성이 가장 우수하였고, Sb2O3가 없거나 일정량 이하이면 저온 영역에서 촉매가 SO2의 영향으로 피독되어 NOx 전환활성이 떨어지는 것으로 추측된다.
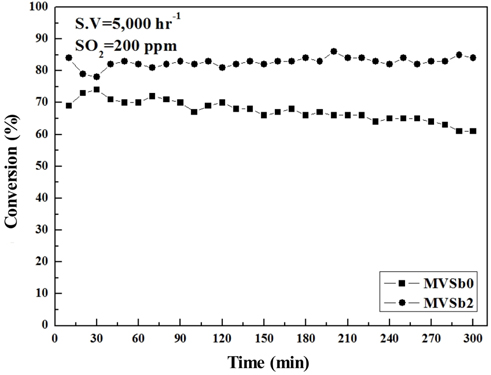
Figure 10에는 MVSb0과 MVSb2 촉매를 대상으로 SO2 200 ppm, 170 ℃ 조건하에서 5시간 동안 NOx 전환활성을 측정한 결과를 나타내었다. MVSb0은 반응초기에 NOx 전환활성이 일시적으로 증가하였다가 40분 정도 경과 후부터는 지속적으로 감소하는 경향을 보였다. 반면에 MVSb2는 초기에 NOx 전환활성 이 일시적으로 감소하였다가 점차 안정화되는 것을 볼 수 있었으며, SO2와 장시간 접촉시키더라도 저온영역에서 NOx 전환활성은 유지됨을 확인할 수 있었다.
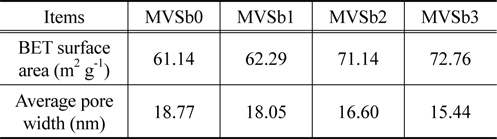
촉매의 비표면적과 기공크기 분포를 BET 및 porosimeter로 측정한 결과를 Table 1에 나타내었다.
[Table 1.] BET surface area and average pore diameters of the prepared catalysts
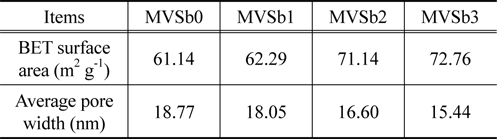
BET surface area and average pore diameters of the prepared catalysts
Table 1에서 보는 것과 같이 촉매의 비표면적은 Sb2O3의 함침량이 증가함에 따라 증가하였으며, 반대로 평균 기공의 크기는 줄어드는 것으로 나타났다. 그러나 MVSb0을 기준하여 MVSb1의 변화폭은 미미하였고, Sb2O3의 함침량이 2 wt% 이상인 MVSb2와 MVSb3 경우는 큰 폭의 변화를 보였으며 상호간의 차이는 그다지 크지 않았다. 이는 Sb2O3의 함침량이 일정량 이상인 경우에 촉매 작용을 일으키는 활성점들이 분포되는 미세 기공들을 상당량 생성되는 것으로 판단되며, 본 연구에서 수행한 NOx 전환활성 측정 결과와도 부합됨을 확인하였다.
Sb2O3의 함침량 별로 제조된 촉매의 비표면적 결과에서 알수 있듯이 MVSb1의 표면에는 Sb2O3 및 촉매 활성성분이 많지 않은 것으로 추정할 수 있었다. 따라서 촉매의 표면 변화를 좀 더 구체적으로 관찰하기 위하여 촉매 표면 상태를 관찰할 수 있는 SEM 분석을 수행하였고, 대표적인 결과를 Figure 11에 나타내었다. MVSb2의 경우는 촉매표면에 미세하게 활성성분이 상대적으로 다량 분포 되어 있는 것을 볼 수 있으며, 이로부터 MVSb2의 촉매가 NOx 전환활성이 다른 촉매보다 우수하였음을 확인할 수 있었다.
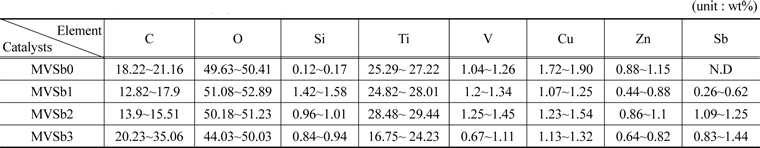
촉매 표면의 성분분석을 위하여 촉매 코팅하기 전에 slurry를 소성하여 파괴하지 않은 상태에서 준비된 촉매의 시료에 대한 EDX 분석을 수행하여 그 결과를 Table 2에 나타내었다. Sb2O3의 함침량이 많을수록 EDX와 XRF분석결과에서도 함침량이 많아졌음을 확인할 수 있었다.
[Table 2.] EDX analysis results of the prepared catalysts
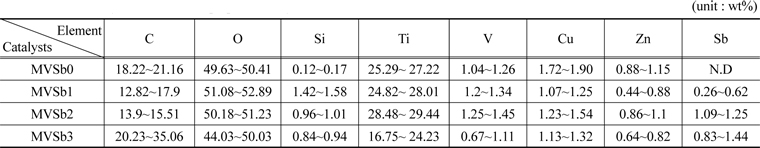
EDX analysis results of the prepared catalysts
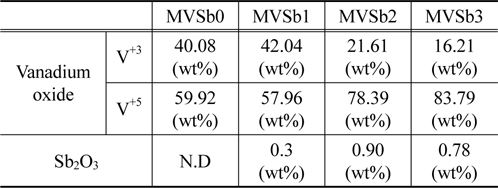
담체와 활성금속간의 상호작용에 의하여 생성되는 바나듐 산화물의 종류와 촉매 표면에서의 Sb2O3 함량을 확인하기 위하여 XPS 분석을 실시하였다. Excitation source로 Al Kα monochromator (1468.6 eV) anode를 사용하였고 진공도는 2.0 × 10−7 Pa를 유지하였다. Figure 12에는 바나듐 peak를 분리하여 나타내었는데 양론적 화합물인 V+5와 V+3의 비양론적인 화합물의 peak가 관찰되었다[18]. 이는 V2O5가 TiO에 담지 되면서 두 물질의 상호작용에 의하여 비양론적인 산화물이 생성되는 것으로 판단된다.
촉매에 따른 2종류의 바나듐 산화물의 상대비율 및 Sb2O3 함량 변화를 Table 3에 나타내었다. MVSb1 경우는 V+5와 V+3의 비율이 비슷하였으나 Sb2O3 함침량을 증가시킨 MVSb2, MVSb3 촉매에서는 V+5 산화물 비율이 급격히 증가한 것으로 나타났으며, Sb2O3 함량도 증가하였는데 MVSb2 촉매가 MVSb3 촉매보다 높은 것으로 측정되었다. 이러한 결과로부터 V+5 산화물이 NOx 전환활성에 대한 기여도가 상대적으로 크고, Sb2O3 함량이 제일 높은 MVSb2 촉매가 SO2에 대한 내구성이 가장 우수하여 저온영역에서 NOx 전환활성이 가장 좋았던 것으로 추정된다.
[Table 3.] XPS analysis results of the prepared catalysts
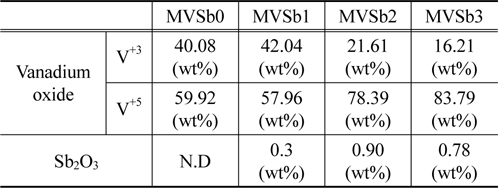
XPS analysis results of the prepared catalysts
저온에서 metal foam 지지체를 사용하여 SO2에 대한 내구성을 높이고 NOx 전환활성을 향상시키기 위한 연구를 수행한 결과 다음과 같은 결론을 얻을 수 있었다.
Sb2O3를 함침한 촉매들의 NOx 전환활성 측정결과, 저온 온도 범위인 160~180 ℃에서는 SO2 존재 유무에 따른 NOx 전환활성 차이가 거의 없는 것으로 나타났다. 그러므로 Sb2O3 성분이 SO2에 대한 내구성에 효과적인 작용을 하는 것으로 판단된다. Sb2O3 함침량을 달리하여 제조한 촉매의 NOx 전환활성을 측정한 결과 저온 온도 범위인 160~180 ℃에서 MVSb2가 가장 높은 NOx 전환활성을 보였고 SO2에 대한 내구성 또한 우수한 것으로 나타났다. NOx 전환활성 효율을 확인하고 V2O5와 Sb2O3의 함량을 조절하여 사용한다면 활성온도 영역에 따라 적용 가능한 저온촉매 제조가 가능하리라 예상된다. Sb2O3의 함침량이 증가할수록 전반적으로 촉매의 비표면적은 증가하였고, 평균기공크기는 감소하는 것으로 나타났는데, MVSb0를 기준하여 보면 MVSb1은 거의 변화가 없었으나 MVSb2와 MVSb3는 큰 폭의 변화를 나타내었다. MVSb2가 가장 높은 NOx 전환활성을 나타낸 것은 표면 성분 분석 결과 Sb2O3 함량이 MVSb3 보다 MVSb2가 더 높아 SO2에 대한 내구성이 증가했음에 기인한 것으로 추정된다.