As the quality of life has improved, the desire for the safety and quality of the foods and drugs has been gradually increasing. For safety and quality management in foods, drugs, health management, agriculture, environmental conservation, and the industrial fields, the demand for quickly and accurately measuring various chemicals has been increasing. As well, the desire for self-diagnosis of one’s own health state and self-examining the safety of environment has been gradually increasing. Optical Isomers can have very different physiological effects on human beings. One isomer can exhibit desirable pharmacological, pharmacodynamic, pharmacokinetic and physiological properties, while the other isomer can exhibit undesirable and toxic properties toward living organisms, especially human beings. And they can exhibit different activities in chemical and biotechnological processes. Although the majority of commercially available drugs are now both synthetic and chiral materials, a most chiral drugs are still marketed as racemic drugs. Thus, to avoid possible undesirable side effects from chiral drugs, more effective methods for separating and recognizing chiral compounds are urgently needed. In this report, we investigated the overall developing trends of the chiral drug separation and analysis technology by using molecular recognition.
21세기는 고령화 사회, 고도의 정보산업 사회와 더불어 웰빙 문화가 하나의 커다란 키워드로 등장하고 있다. 이에 따라 의료, 환경, 그리고 정보에 관한 연구개발이 21세기의 3대 새로운 연구 과제로 부각하고 있다. 더구나 소득 증가에 따라 생활이 윤택하여지고 산업기술이 고도화 되어감에 따라 건강과 환경 및 다양한 정보에 대한 관심이 고조되고 있다.
과학 기술의 발달로 평균수명이 급격히 연장되어감에 따라 건강식품과 의약품에 대한 의존도와 수요도 급격하게 증가하는 추세이다. 최근에는 의약품의 부작용, 건강식품의 부작용, 환경오염과 더불어 수입식품이 급증함에 따라 국내식품의 오염위험성 증가 등이 사회적인 이슈로 등장하고 있다. 부작용이 없는 의약품의 개발, 환경과 식품산업의 건전성 향상을 위해 신속 간편하며 정확하게 건강과 환경을 계측할 수 있는 기술의 개발과 환경 오염물질 및 유해물질을 신속히 검출할 수 있는 기술개발 또한 시급한 과제로 부각되고 있다.
세계적으로 시판되는 의약품 가운데 50% 이상을 차지하는 것이 광학이성질체인 키랄 의약품이다. 일반적으로 화학반응에 의하여 인공적으로 의약품을 합성하면 50% 비율로 광학이성질체가 생성되어지는데 2종의 광학이성질체가 같은 양으로 혼합된 키랄 혼합물을 라세미(racemic) 혼합물이라고 한다. 이 라세미 혼합 의약품의 두 거울상 이성질체(enantiomer)들은 투여 후 각기 다른 속도로 분해, 흡수 및 활성화할 수 있다. 의약품으로 사용할 경우 한 형태의 광학이성질체는 인체에 해가 없고 질병 치료 효과도 좋지만 또 다른 형태의 광학이성질체는 질병 치료 효과는 없으면서 생명을 위협할 정도로 독성이 강한 경우가 많다[1,2].
광학이성질체는 화학구조식, 결합 순서, 녹는점, 끓는점 등 화합물의 기본 물성이 같기 때문에 하나의 형태로 순수한 성분으로 분리하는 것이 매우 어렵다. 더구나 100% 분리가 거의 불가능에 가까워서 의약품 부작용의 주요 원인으로 손꼽히고 있다. 부작용이 없는 의약품의 개발에 있어서 가장 중요한 과제 중의 하나가 의약품용 광학활성물질(이성질체) 분석 및 분리이며, 하나의 형태의 광학이성질체를 생성하는 것은 화학계의 오랜 숙원이기도 하다.
나노기술의 발전이 기존 환경기술의 패러다임 자체를 변화시키고 있듯이 키랄 의약품 분리ㆍ분석 기술 개발에도 새로운 패러다임을 제공할 수도 있을 것이다. 나노수준에서의 분자자기인식 기법을 토대도 키랄 의약품 센싱 및 모니터링 분야의 발전도 기대된다[3].
본고에서는 키랄 의약품, 기존의 키랄 의약품 분리기술, 분자자기인식 기법, 그리고 분자자기인식 기법에 의한 키랄 의약품 분리기술 개발동향에 대한 간단한 소개와 분자자기인식 기법에 의한 키랄 의약품 분리기술 개발 현황과 그 시장성에 대해 고찰하고자 한다.
의약품은 분자 구조에 따라 화학합성 의약품과 바이오 의약품으로 분류되어진다. 화학합성의 과정을 통하여 제조되는 화학합성 의약품(chemical medicine, small molecule drug)과 달리, 바이오 의약품은 유전자 재조합 또는 세포배양과 같은 생명공학기술에 기반을 두어 제조되는 특징을 갖는다[4]. 바이오 의약품은 구조, 크기, 제조방법, 투여경로, 체내 분포 등 다양한 면에서 화학합성 의약품과는 다른 특징을 나타낸다. 이러한 특징은 그대로 바이오 의약품의 장단점으로 연결된다.
바이오 의약품의 구조는 대표적으로 단백질이며 크기는 10 kDa 이상의 거대분자이다. 세포에 의해 생산되기 때문에 순도는 보통 불균일 혼합물로서 일정범위의 규격을 가진다. 정맥주사 등 비경구투여하며 혈장 또는 세포 외액에 분포한다. 반면, 화학합성 의약품은 구조는 유기화합물이며 분자량이 0.1 ~ 1 kDa 정도의 저분자량이다. 화학적 합성에 의해 제조하기 때문에 단일구조로서 높은 순도를 가진다. 대부분 경구투여하기 때문에 기관 내지는 조직에 널리 분포한다.
키랄 의약품은 현재 세계에서 팔리는 약품 매출액의 절반을 차지하고 있으나 현재 시판되는 대부분의 키랄 의약품들은 라세미 혼합물들로 이루어져 있다. 즉, 99.999%의 순수한 의약품이 아니라 49.999% 순도의 의약품들인 것이다. 2종의 광학이성질체가 같은 양으로 혼합된 라세미 혼합물은 광학적으로 비활성이다. 두 거울상 이성질체들은 같은 의약기능을 하는 경우도 있으나 한 성분은 유용한 약품으로 작용하는 반면, 다른 성분은 약품으로써 작용을 하지 않거나 경우에 따라서는 해로운 작용을 할 수도 있다.
아미노산들은 키랄탄소를 가지고 있어 D-아미노산과 L-아미노산의 두 광학이성질체가 가능하나 생명체에서는 L-아미노산만이 발견된다. 그러나, 실험실에서 인공적으로 아미노산을 합성하면 D-아미노산과 L-아미노산은 정확하게 1 : 1로 만들어진다. 키랄탄소를 가진 광학이성질체들은 보통의 경우 편광면의 회전능력, 즉 광학활성(optical activity)을 제외한 그 밖의 물리적ㆍ화학적 성질이 동일하다. 그러나, 다른 광학활성 물질과의 상호작용에서는 각 이성질체들의 반응성이 판이하게 다른 경우가 많다.
아스파라긴의 한 이성질체는 맛이 쓰고 다른 하나는 맛이 달다. 알레르기성 비염에 쓰이는 알 테르페나딘의 광학이성질체 에스 테르페나딘은 졸리는 등의 부작용이 있다. 심지어는 한 이성질체는 질병을 치료하는 약으로 작용하고 다른 이성질체는 독극물로 작용하는 경우도 있다. 탈리도마이드는 졸음과 수면을 유발하는 진정효과로 임산부의 입덧 치료제로 주로 사용되었다가 이 약을 복용한 임산부에서 단지증 등의 기형아 출산이 보고되면서 1960년대 말에 금지된 약물이다. 에탐부톨(ethambutol)의 한 종류는 결핵에 효과가 있는 반면, 다른 종류는 실명을 유발한다. 나프록센의 한 종류는 관절염 등에 효과가 있는 진통제인 반면, 다른 종류는 진통 효과도 없으며 간에 독성을 유발한다[2,5].
이런 이유로 의약품의 효능 및 안전성 향상 등을 위해 순수하게 분리된 단일 거울상 이성질체 약품의 생산이 요구된다. 라세미 혼합물 의약품으로부터 단일 거울상 이성질체 의약품으로의 전환은 1992년 FDA에 의해 발표된 ‘단일 거울상 이성질체의 키랄 의약품을 생산하는 것이 적절하다면서 1992년부터 새로 개발된 모든 신약에 대해 반드시 두 개의 광학이성질체를 구분하여 어느 한쪽이라도 부작용이 없음을 증명하라고 요구하다.’는 정책으로 인하여 폭발적으로 증가하고 있다. 그중에서도 단일 거울상 이성질체의 키랄 약품 개발 방향은 새로운 합성방법 개발과 기존 라세미 혼합물을 분리하는 방법에 대한 연구가 활발하게 진행되고 있다. 그러나, 현재 국내 의약품 개발능력과 새로운 제조 방법에 투입되는 많은 개발노력과 개발비를 고려할 때 현재 시판 중인 라세미체 혼합물들을 고도 분리하여 단일 거울상 이성질체 의약품으로 재개발하는 방법(racemic switches)도 하나의 개발 방법이 될 것으로 예상되며, 단일 성분의 키랄 의약품의 개발(racemic switch)이 계속 일어날 것이다[1,2].
순수한 광학이성질체들의 합성이나 분리가 매우 어렵고 적당한 분석방법도 없기 때문에 의약품에 있어서 불필요한 이성질체의 존재여부의 확인과 동시에 이를 제거할 수 있는 방법은 시급하게 필요한 기술이라 할 수 있다. 실험실에서 인공적으로 합성된 화합물의 경우 각각의 광학 이성질체가 50 : 50으로 섞여있다는 합성화학의 현실적인 한계를 고려한다면 이들 이성질체 중에 불필요한 이성질체를 확인하고 분리하는 기술은 합성기술 만큼이나 중요하다고 할 것이다.
생명공학정책연구센터가 발간한 ‘IMS에서 본 글로벌 의약품 시장 전망’에서 오는 2018년까지 글로벌 의약품 시장이 최대 1조 3100억 달러에 이를 것으로 전망했다. 이는 지난해 이후 글로벌 경제 회복기조의 지속과 고령화 인구의 급속한 증가, 만성질환의 진단 및 치료기술의 발달, 개발국 시장에서의 보건의료서비스에 대한 접근성 향상 등에 기인한 것이다[6].
Min[7] 연구원은 “세계 경제의 회복으로 인해 한국과 인도 등을 포함한 아시아 국가의 수출이 증가하고 있다”며 “아시아 국가들의 의약품 소비도 크게 늘어나 2013년 29%에서 2018년 36%로 증가가 예상된다”고 설명했다. 특히 동남아시아는 인구 및 소득의 증가와 보건의료에 대한 접근성 증가로 글로벌 평균보다 두배 이상 높은 성장이 예상되고 있다. 향후 글로벌 의약품 시장은 제네릭 의약품과 특수 의약품의 비중이 높아질 것이라고 내다봤다.
제약회사는 재정적 압박을 피하기 위해 신약 개발과 동시에 제네릭 사업을 수행한다. 제네릭 시장은 3년 정도 수익을 내는 단기적 전략이지만 미국 식약청의 까다로운 절차로 신약개발의 침체와 불확실성이 앞으로 계속될 것이다. 미국 제약사들은 사업 활성화 전략으로 ‘단일 성분의 키랄 의약품의 개발’과 ‘해외에서의 위탁생산과 위탁 임상’, 그리고 ‘해외 신약 연구 개발 센터의 설립’ 등을 통해 신약 개발의 위험 부담을 줄이고자 하고 있다[1].
현재 시판되고 있는 대부분의 의약품은 기존의 분리방법으로는 분리할 수 없는 물리ㆍ화학적 성질이 동일한 두개의 광학이성질체의 혼합물이다. 그러나 의약계에서는 키랄 의약품의 중요성이 더욱 증가하고 있는 추세이다. 또한, 개발되고 있는 대부분의 의약품들은 키랄 센터를 갖고 있는 화합물의 형태로 합성되므로 “광학이성질체들을 어떻게 하면 순수하게 분리할 수 있을까?”가 최근에 세계 제약업계의 주된 관심의 대상으로 떠오르고 있다. 일례로, 제약업계는 보다 순도 높은 키랄 의약품을 경제적으로 생산할 수 있는 방법 개발을 위해 년간 1450억 달러 이상의 연구비를 투자하고 있다. 연간 10억 달러 이상의 매출을 올리는 키랄 의약품을 블록버스터(blockbuster)라고 하는데 이러한 키랄 의약품이 시장에 출시되는데 시간이 지체되면 그만큼 많은 손해를 보기 때문이다. 예를 들어 연간매출 12억 달러의 블록버스터 의약품의 출시가 1 달 늦어지면 1억 달러 이상의 손해를 보게 된다.
세계시장의 500대 의약품 품목의 수요 중 58%가 키랄 화합물이고 판매액의 55%가 키랄 화합물이다. 의약 중간체나 의약 원료완제를 공급하는 정밀화학업체에서는 키랄 화합물 관련 기술 연구에 많은 투자를 하고 있다. 현재 단일키랄 화합물의 시장은 세계 의약산업 전체 매출 $3900억 중 ⅓에 해당하는 $1330억이며 이것은 2010년에는 전체매출액은 $7200억 중에 $5040억(전체매출액 대비 70%)으로 급속히 증가하리라 예상하고 있다.
키랄 의약품은 현재 세계에서 팔리는 약품 매출액의 절반을 차지하고 있기 때문에 전 세계적인 의약품 산업의 경향 중의 하나는 원하는 의약 효과만을 나타내는 단일 광학이성질체의 키랄 의약품을 생산하는 것이며 이에 관한 많은 연구 개발이 선진국에서 진행 중에 있다. 시장규모가 크고 잠재 성장률이 높은 키랄 의약품을 생산하는 기술의 개발은 국내 의약품 산업의 심화된 선진국 의존도를 해결할 수 있는 한 가지 돌파구가 되리라 판단된다. 이에 발맞추어 키랄 제품 생산을 위한 산업용 분리공정의 상업화는 빠른 속도로 진행되고 있다[1,2].
한 쌍의 키랄 이성질체는 형태, 색상, 녹는점, 끓는점, 점성 등 대부분의 이화학적 성질이 동일하지만, 각각의 키랄 이성질체에 대하여 생물체는 달리 반응한다. 즉 생물체는 한 쌍의 키랄 이성질체를 인식할 수 있다는 말이다.
키랄성 유기합성 농약인 경우 합성과정에서 한 쌍의 키랄 이성질체가 동일한 비율로 생성된 라세미 혼합물이다. 키랄 이성질체의 한 형태가 다른 한 형태보다 독성이 더 강한 경우가 많으며 대사율도 다른 경우가 많다. 독작용과 생물전환반응에 관여하는 생체의 수용체 또는 효소의 입체적인 구조가 어떤 한 형태에 대해 친화도가 다른 한 형태에 대한 친화도보다 더 높거나 낮기 때문에 그러하다.
키랄 분자들이 생물에 미치는 활성 또한 다르다. 생체 내에 입체이성질체들의 구조적인 차이를 구별하여 반응하는 입체선택성(stereoselectivity)을 가지는 어떤 물질이 있다고 추정할 수 있다. 카르본(carvone)의 경우 (+) 거울상이성질체는 캐러웨이(caraway) 씨앗의 향을 띠지만, (−) 거울상이성질체는 스피아민트(spearmint) 향을 띤다. 냄새를 감지하는 코 속의 수용체가 이들 한 쌍의 거울상이성질체를 구별한다는 말이다[1,2].
그러면 이러한 차이를 어떻게 설명할 수 있는가?
어떤 물질이 생물활성이 있다는 말은, 어떤 물질이 생체 내의 어떤 부분과 결합하거나 또 다른 어떤 물질과 반응한다는 말이다. 우리는 이 어떤 부분을 수용체(receptor)이라고 한다. 수용체는 입체적 구조물이다. 생물활성이 높은 물질은 이러한 입체적 구조물과 잘 결합하는 물질이라고 볼 수 있다. 입체이성질체 간에 생물학적 활성 차이가 나는 경우는, 이들 이성질체가 특정 수용체와 결합하는 데에서 차이가 나는 경우이다[1].
생체 내에는 효소 이외에도 화학 물질을 식별할 수 있는 물질이 많이 존재한다. 예를 들면, 항체 혹은 항원, 리셉터도 특정한 화학 물질을 인식하는 기능을 가지고 있다. 또한 생체 인식력을 모방한 앱타머(aptamer), 펩토이드(peptoid), 혹은 고분자를 합성하여 이들 합성 고분자의 분자 인식 메카니즘을 응용하기도 하고 혹은 탄소 나노튜브 등 나노세공 분자체를 합성하여 분자 인식에 응용하기도 한다[8-13].
앱타머(aptamer)는 단일염기서열인 DNA나 RNA로 이루어져있으며 염기 서열이 만들 수 있는 특이적인 3차원적 구조에 의해 다양한 표적 물질에 대한 특별한 친화력과 특이성을 가지는 생체물질감지 소재로 바이오 분야의 블로오션으로 각광받고 있다. 앱타머는 항원항체 반응과 같이 생체물질감지 소재로 활용될 수 있으나 화학적으로 합성되기 때문에 균일하게 생산하기 쉽고, 저비용으로 고순도의 앱타머를 생산할 수 있어 공정을 스케일-업 하기 쉽다. 또한 크기가 작고 항체보다 안정하며 변형이 쉬워 생체 내(in vivo)에서 효능과 전달지속성을 조정하기 유리하며, 변형에 의해 활성을 잃지 않기 때문에 고정화하거나 표지가 쉬우며 가역적으로 변화 가능한 구조를 가지고 있어 재사용이 가능한 장치를 만들기 유리하다[8].
펩토이드(peptoid)도 펩타이드(peptide)를 모방해 만든 인공 고분자(폴리머)이기 때문에 펩타이드 결합(peptide bond)이 없어 단백질 가수분해 효소로부터 자유로울 수 있다. 펩토이드는 고체상 합성 방법을 이용하여 상대적으로 쉽게 합성을 할 수 있으며, 원하는 배열(sequence) 혹은 체인 길이를 인위적으로 조절이 가능하다는 장점이 있다. 합성된 펩토이드는 몸에서의 대사 안정성이 좋기 때문에 항암제와 향균제 등 다양한 분야에 이용이 가능하다. 최근에는 면역반응에 있어서도 펩타이드보다 현저히 줄어든 새로운 형태의 펩토이드 모방체가 개발되기도 하였다[9,10].
서로 상반되는 생리 활성을 나타내는 거울상 이성질체를 분리하기 위해 이성질체를 인식할 수 있는 분자 인식형 고분자(molecularly imprinted polymers, MIPs) 분리막 제조연구[11-13] 혹은 분자크기 세공구조를 갖는 나노세공 분자체는 구조적인 다양성을 이용한 분자 인식[14] 응용연구도 활발히 진행되고 있다.
분자인식소자를 화학 물질식별소자로 이용한 바이오센서는 바이오테크놀로지의 성과의 하나로써 각종 분야에 있어서 현재의 분석 기술의 대용으로 주목받고 있다.
분자인식기법을 활용한 대표적인 분야로 분석분야와 분리 분야가 있다.
생활이 윤택하여짐에 따라 건강관리, 환경보전, 농업, 화학공업 등 여러 분야에서 유해한 화학물질을 간단히 측정할 수 있는 계측기기가 요망되고 있다. 즉, 자기 건강을 자가 진단하고자 하며, 자기가 사는 환경의 안전성 여부를 스스로 확인하고자 하는 욕구가 증대되고 있다. 뿐만 아니라 고령화 사회에 진입함에 따라 노인들의 원격 진단도 요망되고 있는 실정이다. 이들 분야에는 여러 종류의 화학물질이 공존하고 있기 때문에 한 가지 물리적 변수를 측정하는 물리센서와는 달리 여러 화합물이 섞여져있는 혼합물 가운데 특정 화학물질을 선택적으로 측정할 수 있어야 한다. 이런 계로부터 특정한 화학 물질을 선택적으로 측정하기 위해서는, 이들 화학 물질에 대하여 선택적으로 응답하는 분자인식 기법을 이용하지 않으면 안 된다.
화학 물질을 엄밀하게 식별할 수 있는 센서시스템을 개발하기 위해 생체계로부터 많은 것을 모방하였다. 세균 등의 단세포 생물에서부터 고등 생물과 같은 다세포 생물에 이르기까지 각종의 생체계는 각종 자극물에 대하여 감각 기관을 가지고 있다. 이 덕택으로 생명체는 신체를 일정 상태로 유지하며 신체가 정상적으로 기능을 발휘할 수 있도록 반응을 진행시킬 수 있다. 또한, 환경을 측정하거나 적으로부터 신체를 보호한다. 생체계의 분자인식 원리에 기초한 각종 센서가 개발되었다. 예를 들면 리셉터를 이용하는 리셉터센서, 항원ㆍ항체반응을 이용하는 면역 센서, 동ㆍ식물 세포를 이용하는 세포 센서 및 동ㆍ식물 조직을 이용하는 조직 센서 등이 있다[15].
생체분자를 인식하는 부분은 DNA나 RNA와 같은 핵산으로 구성된 바이오칩에 대한 연구가 활발히 진행되었으며 이는 임상의료 부분에서부터 시작해 최근 환경모니터링 용도에까지 폭넓게 연구 개발되고 있다. 핵산을 측정하는 바이오칩은 검출물질의 안정성 및 센싱 시스템의 구성이 비교적 수월하다는 장점이 있으나, 유해물질이나 병원균을 직접적으로 측정하지 못한다는 단점이 있다. 이를 보완하기 위해 질병을 일으키는 직접적인 원인물질로서 측정이 가능한 단백질 칩에 대한 관심이 증대하고 있다[16,17].
분리에 대한 응용의 대표적인 것이 크로마토그래피를 이용한 분리이다. 액체크로마토그래피(HPLC)나 가스크로마토그래피(GC)의 칼럼에 사용하는 일부 충진제 등도 한 쌍의 거울상 이성질체에 대하여 상호작용의 강도가 다르기 때문에 이러한 충진제(키랄 정지상, chiral stationary phases, CSP)를 이용하여 각각의 거울상 이성질체를 분리하기도 한다[1,2].
앱타머를 이용한 분리기술 분야는 그동안 앱타머를 리간드로 비드에 고정화하여 친화성 크로마토그래피(affinity chromatography)나 모세관 전기영동(capillary electrohporesis) 방법으로 단백질을 분리하는 등의 기초적인 연구들이 보고되긴 했으나 많은 연구가 이루어지지는 않았다. 그런데 최근에 광학이성질체를 인식할 수 있는 앱타머들에 대한 연구 보고들이 발표되면서 이들을 이용한 앱타머 기반 이성질체 분리기술에 대한 연구들이 계속해서 보고되고 있다[8].
기존 분석ㆍ분리기술의 한계를 극복하기 위한 방법의 하나로 자기조립(self-assembly)과 분자인식(molecular recognition)에 근거한 새로운 분자 분석ㆍ분리기술(molecular separation technique)에 대한 연구도 본 그룹에 의해 활발하게 시도되고 있다[18-21].
키랄성 화합물의 합성과정에서 일반적으로 한 쌍의 거울상 이성질체가 동일한 비율로 생성된 생성물이 라세미 혼합물이다. 이들의 물리화학적 특성이 동일하기에 일반적으로 분리가 쉽지 않다. 대표적인 분리 방법으로는 크로마토그래피(HPLC)를 응용한 분리법이 있다. 크로마토그래피 분리를 응용한 분리에 관하여 간단히 소개하고자 한다.
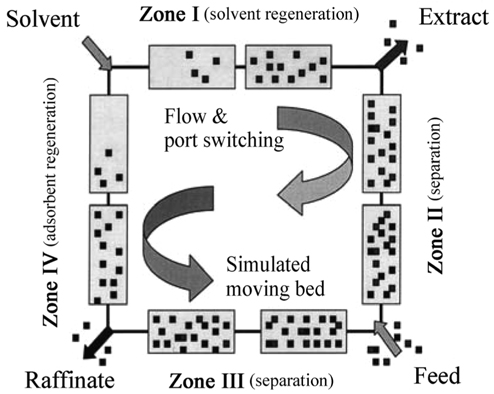
회분식 고성능 액체 크로마토그래피는 칼럼에 채워진 고정상을 광학적 비대칭으로 만들어 한 쌍의 광학이성질체가 칼럼을 통과함에 따라 비대칭 고정상과 상호작용을 하게 함으로써 두 광학이성질체를 분리하는 방법이다[1]. 키랄의약품 광학분할을 위한 하나의 도구로서 사용되는 simulated moving bed (SMB) 기술은 회분식 크로마토그래피의 단점인 많은 용매 소비와 그에 따른 용질의 희석, 그리고 칼럼의 낮은 효율을 보완할 수 있는 기술로서 두 물질의 흡착능 차이를 이용한 연속 분리공정이다[2]. 회분식 크로마토그래피의 생산성의 한계를 극복하고자 연속적인 분리가 가능한 true moving bed (TMB)가 연구되기 시작하였고, 이 공정에서는 고정상과 이동상이 역방향으로 움직인다[1]. 하지만 TMB에서 고정상을 이동상의 반대 방향으로 이동시키는 것은 흡착제의 기계적인 마모가 일어날 수 있고, 이동상과 고정상의 속도를 일정하게 유지하는 것이 매우 어렵다는 단점이 있다. 이러한 형태의 조업은 각 상에서의 불균일한 속도 때문에 성능이 떨어지게 된다. 이런 문제점으로 인해 실제 적용이 어려워 충진제의 흐름을 밸브의 조작에 의해 모사하는 SMB 크로마토그래피가 개발되고 있다. TMB 시스템의 고정상 흐름에 따른 문제를 해결하기 위해 개발된 SMB 크로마토그래피는 한 개의 긴 칼럼을 여러 개의 작은 칼럼으로 분할하여 서로 직렬로 연결하여 구성된다[2].
SMB 크로마토그래피는 고정상 흡착제와 이동상이 서로 반대 방향으로 움직이도록 칼럼사이의 밸브 스위칭이 이루어진다. 밸브 스위칭 방향과 이동상의 움직이는 방향이 같아 고정상과 이동상이 반대 방향으로 움직이는 효과를 유도한다. 다수의 칼럼의 중간 부분에서 유입되는 혼합물은 시료 주입구로부터 일정 거리에서 단일 성분으로 분리가 이루어져 칼럼들의 양단에서 연속적으로 배출된다[1].
SMB 크로마토그래피의 개략도를 Figure 1에 나타내었다. SMB 크로마토그래피에서는 실제로 고정상 흐름은 없고 일정시간(switching time)마다 용매(solvent), 추출(extract), 시료(feed), 그리고 라피네이트(raffinate)의 포트(port) 위치를 이동상이 흐르는 방향으로 변화시키면 각 포트를 중심으로 칼럼이 상대적으로 이동상이 흐르는 반대에 놓이게 된다. 이렇게 가상의 고정상 흐름을 만들어 이동상과 향류흐름을 모사할 수 있다. 용매, 추출, 시료, 그리고 라피네이트의 포트 위치를 연속적으로 이동시킬 수 없지만 다중 접속 라인(multiple access line)을 설치하여 다중 위치 밸브(multi-position valve, rotary valve)를 이용함으로써 주기적으로 각각의 흐름을 이웃한 라인으로 이동시켜줌으로써 거의 같은 효과를 얻을 수 있다[2].
최근에 활발하게 연구되고 있는 키랄 의약품 분리 연구에 대한 간략한 소개를 하면서 키랄 의약품 분리의 중요성을 이해하고 광범위한 연구자들의 연구 개발을 기대하여 본다.
앱타머를 이용한 분리기술 분야는 그동안 앱타머를 리간드로 비드에 고정화하여 친화성 크로마토그래피나 모세관 전기 영동 방법으로 단백질을 분리하는 등의 기초적인 연구들이 보고되긴 했으나 많은 연구가 이루어지지는 않았다. 그런데 최근에 광학이성질체를 인식할 수 있는 앱타머들에 대한 연구 보고들이 발표되면서 이들을 이용한 앱타머 기반 이성질체 분리기술에 대한 연구들이 계속해서 보고되고 있다. 앱타머 기반의 분리기술은 앱타머의 표적에 대한 높은 특이성에 기반을 두고 있으며 특히 저분자물질 표적에 대해서는 기능기 하나의 차이나 이성질체간의 구별이 가능한 것으로 알려져 있다. 앱타머의 표적에 대한 높은 특이성을 이용한 앱타머 기반 분리기술이 활발히 진행되고 있다. Drolet et al. [8]에 의해 1999년에 처음으로 앱타머를 비드에 고정화시켜 친화성 크로마토그래피의 고정상으로 사용한 연구가 보고되었다. 그들은 Human L-selectin 단백질에 대한 36-base의 앱타머를 바이오틴-아비딘 결합을 통해 비드에 고정화시켜 배지에 있는 L-selectin-Ig를 성공적으로 분리해냈다.
앱타머가 서로 다른 이성질체에 대해 강한 선택성을 가진다는 사실이 증명된 이후, 앱타머의 이성질체를 구별하는 능력을 이용하여 앱타머 기반의 키랄 분리공정에 대한 연구들이 계속 보고되고 있다[8].
서로 상반되는 생리 활성을 나타내는 거울상 이성질체를 분리하기 위해 UV 중합법에 의해 이성질체를 인식할 수 있는 분자 인식형 고분자(molecularly imprinted polymers, MIPs) 분리막을 제조하여 그 분리막을 이용한 이성질체의 분리 선택성에 관한 연구와 구조적인 다양성을 갖는 분자크기 나노세공구조를 갖는 분자체를 이용한 분리연구도 진행되고 있다[12].
물리ㆍ화학적 물성 차이에 의한 기존 분리기술의 한계를 극복하기 위한 방법의 하나로 자기조립(self-assembly)과 분자인식(molecular recognition)에 근거한 새로운 분자분리기술(molecular separation technique)이 본 연구 그룹을 중심으로 활발하게 시도되고 있다[22,23]. 분자인식이란, 특정분자만을 인식할 수 있는 기공(공극)구조의 재료를 분자설계를 통해 합성하고 이 공극에 게스트(guest) 분자로서 이성질체 분자를 포함시켜 분리하는 것이다. 공유결합에 의해 내포공극공간에 만들어지는 분자인식 재료의 경우, 공극 크기 및 모양의 정밀설계가 어렵고 공극공간의 크기 및 모양이 단단하게 고정되어 여러 가지 크기 및 모양의 게스트 분자 적용에 한계가 있다. 공유결합에 의한 분리재료 합성의 문제점을 극복하기 위하여 수소결합을 이용한 분리재료를 제조하기도 한다. 수소결합의 경우, 공간구조가 내포될 게스트 분자의 크기와 모양에 따라 가변적으로 변할 수 있어 동일한 분자재료를 이용하더라도 여러 종류의 이성질체 분리에 적용될 가능성이 있다. 그러나 분자재료의 연구가 극히 초기 단계라 광학이성질체의 분리에 적용될 수 있을지의 여부는 사실상 불투명하다. 하지만 분자인식 및 자기조립 기법(molecular recognition and self assembly technique)을 이용한 하이브리드 분리기술 개발은 학술적 측면뿐만 아니라, 기술적 측면과 산업적 측면에서 매우 중요한 의미를 지닌다고 하겠다.