Al/(Al+Zr)의 몰 비를 달리하여 xAl-yZr 산화물 촉매를 공침법으로 제조하였고, 모델반응으로 이소프로판올 탈수반응을 수행하였다. 제조된 촉매는 X-선 회절분석, 시차 열분석법, 질소 흡착법, 암모니아 승온탈착법, 이소프로판올 승온탈착법 등의 특성분석을 수행하였다. 지르코니아에 알루미늄 종을 첨가하면 상대적으로 넓은 비표면적을 갖는 작은 입자를 얻을 수 있으며 지르코니아의 결정상변화를 억제시켰다. 암모니아 승온탈착으로 알루미늄의 몰 비가 증가함에 따라 상대적인 산양이 증가함을 확인하였고, 이소프로판올탈수반응에서 촉매 활성 또한 증가하였다. 이러한 촉매활성은 촉매의 비표면적, 산점, 상대적으로 용이한 이소프로판올의 탈착과 연관시킬 수 있었다.
xAl-yZr mixed oxide catalysts with different molar ratios of Al/(Al+Zr) were prepared by a co-precipitation method and its catalytic performance was compared in the iso-propanol dehydration as a model reaction. The catalysts were characterized by X-ray diffraction (XRD), differential thermal analysis (DTA), N2 adsorprion-desorption, NH3 temperature programmed desorption (NH3-TPD), and iso-propanol TPD analyses. The addition of Al into ZrO2 promoted the formation of relatively small particles with large surface areas and retarded the transformation of teragonal phase to monoclnic phase. NH3-TPD results revealed that the relative acidity of the catalysts increased along with the increase of Al molar ratio. The catalytic activity for the dehydration of iso-propanol to propylene was also increased with the same tendency. The catalytic activity could be correlated with high surface area, acidity and easy desorption of iso-propanol.
지르코니아는 산점 및 염기점을 동시에 가지고 있으며, 우수한 산화환원 특성으로 소량만 존재하여도 생성된 음이온 공백점이 지르코니아 격자의 산소이동성을 향상시킨다고 알려져 있다[1-4]. 이러한 독특한 특성들 때문에 지르코니아 자체촉매 또는 금속촉매의 지지체로서 많은 연구가 진행되었다. Doggali et al. [4]는 휘발성 유기화합물 연소반응에서 지르코니아 지지체 위에 담지된 Cu-Mn 촉매가 지르코니아의 산화환원 특성 때문에 반응성이 증가한다고 보고하였다. Zhao et al. [5]은 바나듐산화물을 다양한 지지체 위에 담지하여 수행한 프로필렌에서 아크롤레인으로의 선택적 산화반응에서 지르코니아 위에 담지된 바나듐 촉매가 가장 높은 아크롤레인 전환빈도를 보인다고 보고하였다. 또한 Sim et al. [6]는 다양한 숙성시간에 따라 제조한 지르코니아 촉매에서 숙성시간이 길어질수록 촉매의 산양이 증가하며, 이소프로판올의 탈수반응에서 반응활성이 증가한다고 보고하였다. 이외에도 지르코니아 촉매는 올레핀의 탈수소화 반응 그리고 올레핀의 이성질화반응 촉진시킨다고 보고되었으며, 일산화탄소 또는 메탄의 산화반응, Fischer-Tropsch 합성반응, 그리고 수소첨가탈황반응과 같은 반응에 사용되었고, 우수한 활성을 나타낸다고 보고되었다[7-12].
지르코니아는 소성온도의 변화에 따라서 무정형에서 정방정계상으로(tetragonal), 다시 단사정계 상으로(monoclinic) 결정상이 변화한다. 온도에 따른 지르코니아의 결정상 변화는 촉매 지지체로 사용되었을 때, 촉매의 반응성에 영향을 미친다. Li et al. [13]는 다른 결정상을 갖는 지르코니아 위에 담지된 Au/ZrO2 촉매상에서 수행한 수성가스전환반응에서 단사정계 지르코니아 위에 담지된 Au 촉매가 정방정계 촉매보다 더 높은 활성을 보인다고 보고하였다. 또한 지르코니아 촉매는 소성 동안에 급격한 소결현상으로 다른 산화물 지지체에 비해 상대적으로 작은 비표면적 값을 보인다. 소성온도 변화에 따른 결정상 변화와 작은 비표면적을 갖는 지르코니아는 다양한 반응에서 지지체로 적용하는데 제약이 따른다. 이러한 문제점을 보완하기 위해, Al2O3-ZrO2, TiO2-ZrO2 그리고 SiO2-ZrO2와 같은 혼합산화물 지지체 또는 증진제 첨가 등의 방법이 제시되었고, 많은 문헌에서 일반적으로 지지체로 널리 사용되는 알루미나에 지르코니아를 첨가하여 지르코니아의 독특한 특성을 갖는 산화물 지지체에 대한 연구를 보고하였다. 알루미나에 지르코니아를 첨가하면 지르코니아의 뛰어난 산화환원 특성으로 전이 알루미나의 안정제로 사용 될 수 있다. 다양한 지지체위에 니켈을 담지한 촉매상에서의 수증기 개질 반응에서 지르코니아 지지체는 촉매의 탄소침적을 억제시키고, 활성 니켈의 비표면적을 증가시킨다[14]. 또한 적당한 양의 지르코니아로 개질된 Ni/Al2O3 촉매상에서 지르코니아는 정방정계의 상을 형성하며, 천연가스 개질 반응에서 수증기의 흡착과 넘김(spillover)현상을 향상시켜 촉매의 전환율 및 선택도를 향상시킨다고 보고되었다[15]. 소량의 지르코니아가 첨가된 알루미나 지지체는 활성촉매의 산점, 비표면적, 그리고 산 밀도를 증가시킨다고도 보고되었다[16].
지금까지 많은 문헌에서 소량의 지르코니아를 알루미나에 첨가하여 지지체로 사용한 연구가 주로 수행되었고, 지르코니아 자체를 알루미나로 개질한 촉매에 대한 자세한 연구는 수행되지 않았다. 따라서 본 연구에서는 지르코니아를 근간으로 하여 알루미나의 함량을 달리하여 혼합산화물을 제조하고 Al/(Al+Zr)의 몰비에 따른 촉매의 특성변화를 조사하였다. 제조한 촉매는 X-선 회절분석(X-ray diffraction, XRD), 시차열분석(Differential Thermal Analysis, DTA), 질소 흡착법, 암모니아 승온탈착법(NH3 Temperature Programmed Desorption, NH3-TPD), 이소프로판올 승온탈착법(
본 연구에서 사용된 xAl-yZr 산화물 촉매는 Al/(Al+Zr)의 몰 비를 각각 0, 0.1, 0.3, 0.5, 1.0으로 달리한 산화물 촉매를 공침법으로 제조하였다. 여기서 x, y는 수용액 상에서 알루미늄과 지르코늄의 몰 비를 나타낸다. xAl-yZr 산화물 촉매 제조는 질산알루미늄수화물(Al(NO3)3・9H2O, 98%, Sigma-Aldrich), 질산지르코늄수화물(ZrO(NO3)2・2H2O, 98%, Sigma-Aldrich)와 암모니아용액(NH4OH, 28-30 vol%, Samchun)을 전구물질로 사용하였으며, 촉매제조방법은 다음과 같다. 각 몰 비로 계산된 양의 질산알루미늄을 400 mL의 탈이온수에 용해시키고 질산지르코늄을 첨가한 후, 완전히 용해되도록 상온에서 30분 동안 교반시켰다. 혼합용액을 암모니아용액으로 pH 10까지 조절하였고, 상온에서 24시간 동안 더 교반하였다. 숙성된 용액을 100 ℃에서 2시간 동안 환류시키고, 감압증류기(Rotary-evaporator, Eyela N-1000)를 사용하여 과량의 수분을 제거한 후, 100 ℃ 건조 오븐에서 12시간 건조하였다. 건조된 촉매를 공기를 흘려주면서 2 ℃/min의 승온속도로 700 ℃에서 2시간 소성하였다. 제조한 촉매는 각각의 몰 비에 따라 ZrO2, 1Al-9Zr, 3Al-7Zr, 5Al-5Zr, Al2O3로 명명하였다.
제조한 촉매의 결정성을 살펴보기 위해 Siemens D-5005 기기를 사용하여 XRD 분석을 수행하였다. 이 때 사용한 전압과 전류는 30 mA, 50 kV이고, 0.4 degree/min의 주사 속도로 2θ = 20 ~ 80°의 범위에서 측정하였다. 결정상의 입자크기는 Scherrer식을 이용하여 계산하였다. Dhkl = 0.9・λ/βhkl・cosθ, Dhkl은 결정 크기, λ는 입사 X-선의 파장, βhkl는 반치 폭, 그리고 θ는 최대 피크에서의 회절 각을 의미한다. 제조된 촉매의 화학적·물리적 변화로 생기는 온도 변화를 알아보기 위해 TA Instruments사의 SDT 2960을 사용하여 시차 열분석(Differential Thermal Analysis, DTA)을 하였다. 온도의 변화와 가스 조건은 10 ℃/min으로 공기 하에 상승시켜 상온에서 900 ℃까지 측정하였다. 제조한 촉매의 비표면적 및 총 기공부피는 −196 ℃의 액체질소 온도 하에서 Micromeritics사의 ASAP 2010을 사용하여 질소흡착법으로 측정하였다. 촉매의 비표면적은 Brunauer-Emmett-Teller (BET)식을 이용하여 P/Po = 0.05 ~ 0.2범위 내에서 측정한 값으로 구하였고, 총 기공부피는 P/Po = 0.995에서의 흡착량으로 계산하였다. 세공분포는 Barrett-Joyner-Halenda (BJH)식을 이용하여 계산하였다. 산화물 촉매의 표면 원소구성비를 알아보기 위해 XPS (VG Science, ESCALAB 210, MgKα X-ray source = 1253.6 eV)분석을 하였고, 표면의 원소분석은 피크의 면적과 제공된 원소의 요소값으로 계산하였다. 촉매의 산특성을 알아보기 위해 질량분석기(Pfeiffer, QMS 200)를 사용하여 NH3-TPD 이소프로판올(iso-C3H7OH, Samchun)을 사용하여 IPA-TPD를 수행하였다. 0.1 g의 촉매를 5 ℃/min의 승온 속도로 상온에서 300 ℃까지 온도를 올린 후 아르곤으로 300 ℃에서 1시간 동안 전처리하였다. 온도를 100 ℃로 내린 다음, 10% NH3/Ar을 30 cm3/min으로 1시간 동안 흡착시켰다. 흡착 후, 같은 온도에서 30 cm3/min의 유량으로 아르곤가스를 흘려주면서 물리 흡착된 암모니아를 제거시켰다. 온도를 상온으로 내린 후, 800 ℃ 까지 10 ℃/min으로 승온시키며 탈착되는 암모니아의 양(NH3,
이소프로판올의 흡·탈착 거동을 알아보기 위해, 질량분석기를 사용하여 이소프로판올(
알루미늄 종의 형태를 알아보기 위해 Bruker AVANCE 500 장치를 이용하여 27Al 고체 핵자기공명 분석(Nuclear Magnetic Resonance, NMR)을 수행하였다. 알루미늄 종의 스펙트럼은 4 mm 로터에 시료를 충진하고 27Al의 공명진동수 130.325 MHz에서 10.0 kHz로 스핀하면서 측정하였고 이 때 공명선은 1.50 μs의 π/4 펄스를 사용하였고, 반복지연시간은 1.0 s로 하였다. 27Al의 화학적 이동은 Al(H2O)6 3+ 수용액의 화학적 이동값을 기준으로 측정하였다.
이소프로판올 분해반응은 내부 직경 12 mm인 U자 모양의 석영 고정층 반응기로 상압 하에서 실시하였다. 반응 전에 제조한 산화물촉매 0.1 g을 석영 반응기에 충진시키고 N2 (50 cm3/min) 분위기 하에서 5 ℃/min의 속도로 400 ℃까지 상승시키고, 1시간 동안 유지한 후 5 ℃/min의 냉각속도로 270 ℃ 까지 냉각하였다. 질소를 희석가스로 사용하여 이소프로판올이 채워져 있는 포화기를 통하여 3 kPa의 이소프로판올 분압을 고정화하여 반응기에 공급하였다. 이 때 총 유량은 50 cm3/min으로 고정하였다. N2는 유량 조절기(Mass Flow Controller, Brooks 5820 E MFC)를 이용하여 반응 장치에 주입하였고, 반응 후 생성물은 FID(Flame Ionization Detector)가 장착된 GC(Chrompack 9002)를 이용하여 분석하였다. GC컬럼은 CP-Volamine(60 m⨯0.32 mm ID)을 사용하였다. 이소프로판올 전환율은 반응된 이소프로판올 농도를 공급된 이소프로판올 농도로 나누어 계산하였다.
본 연구에서 제조한 xAl-yZr 혼합산화물 촉매의 물리·화학적 특성을 알아보기 위하여 XRD, DTA, 질소 흡착법, NH3-TPD, 그리고 IPA-TPD를 수행하였다.
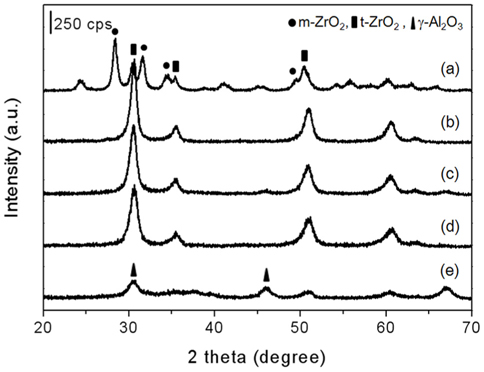
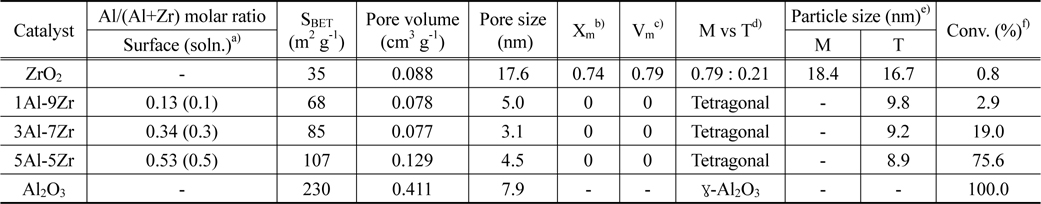
xAl-yZr 산화물 촉매의 XRD 분석 결과를 Figure 1과 Table 1에 나타내었다. XRD 분석 결과 순수한 지르코니아는 79%의 단사정계상(#07-0743)과 21%의 정방정계상(#50-1089)의 혼합상으로 관찰되었다[6]. 알루미늄이 첨가된 1Al-9Zr, 3Al-7Zr, 5Al-5Zr 산화물 촉매는 정방정계의 단일상으로 관찰되었으며, 알루미늄의 함량이 증가함에 따라 정방정계의 2θ = 30.4°의 피크 크기가 감소하고 넓어지는 경향을 나타내었다. 이는 정방정계의 입자 크기가 감소하였다고 유추할 수 있으며, Table 1에서 나타내었듯이, 알루미늄의 함량에 증가함에 따라 입자 크기는 16.7 nm에서 8.9 nm로 감소하는 경향을 관찰할 수 있었다. 순수한 알루미나는 γ-Al2O3상으로 관찰되었으며, 4.7 nm의 입자크기를 나타내었다. Figure 1에 나타내지 않았지만 정방정계의 2θ = 30.4° 피크는 알루미늄 함량이 증가함에 따라 높은 2θ로 이동하였으며, 이는 Al-Zr 고체용액을 형성함에 기인하는 것이다(Zr4+의 이온 반경 = 0.08 nm, Al3+의 이온 반경 = 0.065 nm) [17, 18].
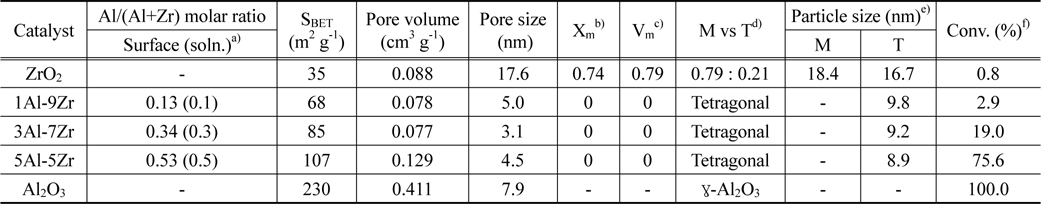
Physical properties of xAl-yZr oxide catalysts and their catalytic performance in IPA dehydration
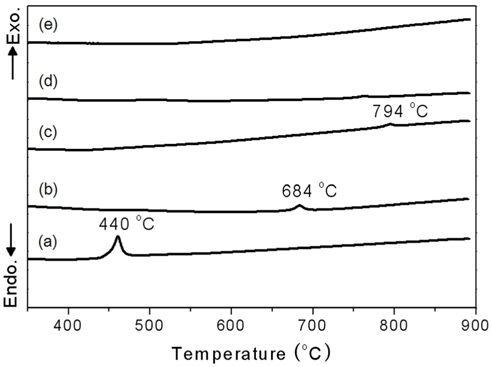
xAl-yZr 산화물 촉매의 DTA 분석 결과를 Figure 2에 나타내었다. 순수한 지르코니아는 440 ℃에서 단사정계에서 정방정계로의 결정변화에 따른 발열점을 나타났다. 알루미늄 함량이 증가함에 따라 발열 온도가 오른쪽으로 점차적으로 이동하였고, 3Al-7Zr 산화물 촉매의 발열점은 794 ℃에서 관찰되었다. 5Al-5Zr 산화물 촉매와 알루미나촉매는 DTA 분석온도범위에서 발열점을 관찰 할 수 없었다. 알루미늄의 첨가에 따라 결정성 변화 온도가 440 ~ 740 ℃ 또는 그 이상의 온도 범위까지 넓게 분포함을 알 수 있었고, 알루미늄의 첨가는 지르코니아의 결정상변화를 억제시키는 역할을 하는 것으로 유추할 수 있으며, 이는 XRD의 분석결과와 잘 일치하였다.
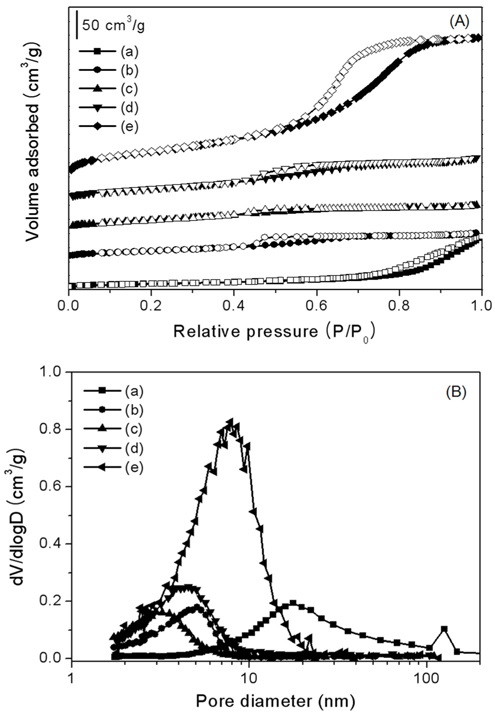
Table 1과 Figure 3에 혼합산화물의 비표면적 및 총 기공부피를 나타내었다. xAl-yZr 산화물 촉매의 등온 곡선은 전형적인 IV형태의 등온곡선을 보였으며, 알루미늄의 함량이 증가함에 따라 비표면적 및 총 기공부피가 증가함을 알 수 있다. 순수한 지르코니아 촉매의 비표면적은 38 m2 g-1, 총 기공부피는 0.088 cm3 g-1이고, 5Al-5Zr 산화물 촉매의 비표면적은 107 m2 g-1, 총 기공 부피는 0.129 cm3 g-1의 값을 나타내었다. 알루미나 촉매의 비표면적은 230 m2 g-1 총 기공 부피는 0.411 cm3 g-1로 가장 큰 값을 갖는 것을 볼 수 있다. 알루미늄이 첨가된 촉매의 비표면적이 증가한 것은, 공침 과정 중 Al-Zr이 고체용액을 형성하면서 알루미나의 큰 비표면적을 공유했기 때문이다. BJH식을 이용하여 등온곡선 중 흡착곡선으로 구한 세공크기는 ZrO2는 17.6 nm, 알루미늄함량이 증가함에 따라 각각 5.0, 3.1, 4.5 nm의 값으로 중기공을 갖는 xAl-yZr 산화물 촉매가 합성되었음을 확인하였다.
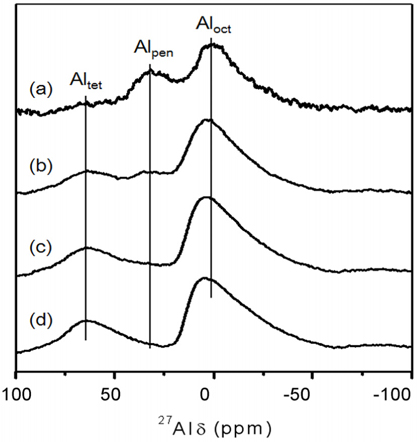
Figure 4에 xAl-yZr 산화물 촉매와 알루미나 촉매의 고체상태 27Al MAS NMR 분석결과를 나타내었다. NMR의 각 스펙트럼은 3.4, 32.2, 그리고 64.4 ppm으로 구성되어 있으며, 각 피크는 팔면체, 오면체, 그리고 사면체로 배위된 Al3+ 이온을 나타내는 것이다[19, 20]. Kwak et al. [19]은 38 ppm의 부근의 오면체로 배위된 Al3+ 이온은 알루미나 촉매의 표면에 존재 가능하다고 보고하였다. NMR 스펙트럼에서 알루미늄의 함량이 증가함에 따라 오면체로 배위된 Al3+이온에 관련된 피크가 감소하는 것을 볼 수 있으며, 알루미나 촉매는 오면체로 배위된 Al3+의 피크가 관찰되지 않았다. 제조한 촉매 중, 1Al-9Zr 산화물 촉매의 피크가 가장 큰 것을 알 수 있으며, 알루미늄이 미량 첨가된 1Al-9Zr 산화물 촉매의 표면에 오면체로 배위된 Al3+ 이온이 가장 많이 존재한다고 유추할 수 있다.
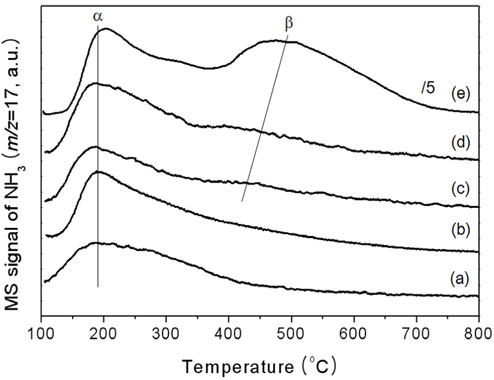
xAl-yZr 산화물 촉매의 산 특성을 파악하기 위하여 암모니아 TPD를 수행하였고 그 결과를 Figure 5에 도시하였다. 100 ℃에서 700 ℃의 넓은 온도 범위에서 암모니아의 탈착현상이 관찰되었다. 순수한 지르코니아와 1Al-9Zr 산화물 촉매는 400 ℃ 이하의 온도범위에서 비대칭성의 큰 피크가 관찰되는데(α 피크), 이는 둘 이상의 서로 다른 암모니아 흡착점이 존재하는 것으로 볼 수 있다. 알루미늄의 함량이 증가함에 따라 α 피크 외에 400 ℃에서 700 ℃의 온도범위에서 큰 피크가 관찰되며, 이 피크는 알루미늄 함량이 증가함에 따라 크기가 점차적으로 커지며, 최대 피크의 온도가 고온으로 이동하는 것을 관찰할 수 있다(β 피크). 400 ℃에서 관찰되는 큰 α 피크는 약산 점을 나타내고 β 피크는 강산 점을 나타낸다고 보고된 바 있다[21]. TPD피크 크기 및 면적은 알루미늄 함량이 증가함에 따라 증가하였는데, 이는 알루미늄 첨가에 따라 흡착된 암모니아의 양이 상대적으로 증가하였음을 의미하는 것으로 상대적인 비표면적 증가와도 연관 지을 수 있었다.
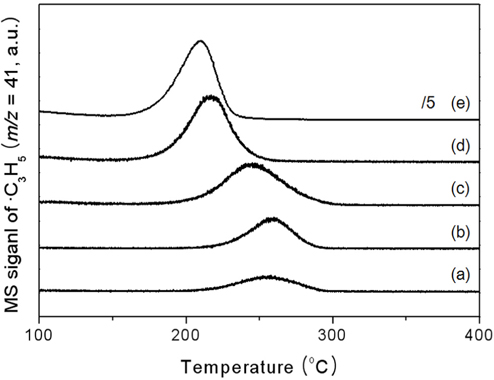
반응물로 사용한 이소프로판올의 흡·탈착 거동을 살펴보기 위하여 이소프로판올 TPD를 수행하여 Figure 6에 나타내었다. 이소프로판올 TPD에서 xAl-yZr 산화물 촉매 표면에 흡착된 이소프로판올은 탈수반응에 의해 프로필렌과 수분으로 탈착되었다. 순수한 지르코니아 촉매는 약 260 ℃에서 최대 피크가 나타났다. 알루미늄 함량이 증가함에 따라 최대 피크가 관찰되는 온도는 점차 낮아졌으며, 알루미늄의 함량에 따라 각각 259 ℃, 245 ℃, 216 ℃의 피크온도를 나타내었다. 알루미나 촉매에서 209 ℃로 가장 낮은 탈착 온도가 관찰되었다. 이는 지로코니아 촉매에 알루미늄이 첨가됨에 따라 제조된 xAl-yZr 산화물 촉매의 표면에서 이소프로판올의 탈착이 용이함을 의미하는 것이라 할 수 있다. 또한 알루미늄이 증가함에 따라 프로필렌의 탈착양도 상대적으로 증가함을 확인하였다. 이러한 탈착양의 증가는 알루미늄 첨가에 따른 xAl-yZr 산화물 촉매의 높은 비표면적과의 연관성을 부여할 수 있었다.
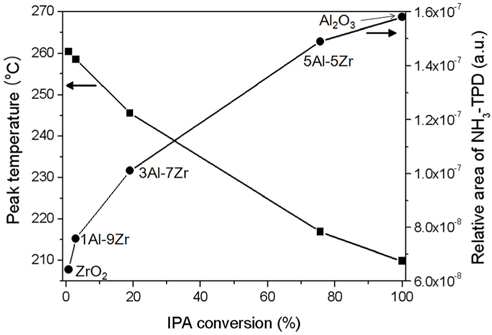
산점을 주로 함유하고 있는 촉매에서는 탈수 반응이 주로 진행되어 주 생성물로 프로필렌이 얻어지고, 염기성 성질을 가지는 촉매에서는 탈수소화 반응이 주로 진행되어 아세톤 생성물이 얻어진다[8]. 본 연구에서 수행한 xAl-yZr 산화물 촉매에 있어 탈수 반응의 주생물로 99% 이상 프로필렌이 얻어졌고, 미량의 아세톤이 부산물로 생성되었다. 알루미늄을 첨가하여 제조한 xAl-yZr 산화물 촉매의 이소프로판올 전환율을 Table 1에 정리하였다. 이소프로판올의 전환율을 6시간의 반응시간을 기준으로 하여 구하였다. 순수한 지르코니아 촉매는 주어진 반응조건에서 약 0.8%의 이소프로판올 전환율을 나타내었고, 알루미나 촉매는 100%의 전환율을 나타내었다. 알루미늄 함량의 증가에 따른 이소프로판올 탈수 반응의 반응활성은 Al2O3 > 5Al-5Zr > 3Al-7Zr > 1Al-9Zr > ZrO2 순으로 나타났다. xAl-yZr 산화물 촉매의 물리화학적 특성과 이소프로판올의 전환율 사이의 관계를 알아보기 위한 관계곡선을 Figure 7에 도시하였다. 이소프로판올 TPD의 피크 탈착온도가 감소함에 따라, 또 암모니아 TPD의 상대적인 피크 면적이 증가함에 따라서 이소프로판올의 전환율이 증가하였다. 이러한 관계 곡선으로부터 xAl-yZr 산화물 촉매상에서 이소프로판올의 전환율 증가는 산점의 증가와 이소프로판올의 탈착 용이에 의한 것으로 해석할 수 있었다.
xAl-yZr 산화물 촉매를 일반적인 공침법으로 제조하고, 알루미늄 첨가에 따른 xAl-yZr 산화물 촉매의 물리·화학적 특성을 알아보고 모델반응으로 이소프로판올의 탈수반응을 수행하였다. 지르코니아에 알루미늄의 첨가는 지르코니아의 결정상변화를 억제시키는 역할을 하였다. 또한 알루미늄의 함량이 증가함에 따라 촉매의 입자크기가 감소하였고, 촉매의 비표면적 산양이 증가하였다. 이소프로판올 탈수반응 수행 결과, 프로필렌이 주 생성물이었으며, 알루미늄 함량의 증가에 따라 이소프로판올의 전환율이 증가하였다. Al-Zr 혼합산화물의 산점 조절은 Al/Zr 비를 변화함으로 가능하였고, 이 촉매 상에서 이소프로판올의 전화율은 촉매의 산점, 이소프로판올의 탈착거동과 직접적인 관련이 있었다.