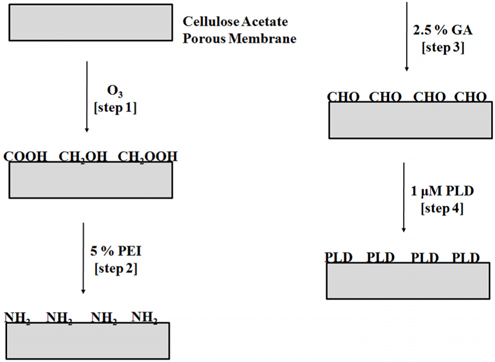
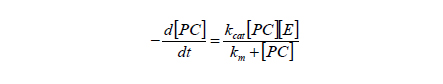포스포라이페이즈디를 공유결합을 통해서 초미세다공성막에 고정화하였다. 고정화는 폴리에틸렌이민, 글루타알데하이드, 포스포라이페이즈디를 순차적으로 처리함으로써 수행되었다. X선 광전자 분광기를 이용하여 고정화가 확인되었다. 포스퍼티딜콜린이 분산된 버퍼용액의 pH값을 시간에 따라 모니터링하여 고정화된 경우와 그렇지 않은 경우에 대해 촉매활성을 산출하였다. 속도상수는 폴리스타이렌나노입자에 고정화된 포스포라이페이즈디에서는 0.64 s-1, 다공성 셀룰로스아세테이트막에 고정화된 포스포라이페이즈디에서는 0.52 s-1, 그리고 고정화되지 않은 포스포라이페이즈디에서는 0.75 s-1의 결과가 도출되었다. 재사용에 대한 연구가 10차례까지 수행되었으며, 초기 사용시의 활성대비로 95%가 유지되었다. 열과 저장성에 대한 안정성도 고찰되었으며, 다공성막에 고정화된 포스포라이페이즈디의 경우에 활성손실이 가장 적은 것으로 관찰되었다. 이 연구결과들로부터, 포스퍼티딕산의 생산용 포스포라이페이즈디의 고정화에 대한 지지체로 다공성 막을 사용할 수 있음을 알 수 있다.
Phospholipase D (PLD) was immobilized on a submicro-porous membrane through covalent immobilization. The immobilization was conducted on the porous membrane surface with the treatment of polyethyleneimine, glutaraldehyde, and the anhydrase, in sequence. The immobilization was confirmed using X-ray photon spectrometer. The pH values of phosphatidylcholine (PC) dispersion solution with buffer were monitored with respect to time to calculate the catalytic activities of PC for free and immobilized PLD. The catalytic rate constant values for free PLD, immobilized PLD on polystyrene nanoparticles, and immobilized PLD on a porous cellulose acetate membrane were 0.75, 0.64, and 0.52 s-1, respectively. Reusability was studied up to 10 cycles of PC hydrolysis. The activity for the PLD immobilized on the membrane was kept to 95% after 10 cycles, and comparable to the PLD on the nanoparticles. The stabilities for heat and storage were also investigated for the three cases. The results suggested that the PLD immobilized on the membrane had the least loss rate of the activity compared to the others. From these studies, the porous membrane was feasible as a carrier for the PLD immobilization in the production of phosphatidic acid.
포스퍼티딕산(Phosphatidic-acid, PA)은 세포에 분포하는 지질성분으로서 세포대사에 관여되는 신호의 전달 및 생성을 수행하며 분열 및 융합과정에 수반되는 세포막의 곡률반경변화를 유도한다[1-6]. 그리고 PA는 대부분의 인지질들에 대하여 생화학적 합성과정뿐만 아니라 인위적인 합성과정에서도 전구체로 작용한다[7,8]. 인위적인 합성으로 통해 획득된 많은 인지질들은 약물 및 조영물질을 포함한 각종 물질의 전달 담지체와 여러 형태의 생체모사막을 구성하는 성분으로 광범위하게 사용되고 있다[9-11]. PA는 글리세롤을 주쇄로 하여, 1,2번 탄소에 지방산그룹들이 탈수축합반응으로 연결되어 있으며, 3번 탄소에 인산기가 결합하고 있다[12]. 이 구조를 바탕으로 인위적인 합성과정을 통해 PA가 대량생산되고 있다[13]. 이 과정에서 유독 용매들이 활용되며, 이 용매들은 폐기물로 남게 되는 문제점이 있다.
자연계에 풍부하게 존재하는 포스퍼티딜콜린(Phosphatidylcholine, PC)로부터 콜린기가 글리세롤 주쇄로부터 가수분해로 분리되어 PA가 생성되며, 이 생성반응은 인지질분해효소 중 하나인 포스포라이페이즈디(Phospholipase D, PLD)에 의해 촉진된다[14]. 풍부히 존재하는 PC로부터 PLD를 통해 PA를 획득하는 반응은 유기합성과정과 비교하여 자연친화적이다[15]. 그러나, 효소를 활용한 공정은 효소의 고가와 생성물로부터 효소의 분리라는 문제점들을 야기한다. 따라서, 효소의 고정화는 고가의 효소를 재활용하며 생성물로부터 효소를 쉽게 분리할 수 있다는 측면에서 장점을 가지고 있다. 효소를 고정화함으로써 효소의 촉매특성이 향상된 사례들이 있으며, 이는 탄산 탈수 효소에서도 나타나고 있다[16]. 본 연구에서는 다공성 막에 공유결합을 통해 고정화시킨 PLD가 가지는 PA의 생산성, 재활용성, 열 및 저장에 대한 안정성들을 평가하고자 한다.
포스포라이페이즈디(Phospholipase D, PLD), 평균 분자량이 750,000인 폴리에틸렌이민(Polyethyleneimine, PEI), 직경이 1 μm인 폴리스타이렌(Polystyrene, PS) 미세입자, 글루타알데하이드(Glutaraldehyde, GA), 트리스(히드록시메틸)아미노에탄-염산(Tris(hydroxymethyl)aminomethane hydrochloride), 그리고 브래드포드 시약은 모두 시그마알드리치(St. Louis, MO, USA)에서 구매되었으며 별도의 정제과정 없이 사용되었다. 염화칼슘(Calcium chloride)은 삼전화학(대한민국, 서울특별시, 강남구)에서 구매되었고, 세공의 직경이 450 nm이고 직경이 25 mm인 셀룰로스 아세테이트 다공성 막(Cellulose acetate porous membrane, CAPM)은 대한과학(대한민국, 강원도, 원주시)으로부터 구매되었으며 사용 직전에 오존으로 처리되었다.
PLD를 CAPM의 세공표면에 공유결합에 의해 고정화시키는 과정들이 Figure 1에 제시되어 있다. CAPM을 1분간 오존으로 처리하여 산화시켰으며, 산화된 표면을 5% (v/v) PEI, 50 mM 탄산나트륨, pH 8 수용액에 2시간 동안 담궈 두었다. PEI로 기능화된 표면은 질소흐름에 건조시키고 건조된 상태로 사용직전까지 보관하였다. 건조된 PEI 처리 표면은 2.5% (v/v) GA, 20 mM 인산나트륨, pH 7.5 수용액에 3시간 동안 담궈졌으며, 비반응 시료들의 제거를 위해 초음파로 처리되고 초순수로 세척되었으며 질소흐름으로 건조되었다. PLD의 고정화는 GA로 처리된 표면을 3 mg/mL PLD, 100 mM 인산나트륨, pH 7의 수용액에 담궈서 수행되었다. PLD의 고정화를 위해 수행된 각 단계들은 모두 25 ℃이며, 150 rpm 속도의 교반 조건이었다. PLD의 고정화는 X선 광전자 분광기(모델명-PHI 5800, Physical Electronics, Inc., Chanhassen, MN, USA)로 확인되었다. PS 미세입자표면에 PLD를 고정하기 위하여, 첫 단계로 과망간산칼륨과 황산으로 산화시키며 PEI로 처리하는 그 다음 단계부터는 CAPM 세공표면에서의 과정과 동일하게 수행하였다. 각각의 경우에 대하여, 브래드포드 방법으로 주입된 PLD와 고정화되지 못한 PLD의 양이 산출되었다. 따라서, 고정화된 PLD의 농도를 계산할 수 있었다.
자유상태의 PLD, PS 미세입자표면에 고정화된 PLD, 그리고 CAPM 세공표면에 고정화된 PLD의 효소활성은 시간에 따른 pH값의 변화를 측정함으로써 규명하였다. PLD 활성에 따른 PC의 가수분해는 PA의 생성을 야기하며, 생성된 PA는 해리되어 수소양이온 농도의 변화를 유도한다. PC는 1 mg/mL이 되도록 0.2 M Tris-HCl pH 7 조건에서 분산시켜 용액 100 mL를 제조하고, 1.0, 1.5, 2.0 μM의 PLD 농도에서 각각 pH값 을 0.2초 간격으로 수집하였다. 변화가 더 이상 나타나지 않을 때까지 pH값을 모니터링하였다. 모니터링이 종료된 후, CAPM은 다음 회 실험을 위한 용액으로 바로 옮겨졌으며 PS 미세입자들은 원심분리과정을 추가로 거친 후에 다음 회 실험 용액으로 옮겨졌다. 잔여 PC의 농도는 고압액체크로마토그래피(Waters Associates, Milford, MA)를 통한 성분분석에 의해 확인하였다.
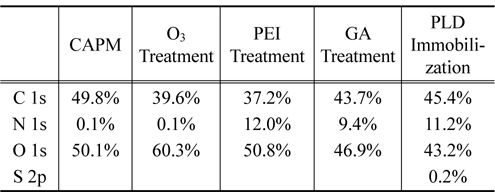
X선 광전자 분광기를 이용한 각 단계별 표면 원소 분석 결과는 Table 1에 정리되어 있다. 표면처리과정전의 순수 셀룰로스 아세테이트 다공성 막의 표면 성분은 대부분 탄소와 산소만으로 구성된다. 오존처리 후에 산소함량비가 늘어난 것이 확인되었고, PEI로 처리된 후에는 질소 성분비가 급격히 늘어가는 것이 관찰되었다. 이는 PEI성분이 CAPM의 표면에 물리적으로 강하게 흡착되어 있음을 의미한다. 그 다음 단계로 수행된 GA처리 후에 관찰된 탄소 비율의 증가와 PLD고정화에 따른 질소 비율의 증가는 각각 예상과 일치한다.
[Table 1.] XPS results for each step of surface treatments
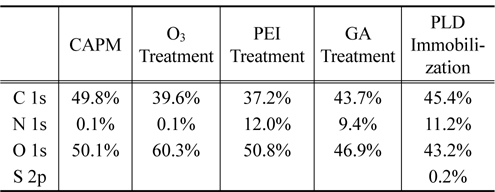
XPS results for each step of surface treatments
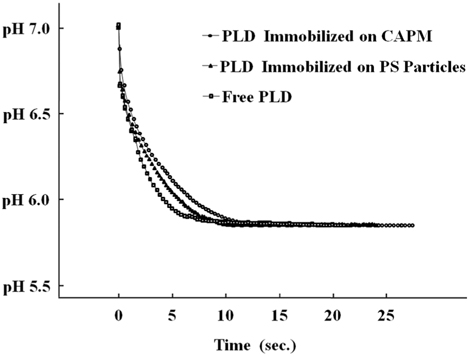
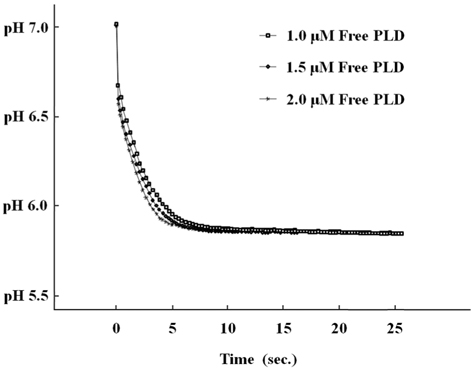
PA생성을 시간에 따른 pH 값의 측정으로 모니터링하였다. Figure 2는 1 μM PLD, 25 ℃에서 자유상태의 PLD, PS미세입자에 고정화된 PLD, CAPM에 고정화된 PLD에 대하여 측정된 pH 변화를 나타내고 있다. 각 조건에 따른 pH 값 변화의 차이가 명확하게 관찰되는 조건을 고려하여, pH 7에서 측정을 수행하였고 완충용액을 사용하였다. 시간에 따른 pH 값의 변화가 자유상태의 PLD에 대하여 가장 빠르며 CAPM에 고정화된 PLD에 대하여 가장 느린 것을 알 수 있다. 이 결과는 PLD에 대한 PC접근의 용이성이 반영된 결과인 것으로 판단 된다. 그러나, 대략 10초 남짓 시간 후에는, 더 이상 변화가 없는 상태에 도달되는 pH의 값은 매우 유사한 것으로 관찰되었다. 따라서, 고정화된 PLD에서도 효소의 활성이 유지됨을 알 수 있다. 효소 농도 변화에 따른 결과를 확인하기 위하여, 자유상태의 PLD가 각각 다른 농도들(1.0, 1.5, 2.0 μM)로 주어진 조건에서도 실험을 수행하였다. PLD의 농도가 증가할수록 반응속도가 가시적으로 확인될 만큼 빠른 것으로 나타났다(Figure 3).
PLD에 의한 PA 생성 반응속도 분석을 위하여, 모형식으로써 Michaelis-Menten식을 아래와 같이 고려하였다.
위 식에서 [
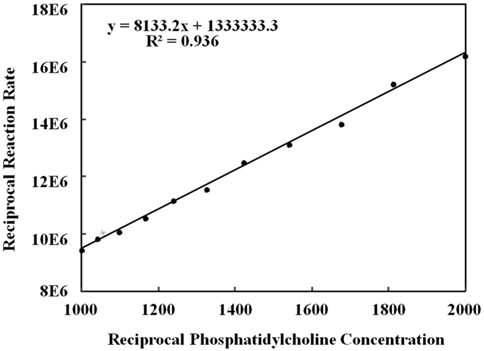
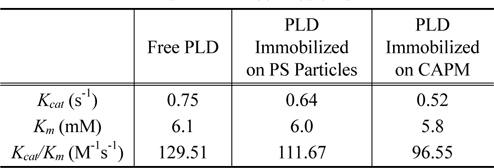
Lineweaver-Burk Plot의 결과로 자유상태의 PLD, PS미세입자에 고정화된 PLD, CAPM에 고정화된 PLD에 대하여 구한
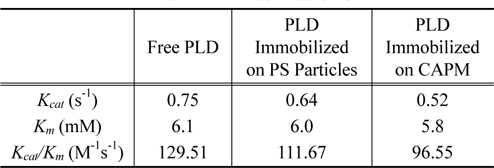
Activity of PLD for free PLD, PLD immobilized on PS particles, and PLD immobilized on CAPM
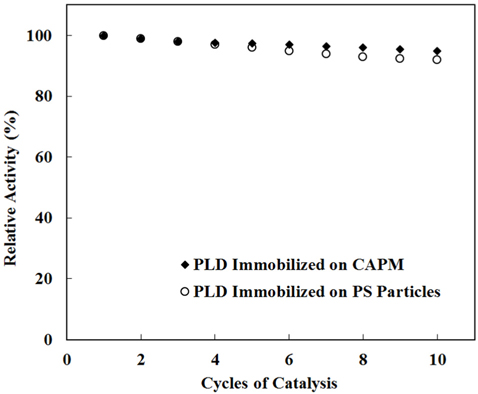
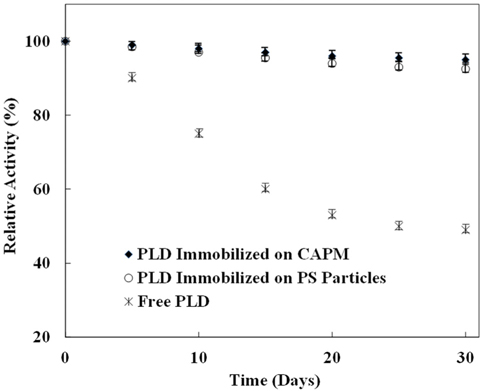
고정된 PLD의 재활용성과 열 및 저장에 대한 안정성을 평가하였다. 활용횟수에 따른 PLD의 활동도를 평가한 결과가 Figure 5에 제시되어 있다. 10회까지 재활용을 하면서 활동도 변화를 관찰하였고, CAPM에 고정화된 PLD의 경우에 1회시의 활동도 대비 평균 95%임을 확인하였다. 반복 실험은 3회 수행되었으며, 94, 95, 96%의 결과가 각각 한 차례씩 나타났다. PS에 고정화된 PLD에서는 평균 92%로 유지되었으며 한 차례는 90%, 두 차례는 93%의 결과를 나타내었다.
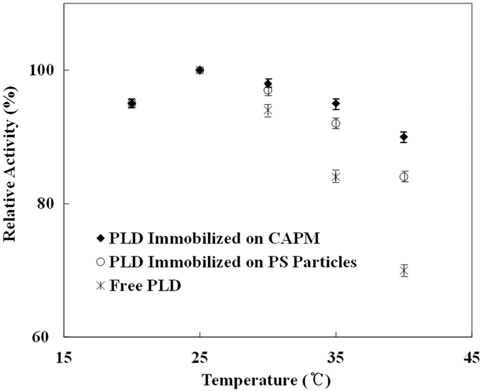
그리고, 20, 25, 30, 35, 그리고 40 ℃에서 실험을 수행하여 온도가 끼치는 영향을 파악하고자 하였다. 20 ℃에서는 활동도는 세 가지 경우에 모두 유사하게 나타났다. 이는 반응에 영향을 주는 PLD 구조가 25 ℃보다 높은 온도에서 변형되는 것으로 해석할 수 있다. 25 ℃ 이상의 온도에서 자유상태의 PLD에서보다 고정된 PLD에서 활동도 감소가 상대적으로 적게 관찰되었다. 자유상태의 PLD는 40 ℃에서 25 ℃보다 활동도가 20% 이하로 감소되었으나, 고정화된 PLD에서는 10% 남짓 감소되었다. 이 결과들은 Figure 6에 제시되어 있다. 고정화된 PLD에서 활동도 감소의 폭이 낮은 결과는, 고온으로 나타나는 PLD 구조의 변성이 자유상태와 비교하여 상대적으로 적게 일어났음을 의미한다.
저장에 대한 안정성은 25 ℃에서 5일 간격으로 30일 동안 조사되었으며, 고정화된 PLD에서 활동도 감소가 작은 것으로 관찰되었다(Figure 7). 이 결과도 역시 단백질의 고정화가 구조 변화를 방해하면서 나타난 결과로 판단된다. 재활용성과 저장에 대한 안정성측면에서 CAPM과 PS에 고정화된 PLD들의 결과는 차이가 관찰되었으나, 열 안정성에서는 CAPM에 고정화된 PLD이 더 현저하게 우수한 것으로 나타났다. 열 안정성에서만 나타난 다소 상이한 결과는 PLD 구조에 대한 열영향이라기보다는 온도변화에 따른 물질전달의 변화에 기인한 것으로 판단된다. 위에서 이미, 25 ℃에서 CAPM에 고정화된 PLD의 활성도가 PS미세입자에 고정화된 경우보다 낮은 결과가 물질의 접근성에 기인한 것으로 추정한다고 기술한 바 있다. 이와 같은 맥락에서, 물질전달이 온도의 영향을 받아 열안정성 결과를 나타낸 것으로 판단된다. 다공성 막에서의 온도에 따른 물질전달변화에 대해, 이전에 수행되었던 연구결과가 이 가설을 뒷받침한다[18].
본 연구에서는 다공성 막에 공유결합을 통해 고정화시킨 PLD가 가지는 PA의 생성 정도, 재활용성, 열 및 저장에 대한 안정성들을 평가하였다. 고정화를 위하여 PEI, GA, PLD의 순서로 표면처리를 수행하였으며, 고정화된 결과는 X선 광전자 분광기를 통해 확인하였다. PC가 분산된 용액에서 pH값을 측정하고 측정값을 이용하여 PLD의 촉매작용을 계산하였다. 그 결과, 자유상태의 PLD, PS에 고정화된 PLD, 그리고 CAPM에 고정화된 PLD에서 각각 0.75, 0.64, 그리고 0.52 s-1의 활성화도가 나타났다. 재활용면에서 10회 이용에도 95%의 활성이 유지됨을 확인하였으며, 열 및 저장에 대하여 평가된 안정성은 CAPM에 고정화된 PLD에서 활성화도의 저하율이 가장 낮은 것으로 관찰되었다. 본 연구의 결과, 다공성 막은 PA의 생산을 위한 PLD의 담지체로 활용될 수 있음을 알 수 있다.