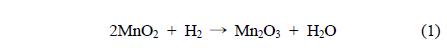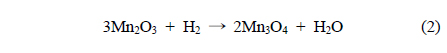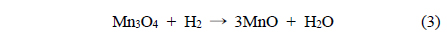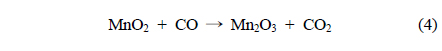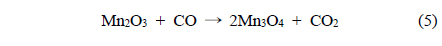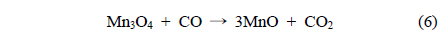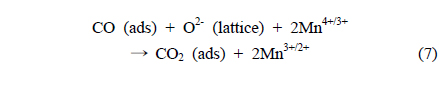MnO2를 KMnO4와 MnCl2・4H2O을 이용해 자연침전을 유도한 후, 수열방법으로 120-200 ℃, 0.5-5시간 범위에서 제조하여 300 ℃에서 열처리 후 CO 산화반응을 수행하였다. 촉매활성 원인의 규명과 물리화학적 특성을 분석하기 위해 X 선 회절 분석, 질소 흡착, 주사전자현미경, 수소 또는 일산화탄소 승온환원 분석(H2- 또는 CO-TPR)을 실시하였다. 합성조건에 따라 순수한 α-MnO2 혹은 α/β-혼합상을 가진 MnO2가 각각 합성되었다. 촉매활성과 안정성은 순수한 α-MnO2 상에서 α/β-혼합상을 가진 MnO2보다 우수하게 관찰되었다. 특히, 150 ℃에서 1시간 수열 합성된 촉매는 가장 큰 비표면적인 214 m2 g-1을 가졌으며 H2, CO-TPR 분석에서 가장 우수한 환원성과 격자산소 종의 활성을 보였으며 일산화탄소의 승온 및 등온 산화반응에서 가장 우수한 촉매활성을 나타내었다. 이것은 촉매의 물리화학적 특성에 기인한 것으로 촉매의 결정구조, 비표면적, 환원성 및 격자산소 종의 활성은 촉매활성과 깊은 상관관계가 존재함을 확인하였다.
MnO2 was prepared by a hydrothermal process method in the range of 120-200 ℃ and 0.5-5 h, calcined at 300 ℃ after induction of precipitation using KMnO4 and MnCl2・4H2O, and its catalytic activity was compared for CO oxidation. The catalysts were characterized using by X-ray diffraction, N2-sorption, scanning electron microscopy, and temperature programmed reduction of H2 or CO. The crystalline structure of pure α-MnO2 or hybrid α/β-MnO2 was controlled by the preparation conditions. The pure α-MnO2 showed better catalytic activity and thermal stability than hybrid α/β-MnO2. Especially, α-MnO2 prepared at 150 ℃ for 1 h has the highest specific surface area 214 m2 g-1, reducibility and labile lattice oxygen species analyzed by H2, CO-TPR, respectively. It also showed the best CO oxidation activity in both conditions of temperature programmed and isothermal reaction. The results came from the physicochemical properties of catalysts like the crystalline structure, specific surface area, reducibility and lattice oxygen species, and which are correlated with catalytic performance.
일산화탄소(CO)는 피셔-트롭시 합성반응((2n + 1)H2 + nCO → CnH2n+2 + nH2O), 수성가스전환반응(CO + H2O → CO2 + H2)의 원료물질과 반도체산업 내 에칭공정에서 수율 촉진을 위한 물질로 사용된다. 이처럼 산업적인 측면에서 매우 중요한 물질로 사용되지만, 연료의 연소, 음식물, 축사분뇨의 부패로 인해 발생하는 CO는 포집을 하기엔 양이 극히 드물고 산발적이며 순도 또한 낮기 때문에 대기에 배출되기 전 독성이 없는 이산화탄소로 산화시켜 배출시키고 있다.
CO 제거반응은 CO + 1/2O2 → CO2 (
Mn산화물은 pyrolusite (1 X 1), ramsdellite (1 X 2), hollandite (2 X 2), romanechite (2 X 3), todorokite (3 X 3) 등 터널 층상구조를 가지고 있으며 합성법과 Mn전구체에 따라 다른 구조를 나타낸다[21,23-27]. 가장 일반적인 방법으로 산화-환원 침전법이 있으며 염기, 약산성 수용액상에서 birnessite, 산성 수용액상에서 hollandite구조로 제조된다[21]. Giovanoli 등[21]은 Mn 전구체로 MnX2 (X - = Cl-, NO3-), 침전제로 NaOH를 사용하여 Na-birnessite구조를 가진 Mn산화물을 합성하였다. NaOH 대신 AOH (A = Li, K, Rb, Cs)를 이용하여 A-birnessite 구조가 합성되는 연구도 제안하였다[29,30]. 계면활성제인 cetyltrimethylammonium (CTAB)을 이용해서 Mn 산화물을 제조한 보고도 있다. 열처리 과정에서 계면활성제는 물질 내에서 제거가 되고 그 자리는 세공으로 남게 된다. CTAB 양에 따라 최종생성물은 정방향계, 6방정계 등 다양한 결정상을 갖게 된다[28]. Soft chemical을 이용한 수열반응은 터널 구조의 망간 산화물의 크기를 조절하기에 적합하다. Soft chemical로 크기가 다른 양이온 전구체(Li+, K+, Mg2+, Ba2+)를 사용해 터널크기를 조절해 spinel (1 X 3), hollandite (2 X 2), romanechite (2 X 3), todorokite (3 X 3)구조를 가진 Mn 산화물을 합성할 수 있다[21]. 그 외 spinel구조를 생성하기 위한 솔-젤법[29]과 Mn 산화물의 분자 및 터널크기를 제어할 수 있는 고상법[30]등 Mn 산화물과 관련되어 많은 연구가 이루어지고 있다. 두개 이상의 전이금속을 결합한 연구도 활발히 이루어지고 있다. 본 연구실의 선행연구[31]에서는 상온에서 우수한 활성과 안정성을 보인 Cu-Mn 산화물촉매를 합성하였다. Cao et al.[32]은 Co-Fe 혼합비율과 소성온도를 달리하여 전이금속산화물 촉매를 제조해 CO 산화반응에 적용하였다. 합성조건에 따라 촉매는 다양한 결정구조, 비표면적, 산소 종을 비롯한 물리화학적 특성과 촉매활성을 보인다. Liang et al.[24]은 수열합성반응으로 합성조건을 달리하여 서로 다른 결정상을 가진 Mn 산화물을 합성해 CO 산화반응을 실시한 결과 α- ≈ δ- > γ- > β-MnO2 순으로 촉매활성이 우수함을 연구하였다.
본 연구에서는 수열합성법으로 합성온도와 시간에 따른 MnO2를 제조하고 촉매활성을 시험하기 위해 승온 및 등온조건에서 CO 산화반응을 수행하였다. 또한 촉매반응의 활성 및 비활성화의 규명을 위해 X-선 회절분석(X-ray diffraction, XRD), 질소 흡착 및 탈착(N2-sorption), 주사전자현미경(scanning electron microscopy, SEM), H2 승온 환원(temperature programmed reduction of H2, H2-TPR), CO 승온 환원(CO-TPR)을 통해 물리화학적 특성을 분석하였다.
본 연구에서는 과망간산칼륨(KMnO4, 99.3%, SAMCHUN CHEMICALS)과 염화망간(II) 4수화물(MnCl2・4H2O, 98%, JUNSEI)을 이용하였다. 두 반응물은 다음과 같은 반응으로 산화물을 형성한다.
2KMnO4 + 3MnCl2 + 2H2O → 5MnO2 + 2KCl + 4HCl
먼저 0.030 mol KMnO4용액에 0.045 mol MnCl2・4H2O 용액을 한 방울씩 떨어뜨렸다. 두 전구체 간 반응을 통한 자연침전을 유도하여 따로 침전제는 사용하지 않았다. 용액의 충분한 혼합을 위해 0.5시간 동안 상온에서 교반 후, acid digestion bombs (PARR INSTRUMENT COMPANY)과 autoclave (Daeil Engineering)를 이용해 50 rpm으로 120, 150, 180, 200 ℃에서 0.5, 1, 3, 5시간 동안 각각 수열반응을 실시하였다. 합성 된 수화물은 4 L의 탈 이온수로 세척을 거쳐 80 ℃에서 12시간 동안 건조되었다. 회수된 수화물은 공기 흐름 하에 300 ℃에서 2시간 공기중에서 열처리를 통해 산화물의 형태로 얻어졌다. 합성된 산화물은 합성조건에 따라 MnX(Y)로 표기했으며, 여기서 X는 합성온도를 나타내며 Y는 동일온도에서 합성시간이다.
결정성과 구조적 특성을 알아보기 위해 Bruker AXS사 (λCu–Kα = 1.5418 Å)장치로 XRD 분석을 실시하였다. 이 때, 사용전류와 전압은 40 mA와 40 kV이며, 2θ = 10~80° 범위에서 측정하였다. 분석결과는 JCPDS (joint committee on powder diffraction standards) 파일을 기준으로 결정피크의 위치를 확인하였다.
비표면적, 세공부피 및 세공크기분포도를 측정하기 위해 Micromeritics사의 ASAP2020 장치로 -196 ℃에서 N2-sorption 분석을 실시하였다. 비표면적은 P/P0 = 0.05-0.20범위에서 계산하였고, 총 세공부피는 P/P0 = 0.995에서 질소 흡착 량으로 계산하였다. 세공크기분포도는 BJH (Barrett-Joyner-Halenda)방법으로 분석하였다.
SEM (Carl Zeiss)으로 표면을 분석을 실시하였다. 시료의 표면분석을 위해 백금으로 시료 표면을 코팅하였다.
촉매의 환원거동을 분석하기 위해 사극자질량분석기(quadruple mass spectrometer, GSD301, Pfeiffer vacuum)를 이용해 H2-TPR 분석을 실시하였다. 0.03 g의 촉매를 U자 석영 고정층 반응기(I.D = 10 mm)에 충진 후 Ar 30 cm3 min-1 유량, 4 ℃ min-1 승온속도로 300 ℃에서 1시간 동안 전처리를 실시하였다. 상온으로 냉각 후 30 cm3 min-1 유량으로 10% H2-Ar을 흘려주면서 10 ℃ min-1) 승온속도로 500 ℃까지 승온하여 환원거동을 분석하였으며, 소모되는 H2의 양(MS signal of ・H2,
촉매활성의 원인이 되는 표면의 격자산소의 양을 관찰하기 위해 QMS를 이용해 CO-TPR 분석을 실시하였다. 반응기와 촉매양은 H2-TPR과 동일하게 하였다. 분석 전, 300 ℃에서(4 ℃ min-1) 30 cm3 min-1 Ar으로 0.5시간 전처리를 실시 후 상온까지 냉각시켰다. 상온에서 5% CO-Ar (30 cm3 min-1)을 700 ℃까지 10 ℃ min-1으로 승온하며 격자산소와 반응하여 생성되는 CO2의 양(MS signal of ・CO2,
승온 CO 산화반응을 위해 석영 고정층 반응기에 촉매 0.05 g을 충진하여 수행하였다. 반응 전, 촉매를 300 ℃에서(2 ℃ min-1) 1시간 100 cm3 min-1 N2로 하여 상온까지 냉각시켰다. 반응물은 총 유량 100 cm3 min-1, CO/O2/N2의 부피비를 1/4/95로 조성하여 반응 초기, 상온에서 0.25시간 촉매 층으로 반응물을 통과시킨 후 2 ℃ min-1으로 300 ℃까지 승온시켰다. 촉매활성 및 안정도를 관찰하기 위해 170 ℃에서 18시간 등온반응을 실시하였다. CO 전환율은 비분산 적외선(non-dispersive infrared, ND-IR)시스템이 구축되어 있는 CO 분석기(Teledyne Model 7500)로 실시간 분석을 진행하여 반응된 CO 농도를 공급된 CO 농도로 나누어 계산하였다.
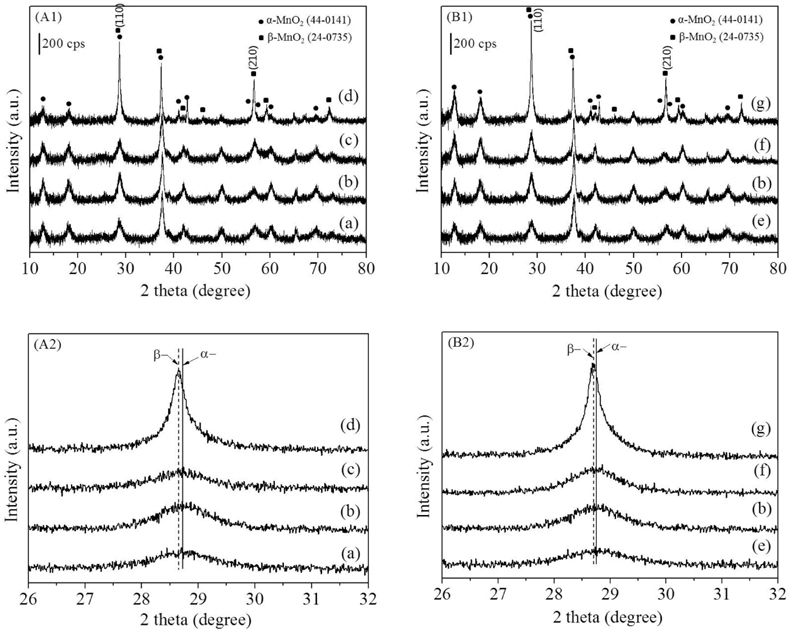
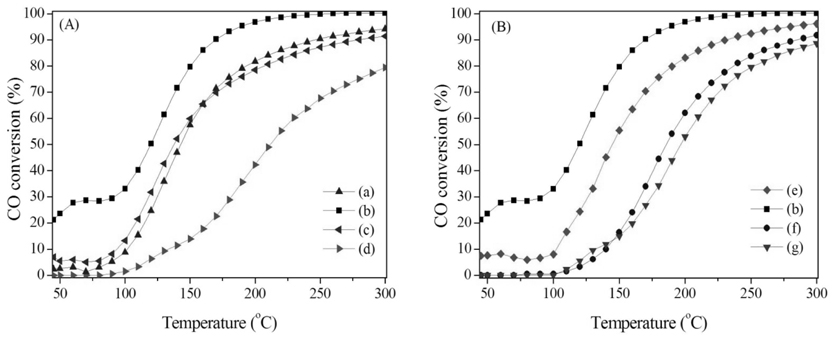
본 연구에서 사용한 MnO2 촉매의 XRD 분석결과를 Figure 1에 나타내었다. α-MnO2는 2θ = 37.3°에서 가장 강한 회절을 보이며 그 순서는 37.5° > 28.8° > 60.3°이다. β-MnO2는 28.6°에서 가장 큰 회절피크를 보이며 28.7° > 56.7° ≈ 37.3°의 순서로 감소한다. 본 연구를 위해 제조된 시료 중 Mn120(1), Mn150(1), Mn180(1)과 Mn150(0.5), Mn150(1), Mn150(3)에서 공통적으로 순수한 α-MnO2의 결정상을 보였으며 Mn200(1)와 Mn150(5) 는 α-MnO2과 2θ = 28.7, 56.7°에서 나타나는 β-MnO2도 함께 관찰되었다(Figure A1, B1). 보다 면밀한 분석을 위해 2θ 범위를 확대하여 Figure 1의 A2와 B2에 나타내었다. α-MnO2에서 관찰되는 2θ = 28.8°의 회절 각이 Mn200(1)와 Mn150(5)은 β-MnO2에서 보이는 가장 큰 회절각인 2θ = 28.7°로 0.1° 자리 옮김을 한 것으로 관찰되었다. 이를 통해 200 ℃에서 1시간, 혹은 150 ℃에서 5시간 수열반응 후 열처리 시 α-상이 뿐만 아니라 일부 β-상도 함께 형성됨을 확인하였다.
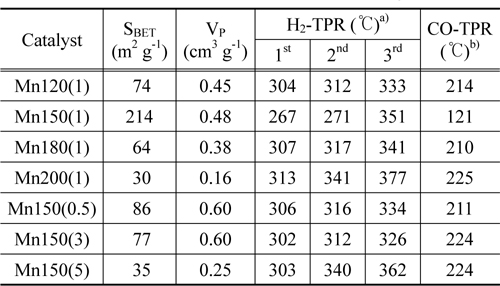
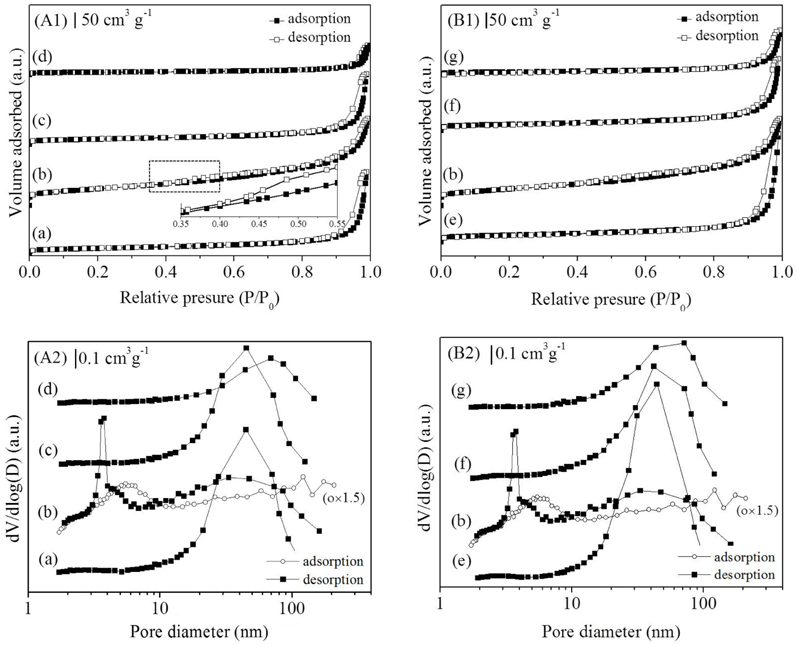
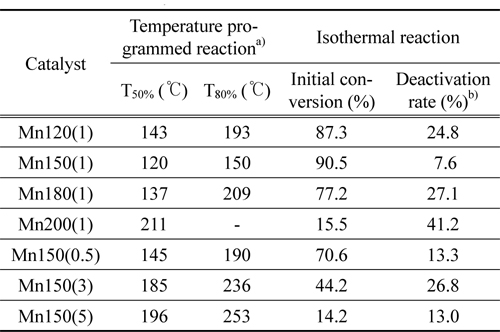
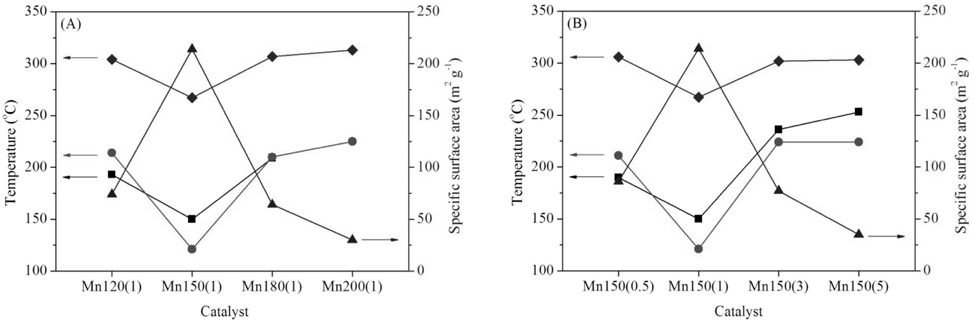
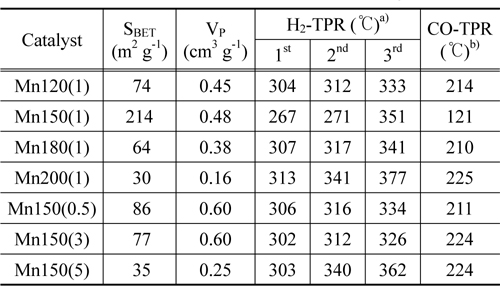
시료의 비표면적과 세공분포에 대한 질소 흡착 등온선 분석결과를 Table 1과 Figure 2에 나타내었다. 모든 시료에서 질소 흡착 시 모세관 응축으로 인한 전형적인 IV형태의 곡선을 보이는 히스테리시스 현상이 다양한 P/P0 범위에서 관찰되었다. 이는 분석된 시료가 중간세공의 크기임을 시사한다. 특히, Mn150(1)는 질소 탈착 시 P/P0 = 0.42-0.48에서 인장 강도 효과로 인한 흡착된 질소의 급격한 탈착이 일어났다. 이는 BJH 세공크기분포 결과에 반영되어, Mn150(1)촉매의 분석결과에서 2-3 nm구간에서 질소 흡착(○) 시 관찰되지 않은 인공세공이 탈착(■) 시 관찰되었다(Figure A2). 또한 질소의 탈착 시 분석된 세공크기는 약 4 nm로 세공에서 발생하는 차단영향 [33]으로 흡착 시 관찰된 세공 크기 (5 nm)보다 작게 분석되었다. 비표면적은 MnX(1) 촉매에서 Mn150(1)이 가장 큰 214 m2 g-1으로 가장 크며 Mn150(1) > Mn120(1) > Mn180(1) > Mn200(1) 순으로 감소하였다. Mn150(Y)에서도 Mn150(1) > Mn150(0.5) > Mn150(3) > Mn150(5)의 경향을 보였다. 수열합성과정에서 핵이 생성되어 비표면적이 증가했지만 합성조건 150 ℃, 1시간 이상에서는 생성된 입자의 뭉침 현상이 발생해 비표면적이 다시 감소함을 알 수 있었다[34,35]. 높은 비표면적을 가진 촉매는 촉매표면에 반응물이 흡착하여 반응할 수 있는 활성점이 다수 노출되어 있기 때문에 우수한 촉매활성을 기대할 수 있다.
Physicochemical properties of MnO2 catalysts prepared by hydrothermal process and calcined at 300 ℃
Figure 3에 SEM 분석결과를 나타내었다. 모든 촉매에서 공통적으로 α-MnO2의 결정형태인 막대기 형태를 보였다[36]. MnX(1)시료에서 Mn120(1)은 일부에서 크기가 불규칙하게 뭉친 형태를 보였고, Mn150(1)은 α-MnO2결정형태가 강하게 나타났다. Mn180(1)촉매는 α-MnO2가 일부 β-MnO2로 전이되어 Mn200(1)에서 β-MnO2의 결정형태인 hollow pyramid로 강하게 성장했음을 관찰하였다(Figure 3(a)-(d))[37]. Mn150(Y)시료에서는 α-MnO2인 막대기 형태를 약하게 보인 Mn150(0.5) 촉매가 합성시간이 증가하면서 Mn150(5)촉매에서는 hollow pyramid형태로 결정성장 및 구조의 변화를 관찰하였다(Figure 3(b), (e)-(g)). 이는 XRD 분석과 상호 일치되는 결과로 150 ℃ 에서 5시간, 혹은 200 ℃에서 1시간 이상의 수열합성 시, 순수한 α상이 아닌 α/β-혼합상의 MnO2가 형성됨을 알 수 있었다.
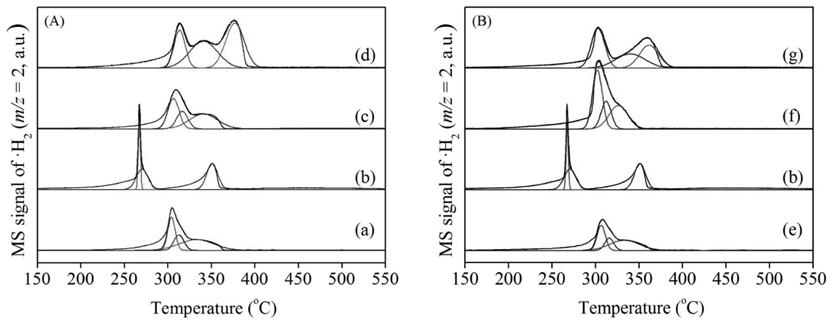
Mn 산화물의 환원성을 알아보기 위해 H2-TPR로 분석하여 Figure 4와 Table 1에 나타내었다. 일반적으로 H2로 인한 Mn종의 환원반응은 다음과 같은 세 단계를 따른다.
제조된 MnO2에서 세 단계로 환원경향이 관찰되었다. 순수한 α-결정구조를 가진 Mn120(1)는 304, 312, 333 ℃에서 각각 Mn 산화물의 환원이 관찰되었고 Mn150(1)는 267, 271, 351 ℃에서, Mn180(1)과 Mn200(1)은 307, 317, 341 ℃와 313, 341, 377 ℃에서 각각 관찰되었다. 공통적으로 1과 2과정이 연속적으로 발생했는데, 이는 산화수 4 (Mn4+)를 갖는 Mn종이 산화수 3 (Mn3+)를 거쳐 일부 2 (Mn2+, Mn3+)의 산화수를 갖는 Mn종으로 급격히 환원되었음을 보여준다[24]. α와 β의 혼합상을 가진 Mn200(1), Mn150(5)는 313, 341, 377 ℃와 303, 340, 362 ℃에서 각각 1, 2, 3단계의 환원이 관찰되었다. H2에 의한 촉매의 산화수 변화가 뚜렷하게 분리되어 발생한 것이며, 이는 순수한 α-상을 가진 촉매와 명확하게 서로 다른 환원성을 갖고 있음을 분석하였다. 총 세 단계 중, 1 과정은 촉매에 존재하는 다양한 산소 종 중에서 촉매활성에 영향을 미치는 촉매표면의 격자산소 종 환원에 대한 정보를 포함한다[1]. MnX(1)에서 Mn150(1)는 가장 낮은 온도에서 1st가 관찰되어 Mn120(1), Mn180(1), Mn200(1)보다 낮은 에너지 상태에서도 활성을 보임을 분석하였다. Mn150(Y)촉매는 Mn150(1) << Mn150(3) ≈ Mn150(5) ≈ Mn150(0.5)의 경향을 보였다. 특히, Mn200(1)과 Mn150(5)의 3 과정은 다른 Mn 산화물의 환원 경향보다 고온에서 관찰되고 그 넓이가 α-MnO2에서 커짐을 알 수 있는데, 이는 Mn 산화물 내에 산소 종이 상대적으로 많이 포함되어 있고 환원을 위해서는 다른 Mn 산화물 보다 높은 활성화 에너지가 필요하며, 실질적으로 CO 산화반응에 참여하지 않는 Mn 산화물이 많음을 시사한다 할 수 있다.
일반적으로, CO 산화반응은 MnO2 촉매 표면에 흡착을 하며 촉매 표면에 존재하는 산소와 반응 후 CO2 형태로 탈착되어 진행이 되며 Mn종의 산화수 변화를 유도한다. 반응경로를 살펴보면 다음과 같다.
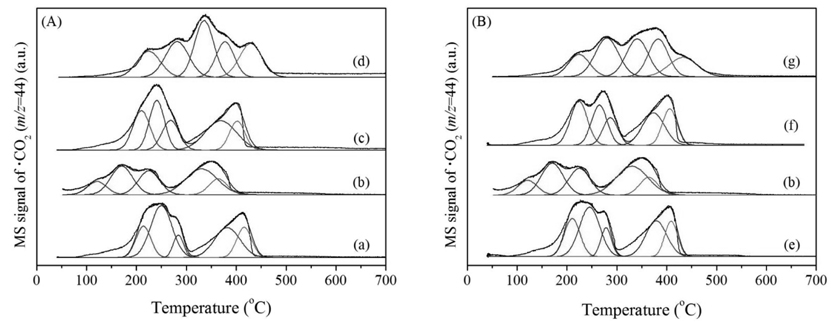
수열합성 조건에 따라 제조된 MnO2가 가진 산소 종의 성질을 관찰하기 위해 CO-TPR 분석을 실시하고 Figure 5와 Table 1에 나타냈다. 모든 시료에 대해 공통적으로 CO에 의한 Mn 산화물의 환원이 5단계에 걸쳐 일어남을 관찰하였다. 이는 Mn 산화물 내 다양한 환경에서 존재하는 산소 종이 존재함을 알 수 있고, 특히 저온에서 생성된 피크는 분석과정에서 CO와 결합한 격자산소 종의 환원 정보를 나타낸다[38, 39]. Table 1에 CO-TPR 분석으로 관찰한 격자산소 종의 활성온도를 나타내었다. MnX(1) 중 Mn150(1)는 121 ℃에서 격자 산소의 활성을 보였으며 214, 210, 225 ℃에서 각각 활성을 나타낸 Mn120(1), Mn180(1), Mn200(1)보다 활성의 용이함을 보였다. Mn150(Y)에서도 Mn150(1)이 가장 낮은 온도에서 활성을 보였으며 Mn150(0.5), Mn150(3), Mn150(5)순서로 각각 211, 224, 224 ℃에서 촉매 표면의 격자산소 종이 CO에 의해 활성을 보였다. 이는 격자산소의 출입이 용이할 때 촉매는 우수한 활성을 보여주는 것으로 보인다. 위 결과로 Mn150(1)촉매가 CO 산화반응에 대한 활성이 가장 우수할 것이라고 기대할 수 있다.
Mn 산화물의 CO 산화반응은 Mars van Krevelen (MvK) 반응기구를 따른다고 보고되었다[40]. MvK 반응기구에서 CO산화반응은 아래 식과 같이 촉매 표면에 흡착된 CO가 격자산소와 반응을 하여 CO2를 생성한다.
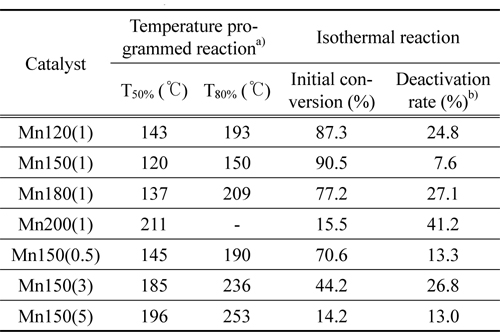
촉매의 합성조건은 촉매구조와 활성에 큰 영향을 끼친다. 수열합성법으로 제조한 촉매에 있어 CO 산화활성을 알아보기 위해 승온 및 등온반응을 실시하여 Figure 6과 Table 2에 나타내었다. 저온(<50 ℃)에서 활성을 보이는 촉매는 40-80 ℃ 영역에서 일시적인 CO 전환율의 급등을 보였다. 이는 상온에서 0.25시간 동안 반응물이 촉매층을 통과하며 CO가 촉매표면에 흡착한 결과로, 승온 과정에서 활성화된 격자산소종과 반응을 하여 CO2가 생성되어 탈착하여 CO전환율에 반영이 되었다. Mn150(1)은 120, 150 ℃에서 CO전환율이 각각 50과 80%를 보여 MnX(1) 중 가장 낮은 온도에서 T50%, T80%을 달성하였다. Mn120(1), Mn180(1)의 T80%은 193, 209 ℃에서 분석되었으며 Mn200(1)은 80% 이상 CO를 제거하지 못했다. Mn150(Y)에서도 Mn150(1)이 가장 좋은 활성을 보였으며 Mn150(0.5), Mn150(3), Mn150(5) 순으로 T80%이 각각 190, 236, 253 ℃를 보여 활성이 감소함을 분석하였다. MnO2는 합성 조건에 따라 화산형 모양의 촉매활성을 보였으며 이 결과는 촉매의 물라화학적 특성과 깊은 관계가 있다. 물리화학적 특성과 반응성의 관계를 분석하기 위해 촉매활성(T80%), 비표면적, H2에 의한 촉매의 환원성, 그리고 CO에 의한 촉매표면 격자산소 종의 활성결과를 Figure 7에 나타내었다. 이 분석결과에서 보다 저온에서 격자산소 종이 활성을 보이고 환원성이 뛰어나며 높은 비표면적을 보이는 촉매일 수록 촉매활성이 우수하였다. 다만, H2에 의한 환원이 Mn150(0.5)은 306 ℃, Mn150(3)은 302 ℃에서 관찰되어 촉매활성(T80%)과는 다른 경향을 보였지만, Mn150(3)보다 높은 비표면적을 가진 Mn150(0.5)이 우수한 촉매활성을 보였다. 또 Mn150(3)와 Mn150(5)은 서로 비슷한 환원성과 격자산소 종의 활성을 보였지만 더 높은 비표면적을 가진 Mn150(3)에서 우월한 촉매활성을 보였다.
Catalytic activity for CO oxidation in the condition of temperature programmed and isothermal reaction over MnO2 catalyst
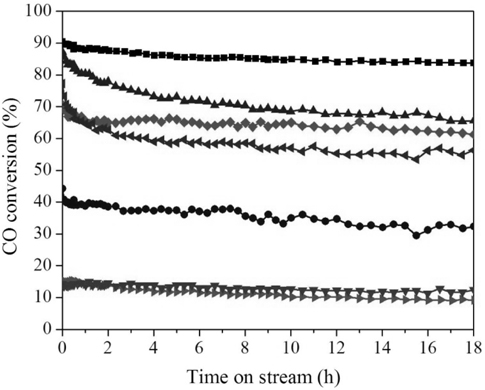
촉매활성의 안정성을 살펴보기 위해 등온반응을 실시하고 결과를 Figure 8과 Table 2에 나타내었다. Mn150(1)이 가장 높은 초기 전환율(90.5%)과 18시간 이후 가장 낮은 비활성화 정도를 보였다(Table 1). 반면, β-상을 띠는 Mn200(1)과 Mn150(5)는 초기 CO 전환율이 각각 15.5%와 14.2%으로 α-MnO2보다 낮은 반응성을 보였다. 특히 Mn150(1)는 α-MnO2 중에서도 높은 비표면적과 많은 격자산소 종을 가지며 환원성이 우수하기 때문에 가장 우수한 촉매활성을 나타냈음을 확인하였다.
KMnO4와 MnCl2・4H2O로부터 별도의 침전제 없이 수열반응을 통해 MnO2를 합성하였다. 승온 및 등온 조건에서 CO 산화반응을 수행하고 활성 및 비활성화의 원인을 규명하기 위해 물리화학적 특성을 분석하였다. 합성 조건에 따라 순수한 α-상 및 α/β-혼합상을 가진 MnO2를 선택적으로 합성하였고, 비표면적, 환원성, 그리고 격자산소 종의 활성을 조절하였다. 본 연구에서는 150 ℃에서 1시간 수열합성 후 300 ℃에서 2시간 소성처리한 촉매가 가장 높은 비표면적과 저온에서 활발한 격자산소 종의 출입을 보였으며 승온 및 등온 CO 산화반응 모두 활성이 가장 우수하였다. 이는 합성과 열처리 과정에서 진행되는 핵 생성과 생성된 핵 간 소결현상으로 촉매의 결정상태, 비표면적과 환원성, 그리고 산소 종의 성질 변화를 비롯한 촉매의 물리화학적 특성과 긴밀한 영향이 있음을 확인하였다.