To investigate the causes of emaciation in cultured olive flounder Paralichthys olivaceus in Korea. We performed histological examinations and polymerase chain reaction (PCR) with a new primer set. In most cases, the most severe emaciation was observed in the abdominal area Using PCR on extracted livers, kidneys, spleens, gills, brains, and intestines, we found that areas around the kidneys and intestines were as almost always positive. In significantly emaciated fish, PCR was positive in all internal organs except the gills. In addition, the homology of 812-bp nucleotide sequences of the 28S rRNA gene was more than 99% in emaciated fish. Partial homology with Myxobolus spp. and Cystodiscus axonis, whose data were obtained from GenBank was 86% and 88%, respectively. Histological examinations detected spores in kidneys and intestines but not in other organs. We also performed cohabitation experiments to determine whether infections could be exchanged among species or only within species. Uninfected olive flounder and red sea bream, Pagrus major, cohabitating with emaciated olive flounder showed 100% and 0% cumulative mortality, respectively. Thus the cause of emaciation in cultured olive flounder of Korea is likely due to a new parasite.
여윔증은1990년 일본의 자주복(
제주 양식산업의 대표적 품종인 넙치는 전국 양식넙치 생산량의 50% 이상을 차지하고 국내 전체 넙치 수출량의 95% 를 점유하고 있는 실정이다. 그러나 제주 양식 넙치의 질병에 의한 연간 피해액이 700억원대에 이르며 해마다 급증하고 있다. 대표적인 폐사 원인으로는 바이러스성 질병인 viral hemorrhagic septicemia (VHS)와 기생충성 질병인 Scuticocilate가 높은 비율을 차지하고 있으며, 세균성 질병인 연쇄구균병과 에드워드병 외에도, 원인불명으로 인한 폐사가 심각한 수준인 것으로 밝혀졌다.
국내의 여윔증은 2007년부터 제주도 넙치 양식장에서 약 20cm전후 크기의 넙치에서 발생하고 있으며, 1-3주 동안 발병하여 폐사를 야기시키고 있다. 일본의 자주복과는 달리, 국내 넙치의 여윔증 발병에 대한 원인은 아직 보고되어 있지 않은 상황이며, 원인불명 질병에 의한 피해를 최소화 하기 위해 신속한 진단법을 마련하여 질병이 확산되는 것을 미연에 방지하는 것은 매우 중요한 점이라 할 수 있다.
본 연구에서는 제주지역에서 여윔증상을 보이는 넙치를 대상으로, 여윔증의 원인을 밝혀내기 위해 분자생물학적 분석 및 조직병리학적 분석을 실시하였으며, 또한 cohabitation test를 통하여 동일한 어종 및 타 어종으로의 전이가 발생하는지를 확인하고자 하였다.
여윔증 연구를 위한 시료는 2010년(E03), 2011년(E06), 2012년(E03) 및 2013년(E12)에 제주지역의 넙치 양식장으로부터 수집하였다. 채집된 넙치는 광학현미경을 이용하여 기생충 검경을 실시하였고, 세균을 분리하기 위하여 tryptic soy agar (Difco Co., USA), thiosulfate citrate bile salts sucrose agar (Difco), Salmonella-Shigella (Difco) 배지에 각각 병어의 간, 비장, 신장 조직을 도말한 후, 25℃에서 배양하였다. Cho et al. (2007)의 방법에 따라 viral hemorrhagic septicemia virus (VHSV), viral nervous necrosis virus (VNNV), hirame rhabdovirus (HRV) 및 red seabream iridovirus (RSIV)등 4종의 바이러스에 대하여 PCR 방법으로 감염여부를 확인하였다.
여윔증상을 보이는 넙치로부터 간, 비장, 신장, 장, 뇌 및 아가미 조직을 적출하였고, DNA를 분리하기 위하여 DNeasyⓇ Blood & Tissue Kit (Qiagen Hilden, Germany)를 사용하였다. 먼저 각 조직의 10 mg에 ATL buffer 180 μL와 proteinase K 20 μL를 첨가하여 56℃에서 조직이 녹을 때까지 반응시켰다. 반응 후, AL buffer 200 μL를 넣어 섞은 다음 ethanol 200 μL를 더하여 spin column에 옮겨 6,000
여윔증상을 보이는 국내의 넙치를 대상으로 여윔증의 원인을 분석하기 위하여, 일본에서 여윔증의 원인체로 보고된
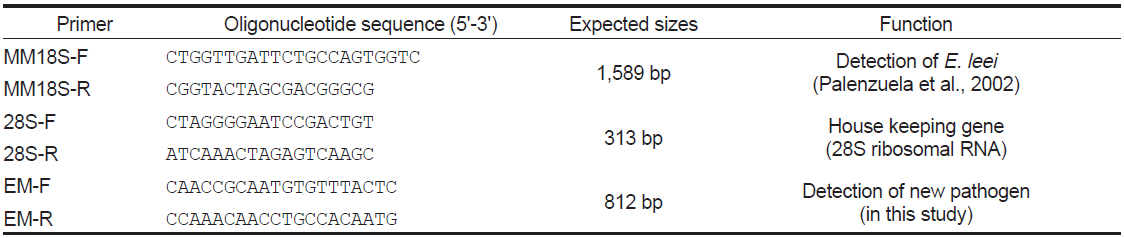
[Table 1.] PCR primers used for the detection of new pathogen
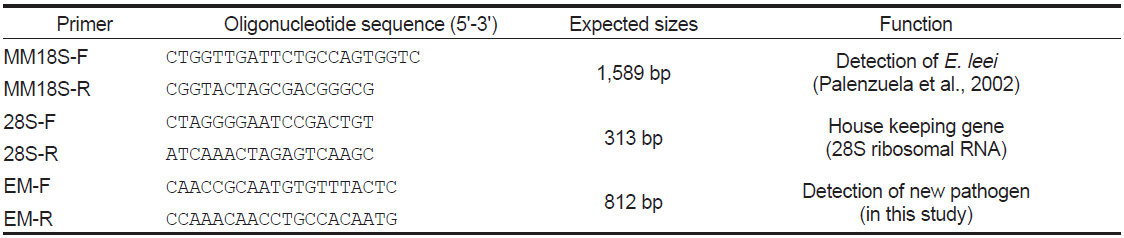
PCR primers used for the detection of new pathogen
PCR은 microtube에 1 μM의 각 primer, 2.5 mM의 각 dNTP, 10×G-Taq Buffer, 2.5 U G-Taq DNA polymerase (Gene Pro Themal Cycler Cosmo, Korea) 및 template DNA로서 추출된 핵산을 첨가한 후 distilled water로 PCR 혼합물의 최종 volume이 20 μL가 되게 하였다. PCR 조건은 95℃에서 3분간 predenaturation시킨후, 95℃에서 30초 denaturation, 55℃에서 30초 annealing, 72℃에서 30초 extension의 반응을 1 cycle로 하여, 35 cycles를 반응시켰다. 그리고, 72℃에서 7분간 post-extension시켰다. PCR 후 증폭 산물은 1×TAE buffer (40 Mm Tris-acetate, 1 mM EDTA)를 전기영동을 위한 완충액으로 하여, 0.5 μg/μL ethidium bromide가 첨가된 1% agarose gel 상에서 전기 영동한 후, UV 검출기에서 band를 관찰하였다. PCR 증폭 산물은 gel purification kit (Bioneer, Korea)를 이용하여 회수한 후, ToPo TA cloning® kit (Invitrogen, USA)로 cloning하여 염기서열 분석을 의뢰하였다(Solgent, Korea).
조직병리학적 분석을 위해 여윔 증상을 보이는 넙치로부터 간, 비장, 신장, 장, 뇌, 아가미 조직을 적출하여 Bouin’s solution에 24시간 동안 고정한 후 70% EtOH를 사용하여 탈수하였다. 이후 파라핀 침투를 시키고(Leica EG 1150HC, Germany) 포매기(Leica Jung 820, Germany)를 사용하여 포매를 실시하였다. 이 후 마이크로톰으로 4-5 μm 두께의 절편을 잘라 유리 슬라이드에 부착시켜 건조시켰다. 제작된 조직표본은 haematoxylin과 eosin (H&E)으로 염색을 실시한 후 광학현미경(Zeiss LT60, Germany)으로 검경하였다.
감염어로부터 물을 통한 감염이 가능한지를 확인하기 위하여 Ishimatsu et al., (2007)의 방법을 사용하여 cohabitation 실험을 실시하였다. 먼저 PCR에 의해 여윔증 감염이 확인된 넙치를 donor group으로 하였고, 음성으로 판정된 넙치 및 참돔을 recipient group으로 지정하여 두 가지 실험을 실시하였다. 첫번째 실험에서는 여윔증에 걸린 넙치(16.3±0.4 cm, 40±5.23g) 15마리와 여윔증이 감염되지 않은 넙치(16.7±0.9 cm, 53.4±8.47 g) 15마리를 이용하여 cohabitation 실험을 실시하였다. 실험에 사용된 넙치는 100 L 플라스틱 수조에 recipient group의 꼬리 지느러미를 조금 잘라내어 구별하였다. 두 번째 실험에서는 넙치 외 타 어종인 참돔으로 여윔증의 전이가 이루어지는지를 조사하고자 하였다. 참돔이 잡아먹히는 것을 방지하기 위하여 100 L 수조 내에 플라스틱 그물망을 사용하여 구역을 나눈 후, 여윔증 감염이 확인된 넙치 10마리와 여윔증 음성 판정이 확인된 참돔(6.5±0.5 cm, 3.5±0.7 g) 10마리를 이용하여 cohabitation 실험을 실시하였다. 실험기간 동안의 사육수온은 19±1℃를 유지시켜 주었으며 1일 1회씩 상업용 사료를 공급한 후, 사육수를 환수시켰다. 매일 폐사 정도를 확인하였고, 폐사어는 조직병리학적 관찰 및 PCR 방법을 사용하여 여윔증 감염 여부를 확인하였다.
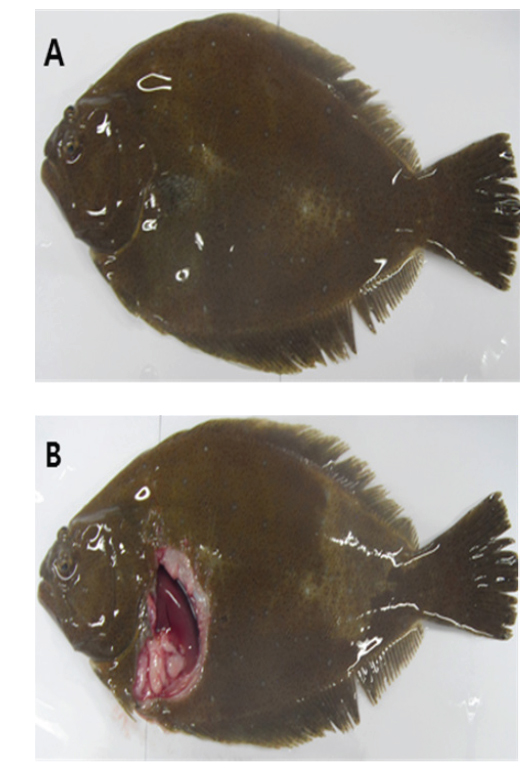
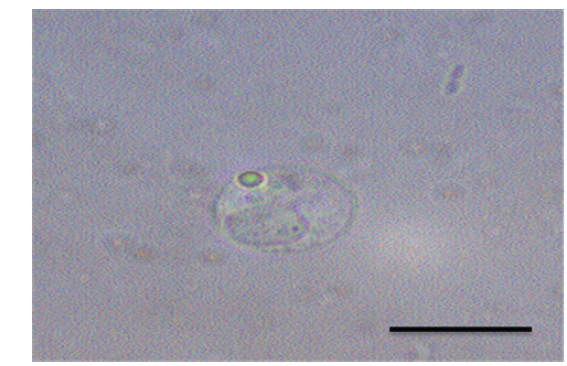
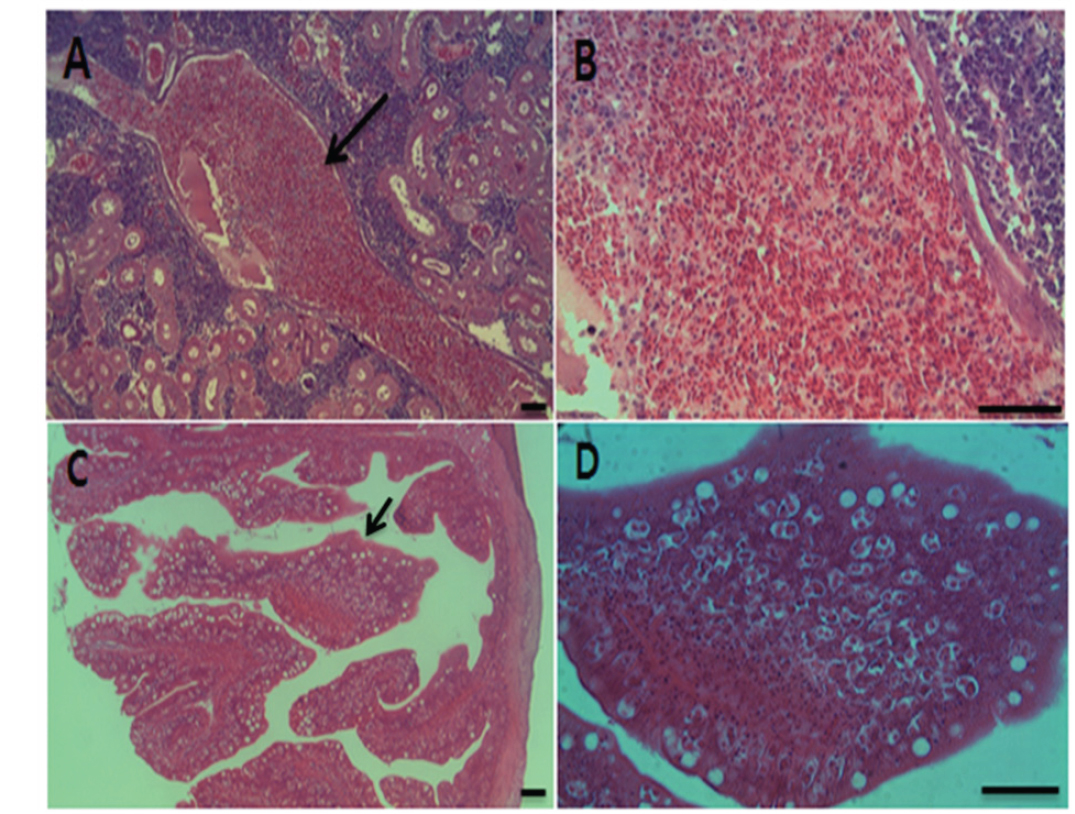
여윔증에 감염된 넙치의 대부분은 복부 부위가 심각하게 여위는 것으로 관찰되었고, 일부 체색흑화 및 해부 시 간 출혈 등의 증상이 관찰되었으나, 일본의 자주복에서 보고되었던(Tun et al., 2000) 안구함몰이나 두부돌출과 같은 증상은 보이지 않았다(Fig. 1A, 1B). 현미경을 통해 기생충 검경을 실시한 결과, 신장 및 장에서 길이 5-8 μm, 폭 7-9 μm의 둥근 형태의 포자가 관찰되었고(Fig. 2), 심각한 폐사를 보이는 일부 넙치양식장의 경우,
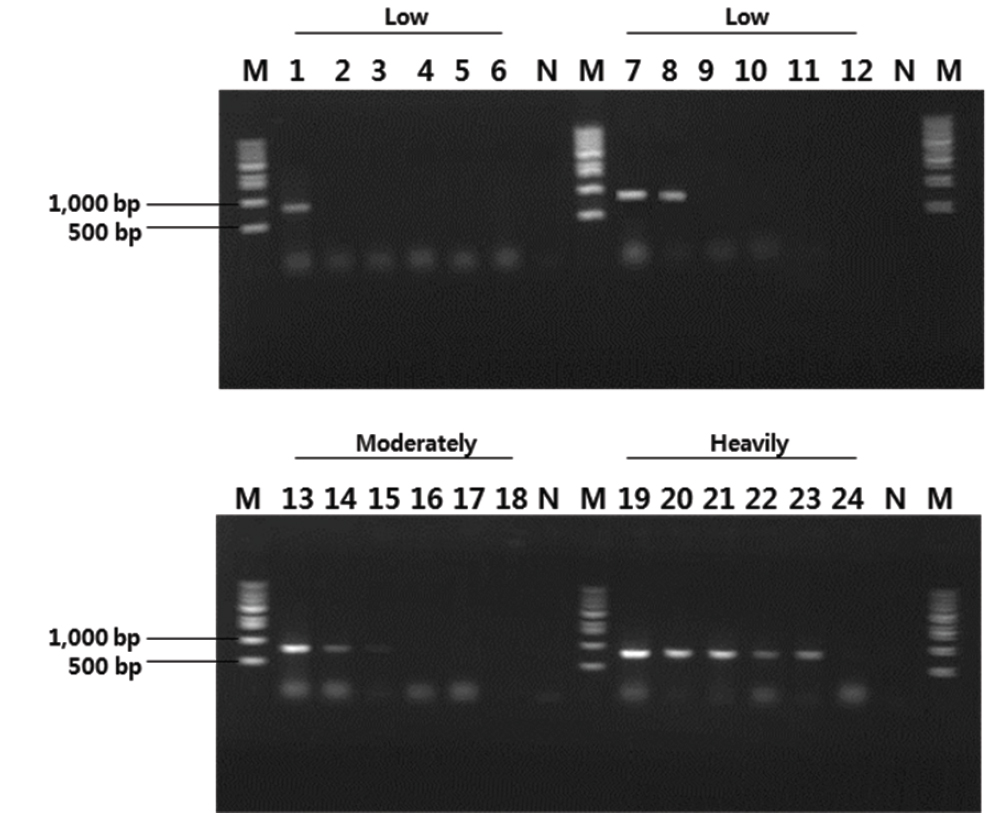
제주도 넙치 양식장에서 여윔 증상을 보이는 넙치를 대상으로 새롭게 제작한 EM-F/EM-R primer set를 이용하여 PCR을 실시한 결과(Table 1), 일본의 여윔증에 대한 연구에서는 원인체가 주로 장에서 검출되는 것으로 보고하였으나, 본 연구에서는 넙치의 장에서 뿐만 아니라 신장에서도 모두 양성의 결과를 나타낸다는 것을 확인하였다(Fig. 3). 여윔증에 감염된 다양한 넙치를 대상으로 PCR을 수행한 결과, 여윔증 원인체의 검출 정도가 신장, 장, 비장의 순서로 높은 것을 확인하였으며, 병원체의 주요 감염 표적장기는 신장 및 장 부위인 것으로 추정되었다. 또한, 심각한 여윔 증상을 보이는 넙치에서는 아가미를 제외한 모든 검사대상 조직에서 PCR 양성의 결과를 확인할 수 있었다(Fig. 3).
검출된 PCR products에 대한 유전자 염기서열을 분석한 결과, 다른 시기에 제주도의 다양한 양식장의 여윔증상 넙치로부터 검출된 병원체들 간의 유전자 상동성은 서로 99% 이상인 것으로 나타났고, 제주도의 넙치양식장에서 발생하는 여윔증의 원인체는 대부분 동일한 기생충 종인 것으로 추정되었다 (Fig. 4). GenBank database를 활용한 유전자 비교 분석을 실시한 결과, 일부 염기서열인 150 bp가
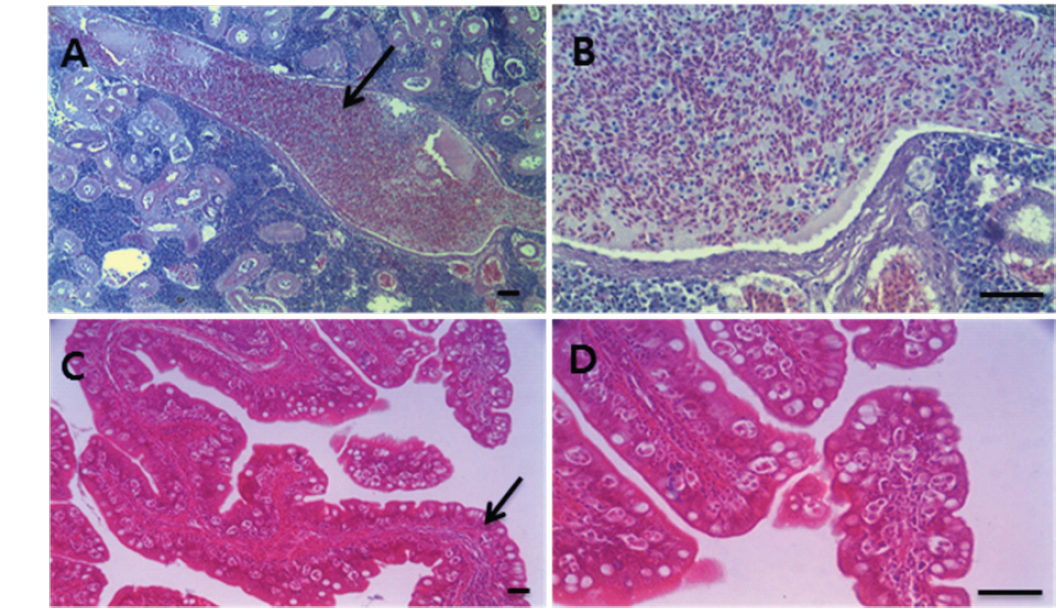
각 장기의 조직 절편을 광학현미경으로 관찰한 결과, 여윔증에 감염된 넙치의 신장과 장 부위에서 원형 또는 난원형의 포자가 다수 관찰되었고, 장 부위에서보다 신장 부위에서 더욱 많은 수의 포자가 관찰되었으며, 기부골절, 사구체, 핵 등의 파괴와 변형체(plasmodium)가 일부 관찰되었다(Fig. 5A and 5B). 감염된 장 상피 부위에서는 포자가 관찰되었지만 변형체는 관찰되지 않았으며, 심한 경우 조직의 탈락 및 파괴가 나타났다(Fig. 5C and 5D). 신장 및 장을 제외한 다른 조직장기 부위에서는 포자가 관찰되지 않았으며, 특이적인 조직학적 이상소견도 관찰되지 않았다(data not shown).
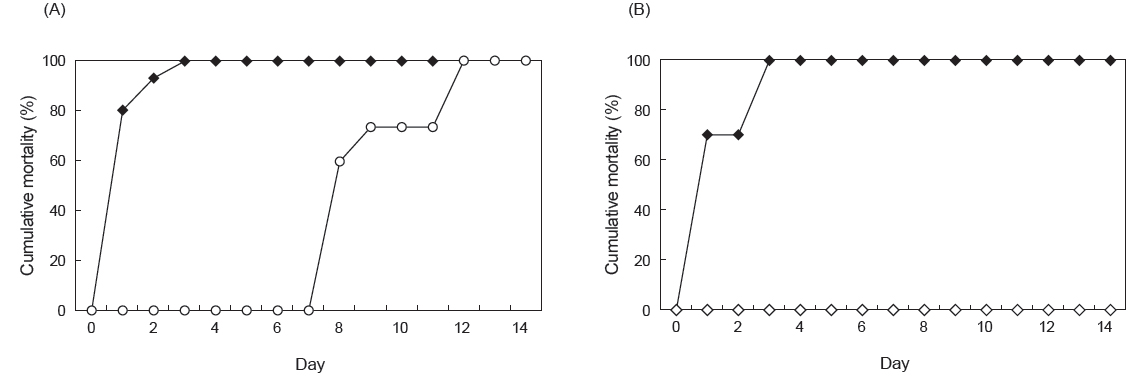
여윔증에 대한 PCR음성 결과가 확인된 넙치 및 참돔을 이용하여 병원체의 전이에 대한 실험을 실시한 결과, 실험 기간 중 2 groups의 donor 넙치는 3일째에 100% 폐사하였고, recipient 넙치에서는 12일째에 100% 누적 폐사율이 관찰되었다(Fig. 6A). 감염어로부터 유출된 병원체에 의해 감염된 recipient group에서의 폐사는 donor group에서 보다 7일 정도 후에 나타나기 시작하였으며, 폐사가 일어난 recipient group의 넙치를 PCR법으로 확인한 결과, 73.3%의 감염률이 관찰되었고(Table 2), 조직학적 검사 결과 신장, 장 부위에서 donor fish와 동일한 형태의 포자가 관찰되었다(Fig. 7). 참돔으로의 병원체 전이에 대한 실험 결과, 실험 기간 중 3일째에 donor group에서 100% 누적폐사율이 관찰되었고, recipient group에서는 실험 종료일까지 폐사가 발생하지 않았으며(Fig. 6B), PCR검사 결과에서 모두 음성인 것으로 판명되었다(Table 2). 조직학적 검사 결과에서도 모든 참돔의 조직 부위에서 포자가 관찰되지 않았다(data not shown).

Infection rate (%) of olive flounder Paralichthys olivaceus and red seabream Pagrus major after cohabitated with the emaciated olive flounder
본 연구에서는 일본의 여윔증에 대한 연구 방법 및 결과들을 국내의 여윔증 연구를 위하여 적용해 보았고, 우리나라의 여윔증 원인체는 일본에서 보고된 여윔증 원인체와 형태학적으로는 유사하지만, 분자유전학적으로는 전혀 다른 종이라는 것을 밝혀내었다. 감염 넙치에 대한 분석 결과, 대부분은 복부 부위에 심각한 여윔이 관찰되었으며, 감염 넙치가 감염되지 않은 넙치보다 체중이 30-40% 정도 낮은 것으로 관찰되었고(data not shown), 간혹 육안상 복부부위가 여위지 않은 넙치에서도 감염이 발생하여 감염 후 여위는 것으로 판단된다. Choi et al. (2012)은 제주도 넙치 양식장에서 발병하는 여윔증 넙치에서
일본의 자주복에서 처음 발견된 여윔증은 Tun et al. (2002)의 연구에서
이전 연구들에서는 sharpsnout sea bream
일본에서는 여윔증의 원인체로 알려진
본 연구에서는 국내의 양식넙치에서 발생하는 여윔증에 대하여 분석하였으며, 기존에 일본에서 보고된 결과와 비교했을 때, 장 조직에서 형태학적으로 유사한 포자가 관찰된 것은 동일하지만, 병원체의 분자생물학적인 분석 및 cohabitation 실험에서는 다른 결과를 보였고, 아직 GenBank에 미등록된 새로운 기생충 종인 것으로 조사되었다. 그리고, 국내의 넙치 양식장에서 많은 문제를 야기시키는 여윔증에 대한 진단법을 처음 개발하여 제시하였고, 이것은 여윔증에 대한 다양한 연구에 있어서 중요한 기반이 될 수 있을 것이며, 향후에는 원인 기생충의 동정에 대한 연구가 이루어져야 할 것이다.