The juvenile red variant of the sea cucumber Stichopus japonicus is distributed worldwide. It is a valuable food source in Korea, China, and Japan. Major issues in farming the juvenile red variant sea cucumber include growth rates and disease resistance. In recent years, studies have focused on feed additives to enhance immune system and health. In this study, we used a common diet (CD), a nutritional diet (ND; mixed nutritional supplements), and an immunity diet (ID; mixed probiotics, spirulina, and levan) and compared the growth rates and immunity of juvenile red variant sea cucumbers fed the experimental diets for 12 weeks. The growth and survival rates in the ID group were significantly increased (P>0.05). This suggests that the feed additives positively influenced immunity and growth in the ID group. However, the immune activity was exhibit a stabilizing effect, and further investigation of immune effects is required.
홍해삼(
해삼은 침전물 섭식 생물로서 주로 유기물, 박테리아, 원생동물 규조류 및 해조류 등을 섭이 한다(Yang et al., 2005). 그 중에서 스피루리나는 홍해삼에게 유용한 먹이성분으로 타 미세조류에 비하여 단백질 함량이 높아 영양성분이 뛰어난 것으로 알려져 왔으나, 셀룰로오스(cellulose)성 세포벽으로 인하여 소화 시에 영양흡수가 어려워 해삼의 성장에 크게 도움은 주지 못하는 것으로 보고되고 있다(Xia et al., 2012; Shi et al., 2013). 해조류 분말 역시 조섬유 등이 다량으로 함유되어있어 충분한 영양흡수가 어렵다고 알려졌다(Erasmus et al., 1997; Ten Doeschate and Coyne, 2008). 특히, 해삼은 소화력이 높지 않아 사료 내에 좋은 천연물질을 첨가한다고 하여도 소화흡수율이 낮아 성분을 충분하게 체내로 받아들이기가 어려워 소화흡수율을 높이기 위해 분말사료의 입자분쇄, 발효 및 소화에 좋은 기능성 물질들의 사료에 혼합을 하는 등 많은 노력이 이루어지고 있는 실정이다(Choi, 2014).
한편, 홍해삼 양식에는 소화 흡수율의 증대 이외에도 질병에 취약한 문제점을 가지고 있다. 홍해삼은 육성 시 피부궤양과 입부분 비대 등의 증상을 유발하는 유행성 질병에 특히 취약하며 이는 홍해삼의 체표면이 다른 해삼에 비하여 부드러운데 그 원인이 있다(Xitao et al., 2014). 따라서 질병이 발생하는 경우 확산이 빠르고 폐사율이 높을 뿐 아니라 지속적으로 성장이 저해되는 현상이 일어나게 되며 양식어가에 큰 경제적 피해를 주게된다. 최근에는 이러한 문제점을 해결하기 위해 친환경적인 양식 방법으로 사료에 프로바이오틱스 등과 같은 천연물질을 첨가하여 양식생물의 성장력 및 면역력을 증진시켜 질병으로 인한 피해를 예방하기 위한 노력이 이루어지고 있다(Zhao et al., 2010; Ma et al., 2013; Wang et al., 2014)
프로바이오틱스(probiotics)는 유용 미생물을 의미하며 숙주에 일정량을 사용하였을 때 숙주의 건강에 도움을 주는 균을 말하는 것으로서 오래 전부터 다양한 분야에서 사용되어 왔다(FAO/WHO, 2001). 프로바이오틱스는 소화 효소를 도와 소화력을 높여주는 역할을 하며(De schrijver and Ollevier, 2000; Ten Doeschate and Coyne, 2008; Yu et al., 2009; Zokaeifar et al., 2012), 장 내에서 비타민과 지방산등을 생성하기도 한다(Sugita et al., 1992; Vine et al., 2006). 그러나 단일 제제만으로는 소화력을 높이는데 한계가 있기 때문에 최근에는 효능을 더욱 강화 시키기 위하여 장내에서 프로바이오틱스의 성장 및 효과를 증진시킬 수 있는 기능성 성분인 프리바이오틱스(Prebiotics)와 함께 사용되고 있다. 프로(pro)바이오틱스와 프리(pre)바이오틱스의 영양성 증진과 내재된 효과 증진을 위해 함께 사용하는 것을 신바이오틱스(synbiotics)라 하며 이를 활용한 연구가 활발히 진행되고 있다(Cross ML, 2002; Morelli et al., 2003).
최근의 연구에서 레반성 제제를 프리바이오틱스로 사용하였을 경우 장내 유용세균의 수를 높이고 대장 내의 pH를 낮추는 효과가 있으며(Gibson and Roberfroid, 1995; El-Nagar et al., 2002; Akin et al., 2007; Adebola et al., 2014), 장내 기능을 개선하는데 도움을 주고 숙주의 장내 유용세균의 수를 증가시킬 뿐더러 생육이나 활성을 촉진 함으로서 숙주의 건강을 증진시킬 수 있다고 보고되고 있다(Kang et al., 2009, Srikanth et al., 2015). 그러나 지금까지 프로바이오틱스, 레반 및 스피루리나가 각각 성장 촉진과 면역증강제로서 사용 될 수 있다는 연구는 많이 이루어지고 있으나 홍해삼에게 적용한 연구는 아직 초기 단계에 머무르고 있으며, 두 가지 이상의 유용물질을 혼합한 신바이오틱스성 사료첨가제에 대한 연구 역시 미흡한 실정이다. 이에 본 연구에서는 선행 연구들에서 면역증강제로서 효능이 입증된 프로바이오틱스, 레반을 혼합하여 신바이오틱스성 면역증강제를 제작하고, 양식어가에서 일반적으로 사용되고 있는 일반 해삼사료, 해삼용 영양제 배합사료 및 면역증강제 배합 사료를 급여 하였을 경우 홍해삼 치삼의 성장율, 생존율 및 생리 활성을 각각 비교분석 하고자 하였다.
실험은 2014년 10월 27일부터 2015년 1월 27일까지 총 12주간 제주도 내 홍해삼 양식장에서 진행되었으며, 양식장 내의 수조 3개를 이용하였다. 실험동물은 홍해삼(
[Table 1.] Water environment of experiment tank for 12 weeks
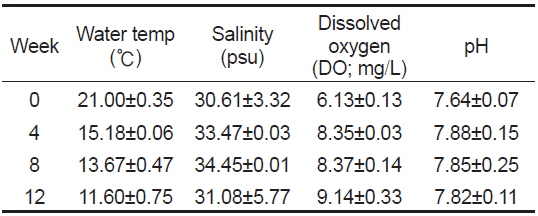
Water environment of experiment tank for 12 weeks
실험사료는 다시마를 주 원료로 한 일반 홍해삼 사료(common diet, CD)와 CD사료에 비타민 등이 포함된 중국산 일반 영양제(sanyihao/yantai, duolai feed co., Ltd.)를 1 kg당 2% 첨가한 사료(nutrition diet, ND)와 1 kg당 스피루리나 15%, 프로바이오틱스(
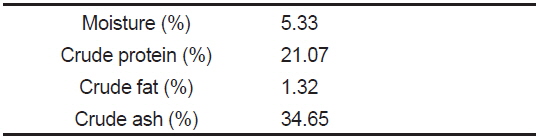
[Table 2.] Proximate composition (%) of common diet (CD) for red sea cucumber Stichopus japonicus
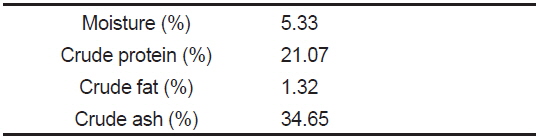
Proximate composition (%) of common diet (CD) for red sea cucumber Stichopus japonicus
홍해삼 치삼 성장도 분석은 사육수조로부터 개체를 전량 회수한 후 계측하였으며, 실험 시작일로부터 4주 마다 반복 측정되었다. 12주의 실험 종료 후 증체율 일간 성장률 및 생존율을 계산하였다. 일간 성장률은 Specific growth rate (%)=(loge final wt-loge initial wt)/days와 같이 계산되었으며, 증체율은 Weight gain (%)=(final weight-initial weight)×100 /initial weight으로 계산되었다.
다당성 물질인 레반 섭이 후 홍해삼 치삼의 체내 다당류 함량변화를 파악하기 위하여 체조직의 다당류 분석을 실시하였다. 홍해삼 치삼을 −70℃에서 3일 이상 동결한 후 냉동건조기를 사용하여 72시간 동안 동결건조 하였다. 건조된 홍해삼 치삼은 분쇄하고 밀봉하여 분석 전까지 4℃에서 냉장보관 하였다. 체내의 다당류 분석은 홍해삼 치삼 건조분말을 2 M TFA(trifluoroacetic acid)로 산가수분해하고 여과(0.2 µm) 및 희석하여 전처리 한 후 HPAEC-PAD system (Dionex, USA)을 이용하여 중성단당류 분리· 동정을 실행하였다. 실험조건은 이동상은 18 mM NaOH, 칼럼은 CarboPacTM PA1을 사용하였다.
면역 활성 분석을 위하여 각 실험군의 홍해삼 치삼을 실험사료 급이 후 10마리씩 무작위로 선별하여 실험에 사용하였다. 체강액은 1 mL 주사기로 채취하여 1.5 mL tube에 넣고 원심분리기를 이용하여 700
홍해삼 치삼의 체강액 내 단백질 함량은 Lowry et al. (1952)의 방법에 따라 측정되었으며, Bovin serum albumin (BSA, sigma, USA)을 사용하여 standard 검량선을 그린 후 750 nm에서 흡광도를 측정하여 정량하였다. Lysozyme 활성은 체강액을 15 μL씩 96 well plate에 분주한 후, 150 μL
결과의 통계처리는 SPSS version 12 (SPSS Inc., USA)를 활용하여 One-way ANOVA- test 로 통계 분석되었으며 데이터 값의 평균 유의차는 Duncan’s multiple test 사후분석을 통해
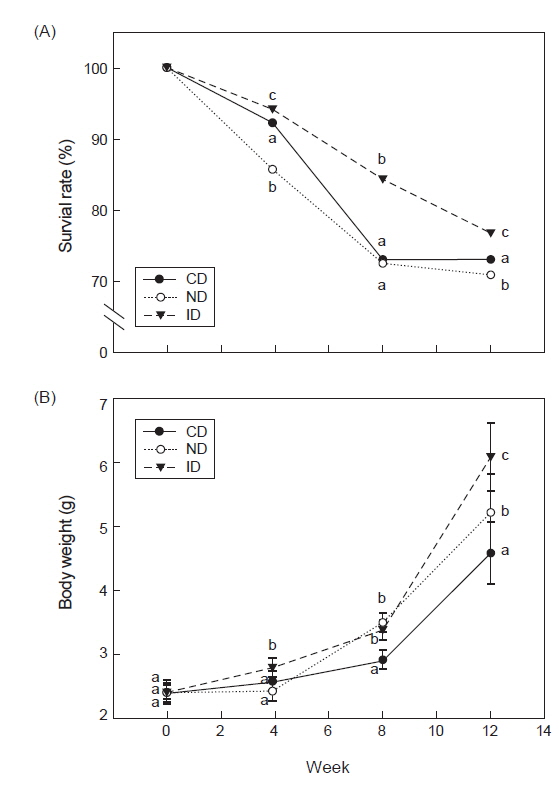
프로바이오틱스와 레반의 혼합 급이가 홍해삼 치삼의 성장과 생존증진에 도움을 주는지 확인하기 위하여 신바이오틱스성 면역증강제를 제작하여 급이 후 4주 간격으로 12주간 생존율과 성장률을 측정하였다. 생존율 실험 결과 CD군은 73.1±0.84%, ND군은 70.9±0.32%, ID군은 76.9±0.5%가 생존하였으며 ID군에서 가장 높은 생존율을 나타내었다(Fig. 1A,
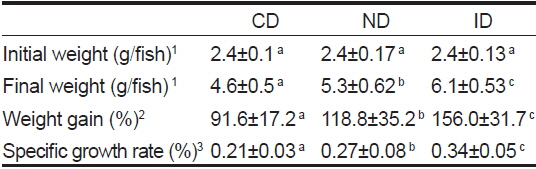
[Table 3.] Growth performance of red sea cucumber Stichopus japonicus after 12 weeks
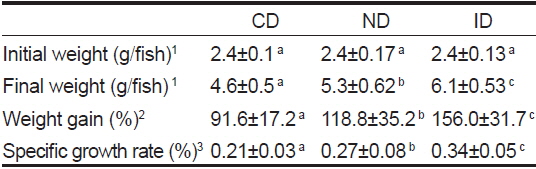
Growth performance of red sea cucumber Stichopus japonicus after 12 weeks
이전의 연구보고에 따르면, 프로바이오틱스, 미세조류, 황기 추출다당류(astragalus membranaceus polysaccharides), 효모 다당류(yeast polysaccharide), 베타글루칸(
해삼과 같이 주로 해조류를 섭이하는 전복
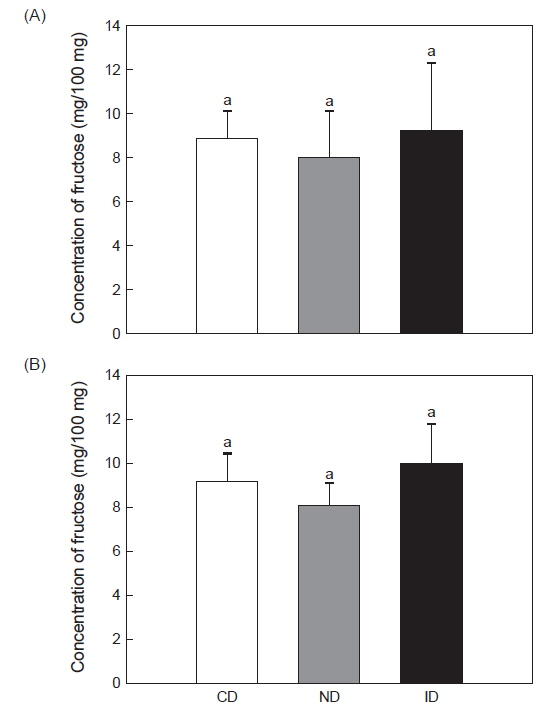
홍해삼에는 다당류가 많이 함유되어 있는 것으로 알려졌으며(Mourão et al., 1996; Yu et al., 2015) 실험에 사용된 레반이 체내 다당류성분에 영향을 미치는지 확인하기 위해 홍해삼을 동결 건조하여 체벽 내에 존재하는 fructose와 glucose의 함량을 분석하였다. Fructose 분석결과 CD군은 8.84±1.35 mg/100 mL, ND군은 8.06±2.07 mg/100 mL 및 ID군은 9.25±3.14 mg/100 mL로 측정되었다(Fig. 2A). Glucose 분석결과 CD군은9.20±2.0 mg/100 mL, ND군은 8.21±0.95 mg/100 mL 및 ID군은 10.04±1.85 mg/100 mL로 나타났다(Fig. 2B). 이와 같이 각 실험구 별로 측정 된 fructose와 glucose의 함량은 유의적인 차이는 나타내지 않았지만(
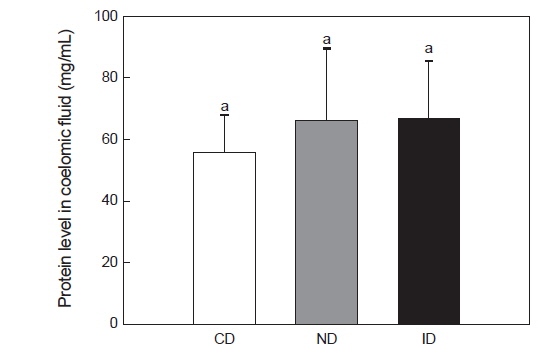
레반을 섭이한 홍해삼의 면역 활성을 확인하기 위해 체강액 내 단백질 함량, lysozyme 및 penoloxydase (PO) 활성을 측정하였다. 체강액 내의 단백질 측정결과 CD군은 56.0±10 mg/mL, ND군은 66.1±24 mg/mL 및 ID군은 66.5±19 mg/mL로 나타났으며(Fig. 3), CD군에 비하여 ND군과 ID군에서 높아지는 경향성을 보였으나 유의적인 차이는 나타나지 않았다(
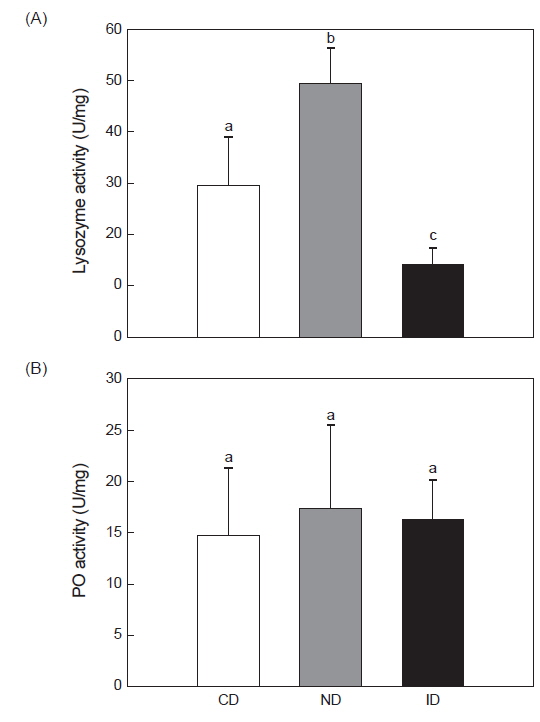
한편, 해삼 체강액 내의 lysozyme 활성 실험 결과 CD군은 29.54±9.2 U/mg, ND군은 49.52±7.2 U/mg, ID군은 14.09±3.2 U/mg으로 ID군에서 유의적으로 낮은 수치를 나타내었다(Fig. 4A,
PO 활성을 측정한 결과, CD군에서 14.7±6.5 U/mg, ND군은 17.2±8.0 U/mg 및 ID군은 16.2±3.8 U/mg로 CD군에 비하여 ND군과 ID군에서 약간의 차이는 나타났으나 유의적인 차이는 없었다(Fig. 4B,
이상의 연구의 결과를 종합 해보면, 신바이오틱스성 면역증 강제 급이를 통해 홍해삼 치삼의 증체율, 일간 성장률 및 생존율이 증가됨을 확인하였으며, 면역 활성의 경우 안정화 되는 경향을 나타내었으나 추가 실험을 통해 면역 활성을 검증해 볼 필요가 있을 것으로 판단된다. 이후 추가적인 보충실험을 통하여 본 연구에서 개발된 면역증강제가 홍해삼의 성장증대와 친환경적인 질병제어에 있어 양식어가에 도움을 줄 수 있을 것으로 여겨진다.