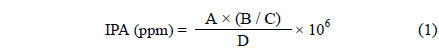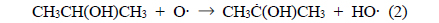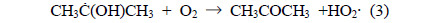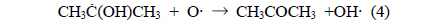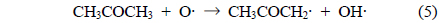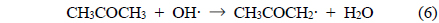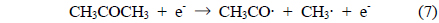This work investigated the plasma-catalytic decomposition of isopropyl alcohol (IPA) and the behavior of the byproduct compounds over monolith-supported metal oxide catalysts. Iron oxide (Fe2O3) or copper oxide (CuO) was loaded on a monolithic porous α-Al2O3 support, which was placed inside the coaxial electrodes of plasma reactor. The IPA decomposition efficiency itself hardly depended on the presence and type of metal oxides because the rate of plasma-induced decomposition was so fast, but the behavior of byproduct formation was largely affected by them. The concentrations of the unwanted byproducts, including acetone, formaldehyde, acetaldehyde, methane, carbon monoxide, etc., were in order of Fe2O3/α-Al2O3 < CuO/α-Al2O3 < α-Al2O3 from low to high. Under the condition (flow rate: 1 L min-1; IPA concentration: 5,000 ppm; O2 content: 10%; discharge power: 47 W), the selectivity towards CO2 was about 40, 80 and 95% for α-Al2O3, CuO/α-Al2O3 and Fe2O3/α-Al2O3, respectively, indicating that Fe2O3/α-Al2O3 is the most effective for plasma-catalytic oxidation of IPA. Unlike plasma-alone processes in which tar-like products formed from volatile organic compounds are deposited, the present plasma-catalyst hybrid system did not exhibit such a phenomenon, thus retaining the original catalytic activity.
산업화가 가속화 되고 다양한 제품이 생산되면서 다양한 종류의 휘발성유기화합물(volatile organic compounds, VOCs)이 배출되고 있다. VOCs는 환경오염뿐 만 아니라 인간 및 생태학적으로도 악영향을 미치고 있다[1-3]. 최근 환경에 대한 사회적 관심이 증가하면서 산업 현장 및 가정에서 배출되는 VOCs의 저감 방안에 대한 관심이 증가하고 있다[4]. 특히, 많은 유럽국가에서는 밀폐된 환경에서 발생되는 냄새 및 VOCs의 배출 제한에 대한 관심이 높아지고 있다[5]. 이러한 VOCs를 저감시키는 방법으로 여과/흡착, 열산화 공정, 광촉매 및 촉매공정, 저온 플라즈마, 이온 빔 조사법 등 다양한 방법이 실시 및 연구되고 있다. 하지만, 여과/흡착의 경우 사용된 흡착제를 처리해야 하는 2차적인 문제가 발생하고, 광촉매의 경우는 낮은 오염수준의 실내 공기에는 성능을 보이나, 반응속도가 느려 고농도의 VOCs처리가 어려운 단점이 있다[4]. 열산화 공정을 이용하여 VOCs를 제거할 경우 높은 온도에 의해 많은 운영 비용이 발생한다[6]. 촉매 공정은 VOCs를 제거하는 전형적인 방법으로 열산화에 비해 낮은 온도에서 휘발성 유기화합물을 제거 할 수 있다[6,7]. VOCs의 분해효율은 촉매 활성에 의해 좌우되는데 귀금속 촉매의 경우 낮은 온도에서 우수한 활성이 나타나지만 높은 비용과 피독에 대한 민감성 등으로 인해 실적용에 큰 제한을 받는다. 따라서 최근에는 가격이 저렴하고 피독 저항성이 강한 구리, 망간, 철 등 전이금속 산화물 촉매에 대한 연구가 활발히 이루어지고 있다[2,3,7]. 하지만 촉매 공정의 경우 300~500 ℃ 정도의 온도를 유지하여야 하며, 완전산화가 이루어지지 않을 경우 독성이 있는 부산물이 생성될 수 있다. 한편, 비교적 새로운 기술인 저온 플라즈마 공정은 플라즈마에 의해 발생되는 1~20 eV의 전자가 배경분자인 질소, 산소 등과 충돌하여 다양한 라디칼 및 이온, 광자 등을 발생시켜 VOCs를 제거한다[1]. 저온 플라즈마를 발생시키는 방법으로 코로나 방전(corona discharge)과 유전체 장벽 방전(dielectric barrier discharge)이 널리 사용되고 있다. Besov and Vorontsov[8]는 플라즈마를 이용하여 아세톤을 분해한 결과 오존보다는 산소 함유 라디칼, 전자 충격 반응 등이 분해에 더 큰 영향을 미친다고 보고하였다. 하지만, 저온 플라즈마의 단점은 대상물질의 불완전한 산화 반응에 의해 유해 부산물을 생성할 수 있다는 점이 다. 이러한 이유로 최근에는 촉매공정과 플라즈마 공정의 결합에 대한 연구가 많이 이루어지고 있다. 촉매를 플라즈마 반응기 내부에 배치할 경우 플라즈마에 의해 발생되는 활성산소, 이온, 라디칼, 전자와의 충돌 등에 의해 촉매 활성이 향상되어 유기물의 산화효율이 증가하고, 낮은 에너지로 유해부산물을 제거할 수 있다[5,9]
본 연구에서는 플라즈마-촉매 공정을 이용한 VOCs 분해 및 부산물 생성거동에 대해 살펴보았다. 아이소프로필 알코올(isopropyl alcohol, IPA)은 용매나 세정제로 전자기기, 종자처리, 코팅, 항균 등 산업 현장 및 실생활에서 광범위하게 사용되고 있다[4,10]. IPA를 분해하기 위한 금속산화물 촉매로는 산화구리(CuO)와 산화철(Fe2O3)을 사용하였다. CuO와 Fe2O3 촉매는 VOCs의 일종인 톨루엔, 메틸에틸케톤(methyl ethyl ketone, MEK) 등의 분해에 대해 높은 활성과 선택성을 보이는 것으로 보고되어 있으므로[11,13], 플라즈마-촉매 복합공정에서도 IPA의 분해에 높은 활성을 보일 것으로 판단되어 이를 확인하고자 하였다. 본 연구에서는 금속산화물을 담지하기 위한 촉매 지지체로 허니컴 형상의 다공질 알루미나 세라믹을 사용하였는데, 펠렛이나 분말은 열전달 저항 및 압력 강하 등의 문제를 유발시킬 수 있기 때문이다[3]. Tsuru et al.[14]에 의하면 허니컴 형상의 알루미나 지지체는 압력강하가 적으며, 내화학성이 우수하고 넓은 온도범위에서 사용이 가능하다.
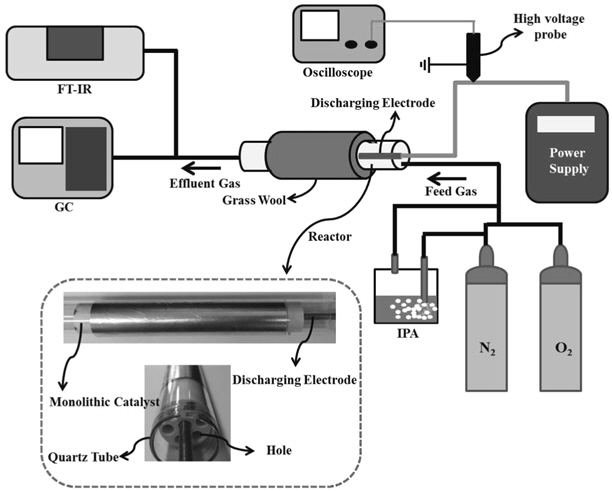
Figure 1은 IPA 분해 실험 장치의 개략도로서, 플라즈마-촉매 반응기는 내경 26 mm(두께: 2 mm)의 석영관, 허니컴 형상의 촉매, 고전압 전극, 석영관 외부를 감싸는 알루미늄 박막으로 구성되었다. 허니컴 형상의 다공성 촉매 지지체(Atech Innovations GmbH, Germany)는 α- Al2O3로 이루어져 있으며, 지름은 25.5 ± 0.2 mm, 길이는 150 mm, 기공크기는 1.2 μm이고, 7개의 기체통로(6 mm)가 단면에 균일하게 분포되어 있다. 허니컴 형태의 촉매 중심에는 6 mm 스테인레스 스틸 전극을 동축으로 삽입하였으며, 여기에 고전압이 인가된다. 방전전력에 따른 IPA 분해 특성을 조사하기 위해 방전전력을 18~47 W로 가변하였다. 석영관 외부를 감싸는 알루미늄 박막은 접지전극의 역할을 한다. 플라즈마 생성은 동축의 스테인레스 스틸 전극과 석영관 사이에서 일어나며, 허니컴 형상의 촉매는 플라즈마 발생영역에 위치하고 있다. 플라즈마 발생영역은 접지전극의 크기에 의해 결정되며 본 연구의 반응기는 130 mm였다. 플라즈마 방전중에 반응기에서 발생되는 열을 촉매반응에 효과적으로 이용하기 위하여 반응기 외부를 유리섬유로 단열하였다. 산화물 촉매 제조에는 함침법이 이용되었다[15]. CuO/α-Al2O3는 Cu(NO3)2・3H2O를 증류수에 용해한 후 Cu기준으로 0.5% (w/w)가 되도록 하였으며, Fe2O3/α-Al2O3는 Fe(NO3)3・9H2O를 출발물질로 하여 Fe 기준으로 0.5%(w/w)가 되도록 하였다. 촉매의 비표면적(BET) 분석에는 비표면적 분석기(Surface Area & Pore Size Analyzer, Autosorb-1-mp, USA), 촉매의 표면 관찰에는 주사전자현미경(SEM, JEOL JSM-6700F, Japan)이 이용되었다.
반응기 내부로 주입되는 기체는 유량조절기(AFC 500, Atovac, Korea)를 이용하여 전체유량이 1 L min-1가 되도록 하였다. 주입기체의 조성은 질소를 기본으로 하여, IPA 농도는 5,000 ppm, 산소 농도는 10%가 되도록 하였다. IPA가 담겨있는 용기 내부의 산기관을 통해 일정 유량의 질소기체를 주입하면 IPA의 증기압에 의해 질소기체가 포화된다. IPA가 함유된 질소기체를 다른 기체에 혼합시켜 IPA의 농도를 5,000 ppm으로 일정하게 유지하여 반응기에 주입시켰다. IPA 농도는 다음 식에 의해 계산할 수 있다:
여기서 A는 IPA로 포화된 질소기체의 유량, B는 IPA 증기압, C는 대기압, D는 전체 유량이다.
플라즈마 발생을 위해 주파수 400 Hz, 최대 전압 20 kV인 전원장치를 사용하였다. 반응기에서 소모되는 방전전력은 Lissajous 선도(전압-전하 선도)를 이용하여 측정하였다[16]. 방전전압은 1000:1 고전압 프로브(Probe P6015, Tekronix)와 오실로스코프(TDS 3034, Tekronix)를 이용하여 측정하였으며, 전하량은 1.0 μF 축전지(DMF-45105, Deadong) 양단에 10:1전압 프로브(P6139A, Tekronix)를 연결하여 측정하였다. IPA의 분해 부산물은 퓨리에변환적외선분광광도계(FTIR, Bruker IFS 66/S, Germany)와 불꽃이온화검출기(FID)가 장착된 기체크로마토그래피(GC, Bruker 450, Germany)를 이용하여 분석하였다. IPA 농도 100~5,000 ppm에 대해 GC 검정곡선을 작성하였다. 모든 실험은 3회 반복되었으며, IPA 분해 효율은 ±5% 이내로 재현성이 높게 나타났다. 반응기 내부의 온도는 500℃까지 측정이 가능한 수은 온도계를 반응기 내부에 설치하여 측정하였다.
Figure 2(a)~(c)는 α-Al2O3 조성의 촉매 지지체에 CuO와 Fe2O3를 담지시키기 전과 후의 주사전자현미경 사진으로, 각각 담지전, CuO/α-Al2O3 그리고 Fe2O3/α-Al2O3를 10,000배 확대하여 촬영한 것이다. 그림에서 보는 바와 같이 지지체 자체는 표면이 대체적으로 매끄러운 반면, CuO/α-Al2O3는 표면에 CuO 가 돌기형태로 존재하며, Fe2O3/α-Al2O3는 Fe2O3가 작은 입자로 고르게 분포되어 있다. 표면에 담지된 활성 물질의 크기가 작아지면 전체적인 비표면적은 증가하게 된다. 촉매의 비표면적을 분석한 결과 지지체 자체는 1.55 m2 g-1, CuO/α-Al2O3는 3.61 m2 g-1, Fe2O3/α-Al2O3는 6.80 m2 g-1으로, Fe2O3를 담지시킨 경우, 비표면적이 담지 전에 비해 약 4배 이상 증가하였다.
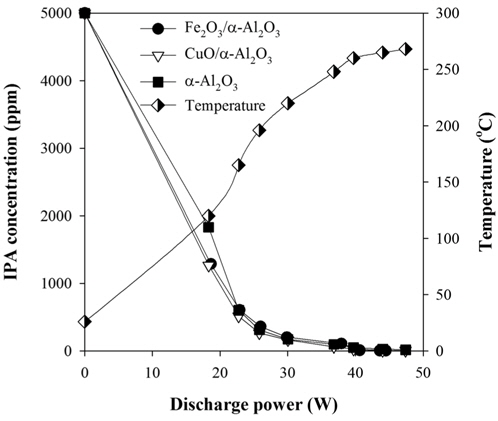
Figure 3은 방전전력 변화에 따른 IPA 농도 및 반응기 내부 온도 변화를 나타낸 것이다. 초기 IPA의 농도는 5,000 ppm, 유량은 1 L min-1 (10% 산소)였다. 반응기 내부의 온도는 방전전력이 증가함에 따라 상승하였으며, 방전전력이 18 W일 때 120 ℃에서 방전전력이 48 W일 때 270 ℃로 증가하였다. 방전전력 증가에 따른 IPA의 농도는 촉매의 종류에 관계없이 거의 유사한 경향을 보였다. 이것으로 보아 IPA 분해 자체는 촉매의 영향보다는 플라즈마의 영향을 더 크게 받는 것으로 판단된다. 그러나 뒤에 상세히 설명하겠지만 부산물의 발생 거동은 촉매의 종류에 따라 상당한 차이를 보였다. Figure 3에서 보는 바와 같이 IPA는 방전전력 30 W 이상에서 대부분 분해 되었으며, 이 때 반응기 내부온도는 220 ℃였다. 에너지 효율은 단위에너지당 분해된 IPA의 양으로 정의될 수 있으며, 30 W의 전력에서 얻어진 에너지효율은 0.13 μmol J-1였다. Jarrige and Vervisch[17]는 플라즈마 공정과 MnO2촉매를 결합하여 IPA 분해연구를 수행한 바 있으며, 에너지 효율이 0.098 μmol J-1라고 보고하였는데, 실험조건이 서로 상이하여 직접 비교는 어려우나, 본 연구의 결과가 약 25% 가량 높은 에너지효율을 보여주었다.
IPA는 아래의 반응들에 의해 아세톤으로 분해되거나 IPA의 탄소-탄소 결합이 분해되어 아세트알데하이드, 폼알데하이드 등의 탄화수소가 생성된다[17].
식 (2)에서 IPA의 2번째 탄소로부터 수소가 제거되는 것은 상대적으로 안정한 2차 탄소 라디칼이 생성되기 때문이다. 또한, IPA의 분해에 의해 생성된 아세톤은 다음과 같은 반응 과정을 거쳐 분해가 개시된다[8].
반응 (5)-(7)의 중간 생성물들은 일련의 산화반응을 거쳐 최종적으로 수증기, 이산화탄소 및 일산화탄소로 전환되나, 산화과정이 완전하지 않을 경우 미량의 폼알데하이드, 아세트알데하이드, 메테인 등이 생성되기도 한다[18].
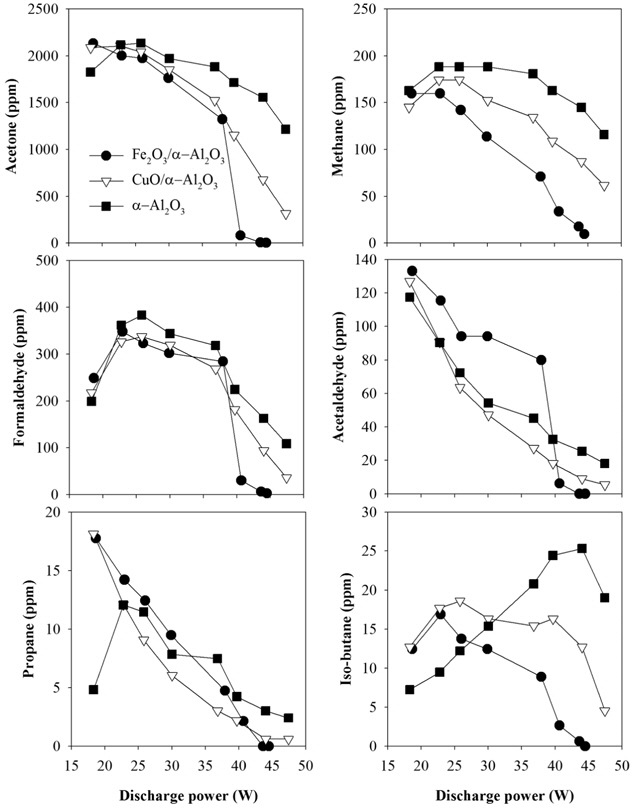
Figure 4는 Figure 3의 조건에서 IPA가 분해될 때 발생되는 탄화수소 부산물을 측정한 결과이다. 그림에서 보는 바와 같이, IPA 분해과정에서 부산물로 아세톤이 가장 많이 생성되었는데, 이는 IPA의 주요 부산물이 아세톤이라고 보고한 선행연구와 잘 일치한다[19]. 초기농도 5,000 ppm의 IPA 분해시 약 2,000 ppm이 아세톤으로 전환되었으며, IPA의 대부분이 분해되는 30 W까지는 아세톤의 농도가 크게 변화되지 않았으나 그 이상의 방전전력에서 농도가 급격히 감소하였다. 이 결과는 플라즈마 상태에서 생성되는 활성 성분들이 대부분 IPA와 우선적으로 반응하며, IPA가 대부분 분해되고 나면 아세톤과도 반응하기 시작한다고 해석할 수 있다. 이는 아세톤의 반응성이 IPA에 비해 더 낮다는 것을 의미한다. 산소 라디칼과의 반응을 예로 들어 설명하면, 아세톤의 반응속도상수는 7.05 × 10-16 cm3 (molecule s)-1으로 IPA의 반응속도상수(6.64 × 10-14 cm3 (molecule s)-1)에 비해 상당히 작다[20]. Wang et al.[21]은 플라즈마를 이용한 아세톤, 테트라클로로에틸렌, m-자일렌, 벤젠의 분해 실험을 통해 아세톤의 탄소-산소 결합에너지가 매우 높아 다른 유기화합물에 비해 분해하기 어렵다고 보고하였다. 아세톤 이외에도 아세트알데하이드, 폼알데하이드, 메테인 등의 부산물이 관찰되었는데, 각 부산물의 생성 농도는 폼알데하이드 > 메테인 > 아세트알데하이드 > 아이소뷰테인 > 프로페인 순으로 나타났다. 한편, 촉매의 종류에 따른 탄화수소 부산물의 농도변화를 살펴보면, 촉매의 종류에 따라 농도는 서로 달랐으나, 농도변화 경향은 촉매의 종류와 관계없이 대체적으로 유사하였다. 폼알데하이드와 메테인의 경우 α-Al2O3를 사용한 경우에 농도가 가장 높았으며, Fe2O3/α-Al2O3를 사용했을 때 가장 낮았다. 아이소뷰테인은 IPA의 분해과정 중 생성된 메테인과 프로페인이 결합되어 생성된 것으로 판단되며, α-Al2O3를 사용한 경우 방전전력이 증가함에 따라 농도가 증가하다가 45 W 이상에서 감소하는 경향을 보인 반면, CuO/α-Al2O3나 Fe2O3/ α-Al2O3를 사용한 경우에는 22 W 이상의 방전전력에서 감소하는 경향을 보였다.
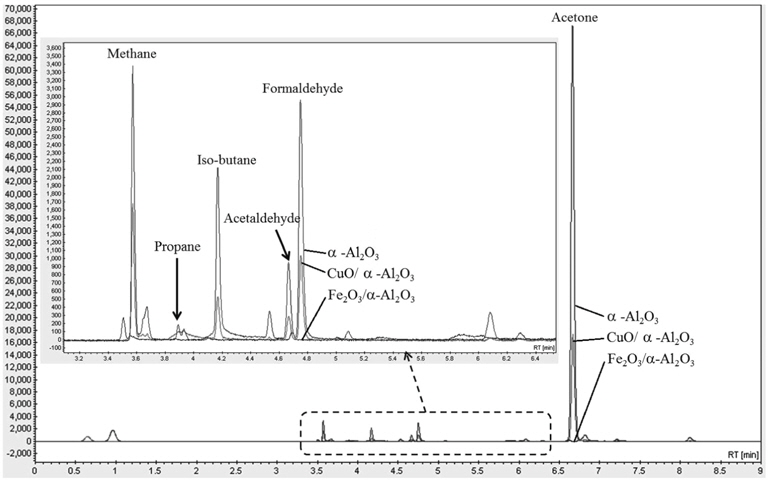
Figure 5의 기체 크로마토그램은 방전전력이 약 47 W일 때 촉매 종류별 IPA 분해 부산물을 나타낸다. 그림에서 보는 바와 같이 촉매가 담지되지 않은 경우(α-Al2O3), 아세톤, 폼알데하이드, 아세트알데하이드 등 부산물 잔존량이 많았으나, CuO/α-Al2O3를 사용했을 때 이들 부산물이 현저히 감소되었으며, Fe2O3/α-Al2O3를 사용했을 때는 탄화수소로 이루어진 부산물이 대부분 사라졌다.
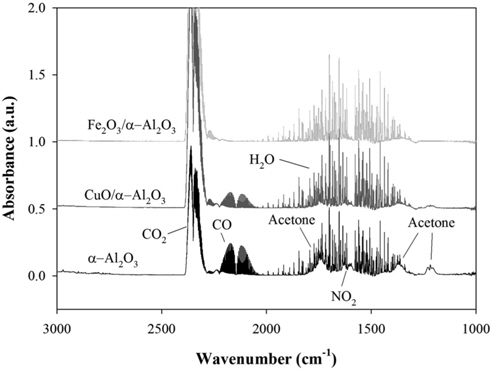
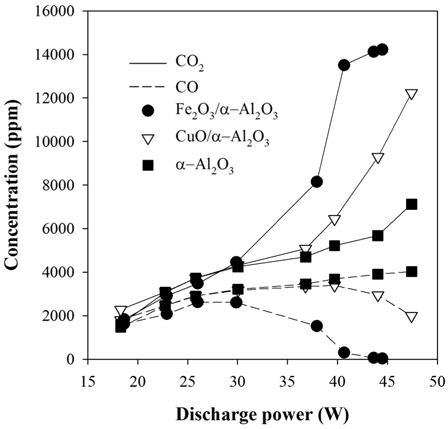
Figure 6은 플라즈마-촉매 반응기 출구의 FTIR 스펙트럼이다. 이산화탄소는 파수 2359 cm-1에서 최대 흡광도를 나타내며, 일산화탄소는 2169 cm-1에서 흡광도가 최대값을 나타낸다. 이산화탄소 발생은 Fe2O3/α-Al2O3 > CuO/α-Al2O3 > α-Al2O3, 일산화탄소 발생은 α-Al2O3 > CuO/α-Al2O3 > Fe2O3/α-Al2O3 순으로 나타났다. 이산화탄소 및 일산화탄소 발생 거동을 좀 더 자세히 살펴보기 위하여 방전전력을 18~47 W까지 변화시켰다. Figure 7은 IPA의 분해에 의해 생성되는 이산화탄소와 일산화탄소이다. 금속산화물 촉매가 담지되지 않은 경우(α-Al2O3)에는 방전전력 18 W에서 측정한 이산화탄소 및 일산화탄소의 농도가 약 2,000 ppm이었으나, 방전전력이 증가함에 따라 이산화탄소와 일산화탄소의 농도가 서서히 증가하여 47 W에서 이산화탄소 농도가 7,000 ppm, 일산화탄소 농도가 4,000 ppm이 되었다. CuO/α-Al2O3를 사용했을 때는 방전전력 증가에 따라 일산화탄소 농도가 증가하다가 37 W 이상에서 농도가 감소하고, 대신 이산화탄소 농도가 급증하는 경향을 보였다. CuO/α-Al2O3촉매를 사용한 경우에 250 ℃ (37 W) 근처에서 촉매활성이 나타나는 것으로 판단되며, 이는 Medina-Valtierra et al.[22]의 실험결과와도 일치한다. Fe2O3/α-Al2O3를 사용한 경우에는 방전전력 30 W (220 ℃) 이상에서 일산화탄소가 감소하고 이산화탄소가 급증하는 경향을 보였으며, 방전전력이 43 W 이상이 되면 일산화탄소가 거의 검출되지 않았다.
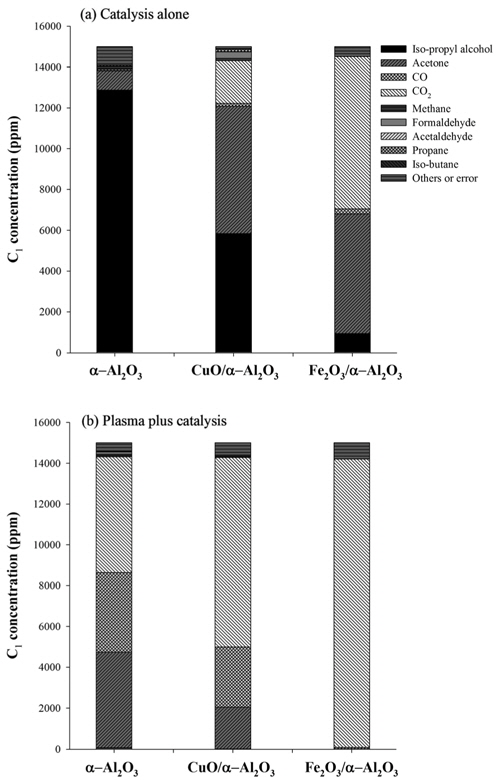
Figure 8(a)는 플라즈마 발생 없이 촉매만 단독으로 사용했을 때의 촉매종류별 탄소 밸런스이고, Figure 8(b)는 플라즈마와 촉매를 결합했을 때의 촉매종류별 탄소 밸런스이다. Figure 8(b)에서 플라즈마 방전전력은 47 W였으며, 이때 반응기 온도가 270 ℃였다. 촉매만 단독으로 사용했을 때는 반응기를 furnace 내에 설치하여 온도를 270 ℃로 일정하게 유지하며 실험을 수행하였다. 그림에서 보는 바와 같이 촉매를 단독으로 사용한 경우에는 일산화탄소 발생량이 매우 적은 반면, α-Al2O3나 CuO/α-Al2O3 상에서 플라즈마-촉매를 사용한 경우에는 촉매만 단독으로 사용했을 때 보다 IPA 농도가 크게 감소한 대신 일산화탄소 생성이 많아졌다. 그러나 Fe2O3/α-Al2O3를 사용한 플라즈마-촉매의 경우에는 IPA의 대부분이 완전 산화되어 이산화탄소만 분석되었다. 일반적으로 금속산화물 촉매의 활성은 금속산화물의 생성 엔탈피와 밀접한 관련이 있다. Fe2O3와 CuO의 산소원자당 생성 엔탈피는 각각 -274.7와 -157.3 kJ/g-Oatom이며, Fe2O3의 생성 엔탈피가 산화반응을 일으키기에 적절한 값으로 알려져 있다[23]. 금속산화물 촉매는 산화와 환원을 반복하며 VOC를 산화시키게 되는데, 생성 엔탈피가 너무 크거나 너무 작으면 산화환원과정이 원활하지 않아 산화력이 낮아진다. 금속산화물 촉매의 산화환원과정과 관련하여 플라즈마를 결합했을 때의 장점은 촉매의 재산화과정 촉진이다. 일반적인 촉매 공정에서는 금속산화물의 재산화과정에 산소 분자가 관여하는 반면, 플라즈마 상태에서는 산소 분자뿐 아니라 반응성이 우수한 산소 라디칼도 금속산화물의 재산화과정에 참여하므로 반응성이 높아진다.
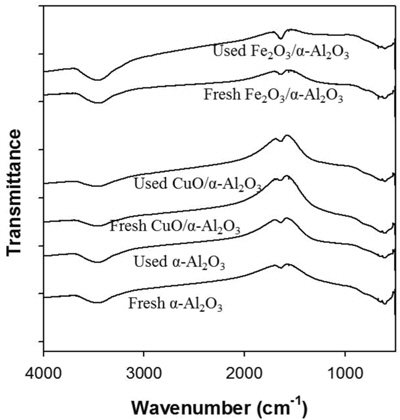
일반적으로 플라즈마 기반 VOC 제거공정의 경우 타르 형태의 갈색 생성물이 반응기에 침착되는 현상이 나타난다. 플라즈마-촉매 공정에서 이와 같은 현상이 일어나면 궁극적으로 촉매 표면이 뒤덮이게 되어 촉매가 활성을 잃어버리게 된다. Figure 9는 IPA 분해 반응 전과 후의 촉매 특성을 분석한 결과이다. IPA 농도 5,000 ppm, 방전전력 47 W 조건에서 10 h 동안 사용한 촉매시료와 반응 전 시료를 비교 분석하였다. 먼저 촉매 시료를 가루로 만들어 KBr 파우더와 혼합한 다음 얇은 디스크를 만들어 FTIR 분석을 수행하였다. 촉매표면에 유기물 퇴적물이 존재한다면 FTIR 스펙트럼에 C-H 특성 피크들이 나타나야 하나, Figure 9와 같이 촉매 모두 IPA 분해반응 전과 후의 스펙트럼이 동일하였고, 이는 유기물 퇴적물에 의한 촉매 표면 변화가 일어나지 않았다는 것을 의미한다. 이 결과는 촉매 표면에 유기 중간생성물이 흡착하더라도 고분자화되기 전에 빠르게 산화되어 촉매 표면이 깨끗하게 유지되었기 때문으로 해석된다.
본 연구에서는 금속산화물로 이루어진 플라즈마-촉매 반응기를 세정제 및 용매로 널리 사용되는 IPA의 분해에 적용하였다. 금속산화물 종류에 따라 IPA 분해효율 자체는 큰 차이가 없었으나, 부산물의 발생 거동은 금속산화물 담지여부 및 종류에 따라 큰 차이를 보였다. 허니컴 지지체에 금속산화물 촉매를 담지하지 않거나, CuO 촉매를 담지하여 사용했을 때는 IPA의 분해에 이산화탄소나 일산화탄소뿐 만 아니라 아세톤, 폼알데하이드, 메테인, 아세트알데하이드 등 다양한 중간 부산물이 생성되었다. 반면 금속산화물로 Fe2O3를 사용한 경우에는 분해된 IPA 대부분이 이산화탄소로 전환되었다. 또한 Fe2O3 가 IPA의 분해에 가장 높은 촉매활성을 보였으며, 촉매를 단독으로 사용한 경우보다 플라즈마와 촉매를 결합한 경우 분해효율이 크게 증가되었다. 플라즈마 기반의 VOC 분해공정은 타르형태의 생성물이 반응기에 퇴적되는 문제점이 있으나, 본 연구의 플라즈마-촉매 공정에서는 이러한 현상이 관찰되지 않았다. 이는 플라즈마-촉매 공정을 장시간 사용하였을 경우에도 촉매활성이 그대로 유지되어 분해효율이 안정적으로 유지될 수 있다는 것을 의미한다.