The aim of this study was to investigate whether peripheral or central administration of triptolide is involved in pain modulation in inflammatory orofacial pain. The inflammatory orofacial pain was induced by the injection of 5% formalin into right vibrissa pad of rats. The pain behavioral response was measured the number of grooming or scratching on the orofacial area for 9 successive 5 minutes intervals. Triptolide was administrated into the identified vibrissa pad (12.5, 25, 50 μg/50 μl) or intracisternal space (0.01, 0.1, 1 μg/10 μl) 10 min before formalin injection. The nociceptive responses were reduced in the 2nd phase (11~45 minutes), particularly 20, 30 minutes after fomalin injection following administration of triptolide into vibrissa pad (25, 50 μg/50 μl). Intracisternal (1 μg/10 μl) administration of triptolide alleviated the formalin-induced pain behaviors in the 2nd phase, especially 25~40 minutes after formalin injection. Triptolide could be a promising analgesic agent in the treatment of inflammatory orofacial pain.
안면부 통증은 치아, 치조골, 구강 연조직 및 악관절의 손상에 따른 통증뿐 아니라, 삼차신경통, 편두통과 같이 신경병증성 통증을 포함한다. 이러한 통증은 조직에 손상을 주거나 잠재적인 손상을 줄 수 있는 유해 자극에 의해 나타나는 일종의 경고성 감각인 통각(nociceptive pain), 손상된 조직과 그 주변조직으로부터 활성화되어 분비되는 interleukin-1β등의 염증성 매개물들1)이 유해 감수기에 작용하여 나타나는 염증성 통증(inflammatory pain), 그리고 말초와 중추신경의 자체 손상으로 인해 유해하지 않은 자극에도 지속적으로 나타나는 신경 병증성 통증(neuropathic pain)으로 구별될 수 있다2,3). 염증성 통증은 통증 부위의 움직임을 제한하여 더 이상의 손상을 방지하고 일정 기간 후 사라지지만 때로는 해가 되는 방향으로 진행되어 신경 병증성 통증으로 발전되는 경우도 있어 염증성 통증의 조절이 중요하다고 보인다.
포르말린 테스트는 염증성 통증 모델 중 널리 사용되는 방법 중 하나이다. 흰쥐의 발바닥4), 입술5), 악관절6), 안면부피하7) 등으로 포르말린을 주입하면 주입 즉시 염증반응과 조직 손상에 의한 특징적인 이상성 통증행위반응(biphasic nociceptive response)을 나타내며, 이 때 주입부위를 긁거나 문지르는 행위 또는 핥는 행위의 횟수나 시간 등을 통증행위반응의 지표로 간주한다. 포르말린 주입 후 유해자극에 의한 말초 감작으로 0~10분간 지속되다가 사라지는 반응을 1차 통증행위반응(first phase)이라 하고, 이후 유해자극이 사라짐에도 불구하고 중추 감작(central sensitization)에 의해 11~45분간 지속되는 반응을 2차 통증행위반응(second phase)이라고 한다8,9). 이때, 1차 통증행위반응은 말초 감작으로 간주하며 2차 행위반응은 중추 감작으로 분류할 수 있다. 말초 감작은 조직에 가해진 손상이 유해 수용기를 자극하면서 생성된 substance P, histamine, bradykinin 등의 여러 통증 유발 물질들이 서로 상승작용을 나타내어 구심성 Aδ, C 섬유 말단의 통각 수용기의 역치를 낮추고 작은 자극에도 강력히 활성화됨으로써 통증이 증강되는 현상이다10). 반면에, 중추 감작은 C 섬유를 통한 고빈도 자극과 Aδ 섬유를 통한 저빈도 자극이 지속적인 경우 척수 후근에 있는 광범위 영역 신경세포(wide-dynamic range neuron)나 nociceptive neurons의 흥분성이 증가하는 현상으로, 지속적인 glutamate의 분비로 인한 시냅스 후 N-methyl-D-aspartate (NMDA) 수용기가 활성화되고 이로 인해 세포 내 유입된 Ca2+가 증가되면서 중추 감작이 일어나게 된다11).
안면부 통증 조절을 위해 임상에서는 acetaminophen, 근육이완제, 항우울제, 비스테로이드성 항염증제(nonsteroidal anti-inflammatory drugs), opioid계 약물 등 다양한 합성화학약물들이 처방되고 있으나12), 일부는 의존성, 내성, 변비, 오심, 구토 등의 부작용을 야기하므로 최근 연구는 상대적으로 부작용이 적은 천연물 유래의 통증조절 약물에 대한 관심이 증가하고 있는 상황이다13-15).
Triptolide는 천연약초인 미역순나무(
따라서 본 연구는 실험동물의 안면부 피하에 포르말린을 주입하여 염증성 통증을 유발하였고, triptolide의 중추 및 말초로의 투여가 안면부 통증 조절에 미치는 영향을 평가하고자 하였다.
본 연구는 의식이 있는 동물의 실험에 관한 통증연구학회의 윤리적 규정에 따라 수행하였으며, 동의대학교 동물실험윤리위원회의 연구 승인을 얻은 후 실시하였다(R2015-002). 실험동물은 240~280 g의 Sprague-Dawley 계 수컷 흰쥐를 효창사이언스(Daegu, Korea)에서 공급 받아 사용하였으며, 실험기간 동안 실험 동물용 투명 플라스틱 통에서 사료와 물을 자유로이 공급 하며 사육하였다. 12시간 주/야 순환 주기 및 23℃~25℃의 일정한 환경을 유지하였다.
실험동물의 스트레스를 최소화하기 위해 플라스틱통에 10분 이상 적응시키고 테스트 동안 물과 음식의 섭취를 금하였다. 인슐린 주사기(0.25×8 mm)를 이용하여 실험동물(n=6)의 오른쪽 수염부 피하에 5% 포르말린(30 μl)을 주입하였고, 약물이 주입된 안면부위를 문지르거나 긁는 행위를 통증 지표로 간주하였다. 주입 직후부터 5분 단위로 누적하여 총 45분간 기록하였으며, 1차 통증행위반응(0~10분)과 2차 통증행위반응(11~45분)으로 구분하여 평가하였다21).
Triptolide (Sigma, St. Louis, MO, USA)는 5% dimethyl-sulfoxide에 1 μg/μl의 농도로 희석시켜 −70℃에서 보관하였고, 실험 직전 사용농도로 희석하여 사용하였다. Triptolide의 말초 효과를 평가하기 위해 12.5, 25, 50 μg/50 μl의 농도로 포르말린 주입 10분 전 동일한 부위에 각각 투여하였다. 중추 효과를 평가하기 위해서 0.01, 0.1, 1 μg/10 μl 의 농도로 Hamilton 시린지(Hamilton Co., Reno, NV, USA)를 사용하여 포르말린 주입 10분 전 소뇌연수조 내로 투여하였다. Triptolide의 투여농도는 Hu 등22)의 연구를 참고하였다. 포르말린은 5%의 농도로 생리식염수에 희석시켜 사용하였다.
실험동물은 zoletil (1 ml/kg)과 xylazine (0.25 ml/kg) 혼합액을 근육 주사하여 마취하였다. 마취된 쥐의 뒤통수 부위를 면도하여 stereotaxic frame (Model 1404; David Kopf Instruments, Tujunga, CA, USA)에 고정시키고 정수리점부터 뒤통수 뼈 아래까지 피부를 절개하였다. 후두근을 포함한 주변근육을 젖히고 소뇌연수조(intracisternal space)에 26 gauge의 주사바늘로 작은 구멍을 내어 뇌척수액의 미세유출을 확인 후 폴리에틸렌 카테터(8 cm, PE10; Caly Adams, Parsippany, NJ, USA)를 약 1~2 mm 삽입하였다. 카테터는 마루뼈에 미리 삽입된 mini implant screw에 회전시켜 치과용 자가중합레진(Dentsply, York, PA, USA)으로 두개골에 고정하였으며, 카테타 끝은 뇌척수액의 흐름을 방지하기 위하여 stainless steel wire (0.32 mm)로 막아두었다. 절개부위는 4-0 나일론 봉합사로 봉합하였고, gentamycin (0.05 ml/kg)을 근육 주사하였다. 술 후 실험동물은 각각 별도의 플라스틱 통에 두었고, 72시간 이상 회복 후 실험에 사용되었다.
실험결과의 통계 분석에 사용된 프로그램은 IBM SPSS Statistics ver. 19.0 (IBM Co., Armonk, NY, USA)과 sigmaplot 2001을 사용했으며, 반복측정 자료는 LSD 사후분석을 이용한 일원배치 분산분석을 하였다. 통계적인 비교를 위해 통계적 유의성의 표준값은 p<0.05로 설정하였으며, 결과는 평균±표준 오차(standard error of the mean)로 표시하였다.
1. 말초 triptolide의 투여에 의한 통증행위반응 조절효과
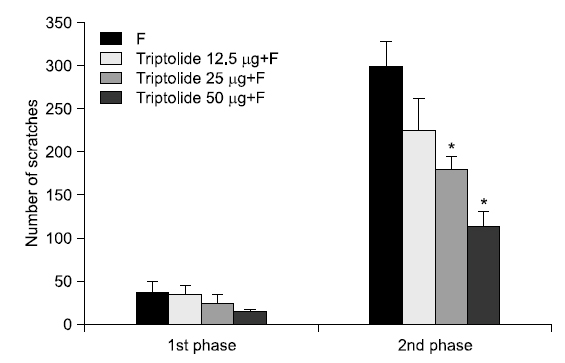
실험동물의 안면부에 포르말린으로 유도된 통증행위반응에 대한 triptolide의 말초투여의 영향에 대한 결과는 Fig. 1과 같다. 본 실험에 앞선 예비실험에서 그래프에는 나타나지 않았으나 포르말린 주입군은 아무것도 처치하지 않은 naive군에 비해 통증행위반응이 증가됨을 확인하였다. 1차 통증행위반응의 결과, 안면부 피하로 triptolide (12.5, 25, 50 μg/50 μl) 투여 후 포르말린을 주입한 군은 각 농도에 따라 통증행위반응 수치가 36.67±9.84회, 24.17±10.76회, 15.50±2.21회로 나타났으며, 36.67±13.44회로 나타난 포르말린 주입군과 비교 시 유의한 차이를 나타내지 않았다. 하지만 2차 통증행위반응의 결과, 포르말린군에서 299.00±28.14회, triptolide 투여 후 포르말린을 주입한 군에서 각 농도에 따라 226.00±35.44회, 179.17±15.36회, 114.33±16.65회로 나타나, 안면부 피하로 주입한 25, 50 μg/50 μl의 triptolide는 포르말린으로 유도된 통증행위반응을 2차 통증행위반응 시기에서 유의하게 감소시켰음을 확인하였다(Fig. 1).
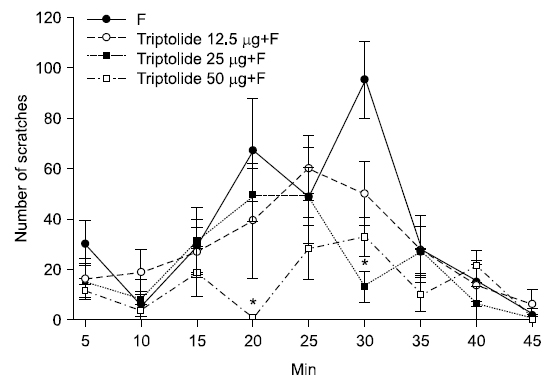
통증행위반응의 변화를 시간의 경과에 따라 보면, 안면부피하로 triptolide 투여 후 포르말린을 주입한 군(50 μg/50 μl)의 통증행위반응은 포르말린 주입군과 비교 시 20분, 30분에 유의하게 감소되었음을 확인하였다(Fig. 2).
2. 중추 triptolide의 투여에 의한 통증행위반응 조절효과
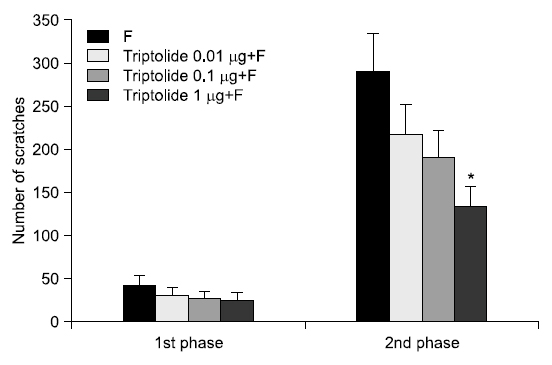
실험동물의 안면부에 포르말린으로 유도된 통증행위반응에 대한 triptolide의 중추투여의 영향에 대한 결과는 Fig. 3과 같다. 1차 통증행위반응의 결과, 소뇌연수조 내로 triptolide (0.01, 0.1, 1 μg/10 μl) 투여 후 포르말린을 주입한 군은 각 농도에 따라 31.00±10.23회, 27.50±8.49회, 25.33±8.95회로 통증행위반응이 나타나, 42.00±12.27회로 나타난 포르말린주입군과 차이를 보이지 않았다. 2차 통증행위반응의 결과로, 소뇌연수조 내로 triptolide 투여 후 포르말린을 주입한 군에서 각 농도에 따라 216.50±35.61회, 190.50±30.72회, 134.00±23.03회로 나타났으며, 포르말린 주입군에서 289.50±44.30회로 나타나 triptolide 1 μg/10 μl의 투여군 에서 포르말린으로 유도된 통증행위반응을 감소시킴으로서 통증조절효과를 나타내었다(Fig. 3). 그래프에는 나타나지 있지 않으나, triptolide 10 μg/10 μl의 투여군도 triptolide 1 μg/10 μl의 투여군과 유사한 수준의 통증조절효과를 나타내었다.
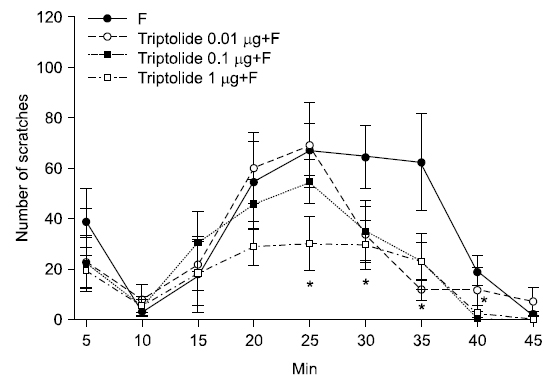
시간의 경과에 따른 통증행위반응의 변화를 보면, 소뇌연수조 내로 triptolide (1 μg/10 μl) 투여 후 포르말린을 주입한 군의 통증행위반응은 포르말린 주입 후 25~40분에 포르말린군과 비교하여 유의하게 감소되었음을 확인하였다(Fig. 4).
구강 및 턱관절을 포함하는 안면부는 삼차신경(trigeminal nerve)에 의해 지배를 받으며, 여러 가지 외부의 자극에 의해 염증성 혹은 신경병증성 통증이 유발되면 감정적 혹은 정신적인 부분에서도 불편감을 나타내는 인체에서 가장 민감한 부위 중 하나이다23). 안면부에서 발생한 염증성 급성 통증이 해소되지 못할 경우 신경병증성 통증으로 발전될 수 있어 통증조절의 중요성이 강조되며, 최근 연구는 합성성분의 약물로 인한 부작용을 최소화하기 위해 천연물을 이용한 통증조절에 관한 연구로 이어지고 있다15,24). 따라서 본 연구는 포르말린으로 유도된 염증성 안면통증 모델에서 천연약초인 triptolide의 말초조직의 피하 또는 소뇌연수조 내로 투여가 안면부 통증조절에 미치는 영향을 확인하고자 하였다.
약물의 진통효과를 평가하기 위해 실험동물을 대상으로 하는 약물의 투여 경로에는 복강투여, 국소부위의 말초침윤투여, 경구투여, 중추투여 등 다양한 방법으로 적용될 수 있다. 약물의 효과는 약물의 투여 방법에 따라서도 크게 좌우되므로 어떠한 방법으로 약물을 투여하여야 유효한 양의 약물이 병적 부위에 신속히 도달할 수 있는가를 고려하여 투여방법을 선택하여야 한다. 예를 들어, Cho 등25)은 ketamine의 말초제통효과 확인을 위한 포르말린 테스트에서 ketamine의 복강 내 투여보다 말초침윤이 더 효과적이었고, 제통효과를 얻기 위해 약물의 말초침윤투여가 복강투여보다 더 적은 양으로 전신부작용을 최소화하면서 말초 통증관리가 가능한 장점이 있다고 보고하였다. 또한 모르핀의 척수강 내(intrathecal) 투여는 운동기능 및 자율신경 기능장애 등의 부작용을 최소화하면서 경구 투여용량의 약 1/300로 동일한 진통효과를 나타낼 수 있다고 하였다26,27). 척수강 내 투여법은 실험동물의 통증모델에서 약물의 효과를 검증하기 위해 널리 사용되는 투여법 중 하나로17,22), 제4~5번 요수사이의 지주막하로 약물을 투여하여 뇌혈관장벽의 투과성이 낮은 약물의 최대 치료효과를 유도할 수 있다고 하였고, 약물주입을 위한 카테터 삽입 후 마비, 운동성 감소, 배변배뇨 등의 이상소견이 없었으며, 기계적 이질통에 대한 실험에서도 정상군과 비교하여 차이가 나지 않았다고 보고26)하여 실험동물에서 약물의 약효를 검증하는 데 유용한 투여법으로 제시되어 진다.
실험동물의 소뇌연수조(intracistenal) 투여법은 척수강 내 투여법과 유사한 방법으로 안면부 통증 유발 모델에서 중 추약물투여방법으로 널리 사용된다7,21). 소뇌연수조는 소뇌의 아래쪽과 연수의 뒤쪽 사이에 지주막 밑 공간이 커져 있는 부위로 뇌척수액을 함유하고 있으며, 소뇌연수조 내로의 약물투여 시 안면부의 감각정보를 투사 받는 삼차신경핵군에 대한 약물의 직접적인 중추효과를 확인할 수 있기 때문이다.
따라서 본 연구에서는 triptolide를 통증이 발생한 해당 말초부위의 피하에 투여했을 때의 효과와 적은 용량으로 약물의 효과를 유도할 수 있는 소뇌연수조 내로 triptolide을 투여했을 때의 진통효과를 평가하였다. 그 결과, 두 약물투여법 모두 유의한 통증조절효과를 나타내었다. 말초조직에 직접 투여한 triptolide는 25, 50 μg/50 μl를 투여한 실험군에서 효과적인 통증조절효과를 나타내었으며, 소뇌연수로조 투여한 triptolide는 1 μg/10 μl의 적은 용량에서 통증행위반응에 유의한 감소효과를 나타내었다.
Triptolide의 통증조절효과에 대한 연구로, 척수신경 결찰에 의한 신경병증성 통증모델에서 복강투여한 triptolide는 증가된 척수후각의 미세아교세포(microglia)와 성상교세포(astrocyte)의 발현 및 염증성 매개물인 interlukin (IL)-6, IL-1beta, monocyte chemotactic protein, tumor necrosis factor-α (TNF-α)의 messenger RNA의 발현을 억제함으로써 기계적 이질통을 완화시켰고17), triptolide의 척수강 내 투여는 신경결찰에 따라 증가된 TNF-α, IL-2를 억제함으로써 기계적 이질통을 완화시켰다22)는 보고가 있다. 또한 CFA로 실험동물의 발바닥에 유도된 지속성 염증성 통증 모델에서 복강으로 반복 투여한 triptolide는 척수후각의 미세아교세포와 성상교세포의 발현을 억제하여 열 및 기계적 과민반응을 완화시켰다18)는 보고가 있다. 본 연구에서 triptolide는 안면부 염증성 통증행위반응 경감효과를 나타내었으며, 이는 이전 연구결과들을 근거로 하는 triptolide의 생리약리학적 특성이 포르말린으로 유도된 염증 및 통증신호경로를 조절함으로 나타난 것으로 생각된다.
본 연구의 결과, 염증 및 통증신호의 조절효과를 가지는 triptolide는 말초와 중추투여를 통해 포르말린으로 유도한 염증성 안면부 통증 모델에서 실험동물의 행위반응을 감소시킴으로써 유의한 통증경감효과를 나타내었다. 따라서 triptolide는 안면부 통증의 예방 및 치료의 연구에 있어 활용 가능한 천연대체약물로 제시될 수 있으나, 이를 위해서는 염증 및 통증신호의 전달과정에서 triptolide의 생리약리학적 역할에 대한 추가적인 연구가 필요할 것으로 생각된다.
본 연구는 trtiptolide의 안면부 통증 조절효과를 평가하기 위하여 포르말린으로 유도된 실험동물의 안면부 통증모델에서 말초와 중추로 투여한 trtiptolide의 농도별 차이를 확인하였고, 다음과 같은 결과를 얻었다. 먼저, 안면부 피하로 triptolide 투여 후 포르말린 주입군에서 포르말린 주입 후 11~45분에 발생하는 2차 통증행위반응은 25, 50 μg/50 μl의 각 농도에 따라 179.17±15.36회, 114.33±16.65회로 나타났고 299.00±28.14회로 나타난 포르말린 주입군과 비교시 통증행위반응이 유의하게 경감되었다. 시간의 경과에 따른 변화에서 50 μg/50 μl의 투여군에서 포르말린 주입 후 20분, 30분에 통증행위반응이 포르말린군과 비교하여 유의하게 감소되었음을 확인하였다. 안면부 피하로 투여한 triptolide는 포르말린으로 유도된 통증행위반응을 감소시킴으로써 안면부 통증조절효과를 나타내었다. 다음으로, 소뇌연수조 내로 triptolide 투여 후 포르말린 주군에서 2차 통증행위반응은 1 μg/10 μl의 134.00±23.03회로 나타났고, 289.50±44.30회로 나타난 포르말린군과 비교 시 통증행위 반응이 경감되었다. 시간의 경과에 따른 변화에서, 1 μg/10 μl의 triptolide 투여군에서 포르말린 주입 후 25~40분에 통증행위반응이 감소되었음을 확인하였다. 소뇌연수조로 투여한 triptolide는 포르말린으로 유도된 통증행위반응을 감소시킴으로써 안면부 통증조절효과를 나타내었다. 이상의 결과는, triptolide는 구강 및 턱관절 등을 포함하는 안면부 통증 조절의 예방 및 치료에 있어 활용 가능한 천연대체약물로 제시될 수 있을 것으로 생각된다.