We investigated the effects of a mutan (water-insoluble α-glucans) isolated from
치주질환은 치주조직의 소실을 동반하는 염증 및 면역반응으로 치조골 흡수 및 치주낭 형성을 특징으로 하는 염증성 질환이다. 치주질환의 주요 원인은 치근면에 존재하는 병원균의 효소와 독소이며, 이는 조직으로 침투하여 질환의 상태를 악화시킨다1). 특히 독소와 효소들은 염증과 면역반응에 영향을 주어 급성 또는 만성적인 치주조직 파괴를 유도한다2). 또한 구강 내 감염성 질환을 일으키는 세균의 주요인자 가운데 하나는 부착인자이다. 부착인자는 세균이 숙주에 부착하는 세균의 표면 구조물로서, 부착능이 없는 치주병원균이 부착능이 강한 세균과 결합함으로써 치주국소에 정착이 가능하도록 한다. 치아표면에 부착하는 최초의 세균의 예는 그람 양성균인
본 연구는
1) 균주 및 배지
실험에 사용한
2) Mutan의 분리 및 정제
Mutan을 분리하기 위해, 먼저 균체 외 조 다당류를 정제하고 불용성 mutan을 분리하였다.
3) 실험 동물
실험동물은 180∼200 g의 Sprague-Dawley계 암컷 흰쥐를 대한바이오링크(Eumseong, Korea)에서 구입하여 실험실 환경적응을 위하여 1주간 예비 사육 후 실험을 실시하였다. 본 실험은 순천향대학교 동물실험윤리위원회의 승인(SCH12_05_01) 하에 표준작업 지침서에 따라 수행되었으며 사육실 조건은 23±2°C, 50±5%의 상대습도와 12시간의 명암주기를 유지하고 물과 사료(Dhbiolink)는 자유롭게 섭취하도록 하였다. 실험목적에 따라 saline을 처리한 대조군, lipopolysaccharide (LPS) 처리군, mutan 처리군으로 하여 각 군에 6마리씩을 배정하였다. 실험동물의 체중변화는 Table 1과 같다.
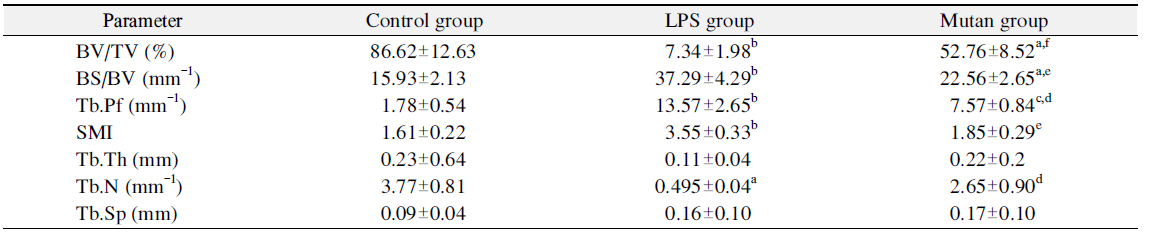
[Table 1.] Bone Histomorphometry of the Alveolar Bone Defects in All the Study Groups
Bone Histomorphometry of the Alveolar Bone Defects in All the Study Groups
치조골 결손부를 형성하기 위하여 실험 대상 흰쥐를 ethyl ether로 흡입 마취시킨 후, 하악골 좌측 피부털을 제거하여 표피를 노출시켰다. 외과용 blade를 이용하여 구외측으로 하악골 좌측 협면에 구각부위에서 1 cm 정도 떨어진 부위를 시작점으로 하여 약 2 cm로 표층 피부를 절개하였다. 표피를 하방의 근육들로부터 하악각 쪽으로 넓게 박리하여 분리하다. 교근을 주변 인접근육들로부터 박리한 뒤, 하악골 부착부에서 절단하고 하방의 골막에 절개를 하여 하악골을 노출시켰다. 하악의 협측을 덮고 있는 하악골의 중앙부위인 제3대구치 치근 첨단부의 후하방에 저속엔진 하에서 치과용 절삭 bur를 이용하여 골 결손부를 형성하였다. 하악골을 천공하지 않도록 주의하면서 골 결손부를 폭 1.5 mm×길이 3 mm의 크기로 형성한 후, 봉합사를 층별로 골막과 표피의 봉합을 수행하였다. 24시간 후, 골 결손부에 각 군당 양성대조군인 LPS (1 mg/kg body weight; serotype O111:B4; Sigma-Aldrich) 그리고 mutan (1 mg/kg body weight)을 총 4주 동안(주 3회, 총 12회) 매회 당 20 μl씩 골결손부 피하에 주사하였다. 각 시료는 20°C 냉동고에 보관한 후 실험에 사용하였다.
3. Three-dimensional (3D) μCT 촬영
하악골의 골치유 정도를 알아보기 위해 관찰부위는 미세 단층촬영기 μCT (SkyScan 1172; Bruker, Antwerp, Belgium)에 의해 촬영되었다. 시료가 미세단층촬영기 내에서 특정 방향을 향하도록 한 후 촬영하였다. 화소 크기는 26.5 μm이며 60 kA의 전압과 167 μA의 전류의 X-선을 방사하여 0.5 mm 알루미늄 필터를 거쳐 시료를 투과하는 방식으로 미세영상이미지를 획득하였다. 획득된 미세영상이미지는 Nercon Ver 1.3 (SkyScan)을 이용하여 gray scale level로 재건하였으며, 재건된 2차원 영상은 CTAn (SkyScan) 소프트웨어를 이용하여 3차원 모델을 재구성하였다.
정량적인 결과는 평균값과 표준편차로 표시하였다. 통계적인 차이는 PASW Statistics ver. 18.0 (IBM Co., Armonk, NY, USA)을 이용하여 Student’s t-test로 분석하였고 p값이 0.05 이하인 경우 통계적으로 유의한 것으로 판단하였다.
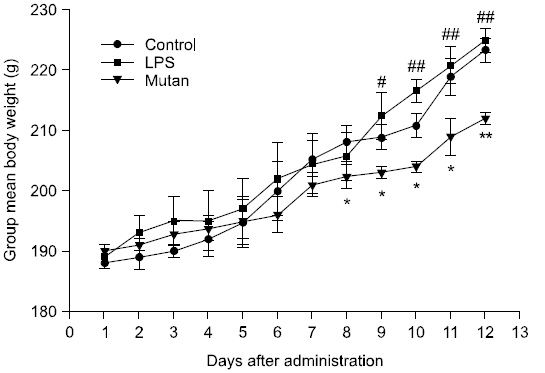
실험기간 동안의 실험동물의 체중변화는 Fig. 1에 나타냈다. 각 시험군의 체중은 4주 동안 총 12 회 투여 중 1∼7회차까지는 처리군 간에 유의한 차이가 없었으나, 8회차부터 mutan 처리군에서 saline을 처리한 대조군에 비해 유의한 체중 증가를 보였다(p<0.05). 9회차에는 mutan 처리군이 대조군과 LPS 처리군에 비해 유의한 체중 증가를 보였으며(p<0.05), 10∼12회차에서도 LPS 처리군과 비교하여 유의한 체중 증가를 나타냈다(p<0.01). 이는 실험 기간 중 시료 투여 및 외과적 시술이 정상적인 식이 투여에 영향을 미치지 않고, 성장했음을 시사한다.
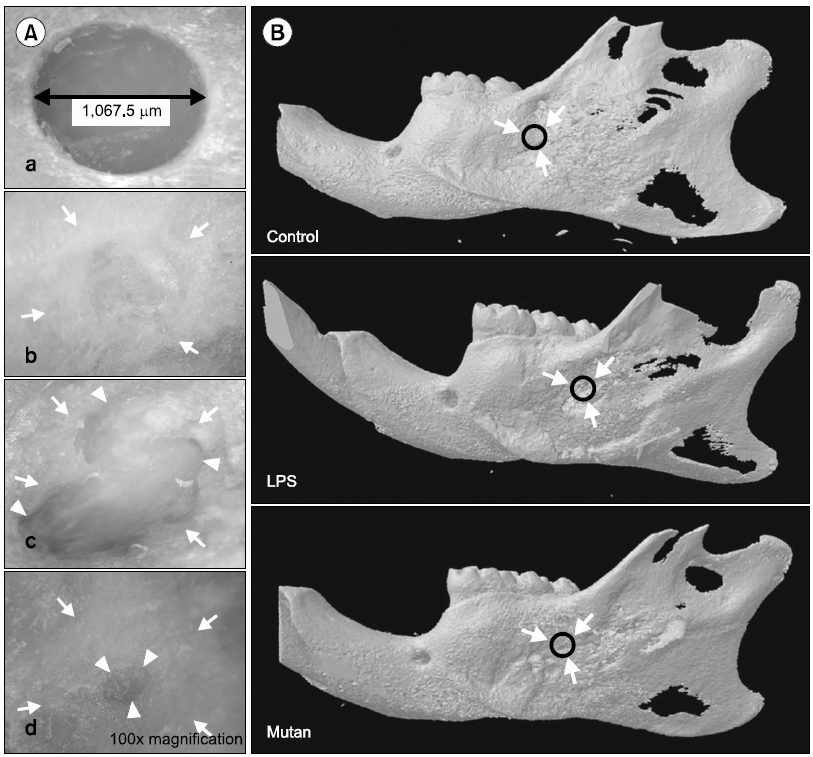
하악골에 인위적인 골 결손부를 형성한 후 4주가 경과한 후에 mutan에 의한 골치유 여부를 도립 현미경과 3차원 micro CT (3D μCT)를 통해 관찰해 본 결과는 Fig. 2와 같다. 동일한 양의 saline을 처리한 대조군은 자연적인 골치유 반응으로 인해 정상적인 골형성 소견이 관찰되었다. Mutan 처리군은 골 결손부 변연으로부터 심부로 진행된 골형성 소견이 관찰되었으나, LPS 처리군에 비해 완전한 골 결손부의 회복이 이루어지지 않았다. 반면에 LPS 처리군은 전체적인 골 결손부의 회복은 보이지만, 골형성뿐만 아니라 골흡수도 진행되어 기존의 인공적인 골 결손부 외에 주변 변연부로의 진행된 골흡수 소견이 관찰되었다.
3. 3차원 μCT 미세구조의 형태계측학적 지표값 분석
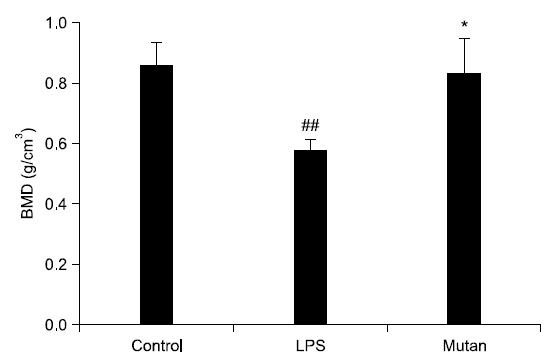
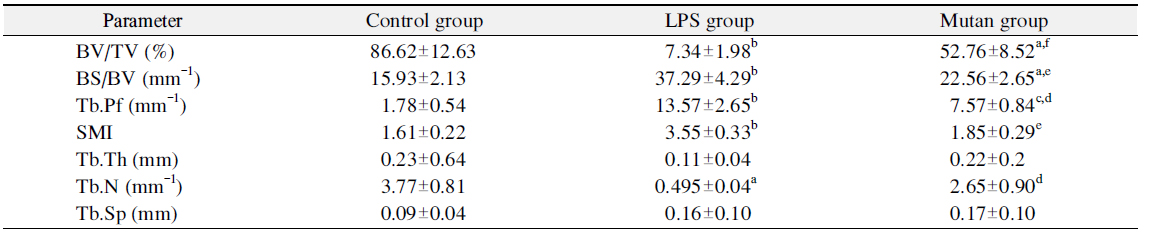
Table 1과 Fig. 3에서 보는 바와 같이, 시각화된 μCT 상의 데이터를 수치화하기 위해 3차원 미세구조의 형태계측학적 지표(mophometric parameter)인 tissue volume (TV), bone volume (BV), percent bone volume (BV/TV), bone surface (BS), interception sulface, bone surface density (bone surface/bone volume [BS/BV]), trabecular bone pattern factor (Tb.Pf), structure model index (SMI), trabecular thickness (Tb.Th), trabecular number (Tb.N), trabecular separation (Tb.Sp), BMD 총 12개 항목을 분석하였다. 전체 조직에서 골소주의 부피를 나타내는 BV/TV는 전체 TV에서 BV의 비율을 %로 나타낸 것으로 값이 높을수록 골강도가 강한 것으로 판단하며, LPS 처리군(7.34±1.98)은 각각 대조군(86.62± 12.63)과 mutan 처리군(52.76±8.52)에 비해 골강도가 유의하게 낮은 것을 확인할 수 있었다. BS/BV는 관심 용적내의 골용적에 대한 골표면 면적의 비율이며, 구조의 복잡성(complexity)을 특징짓는 영상지표로서, parameter 값이 낮을수록 골강도가 강한 것으로 판단하며, mutan 처리군(22.56±2.65)은 대조군(15.93±2.13)보다 다소 낮은 골강도를 보였으나, LPS 처리군(37.29±4.29)에 비해 유의하게 높은 골강도를 나타냈다(p<0.01). 골소주 사이의 연결성을 나타내는 Tb.Pf는 낮은 값이 좋은 연결성을 나타내며, 전체 골소주 면적에서 오목함(concavity)과 볼록함(convexity)의 상대적인 비에 기초한 연결성 지표이다. 오목함은 둘러싸인 골수강의 존재를 의미하고 볼록함은 끊어져 있는 골소주 지주들(trabecular struts)을 의미한다. LPS 처리군, mutan 처리군, 대조군 순으로 연결성이 좋은 것으로 판단되며 특히 mutan 처리군에서 대조군에 비해 유의하게 좋은 연결성을 보였다(p<0.001). SMI는 골소주의 형태가 막대모양(rod-like structure) 혹은 판모양(plate-like structure) 중 어느 형태가 우세한지 알려주는 지표로 대개는 0∼3까지의 지수로 표현되며 0에 가까울수록 판모양, 그리고 3에 가까울수록 막대 모양으로 표현된다. 측정 결과, LPS 처리군은 막대형, 나머지 처리군은 판형에 가깝게 나타났다. Tb.Th는 골소주의 평균 두께를 나타내며, 골소주 내에 수많은 구(sphere)를 위치시켜 이 구들의 직경의 평균을 내어 얻어진다(parallel plate-like model). 골소주의 두께가 두꺼울수록 골강도가 크므로 LPS 처리군, mutan 처리군, 대조군으로 갈수록 골강도가 증가함을 확인하였다. 골소주의 평균 개수를 나타내는 Tb.N는 mutan 처리군(2.65±0.90)에서 LPS 처리군(0.50±0.04)보다 골소주의 평균 개수가 높게 나타났다. Tb.Sp (mm)는 골소주 간극, 즉 골소주 사이의 평균길이를 의미하며 mutan 처리군에서 가장 높은 수치를 보였다. BMD는 hydroxyapatite (CaHA)에 대한 체적당 질량의 단위로서 g/cm3로 나타내며 0.25 g/cm3와 0.75 g/cm3인 팬텀(phantom)을 기준으로 골밀도를 측정해주는 지표로서, 측정 결과는 Fig. 3과 같다. 대조군의 골밀도치가 LPS 처리군과 mutan 처리군의 골밀도치보다 높았으며 mutan 처리군의 골밀도치는 LPS 처리군과 비교하여 유의한 차이를 나타내었다(p<0.01).
감염성 미생물에 존재하는 수많은 종류의 탄수화물은 숙주 면역세포 표면에 존재하는 다양한 수용체에 인식되어 면역 활성과 염증 등을 유도한다17). 본 연구는
본 연구결과 그람 양성균의 다당체인 mutan은 그람음성균의 LPS보다 비교할 만큼 골재생억제에 영향을 미치진 않았으나, 어느 정도 골치유를 지연시키는 것으로 관찰되었다. μCT 촬영 결과, 형태계측학적 지표 값을 분석하여 3차원 골 미세구조 지표를 알아보기 위해 골 결손 주변부에 관심부위를 설정하여 3차원 모델을 재건하여 분석하였다. μCT 미세구조 지표의 분석에 있어 골밀도와 μCT 지표들 Tb.Th와 BV/TV가 골밀도와 밀접한 상관관계가 있다고 보고된 바 있으며, μCT 지표를 연구 변수로 사용하는 것이 타당하다고 보고된 바 있다24-26). 본 연구에서 하악의 치조골을 μCT로 촬영하여 생성된 이미지를 관찰한 결과, 대조군에 비해 mutan 및 LPS 처리군에서 골치유 능력이 상대적으로 저하된 것을 확인하였다. BV/TV는 LPS 처리군이 다른 처리군보다 골강도가 유의하게 낮게 나타났으며, 따라서 mutan 처리군은 골소주의 부피에 직접적인 영향을 주지 않음을 알 수 있었다. BS/BV는 mutan 처리군이 LPS 처리군에 비해 유의하게 높은 골강도를 나타냈으며, Tb.Pf의 경우 mutan 처리군이 LPS 처리군보다 유의하게 골소주 사이의 우수한 연결성을 보였다. SMI는 LPS 처리군은 막대형인 반면, 대조군 및 mutan 처리군은 판형에 가깝게 나타났다. 골소주 모양이 막대보다는 판모양일 때 골강도가 높기 때문에 대조군과 mutan 처리군이 LPS 처리군보다 단단하며 판모양을 보인다고 생각된다. Tb.Th는 LPS 처리군, mutan 처리군, 대조군으로 갈수록 골강도가 증가함을 확인하였다. Tb.N는 mutan 처리군에서 LPS 처리군보다 골소주의 평균 개수가 높게 나타나 mutan 처리군이 LPS 처리군 대비 골강도가 유의하게 높은 것으로 생각된다. Tb.Sp는 mutan 처리군에서 가장 높은 수치를 보여 골소주들 간의 공간이 증가되어 골강도가 낮은 것으로 생각된다. BMD의 경우, mutan의 골밀도치는 대조군과 뚜렷한 차이를 보이지는 않았으나, LPS 처리군에 비해 유의하게 골밀도치가 높은 것이 확인하였다. 이러한 결과는 LPS 처리군이 대조군과 mutan 처리군에 비해 관심용적 내의 골소주의 양과 골소주의 두께가 감소하였으며, 골 용적에 대한 골 표면적에 대한 비율도 감소하는 경향을 보인다고 생각된다.
본 연구의 한계점은 주요 실험이 in vivo에서 μCT 관점에서 이루어졌으므로 학술적 가치를 주장하기 위해서는 조직학적 및 면역학적 연구가 보완되어야 한다. 또한 S. mutan에 존재하는 mutan이 염증을 유발하고 골치유를 지연시키는 영향을 규명하기 위해서는 진균류의 베타글루칸 수용체인 dectin-1의 발견처럼 in vitro에서 mutan에 대한 innate immune을 담당하는 면역세포의 mutan 수용체 발견과 그들의 신호경로(signal pathway)에 관한 연구가 요구된다.
결론적으로 LPS를 처리한 실험군은 염증유도에 의한 골 흡수를 증가시킴으로써, 실험동물에서 골조직의 치유를 억제하고 골 소실을 현저히 증가시켰으며,