폐수 처리수에 대한 생태독성 시험생물종으로 우리나라는 갑각류인 D. magna 단일종을 적용하고 있으나, 독일에서는 급성 시험 시에는 물벼룩, 박테리아를, 만성 시험 시에는 조류, 물벼룩, 어류(난), 개구리밥 등 다양한 생물을 시험종으로 사용하고 하고 있으며, 담수시험용과 해수시험용을 구분하여 적용하고 있다(MOE, 2013). 또한 미국에서도 급성 시험인 경우 물벼룩, 어류 등을, 만성시험인 경우 조류, 물벼룩, 어류, 갑각류, 성게, 대형조류(macroalga) 등을 사용하고 담수역, 기수역 및 해수역에 따라 시험종을 구분하고 있다(MOE, 2013). 따라서 민물에서 서식하는 D. magna 를 시험종으로 사용하여 염분을 함유한 폐수 처리수에 대한 생태독성을 평가하고자 할 경우, 일정농도 이상의 염도가 담수종인 물벼룩에게는 독성으로 인식되므로 적절하지 않으며 적어도 일반적인 해양생태계에서 서식하는 생물종에 의해 독성평가가 이루어져야 할 필요가 있다. 현재 생태독성원인이 염인 경우 규제 완화를 위한 관련 규정(MOE, 2014; NIER, 2015)에 해양생물종을 이용토록 하고 있으나 사용하고자 하는 해양생물종의 종류나 독성값에 관한 객관적이고 구체적인 기준은 아직 마련되어 있지 않다. 본 연구에서 다루고 있는 해양생물종인 Vibrio fischeri 를 이용한 생물검정법(bioassay)은 측정방법중 비교적 짧은 시간에 많은 시료의 독성을 측정하면서도 매우 좋은 민감도를 보이는 독성 평가 기술로, 유해화학물질, 육상과 해양환경의 물, 퇴적물, 토양, 공극수, 유기추출물 등 다양한 매질의 생물독성을 평가하는 유용한 기술로 알려져 있다(Gustavson et al., 1998; Svenson et al., 1996).
대부분 폐수의 독성은 여기에 포함된 염소, 암모니아, 중금속 또는 합성 유기화합물 등에 의해 야기되나 일반적으로 발견되는 여러 이온들이나 화합물 등이 생물학적으로 감당할 수 있는 수준을 벗어나는 경우 시험생물종으로 사용되는 수생 생물체에 유해할 수 있다(SETAC, 2004). 즉, 수생생물에 필수 이온은 무기이온인 Ca2+, Mg2+, Na+ 등으로 알려져 있는데 이들의 양이 수생생물이 견딜 수 있는 범위를 초과하거나 부족한 경우 문제가 된다. 이온 불균형은 수질환경기준을 준수하더라도 생태독성결과에 독성을 야기하므로 뚜렷한 독성물질이나 유해물질이 배출되지 않는 폐수 처리수에 대해서는 이를 보다 적절하게 관리할 수 있는 제도적 수단이 필요하다. 특히 해양으로 배출되고 생태독성 원인물질이 ‘염’으로 생각되는 경우 이에 대한 합리적인 독성평가방법이 요구된다.
본 연구는 폐수처리수에서 나타나는 생태독성이 오로지 염 농도에 기인하고 대부분 해양으로 배출되어 실질적으로 해양생태계에 큰 영향을 미치지 않는 것으로 생각되는 염분함유 폐수에 대하여 기존 물벼룩 (D. magna) 및 해양생물종인 V. fischeri 에 의한 급성독성 평가결과를 비교, 고찰함으로써 해양으로 방류되는 염 함유 폐수에 대한 생태독성 평가방법의 적절성을 평가하고자 수행되었다.
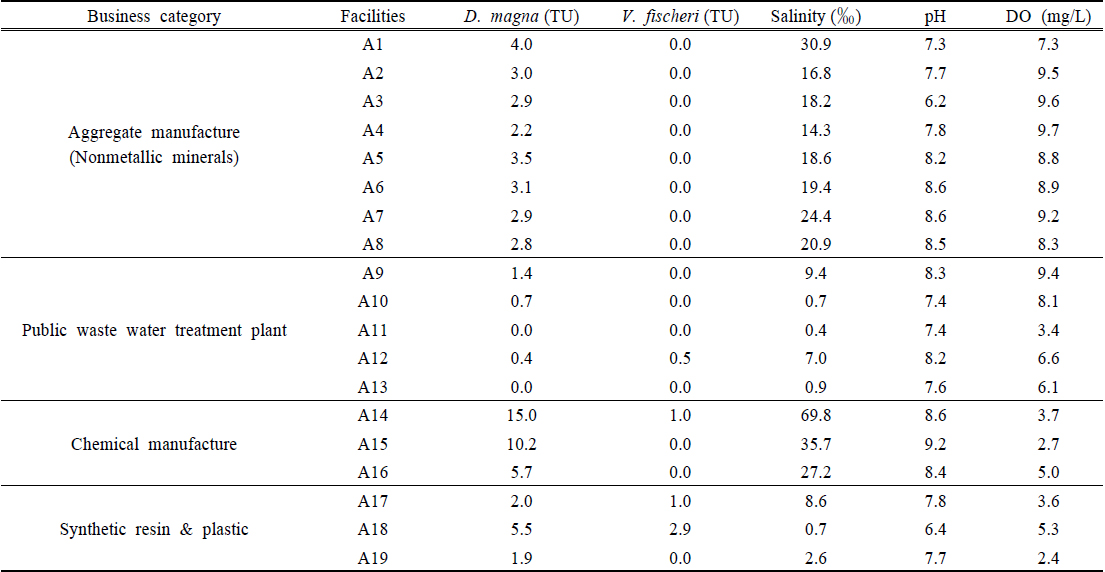
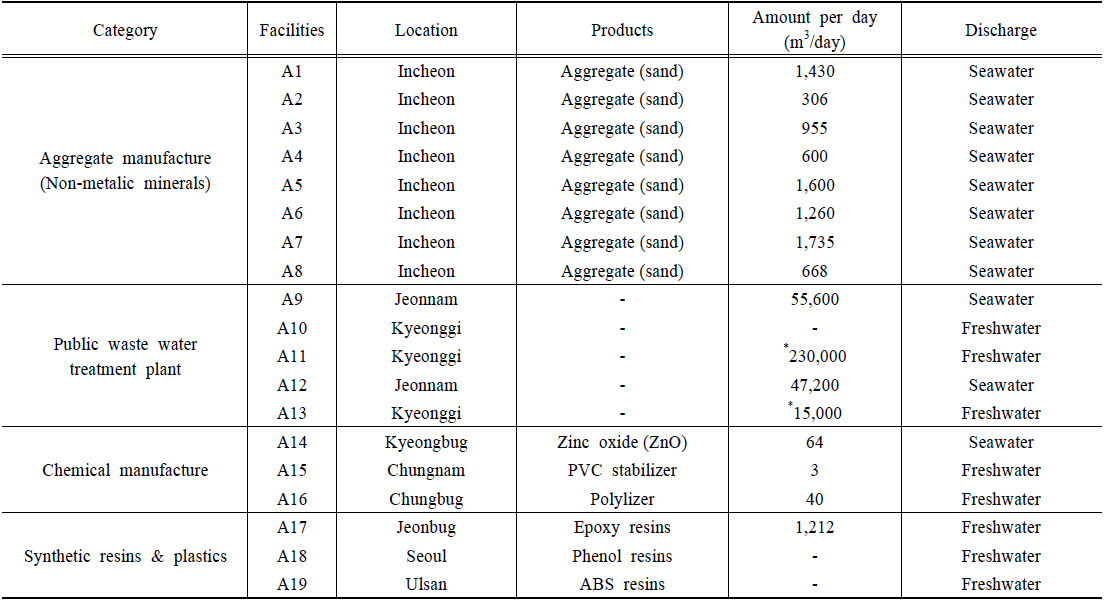
시료채취는 업종별 특성 또는 폐수처리수가 방류되는 수역 등을 감안하여 개별 폐수배출시설 중 해사채취시설(비금속광물광업시설) 8개소, 기타 분류 안 된 화학제품 제조시설 3개소, 합성수지 및 기타 플라스틱 제조시설 3개소, 그리고 폐수종말처리장 5개소 등 4개 업종 19개 폐수배출시설 폐수처리수를 대상으로 수행되었다(Table 1).
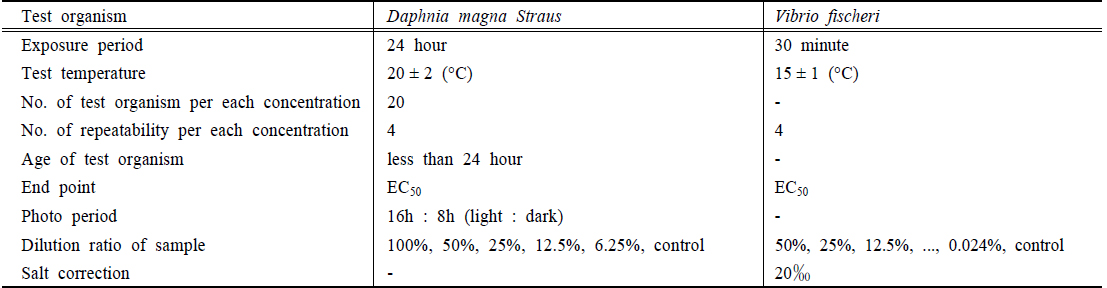
폐수처리수에 대한 생태독성수준 평가를 위해 수질오염공정시험기준에 따라 물벼룩(D. magna)을 이용한 급성독성시험(NIER, 2014a)을 수행하였고, 동일 시료에 대하여 해양생물종인 발광박테리아(V. fischeri)에 의한 시험결과와 비교하였다. 발광박테리아를 이용한 독성시험방법은 KS ISO 시험방법(KATS, 2009)에 따라 V. fischeri 를 이용하여 원폐수 및 단계별로 희석된 시료를 발광박테리아 현탁액과 혼합시켜 일정시간 경과 후 발광저해율을 측정하였다(Table 2). 시료의 발광저해 효과는 EC50값을 산출하여 TU값으로 평가하였다. D. magna 는 표준독성물질(K2Cr2O7)시험결과 EC50값이 평균 1.17 mg/L (0.93 mg/L ~ 1.74 mg/L, n = 20, 기준 0.9 mg/L ~2.1 mg/L)이었으며, V. fischeri 는 표준독성물질(ZnSO4)에 대하여 EC50값이 평균 6.61 mg/L (4.4 mg/L ~ 8.19 mg/L, n = 5, 기준 1 mg/L ~ 10 mg/L)이었다.
폐수처리수 중의 염분농도, 전기전도도, pH, 용존산소 농도는 다항목 측정기(Yellow Springs Instrument model 556, OH, USA)를 이용하여 측정하였으며 경도는 경도계(HI 93735, HANNA Instruments), 잔류염소는 잔류염소측정기(HI 93734, HANNA Instruments), 암모니아는 암모니아 측정기(HI 93715, HANNA Instruments)를 이용하였다. 이온성 물질(Ca2+, Mg2+, Na+, K+, SO42−, Cl−) 분석은 Ion Chromatography(Professional IC 850, Metrohm)를 이용 분석하였다. V. fischeri 의 발광저해율은 발광저해율측정기(N-Tox 200, Micro Digital Co.)로 측정하였다.
염 함유 폐수처리수의 생태독성 시험생물종으로 제시한 V. fischeri 는 국내 산업배출수의 독성 민감도 조사결과 조류(Pseudokirchneriella subcapitata), 물벼룩(Daphnia magna), 어류(Oryzias latipes)에 비해 가장 민감도가 높고, 시험을 위한 초기구축비용이 상대적으로 낮았으며, 전문가 설문조사 등에서도 타 후보 시험종에 비해 가장 적절한 것으로 조사된 바 있다(MOE, 2013). 아울러 지표수 및 지하수, 산업폐수, 도시하수 그리고 퇴적물 등 거의 모든 시료에 적용 가능하고(Boyd et al., 1997; Cotou et al., 2002; Reemtsma et al., 1999; Salizzato et al., 1998), 다양한 산업폐수의 독성을 결정하기 위한 민감하고 신속한 검색방법으로 적용되어 왔으며(Davere and Bahadir, 1994; Rigol et al., 2004), 해양에서 서식하므로 일정수준까지의 염분 농도에서는 영향을 받지 않기 때문에 해양으로 배출되는 염 함유 폐수처리수에 대한 독성평가에 적용하였다.
Table 3은 3개 업종(해사채취시설, 화학제품 제조시설, 합성수지 및 플라스틱 제조시설)및 폐수종말처리장 각 사업체별 폐수처리수를 대상으로, D. magna 및 V. fischeri 를 시험종으로 하여 조사된 생태독성값과 염분농도를 나타낸 것이다. 해사채취시설(A1 ~ A8)은 바닷모래를 담수로 세척하여 건축용 골재(모래)를 생산하는 시설로 염분을 함유한 해사를 담수로 세척하는 과정에서 세척폐수가 발생되며 폐수에는 염분이 다량 포함된다. 담수종인 D. magna 로 생태독성을 평가하였을 때 독성값은 Toxic Unit (TU) 2.2 ~ 4.0 정도이었으나 해수종인 V. fischeri 를 시험종으로 사용한 경우 모두 TU = 0이었고, 선행 연구결과에서도 V. fischeri가 다른 시험종에 비해 민감도가 높은 것으로 보고되고 있으므로(MOE, 2013), 염 성분(염분농도 기준 14.3‰ ~ 30.9‰) 외 유해물질은 없는 것으로 판단된다. 폐수종말처리장 폐수처리수에서는 A9 및 A10 사업장은 D. magna 에 독성을 나타냈으나 V. fischeri 에서는 나타나지 않았고, A12사업장은 두 시험종 모두에서 독성을 나타냈으나 배출허용기준(TU = 1) 이내였으며, 나머지 2개 사업장에서는 독성이 발현되지 않았다.
Shin et al. (2015)은 NaCl을 대상으로 20회 반복 급성독성실험(D. magna, 24h)에서 EC50값은 평균 6,114 mg/L (4,242 mg/L ~ 7,071 mg/L)이었다고 하였고, U.S. EPA의 ECOTOX data에서 NaCl에 대한 LC50값이 평균 6,380 mg/L (6,160 mg/L ~ 6,600 mg/L) 수준이었다(U.S. EPA, 2014). 또한 Anderson (1946)은 NaCl 에 대하여 D. magna 에 의한 48 hr 독성시험결과 독성이 나타나는 농도(No-Observed-Effect-Concentration: NOEC)를 4,200 mg/L (4.2‰)라고 보고하였다. 이 자료들과 V. fischeri 독성값이 TU = 0임을 감안할 때 A9 사업장의 독성원인은 염분(9.4 ‰)에 의한 것으로 생각되며, A12 사업장은 D. magna 와V. fischeri 모두에서 기준 이내이긴 하나 독성이 나타났으므로(TU, D. magna 0.4, V. fischeri 0.5) 염분농도(7‰) 뿐만 아니라 다른 유해물질에 의한 영향이 의심된다. 기타 분류 안 된 화학제품 제조시설 업종(A14 ~ A16) 폐수처리수는 모두 D. magna 에 대한 높은 독성값(TU 5.7 ~ 15.0)을 보였으나 V. fischeri 에서는 독성을 나타내지 않거나(TU = 0) 상대적으로 낮은 값(TU = 1)을 나타냈다. 그런데 이들 사업장(A14 ~ A16) 폐수처리수에서 염분농도는 높은 수준을 보이고 있어(27.2‰ ~ 69.8‰), D. magna 에는 독성을 나타냈으나 V. fischeri 에 독성을 나타내지 않았던 A15 및 A16 사업장 폐수처리수의 독성 원인은 염분(27.2‰ ~ 35.7‰)에 의한 것으로 판단되며, A14 사업장의 폐수처리수도 높은 염분농도(69.8‰)가 V. fischeri 에 독성을 나타낸 것으로 생각된다.
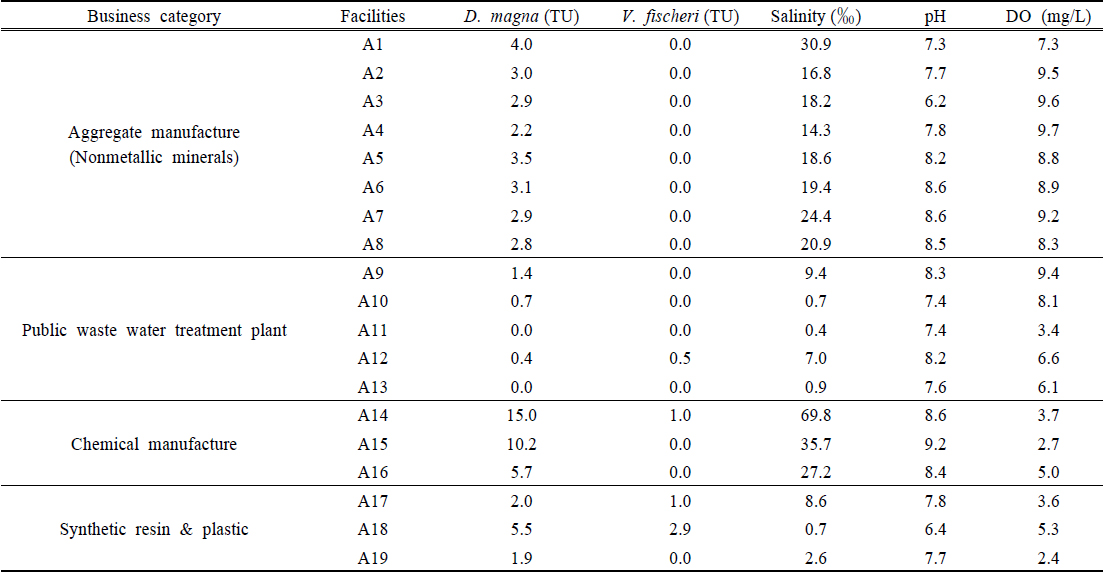
Fig. 1은 해양으로 배출되는 사업장의 폐수 처리수 내 생태독성 유발물질이 염임을 증명하기 위해 작성된 보고서(화학약품 제조 및 기초화합물 제조시설)(LG chemical, 2011; LG chemical Co., 2013; Ristecbiz, 2012)의 조사 데이터 중 시험종인 V. fischeri 에 독성을 나타낸 폐수 처리수의 급성독성값과 그때의 염분농도 간의 상관분포를 도시한 것이다. 이 결과에서 보면 65.1‰ ~ 277.0‰ 범위의 염분농도가 V. fischeri 발광율에 영향을 미치는 것으로 나타났다(TU 1.2 ~ 7.1). 그러나 대부분 해사채취시설을 대상으로 작성된 보고서(Boram Shipping Co., 2012; Dongwon Co., 2012; Fresh Industry Development Co., 2013; Gyeongu Shipping Co., 2012; Hana Shipping Co., 2012; Samhangang Co., 2012; Sampyo Co., 2014; Seongjin Material Co., 2012; Seonkwang Co., 2012; Yeongjin Corp. Co., 2012; Yujin Industry Co., 2012)의 조사데이터를 보면 5.8‰ ~ 26.1‰ 범위의 염분농도에서는 V. fischeri 에 의한 독성값은 0 (TU= 0)으로 나타난 바 있다. Soto et al. (2009)는 총 15종의 서식환경(공생숙주)에서 서식하는 V. fischeri strain을 대상으로 염분농도에 의한 영향을 조사하였는데 박테리아 성장이 관찰되지 않았던 염분농도는 균주별로 70‰, 80‰, 90‰ 정도였다고 보고하였다. 즉, 해양종인 V. fischeri 도 일정 수준을 초과하는 고농도의 염분은 독성물질로 인식되므로, 높은 농도를 갖는 염분이 함유된 폐수처리수는 해양생태계에 악영향을 미칠 수 있다는 것을 암시한다. 또한 V. fischeri 에 영향을 미치는 염분 농도는 위 조사결과와 문헌에서 보고된 결과로 판단할 때 65‰ ~ 70‰ 정도인 것으로 생각된다. 따라서 해사채취시설과 같이 원료에 의한 유해성분 유입가능성이 극히 적은 폐수배출시설에서 폐수처리수를 해양으로 배출하는 경우, 해양생물종인 V. fischeri 를 생태독성 시험생물종으로 적용이 가능하나 고농도의 염을 배출하는 폐수배출시설은 폐수처리수내 염 성분 외에는 유해물질이 포함되어있지 아니하더라도 해양으로 그대로 배출하기에는 부적합한 것으로 판단된다.
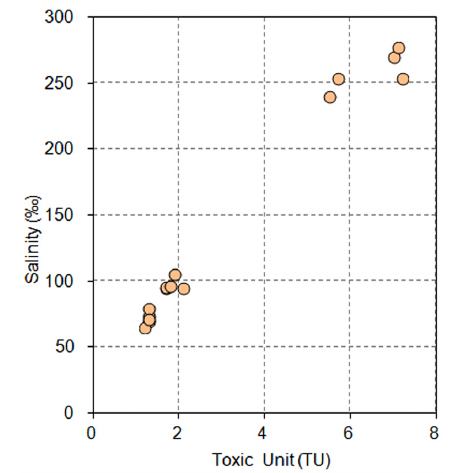
V. fischeri 에서 독성이 발현되지 않았던(TU = 0) 사업장 폐수처리수(A1 ~ A10, A15, A16, A19)의 경우(Table 3) 염분 농도 변화는 담수종인 D. magna 독성값의 증감에 영향을 미치는 것으로 조사되었다(r2=0.66, p<0.01, n=13)(Fig. 2). 또한, 인용문헌(Boram Shipping Co., 2012; Dongwon Co., 2012; Fresh Industry Development Co., 2013; Gyeongu Shipping Co., 2012; Hana Shipping Co., 2012; Samhangang Co., 2012; Sampyo Co., 2014; Seongjin Material Co., 2012; Seonkwang Co., 2012; Yeongjin Corp. Co., 2012; Yujin Industry Co., 2012; )에서 제시된 데이터 중 해사채취시설 11개소(총 51회 조사)의 폐수 처리수에서도 D. magna 독성값은 염분농도 변화를 90% 이상(r2 = 0.91 ~ 0.93) 설명할 수 있었다. 아울러 동일 문헌상에서 해양종인 V. fischeri 와 Monocorophium acherusicum(저서성 단각류)를 시험종으로 적용하여 독성평가를 수행한 결과 2종 모두 독성이 발현되지 않는 결과를 보였으나(V. fischeri TU = 0, M. acherusicum 생존률 91% 이상, 평균 96.7%). 시험종의 적절성을 감안할 때 4일(96시간)정도 소요되는 M. acherusicum 시험방법(MOF, 2013) 보다 상대적으로 분석이 용이한(30분 소요) V. fischeri 시험방법이 염 함유 폐수처리수 독성평가에 더 적절할 것으로 판단되었다.
이상과 같이 D. magna 에 의한 독성시험에서는 독성이 나타났으나 V. fischeri 에서는 독성이 발현되지 않으면 염분농도만이 D. magna 에 독성으로 영향을 미친 것으로 판단되므로 기존 D. magna 와 V. fischeri 를 조합하여 시험종으로 사용하면 염 함유 폐수처리수의 생태독성 관리에 적용 가능할 것으로 생각된다. 이때 시료의 염분농도는 선행 연구결과(Soto et al., 2009)를 참조하여 65‰ 이하인 경우로 제한할 필요가 있다. 아울러 향후에는 박테리아인 V. fischeri 외 조류나 어류 등 여러 영양단계를 가진 시험종을 조합하여 활용하는 방안에 대하여 추가 연구가 필요할 것으로 생각되며 이 경우에도 단순히 민감도 뿐만 아니라 시험방법의 편의성 등도 같이 검토되어야 할 필요가 있다.
수중에 존재하는 일반적인 이온성물질도 존재하는 비율이 차이가 나거나 이온 농도가 너무 낮거나 높은 경우 수생생물에 악영향을 미칠 수 있다. 특히, 폐수처리수에 대한 생태독성실험에서 이온성물질의 불균형은 수질기준을 충족하더라도 시험생물종에 독성을 야기하므로 생태독성 평가시 적절한 평가가 수행되었는지에 대해 논란의 여지가 있다(SETAC, 2004).
바다에서의 염분 농도는 대략 33‰ ~ 37‰ 정도이며 Na+ 이온과 Cl− 이온이 약 85%를 차지하고 나머지는 Mn2+, K+, Ca2+, Br−, SO42−, HCO3− 등으로 구성된다. 이 성분들은 해양생물의 생명유지에 필수적인 이온이나 이온 농도가 바닷물 염류의 구성비율과 맞지 않는 경우 오히려 해양생물에 독성으로 작용될 수 있다(Douglas et al., 1996). 수생생물의 경우 외부와 내부의 이온균형을 맞추기 위해 에너지를 소모하는데 환경 변화에 따른 이온불균형이 나타나면 이것은 성장이나 생식시기에 만성적인 stress로 작용하게 되므로 해양으로 방류되는 폐수처리수의 생태독성을 평가하는 경우 이러한 이온성 물질들의 불균형에 의한 영향도 고려되어야 한다.
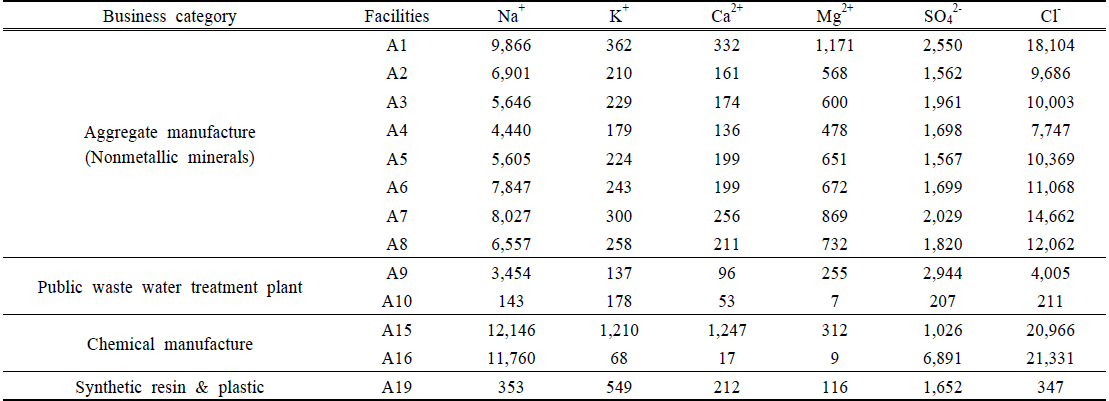
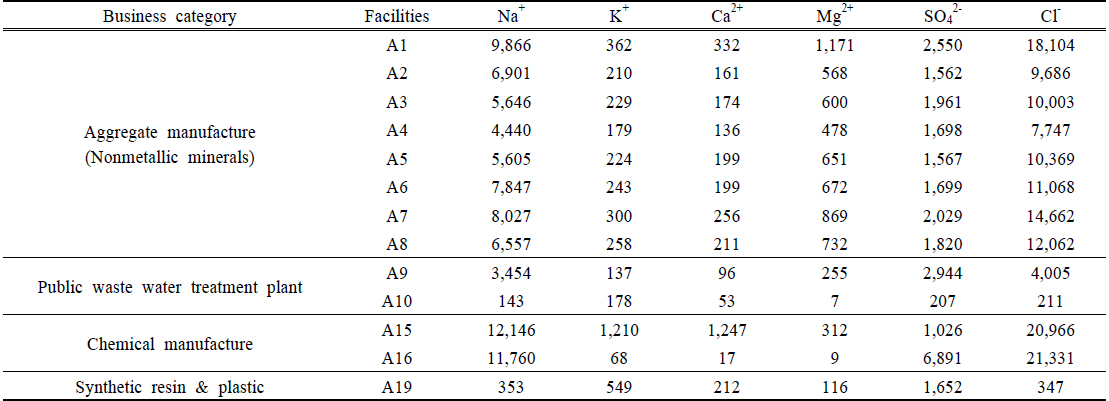
Table 4는 해양생물종인 V. fischeri 를 시험종으로 독성평가시 TU = 0이었지만 D. magna 를 시험종으로 하였을 때 독성을 나타낸 사업장(A1 ~ A10, A15, A16, A19)을 선별하여 각 사업장 폐수처리수의 주요 이온농도 분석결과를 나타낸 것이다. 이들 사업장 폐수처리수에는 V. fischeri 및 D. magna 에 의한 독성평가 결과로 볼 때 염 성분이 D. magna 사멸율에 영향을 미친 것으로 판단되었다.
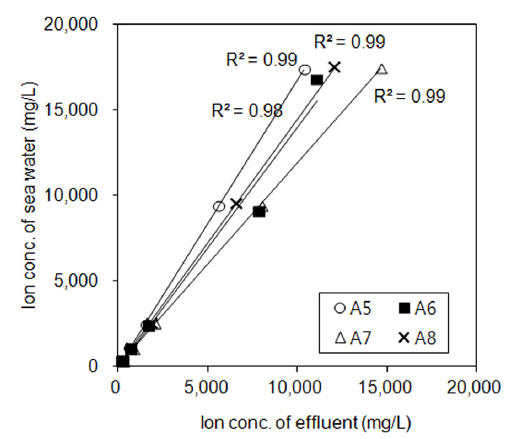
비금속광물광업시설(해사채취시설)에서는 8개 업체 시료 모두 Cl− 이온과 Na+ 이온이 타 이온들에 비해 상대적으로 높았고, 변동폭도 큰 것으로 나타났다. 선행 연구에서 Na+ 이온는 일반적으로 수환경의 독성에 크게 관여하지 않으며 Cl− 이온은 상대적으로 Na+ 이온보다 독성이 강한 것으로 보고된바 있다(Mount et al., 1997). 일반적으로 D. magna에 대한 독성 정도는 K+> Mg2+ > Cl− > SO42− 순으로 알려져 있는데(Mount et al., 1997), 폐수처리수내 이온 농도 조성을 보면 K+ 이온 및 Mg2+ 이온 농도는 타 이온성분에 비해 현저하게 낮은 값을 보이므로 상대적으로 높은 수준을 보이는 Cl− 농도가 물벼룩에 미치는 독성수준에 주도적으로 영향을 미친 것으로 판단된다. 나머지 3개 업종은 업체별로 상이한 이온성 물질 농도 분포를 나타내고 있으며 그 이유는 다양한 원료성분 또는 처리공정의 차이에서 비롯된 것으로 보인다. 여기에서도 폐수종말처리장(2개소)과 화학물질제조시설(2개 사업장)의 폐수처리수의 Cl− 이온 농도는 상대적으로 높았으며, 합성수지 및 기타 플라스틱 제조시설(1개 사업장)은 SO42− 이온이 높게 나타나 이들 이온농도가 D. magna 사멸율에 영향을 준 것으로 판단되었다. 한편 Fig. 3은 폐수처리수를 해양으로 직접 방류하는 해사채취시설 4개 업체(A5 ~ A8)의 주요 이온성 물질들(Na+, K+, Ca2+, Mg2+, SO42−, Cl−)과 각 사업장 인근 해수의 이온성 물질과의 상관성을 도시한 것인데 거의 결정계수(r2) 0.98 ~ 0.99 정도로 해사채취시설 폐수처리수의 이온 구성비율과 인근 해수의 이온 구성비율이 유사한 것으로 나타나고 있어 해사채취시설에서 해양으로 직접 방류되는 폐수처리수인 경우 이온 불균형에 의한 영향은 없는 것으로 판단되었다.
총 4개 업종 19개 사업장 폐수 처리수를 대상으로 D. magna와 V. fischeri 에 의한 급성독성시험결과를 비교, 검토하여 염 함유 폐수처리수 관리를 위한 V. fischeri 의 시험생물종으로의 적합성을 검토 하고 아울러 폐수처리수내 이온성 물질의 특성을 분석하였다.
V. fischeri 에서 독성이 발현되지 않았던 사업장 폐수처리수에서 염분 농도는 D. magna 독성값 변동을 대략 66% ~91% 정도 설명할 수 있는 것으로 나타났으며 해사채취시설과 같이 원료에 의한 유해성분 유입가능성이 극히 적은 폐수배출시설에서 폐수처리수를 해양으로 배출하는 경우, 해양생물종인 V. fischeri 를 D. magna 와 조합하여 생태독성 시험생물종으로 적용이 가능할 것으로 생각되었다. 단 폐수처리수에 고농도의 염이 함유된 경우(65‰ ~ 70‰ 이상) 해양생물종에서도 독성을 야기하므로 유해물질이 포함되어있지 아니하더라도 해양으로 그대로 배출하기에는 부적합할 것으로 판단되었다.
해사채취시설 폐수처리수내 6개 이온(Na+, K+, Ca2+, Mg2+, SO42−, Cl−)에 대한 분석결과 Na+ 이온 농도(평균 5,740 mg/L)와 Cl− 이온 농도 (평균 9,727 mg/L)이 가장 높은 수준을 보였고 이중에서 Cl− 이온성분이 D. magna 생존에 영향을 미친 것으로 판단되었다.