염색과 관련된 국내 섬유산업의 업체 수는 2013년 현재 360,616(제조업)개소로 전체 폐수배출업소의 3.6%에 불과하지만, 전체 폐수발생량의 22.2%에 해당된다. 또한 배출되는 유기물질 부하량이 2,134,429 kg/d로 전체의 24.3%에 달하여 폐수발생량 및 폐수의 특성 면에서 대표적인 오염 산업으로 분류되고 있다(MOE, 2013). 염색가공 공정은 호발 공정(Desizing), 정련 및 표백공정(Scouring and Bleaching), 광택공정(Mercerizing), 염색공정(Dyeing)으로 이루어진다. 이들 공정은 섬유의 특성에 따라 사용되는 염료 및 공정들이 달라지므로 공정에 따라 발생되는 폐수의 성상 또한 다르다(Sathian et al., 2014). 물 사용량은 정련 및 표백공정이 77%를 차지하며, 오염물질의 발생은 호발 및 정련공정이 83%를 차지하고 있어 물사용량과 오염발생의 대부분이 정련 및 표백공정과 호발공정에서 나타난다(Kim et al., 2008). 염색가공 공정에서 발생되는 폐수는 가공방법 및 소재 등이 계절별, 시대별로 변화하여 폐수의 성상이 자주 변동되고 오염부하량의 변화가 심하여 폐수처리의 최적상태를 유지하는데 상당한 문제점을 안고 있으며, 하절기에는 40℃를 넘는 고온이고 pH가 11.5~12인 강알칼리성으로 전반적인 처리효율이 낮으며 BOD, COD, 색도 등의 배출농도가 높다. 또한, 미생물에 의해 분해가 되지 않거나 분해속도가 느린 염료와 각종 고분자 유기화합 물질을 다량 함유하고 있어 처리에 큰 어려움을 겪고 있다(Kim et al., 2008; Moghaddam et al., 2010).
염색폐수 중의 염료를 제거하는 방법에는 화학적(Blanco et al., 2014; Rodrigues et al., 2014; Soares et al., 2015; Ying et al., 2011), 물리・화학적(Abidi et al., 2015; Lin et al., 2015) 및 생물학적 처리방법(Lotito et al., 2012; Lu et al., 2010) 등이 제시되고 있다. 화학적 처리방법으로는 대표적으로 염소계 산화법, 펜톤 시약법, 오존법 등을 들 수있다. 이런 처리방법은 화학적 슬러지를 발생하고 해로운 중간 생성물이 발생되며 운전비용이 비싸다는 단점이 있다(Lin et al., 2015; Lotito et al., 2012). 생물학적 처리방법은 일반적으로 활성화된 호기성 미생물에 의해 유기물을 흡착 또는 분해시키는 활성슬러지 공정이 가장 많이 이용되고 있으나, 슬러지 발생량이 많고 침전조에서 고액분리가 잘 되지 않는 단점을 가지고 있다(Rodrigues et al., 2014; Rodrigues et al., 2011). 또한 염색폐수내의 염료는 대부분이 생물학적으로 분해하기 어려운 물질로 구성되어 있고 분해가 되더라도 독성물질을 생성할 수 있기 때문에 처리효율이 좋지 못하다(Rodrigues et al., 2011). 한편, 물리적처리방법으로는 활성탄, 이온교환수지법, 막분리법 등이 있다. 이온교환수지법은 염료의 제거능력이 우수하지만 이온 교환수지의 가격이 대단히 비싸고 일부 염료에 대해서만 흡착력이 우수하기 때문에 염색폐수 처리에 적용하는데 한계가 있다(Sathian et al., 2014). 막분리법은 염료의 종류에 상관없이 제거하지만 분리 후에 남아있는 농축된 잔여물의 처리문제가 발생하고 초기 투자비가 많이 들고 또한 전처리 등의 공정이 복잡하다. 이 외에도 clogging의 가능성, 막 교체의 필요성과 같은 문제를 안고 있다(Moghaddam et al., 2010). 한편, 흡착법은 폐수로부터 오염물질을 제거하는 효율과 처리공정이 간단하여 경제적으로 실행할수 있음이 증명되었기 때문에 여타의 방법에 비해 가장 타당성이 높은 방법으로 알려져 있다(Rahman et al., 2013). 그러나 흡착법에서 일반적으로 사용되는 활성탄은 가격이 비싸고 대부분 재생이 되지 않는다는 단점이 있다. 따라서 값이 저렴하면서 염료 흡착에 쉽게 이용할 수 있는 물질들에 대한 관심이 높아지고 있다.
Mg으로 개질한 zeolite (Mg-zeolite)는 환경친화적인 새로운 흡착제의 대안이 될 수 있다. 일반적인 Zeolite의 양이온 교환능력은 100 g 당 200-400 meq정도로서 유사한 용도로 사용되는 벤토나이트의 주성분 광물인 스멕타이트의 양이온 교환능력(80-100 meq/100 g)보다 2배 이상의 높은 값을 갖는다(Yun, 2004). Zeolite는 광물질 중에서 가장 뛰어난 양이온 교환능력을 갖는 것 이외에, 양이온들을 선택적으로 교환할 수 있다(Filippousi et al., 2015; Yun, 2004). Zeolite의 골격은 [SiO4]4-와 [AlO4]5-로 구성된 정사면체 단위가 산소가교를 통해 연결되어 있다. [SiO4]4-의 Si은 +4의 전하를 갖고 있지만 [AlO4]5-의 Al은 +3의 전하를 가지고 있으므로 Al이 있는 곳마다 음전하를 한개씩 수용하고 있다. 따라서 전하 상쇄를 위해서 양이온들이 존재하게 되며, 양이온 들은 골격 내부가 아니라 세공 내부에 존재하고 나머지 공간들은 물분자로 채워져 있다. SiO4/AlO4의 비율이 2.5이상일 경우 산에 대한 저항력과 열안정성 그리고 소수성은 증가하나 극성 흡착질에 대한 친화력과 양이온 교환능은 감소한다. 그와 반대로 SiO4/AlO4의 비율이 2이하로 감소할 경우 친수성과 양이온교환특성이 증가한다(Whiting et al., 2014). 이러한 양이온들은 세공내부에서 비교적 자유로운 이동(mobility)을 가지고 있으며 다른 양이온들과의 이온교환도 아주 순조롭게 일어난다. 따라서 zeolite는 탁월한 이온교환능력을 지닌 무기 이온 교환제이다(Park et al., 2013; Yun, 2004; Zhan et al., 2015). 또한 개질한 Mg-zeolite는 고농도의 NaCl에 세척하여 재사용할 수 있어서 매우 경제적이다(Whiting et al., 2014). 그러나 아직까지 Mg-zeolite응집제를 이용하여 하・폐수의 유·무기물을 응집 처리한 연구는 미미하다. 따라서 본 연구는 개질한 Mg-zeolite를 이용하여 염색공장 폐수의 유・무기물을 흡착처리하여 처리효율의 가능성을 확인하고자 하였다.
Mg-zeolite는 이온교환작용에 의하여 유・무기물질을 흡착제거할 수 있으며 zeolite를 사용함으로써 무기염의 사용량을 감소시킬 수 있다. Mg-zeolite는 철염이나 알루미늄염 사용시 발생하는 폐수처리 후의 추가처리에 대한 문제가 없으며 적은 양의 무기염을 사용할 수 있어 매우 경제적이다. 또한 K+를 이용하여 개질한 zeolite는 3Å 크기의 구경을 갖는데 반해서 Mg2+를 이용하여 개질한 zeolite는 4Å-5Å의 크기를 갖는다. 구경이 큰 zeolite는 상대적으로 우수한 표면 활성과 큰 결정 공극을 갖기 때문에 촉매나 흡착능력이 작은 구경의 zeolite 보다 훨씬 뛰어나다(Park et al., 2013).
2.1. Characteristic of Dyeing Wastewater
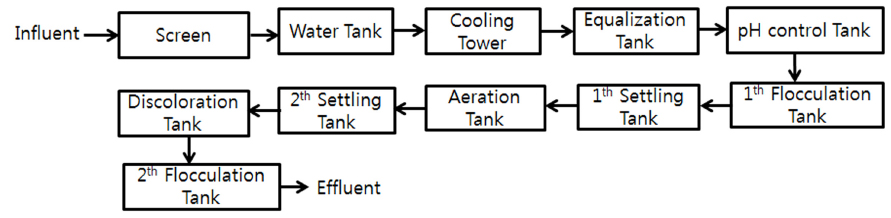
실험에 사용된 염색공장폐수는 대구의 D사의 2차 응집조 폐수를 사용하였으며 폐수 발생량은 평균 1,800 m3/day이다. D사의 구체적인 폐수처리공정은 Fig. 1에 나타내었다. 유입된 하수는 스크린과 집수조를 거쳐 냉각탑에서 폐수를 냉각시킨다. 냉각된 폐수는 유량조정조를 거쳐 pH 조정조에서 NaOH/HCl을 이용하여 pH를 조정한 후 1차 응집조에서 응집처리 후 침전시킨 후 폭기조를 거쳐 2차 침전시킨다. 2차 침전된 폐수는 탈색조에서 색도를 제거한 후 2차 응집처리를 하여 가압 부상조를 거쳐 배출하게 된다. 본 실험은 탈색조와 2차 응집에 사용되는 비용을 감소시키고자 1차 응집조의 폐수를 가지고 실험하였다. 1차 응집조에서 응집효율이 높을 경우 탈색조와 2차 응집과정을 생략하고 1차 침전조와 폭기조를 거쳐 2차 침전 후에 바로 방류할 수 있다.
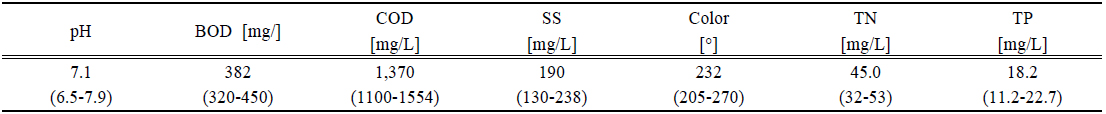
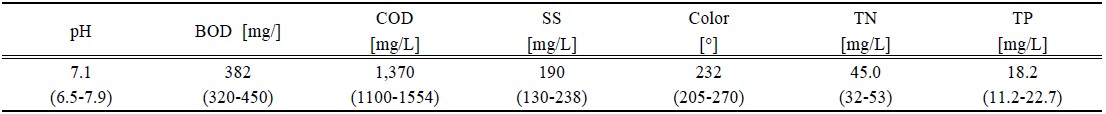
염색폐수는 섬유의 종류에 따라 염색방법과 염색공정이 다르기 때문에 섬유의 종류에 따라 발생하는 폐수의 성상도 다르다. 땀, 비누, 물, 빛, 산화제 등에 노출이 되었을 때 탈색을 방지하기 위하여 사용되는 염료는 합성물이며 주로 복잡한 aromatic 분자구조 이므로 안정적이고 생분해하여 처리하기가 어렵다. 구체적인 염색폐수의 성상은 Table 1에 나타내었다. 유입수의 염색폐수는 일반적으로 강 알칼리성이고 생물학적 처리에 필요한 영양염류가 부족하며 상대적으로 COD와 색도가 높다. 특히 생물학적 난분해성물질이 다량 함유되어 있으며 중금속 등 미생물의 성장에 영향을 미치는 독성물질이 함유되어 있는 특성을 가지고 있다. 본 실험에 사용된 1차 응집조의 폐수는 pH 조정조를 거쳐서 pH는 높지 않았으나 COD와 색도는 높았다.
[Table 1.] Characteristics of dyeing wastewater
Characteristics of dyeing wastewater
본 실험에서 점토광물로 사용한 zeolite (Kumnong Company, Pohang, Korea)는 직경 3 mm(3Å)로 성형된 제품이다. Zeolite는 알루미늄 산화물과 규산산화물의 결합으로 생겨난 음이온에 알칼리토금속이 결합되어 있는 광물을 총칭한다. 즉, 결정질 알루미늄 규산염광물을 의미한다(Yun, 2004). Zeolite의 필수적 성분은 Al, Si, O, H2O이며 선택적 성분은 Na, Ca, K, Mg 등이다. 제올라이트의 골격은 실리콘(Si)과 알루미늄이 각각 4개의 가교 산소를 통해 연결되어 있는 삼차원적인 무기고분자이며 이때 알루미늄이 4개의 산소와 결합하게 됨에 따라 음전하를 갖게 된다. 이러한 전하를 상쇄하기 위하여 다양한 양이온이 필요하다. 결정내부에 존재하는 세공내부에는 보통 물로 채워져 있는데 열을 가하면 세공내부에 있는 물분자들이 대기중으로 쉽게 빠져나와 세공내부는 완전히 비게 된다. 이러한 공동되어 있는 세공속으로 물분자 또는 크고 작은 양이온들의 내부 공동 출입이 자유롭게 일어난다. 따라서 zeolite는 탁월한 이온교환능력을 지닌 무기이온 교환제이다(Filippousi et al., 2015; Park et al., 2013; Yun, 2004; Zhan et al., 2015).
본 연구에 사용된 MgCl2・6H2O (> 98%)는 Junsei Chemical Co. Ltd (Tokyo, Japan))의 제품을 사용하였다. 양이온의 수가 높을수록 폐수의 유·무기물이 Zeolite에 잘 흡착될 수 있다. Fe2+, Ca2+, Mg2+, Fe3+ 그리고 Al3+ 등은 다가의 양이온 그룹에 속하는데 이러한 다가의 양이온을 Zeolite와 혼합하면 Mg-zeolite-유·무기물의 형태로 흡착된다. 유・무기물은 개질된 Mg-zeolite에 빠르게 흡착되며, 개질된 Mg-zeolite는 미세한 작은 입자까지도 흡착제거할 수 있다.
Mg-zeolite는 아래와 같이 제조하였다. Zeolite (Kumnong Company, Pohang, Korea)는 직경 3 mm (3Å)로 성형된 제품이며, 실험을 위하여 325 mesh로 분쇄하여 증류수로 수차례 세척하였다. 세척한 zeolite는 100℃에서 24시간 동안 건조하여 zeolite에 함유되어 있는 수분을 완전히 제거하였다. 250 mL 삼각플라스크에 전처리한 zeolite 분말 2 g과 MgCl2・6H2O (1M) 200 mL를 넣은 후 수평진탕기를 사용하여 250 rpm으로 24시간 동안 교반하였다. 24시간 후에 반응한 상등액을 버리고 새로운 MgCl2・6H2O (1M)를 교체하였고 위의 과정을 3번 반복하였다. 반응 후 zeolite는 증류수로 수차례 세척한 다음 85℃에서 24시간 건조하여 데시게이터에 보관하여 실험에 사용하였다(Park et al., 2013). 이때 Mg와 Si의 몰비는 약 0.8-1.2, Si과 Al의 몰비는 1.2-1.5였다. 실험은 Jar-test의 형식으로 실행하였으며, 염색폐수 1 L에 제조된 Mg-zeolite를 실험의 계획에 따라 다양한 양을 (0-500 mg/L) 투입하여 초반 5분간은 200 rpm 으로 교반한 후 후반 25분간은 100 rpm으로 천천히 교반하였다. Mg-zeolite와 혼합한 일반하수는 2500 rpm으로 20분간 원심분리한 후 상등액을 샘플링하여 염색폐수에 함유되어 있는 유・무기물의 제거율을 측정하였다.
Zeolite에 함유되어 있는 무기 성분의 질적 양적 분석은 X-ray fluorescence (XRF-1500, Shimadzu, Japan)을 사용하여 분석하였고 표면 분석을 위한 SEM 이미지는 (SM-300, Topcon, Japan)을 사용하였다. Zeolite 입자의 크기는 입도분석기(Laser Diffraction Master class 3&4, Malvern, England)를 이용하였고, Zeolite의 양은 전자저울(XP26, Mettler Toledo, Swiss)로 측정하였다. pH는 pH meter (SevenGO pro, Mettler Toledo)를 이용하여 측정하였으며, 색도는 UV/Vis (JASCO V-550)을 사용하여 파장 200 nm에서 900 nm 까지 scanning 하여 흡광광도의 변화로 측정하였다. SS, COD 그리고 BOD는 수질오염공정시험법을 이용하여 측정하였다. 실험은 5번 반복하였으며 평균 데이터를 사용하였다.
3.1. Change of pH by different mixing time and Mg-zeolite dose
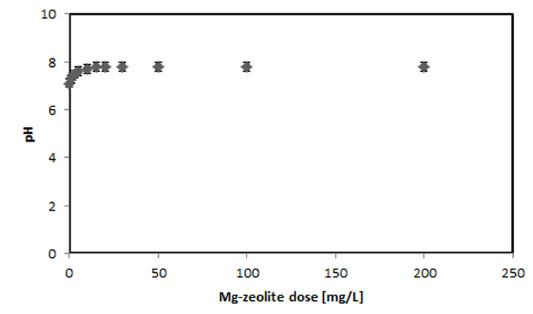
Zeolite의 촉매특성에 영향을 주는 요인들은 zeolite의 구조, 양이온의 성격과 구조상의 위치, Si/Al의 함량비, 활성금속원소들의 존재 여부 및 pH이다(Yun, 2004). Zeolite의 촉매특성과 흡착특성은 밀접한 연관을 가지며 주로 큰 구경을 갖는 개질된 합성 zeolite들이 뛰어난 성능을 나타낸다. 개질된 Mg-zeolite는 분자들을 흡수할 수 있을 만큼 큰 공동과 높은 공간 체적율로 인해서, 높은 표면 활성을 갖게 된다(Margeta et al., 2013). 따라서 개질된 Mg-zeolite는 우수한 촉매효과를 나타낸다. Fig. 2에 Mg-zeolite 양에 따른 pH의 변화를 나타내었다. 실험결과 초기 pH 6.5에서 Mg-zeolite 10 mg/L까지는 지속적으로 pH가 상승했으나, Mg-zeolite 10 mg/L 이상에서는 pH가 7.7-7.8로 Mg-zeolite의 양에 관계없이 일정하였다. Zeolite는 그 자체만으로도 약 알칼리(pH 8-9)를 나타내며, zeolite 내부의 공동이 클수록 pH가 약간 상승한다. 이는 이온치환능력이 입자 표면적과 비례적으로 작용하기 때문이다. 또한 zeolite는 산성폐수나 산성토양을 중화시킬 수 있는데 이는 zeolite의 층 사이에 함유되어 있는 OH- 이온이 산성폐수의 H+ 이온과 결합하면서 물이 형성이 되고, 이러한 반응들에 의해 Zeolite는 pH를 중성화시킬 수 있다. 선행연구에(Rodrigues et al., 2011; Soares et al. 2015) 의하면 취급이 용이하여 주로 정수처리에 많이 사용되는 알루미늄염(Al2(SO4)3・18H2O, NaAlO2, Aln(OH)mCl3n-m 등)은 pH 6-8 그리고 넓은 pH에 적용이 가능하여 주로 해수의 담수화에 많이 사용되는 철염(FeSO4・7H2O, FeCl3・6H2O, Fe2(SO4)3・nH2O 등)의 응집제는 5-11이 적정 pH이다. Mg-zeolite의 양에 따른 pH는 7.5 ± 0.3로 나타나 Mg-zeolite의 사용을 위한 적정 pH이다.
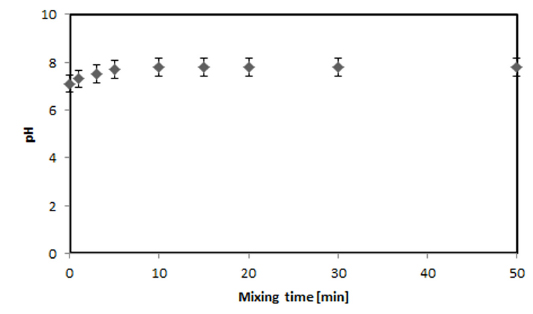
Mixing time에 의한 pH변화를 알아보기 위하여 Mg-zeolite 10 mg/L를 150 rpm 으로 교반하였다. Mixing time 에 의한 pH의 변화는 초기 pH 7.1에서 10분 교반까지 7.8까지 상승하였으나 10분 후부터 50분까지의 교반시간동안 pH는 변화가 없었다(Fig. 3). 따라서 10분안에 Mg-zeolite와 하수가 충분이 혼합됨을 알 수 있었다.
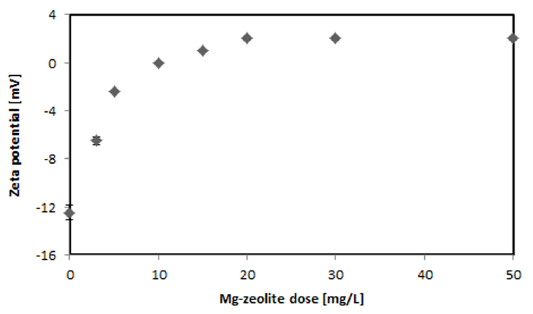
제타 전위(zeta potential)란 입자 사이의 반발력이나 인력의 크기에 대한 단위로, 제타전위 측정은 분산 메커니즘을 자세히 이해할 수 있도록 해주며 정전기 분산을 제어하는데 중요한 요소이다. 제타전위 값이 크다면 입자들간의 반발력이 큰 것이고, 작으면 응집력이 큰 것이다. 즉, 제타전위의 절대값이 크다면 안정하다고 할 수 있다. 따라서 제타전위 측정은 하폐수 처리, 정수 처리등 광범위한 분야에서 매우 중요하게 사용되는 파라미터이다(Chen et al., 2010). Fig. 4에 Mg-zeolite의 양에 따른 제타전위의 변화를 나타내었다. 초기 -12.5 ± 2.4 mV에서 점차 상승하여 Mg-zeolite 50 mg/L의 양에서는 +2.03 ± 0.4 mV를 나타내었다. 제타전위는 전단면에서의 전위를 말하며, 콜로이드 표면의 전기적 성질을 나타내는데, 흡착을 촉진시키기 위해서는 제타전위가 0 부근이 가장 좋다. 제타전위의 값이 + 또는 -로 크면 입자 상호간의 전기적 반발력이 크게 작용한다. Moghaddam et al. (2010)은 흡착에 가장 좋은 최적 제타전위는 ±3 mV (-3 mV ~ +3 mV)이라 보고하였다. 본 실험에서는 5 mg/L에서 -2.4 mV, 10 mg/L에서 0 mV 그리고 20 mg/L에서 2mV를 나타내었으며 15 mg/L이상에서는 제타전위가 크게 변하지 않아, Mg-zeolite 5 mg/L 이상의 양에서 흡착을 하기 위한 최적의 제타전위임을 알 수 있었다.
3.2. Removal of SS and Colour by various Mg-zeolite dose
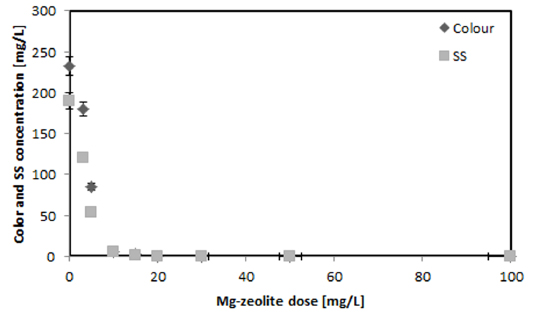
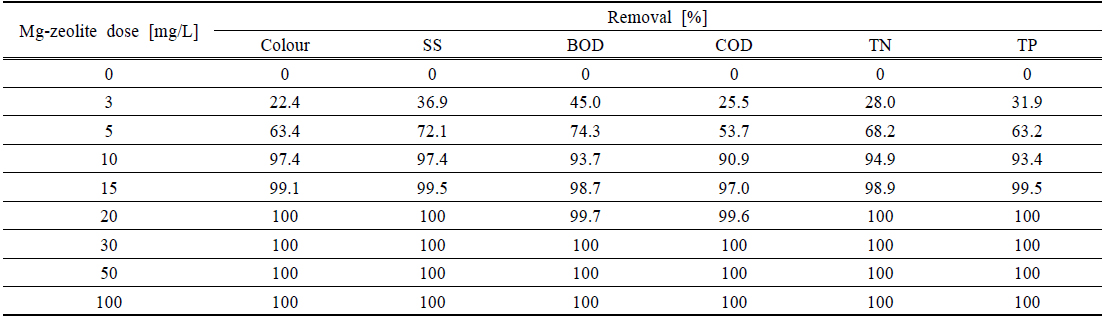
Fig. 5에 Mg-zeolite의 양에 따른 SS와 Colour 제거율을 나타내었다. SS와 Colour는 비슷한 제거 양상을 나타내었으며 10 mg/L의 Mg-zeolite 양에서 각각 97.37과 97.41%의 제거율을 나타내었으며 20 mg/L의 농도에서는 100%의 제거율을 나타내었다. Mg-zeolite 농도 20 mg/L 이상에서의 제거율을 차이가 없었다. 따라서 SS (초기농도 190 mg/L)와 Colour (초기색도 232) 제거를 위해서는 20 mg/L의 Mg-zeolite의 농도가 최적이었다.
3.3. Removal of COD and BOD by different Mg-zeolite dose
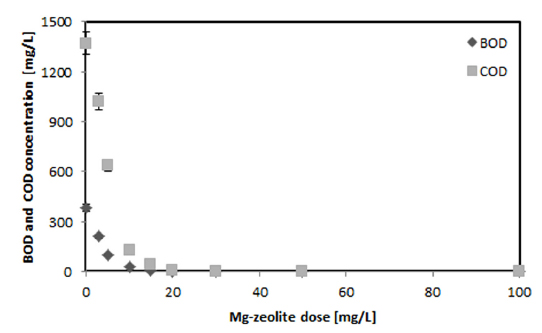
다양한 Mg-zeolite의 양에 따른 COD와 BOD 제거율을 Fig. 6에 나타내었다. 실험의 평균 값인 COD 초기농도 1,370 mg/L는 20 mg/L Mg-zeolite에서 99.6%, 30 mg/L의 Mg-zeolite 양에서는 100%의 제거율을 나타내었다. 실험결과 1 mg/L의 Mg-zeolite는 약 45 mg/L의 COD를 제거할 수 있었다. BOD는 초기농도 382 mg/L에서 15 mg/L와 20 mg/L의 Mg-zeolite의 양에서 각각 평균 98.7%와 99.7%의 제거율을 나타내어 15 mg/L와 20 mg/L의 Mg-zeolite의 양에서의 제거율의 차이는 크지 않았다(Fig. 7). BOD도 COD와 비슷하게 30 mg/L의 Mg-zeolite 양에서 100%의 제거율을 나타내었다. 염색공장폐수에서 Mg-zeolite 1 mg/L는 BOD 12.7 mg/L를 제거할 수 있었다. 실험결과 Mg-zeolite 1 mg/L가 제거할 수 있는 COD의 양은 BOD와 비교하여 약 3배 이상 많았다.
3.4. Removal of TN and TP by various Mg-zeolite dose
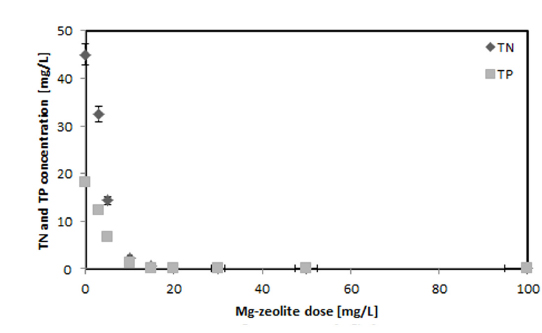
TN와 TP의 Mg-zeolite의 양에 따른 제거율을 Fig. 7에 나타내었다. TN은 15 mg/L의 Mg-zeolite에서 98.9%의 제거율을 나타내었고, 20 mg/L의 양에서는 100% 제거되어 적은 양의 Mg-zeolite에서 높은 제거율을 나타내었다. TP의 제거율은 TN과 마찬가지로 15 mg/L의 Mg-zeolite 에서 99.5%의 높은 제거율을 나타내었으나, 20 mg/L에서는 100%의 제거율을 나타내었다. 본 실험결과 염색공장폐수에서 1 mg/L의 Mg-zeolite는 0.91 mg/L TP 그리고 2.25 mg/L의 TN을 제거할 수 있었으며 TP 보다는 TN을 더 쉽게 제거할 수 있었다.
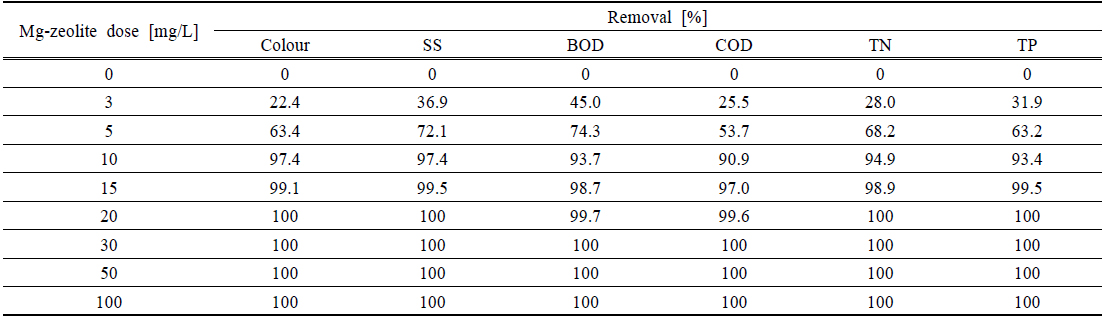
Table 2에 다양한 Mg-zeolite의 양에 따른 colour, SS, TN and TP의 제거율을 나타내었다. Colour, SS, TN 그리고 TP는 20 mg/L Mg-zeolite의 양에서 각각 100% 높은 제거율을 나타내었으며, COD와 BOD는 30 mg/L의 Mg-zeolite의 양에서 100%의 제거율을 나타내었다. Mg-zeolite는 화학적인 응집보다는 이온교환작용에 의한 물리적인 흡착으로 하폐수의 유・무기물을 흡착할 수 있고, 기존의 흡착제와 비교하여 적은 양으로 고효율의 처리를 할 수 있다.
[Table 2.] Removal of colour, SS, TN and TP by various Mg-zeolite dose in the dyeing wastewater
Removal of colour, SS, TN and TP by various Mg-zeolite dose in the dyeing wastewater
Rong et al. (2014)은 Alum, FeCl3 그리고 PAC (polyaluminium chloride)를 이용하여 일반하수를 처리한 결과 Alum, FeCl3 그리고 PAC 150 mg/L 를 사용하여 각각 83.6%, 91.8% 그리고 93.6%의 SS 제거율을 보고하였다. 그러나 Anionic polyacrylamide (AP) 50 mg/L를 응집보조제로 사용하였을 경우 Alum, FeCl3 그리고 PAC 사용량은 100 mg/L로 감소하였고 제거율도 각각 89.1%, 97.3% 그리고 95.5%로 상승하였다. Amuda and Alade (2006)은 염색공장폐수에서 Alum을 750 mg/L을 이용하여 78%의 COD 제거율과 87% TN, 69.8% TP 제거율을 보고하였고, Ismail et al. (2012)은 ferric 과 ferrous sulfates를 혼합하여 50 mg/L의 양으로 일반하수를 응집처리한 결과 95% TN의 제거율 그리고 lime 과 ferrous sulfate을 혼합한 응집제 150 mg/L을 사용하여 83%의 TP 제거율을 보고하였다. Natural zeolite 또한 유·무기물질을 흡착제거할 수 있는데 Margeta et al. (2013)은 natural zeolite를 이용하여 56% colour, 38% COD와 43% TN 제거율을 보고하였다. 본 연구에서는 개질된 Mg-zeolite 20 mg/L를 이용하여 Colour, SS, TN 그리고 TP는 각각 100% 높은 제거율을 나타내었고, COD와 BOD는 30 mg/L의 Mg-zeolite의 양에서 100%의 제거율을 나타내어 Alum 과 철염을 이용한 응집제 또는 natural zeolite와 비교하여 적은 양으로 높은 제거율을 나타내었다. 개질된 Mg-zeolite는 내부의 비어있는 공동을 물분자 또는 세공입구를 통과할 수 있는 크기의 다른 작은 분자들을 흡입하여 빈공간을 메꾸려는 성향이 매우 강하다. 이러한 현상은 격자에너지(lattice energy)를 낮추려는 자연스러운 열역학현상이다(Margeta et al., 2013; Yun, 2004). 이러한 이유로 개질된 Mg-zeolite는 강한 흡착제 또는 흡수제로 사용할 수 있다. 특히 세공을 이루는 골격에 음전하가 퍼져있으며 세공내부에 양이온들이 존재하므로 세공내부는 강한 극성을 띄고 있다. 그러므로 개질된 Mg-zeolite는 특히 극성분자들에 대한 친화도가 매우 높다. 현재까지 흡착법은 하・폐수로부터 오염물질을 제거하는 효율과 처리공정이 간단하여 경제적으로 실행할 수 있음이 증명되었기 때문에 여타의 방법에 비해 가장 타당성이 높은 방법으로 알려져 있다. 그러나 흡착법에서 일반적으로 사용되는 활성탄은 가격이 비싸고 대부분 재생이 되지 않는다는 단점이 있다. 그러나 개질한 Mg-zeolite는 고농도의 NaCl로 세척한 후 100℃에서 건조하면 다시 재사용할 수 있고, 환경친화적인 응집제로 사용되고 있는 chitosan ($1-3/kg USD) 또는 흡착제로 많이 사용되고 있는 활성탄($0.8-2/kg)과 비교하면 $0.2-1.0/kg으로 저렴하여(Abidi et al., 2015) 매우 경제적이다.
Mg-zeolite를 이용하여 염색공장폐수를 처리한 결과는 아래와 같다
1) Colour, SS, TN 그리고 TP는 20 mg/L Mg-zeolite의 양에서 각각 100% 높은 제거율을 나타내었다. 2) COD와 BOD는 30 mg/L의 Mg-zeolite의 양에서 100%의 제거율을 나타내었다. 3) 염색공장폐수에서 1 mg/L의 Mg-zeolite는 11.6의 colour, 9.5 mg/L SS, 45 mg/L의 COD, 12.7 mg/L의 BOD, 0.91 mg/L의 TP 그리고 2.25 mg/L의 TN을 제거할 수 있었으며 적은 양으로 COD를 가장 많이 제거할 수 있었으며, 1 mg/L의 TP를 제거하는데 가장 많은 Mg-zeolite의 양이 필요했다. 4) 따라서 Mg-zeolite 흡착제는 고농도의 COD, SS 그리고 BOD을 함유하고 있는 하・폐수 처리에 적합하며, 적은 양으로 고효율의 흡착효과를 나타내어 하・폐수처리의 처리비용을 절감할 수 있다.