국내에서는 2012년 이후부터 T-P의 배출허용기준을 최대 0.2 mg/L까지 강화하여 규제하고 있다. 이와 관련해 강화된 방류수 수질기준의 총인 농도를 준수하기 위하여 공공하수처리시설에 신규시설, 기존시설 개량 및 보완 등을 통해 인 처리를 위한 시설이 설치되어 운영되고 있으며 계속적인 인 처리 시설 설치 사업이 진행 중에 있다(Yu et al., 2012). 하수에서의 인 제거방법에는 생물학적 처리방법, 화학적 처리방법, 그리고 두 방법을 병행한 방법이 있다. 이 중 생물학적 처리 방법은 하수처리에 함유된 인을 제거하기 위해 광범위하게 이용되나 미생물에 흡수되어 제거 가능한 인의 양에는 한계가 있어 대략 1 mg/L의 농도를 생물학적 처리방법에서 획득 가능한 한계 농도로 보고 있다(Park et al., 2011). 따라서 더욱 낮은 농도의 인 제어를 위해 생물학적 방법을 사용한 후 화학적 처리방법을 주로 이용한다. 응집처리는 화학적 처리방법 중 가장 대표적인 처리방법으로 수중에 함유된 인과 응집제가 결합시켜 고액분리가 용이하게 한 후 제거하는 방법이다(Han and Kang, 2010; Kim, 1996).
국내외적으로 하수처리장 유출수의 인의 농도규제가 더욱 강화하는 추세를 만족하기 위해서는 수중에 함유된 인의 존재형태에 대한 분석이 선행되어야 하며 이에 따른 적절한 처리방법이 시급하다고 보고하고 있으며 인의 처리농도를 더욱 낮추기 위한 연구가 진행되고 있다(Barbusinski and Fajkis, 2011; Gu et al., 2011; Neethling et al., 2008). 그러나 응집에 대한 국내 연구들은 대부분 알루미늄계 응집제를 이용한 주입량 및 주입된 응집제의 가수분해분포의 영향 등 최적운전조건만 도출하고자 시도한 연구가 대부분이며(Han and Moon, 2012; Moon and Han, 2012), 응집처리를 이용한 인의 존재형태별 제거효율에 대한 연구는 찾아보기 어렵다.
수중에 함유된 총인은 용존성 인과 입자성 인으로 함유하고 있다. 여과 여부에 따라 DTP(Dissolved Total Phosphorus)와 STP(Suspended Total Phosphorus)로 나누어지며, 분석방법에 따라 RP(Reactive Phosphorus), HP(acid-Hydrolyzable Phosphorus), OP(Organic Phosphorus)로 구분된다. 입자성 인의 제거는 비교적 용이하나 용해성 인 중 반응성 인을 제외한 용존 유기인(DOP: Dissolved organic phosphorus)등은 화학적 처리공정 후에도 유출수에 함유되어 배출된다(Sattayatewa et al., 2011). 국내 하수처리 유출수의 함유된 인의 존재형태 분석에 대한 연구에 의하면 총인의 86%가 용존성 인이고 14%는 입자성 인으로 존재하며 용존성 인에는 유기인 및 무기인의 형태가 모두 존재하며 무기인의 형태는 대부분 정인산 인(ortho-p)을 나타내고 나머지는 유기 인으로서 존재한다(Woo et. al., 1993). 총인 중에서 약 21% 정도가 대부분 용존 유기 인으로 이루어져 있는 비 반응성 인이라고 보고되고 있다(Choi and Lee, 2007).
비 반응성 인의 처리를 위하여 비 반응성 인을 산화하여 반응성 인으로 전환시킨 후 응집 처리하는 방법들이 시도되고 있다고 보고하고 있다(Lau et al., 2001). 비 반응성 인을 반응성 인으로 전화시키기 위하여 Fenton 산화반응 후 응집하거나 오존산화 후 응집시키는 방법들이 시도되었으나 pH 조절, 슬러지 발생량 및 낮은 제거효율 등의 문제로 실제 적용하기에는 제한적인 요소가 있다(Cho et al., 2004; Xu et al., 2011). 난분해성 물질을 함유한 폐수처리에서 철 응집 후 H2O2를 주입하여 오염물질 제거효율이 상승된 결과들이 다수 보고되고 있다(Peres et al., 2004; Aziz et al., 2010). 최근 하수에 함유된 총인의 처리를 위해 FeCl3를 사용한 응집과 FeSO4을 사용하여 응집 후 H2O2 주입을 순차적으로 적용하여 총인의 처리효율을 비교한 결과 FeSO4을 사용한 후 H2O2 주입 후 2차 응집에 의해 총인의 제거효율이 상승하고 처리비용도 유사하다고 보고하였다(Li et al., 2009). 그러나 총인의 제거효율 중 비 반응성인을 포함한 인의 존재형태에 따른 제거효율과 응집 시 발생되는 응집 플럭의 크기 및 생성속도 등에 대한 연구는 미미한 실정이다.
따라서 본 연구는 철 응집에 의한 인의 존재형태 별 처리 효율을 살펴보고 철 응집 후 H2O2의 주입효과를 비교분석하여 이때 발생되는 응집 플럭의 성장속도 및 크기 분포를 파악하여 처리효율과의 상관관계를 도출하는 것에 목적이 있다.
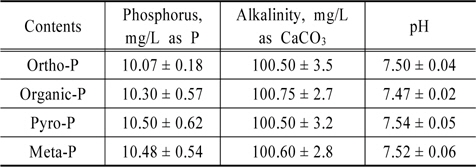
실험에 사용되는 인공하수의 알칼리도는 Na2CO3를 사용하여 평균농도를 100 mg/L (as CaCO3)로 조절하였으며 인의 농도는 10 mg/L로 조제하여 수행하였다. 실험에 사용된 유기인(C3H7O6P-Na2)은 (Kanto Chemical Co.) 5 수화물, 메타인(Na3O9P3)은 (Kanto Chemical Co.) 3 수화물, 그리고 피로인(Na4P2O7)은 (Junsei Chemical Co.) 10 수화물을 사용하였다. 조제한 인공폐수의 성상은 Table 1에 나타내었다.
[Table 1.] Characteristics of artificial wastewater
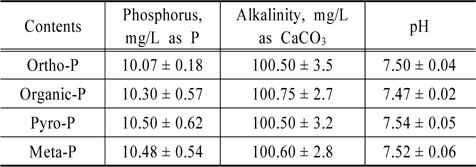
Characteristics of artificial wastewater
철염의 응집효율을 파악하기 위하여 철염응집제(FeSO4·7H2O)는 실험직전에 용해농도 10%로 제조하여 필요에 따라 Fe/P의 몰비를 1~4 범위로 주입량을 조절하여 실험하였다. 교반강도 G를 500(sec−1)로 고정하여 60 초 동안 급속혼화 후 상등액을 취하여 0.45 μm filter를 통과한 여액의 인의 농도를 측정하여 처리효율을 분석하였다. 실험에 사용된 Jar는 6 개의 paddle을 가진 표준 Jar-tester를 이용하였다. paddle의 크기는 25.4 × 76 mm의 장방형이며, 교반장치는 tachometer와 조정장치가 부착되어 회전수를 조절할 수 있도록 구성되었고, 크기는 W 115 × L 115 × H 210 mm 이다.
실험은 Fe/P의 몰비를 1~4 범위에서 단계적으로 증가시켜 철염 응집제 주입량이 인의 존재형태별 제거효율에 미치는 영향을 살펴보았다. H2O2의 주입 효과를 살펴보기 Fe/P의 몰비를 고정하여 철염 응집제를 주입하여 30 초 급속혼화 후 H2O2를 주입하여 30 초 급속혼화 후 상등액을 취하여 0.45 μm filter를 통과한 여액의 인의 농도를 측정하여 처리효율을 분석하였다. 철 응집 시 H2O2 주입 시점이 인산염의 제거에 미치는 영향에 관한 연구결과에 따라 최대 제거율을 나타낸 철 응집 후 H2O2 주입 방법에 따라 수행하였다(Park and Moon, 2013). 각 운전조건에서 발생되는 응집 플럭의 크기 및 성장속도는 iPDA-100 (EcoNovel)을 사용하여 연속적으로 생성되는 floc의 크기를 FSI (floc size index)값으로 측정하였다.
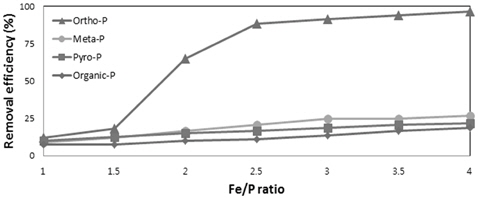
Fig. 1에는 철 응집제 주입량이 인의 존재형태별 제거효율에 미치는 영향을 나타내었다. 철 응집제의 주입량이 증가할수록, 즉 Fe/P의 몰비를 증가할수록 인산염인의 제거효율을 상승되었다. 그러나 정인산 인을 제외한 비 반응성 인인 메타인, 피로인, 유기인의 제거효율은 Fe/P의 몰비를 증가시켜도 제거효율의 상승폭은 높지 않았으며 최대 25%의 제거율을 나타내었다.
철 응집에 의한 비 반응성 인들의 제거효율은 메타인, 피로인, 유기인순으로 제거효율이 높은 것으로 나타났으나 제거율의 차이는 많지 않았다. 따라서 정인산 인을 제외한 비 반응성 인들은 철 응집만으로는 인 제거가 용이하지 않음을 확인할 수 있었다. Al 염을 이용한 정인산 인과 메타인의 응집에 대한 연구에서 정인산인의 제거효율이 메타인의 제거효율 보다 높게 나타났으며 이는 정인산에 함유된 인의 분자 당 음전하가 높고 정인산 인의 이온의 크기가 작아 응집이온과 결합력이 높은 이유라고 설명하였다(Georgantas and Grigoropoulou, 2007). 즉 인을 함유한 분자 당 음전하가 낮고 인을 구성하는 물질의 이온의 크기가 큰 비 반응성인들은 응집제와의 반응이 비교적 용이하지 않아 제거율이 낮음을 알 수 있다.
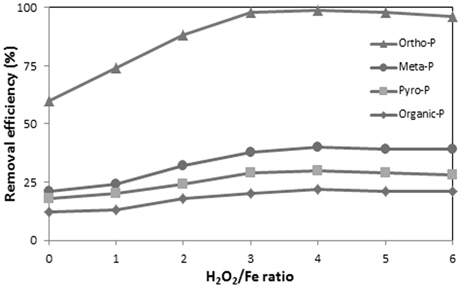
철 응집제 주입 후 H2O2의 주입량에 따른 영향을 파악하기 위하여 철 응집에 의해 비교적 인의 제거효율이 낮았던 Fe/P의 몰비 2에서 H2O2 주입량을 변화시켜 인의 제거효율을 살펴보았다. Fig. 2에 나타난 바와 같이 H2O2/Fe의 몰비가 증가할수록 제거효율이 높아져 정인산 인의 경우 H2O2/Fe의 몰비 3 이상에서는 대부분의 정인산이 제거되는 것으로 나타났다. 그러나 비 반응성 인들의 경우에는 H2O2/Fe의 주입 몰비가 증가할수록 제거율은 상승하였으나 제거효율은 높지 않은 것으로 나타났다.
H2O2/Fe의 몰비가 4 이상에서는 인산염 인을 비롯한 비반응성의 제거율이 유지되거나 오히려 감소하는 경향을 나타내었으며 이는 철 응집제에 비해 과량의 H2O2가 주입되면 철 응집제는 응집반응에 이용되는 것보다 OH라디칼 생성에 의한 산화반응인 펜톤산화 반응의 촉매로 작용하게 되므로 결과적으로 응집효율의 저하를 나타난 것으로 사료된다. 또한 과량의 H2O2의 주입은 기포형성으로 인해 플럭의 생성 및 침전을 방해하는 것으로 관찰되었다. H2O2의 적정 주입량은 H2O2/Fe의 몰비 4 로 나타났다.
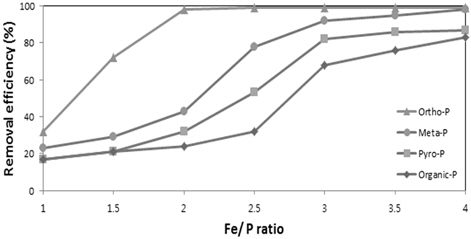
Fig. 3에는 철 응집제 주입량 즉 Fe/P의 몰비를 증가시켜 주입하고 H2O2는 H2O2/Fe의 몰비를 4로 고정하여 주입하여 인의 존재형태별 제거효율을 실험한 결과를 나타내었다. Fig. 1의 결과와 비교하여 철 응집 후 H2O2를 주입하면 제거효율이 증가됨을 알 수 있으며 Fe/P의 몰비가 증가될수록 제거효율이 높게 나타났다. 철 응집 후 H2O2를 주입하였을 때 특히 메타인의 제거효율의 가장 높게 상승되었다. 메타인의 제거효율은 Fe/P의 몰비 2 이상에서 제거효율이 급격히 증가하였으며 Fe/P의 몰비가 4일 때 93%의 제거율을 나타내었다. 피로인의 제거효율은 철 응집제 주입량이 Fe/P의 몰비 2.5 이상에서 H2O2룰 주입하여야 제거효율이 급격히 증가하였다. 유기인 또한 마찬가지로 Fe/P의 몰비 2.5 이상에서 H2O2를 주입하여야 제거효율이 증가되는 것으로 나타났다. Fe/P의 몰비 4에서 응집 후 H2O2를 주입하여 2차 응집 후 전체적인 제거효율은 메타인 93%, 피로인 80%, 유기인은 78%로 나타났다. 따라서 단일 철 응집에 의한 인의 제거 효율에 비해 철 응집 후 H2O2를 주입하여 2차 응집을 수행한 결과 제거효율이 대폭 상승하는 것을 알 수 있다. 이는 철 응집 후 H2O2가 주입되면 fenton 산화반응에 의해 비 반응성 인이 반응성 인으로 변화하여 응집이 용이한 상태로 전환되며 산화작용과 함께 발생되는 Fe(III) 이온에 2차 응집반응이 더욱 촉진되어 처리효율이 증가한다는 것을 알 수 있다. 따라서 하·폐수에 함유된 인의 존재형태 따라 응집에 의한 제거효율이 변화하며 인의 제거효율을 상승시키기 위해서는 비 반응성 인을 반응성 인으로 변화시켜야 함을 알 수 있다. 이는 하수에 함유된 총인의 제거효율을 높이기 위해서는 인의 존재형태를 파악하여 응집제 및 H2O2의 최적주입량 및 운전조건을 도출할 필요가 있음을 나타낸다.
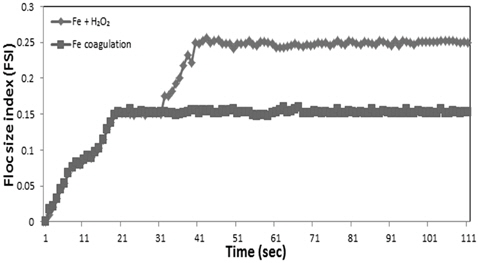
Fig. 4에는 iPDA를 사용하여 정인산 인의 응집 반응 시 생성되는 플럭의 크기를 FSI 값으로 측정한 결과를 나타내었다. Fe/P의 몰비 3의 운전조건에서 철 응집만을 수행한 경우에는 응집 플럭의 크기는 초기에 증가한 후 약 20초 후에는 정상상태에 도달하여 FSI의 값이 0.15로 일정하게 유지되는 것으로 나타났으며 30초 후 H2O2를 H2O2/Fe의 몰비 4로 주입하여 2차 응집 시 응집 플럭의 크기가 더욱 상승하여 약 50초 이후에 정상상태에 도달하여 FSI 값이 0.25를 유지하였다.
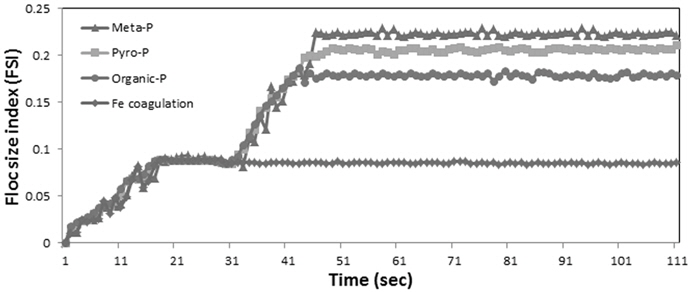
Fig. 5에는 정인산 인과 동일한 운전조건에서 비 반응성 인인 메타인, 피로인, 유기인의 응집 플럭 형성변화를 나타내었다. 철 응집만 하였을 경우 정인산 인의 응집 시 발생되는 응집 플럭의 성장속도에 비해 비 반응성 인의 응집 플럭 성장속도가 늦었으며 그 크기 또한 비교적 작은 플럭들이 발생되었다. 철 응집 이후 H2O2를 H2O2/Fe의 몰비 4로 주입하여 2차 응집을 수행한 결과 비 반응성 인을 함유한 응집 플럭의 크기가 철 응집 시와 비교했을 때 비약적으로 상승하였다. 이 중 유기인의 경우 가장 먼저 정상상태에 도달하였으며 피로인과 메타인의 순으로 정상상태에 도달함을 알 수 있다. 반면에 정상상태에 도달한 응집 플럭의 크기는 메타인, 피로인, 유기인 순으로 크게 나타났다. 이는 응집 플럭의 크기가 클수록 제거효율 또한 높게 나타남을 알 수 있다. 철 응집에 과산화수소 주입이 높은 제거율을 보이는 것은 철 응집 후에는 비 반응성 인과 결합되지 않은 철 이온이 잔존하게 되는데, 이때 H2O2가 주입되면 잔존하는 철 이온과 반응하여 fenton 산화 반응에 의해서 발생된 OH 라디칼이 비 반응성인을 반응성인으로 변환시킨다. 변환된 반응성 인은 응집에 유리한 상태 되며 산화작용과 함께 발생되는 Fe(III)에 의한 2차 응집 반응으로 응집 플럭의 크기 및 성장 속도가 증가하게 된다. 이로 인해 응집에 상승효과가 나타나므로 고액분리가 용이하게 되어 처리효율이 증가하게 됨을 알 수 있다. 이는 난분해성 물질을 함유한 침출수 처리에서 철 응집 후 H2O2 주입으로 2차 응집을 발생시켜 응집력이 높아져 난분해성 물질의 제거효율이 상승한 연구(Yoon et al., 2002)와 유사한 결론을 나타낸다.
따라서 응집반응성이 낮은 비 반응성인의 제어를 위해서는 반응성이 높은 반응성인의 존재형태로 변환시켜 응집처리하여야 응집 플럭의 크기 및 성장속도를 증가시켜 인의 제거 효율을 높일 수 있음을 알 수 있다.
본 연구는 인의 존재형태별 제거특성을 파악하기 위해 실시하였으며 이를 위해 철 응집의 영향, 철 응집 후 H2O2의 주입에 따른 영향 및 응집플럭 특성평가를 진행한 결과 다음과 같은 결론을 얻을 수 있었다.
1) 철 응집에 의한 정인산염 인의 제거효율은 철염응집제 주입량 즉 Fe/P 몰비가 증가할수록 제거효율이 상승하였으며 Fe/P의 몰비 4에서 약 97%의 제거율을 보였다. 반면에 정인산 인을 제외한 비 반응성 인들은 Fe/P의 몰비를 증가시켜도 제거효율은 최대 25%이하로 낮았으며 메타인 > 피로인 > 유기인의 순으로 제거가 용이한 것으로 나타났다.
2) H2O2의 최적주입량은 철염응집제를 Fe/P의 몰비 2로 주입하여 응집반응 후 H2O2를 주입하여 2차 응집을 수행한 결과 정인산인의 경우는 H2O2/Fe 몰비 3에서 비 반응성 인들은 몰비 4에서 가장 높은 제거효율을 나타내었다.
3) 철염응집제의 Fe/P의 몰비 주입량을 변화시켜 응집반응 후 H2O2의 주입량을 H2O2/Fe의 몰비 4로 고정하여 2차 응집을 수행한 결과 정인산염 인은 Fe/P의 몰비 2 이상에서부터 99%이상의 제거율을 보였으며, 비 반응성인들의 경우 Fe/P의 몰비 2, 2.5, 3 이상에서 급격한 제거율의 상승이 나타나 Fe/P의 몰비 4에서 메타인(95%) > 피로인(82%) > 유기인(78%)의 순으로 제거효율이 높게 나타났다.
4) 철염 응집제 주입량 Fe/P 몰비 3에서 정인산 인에서 발생되는 응집플럭의 크기는 FSI값으로 0.16을 나타내었으며 H2O2 주입량을 H2O2/Fe의 몰비를 4로 주입한 결과 응집플럭의 크기는 FSI 값으로 0.25로 크게 성장되었다. 동일한 운전 조건에서 비 반응성 인들의 응집플럭의 크기를 FSI 값으로 나타낸 결과 메타인(0.22) > 피로인(0.20) > 유기인(0.16)의 순으로 나타나 제거효율이 높을수록 큰 응집 플럭이 발생되는 것으로 나타났다.