최근 들어 여주의 혈당개선의 약리학적 효능이 보고됨에 따라 기능성 채소로 각광받고 있다. 주로 여주 과실만이 식용으로 쓰이지만 여주씨 또한 다양한 가공과정을 거칠 경우(건여주 혹은 건조분말, 환, 엑기스 등) 필연적으로 함께 섭취되기도 한다. 본 연구에서는 과실이외의 특히, 연구결과가 미비한 여주씨에 대해 생리활성물질의 구명 및 혈당개선의 효과에 대한 연구를 수행하였다. 다양한 추출물 및 단일 활성성분의 혈당개선 in vitro검증법인 α-glucosidase에 대한 저해효과를 측정하였고, 활성을 나타내는 추출물 또는 활성성분과의 상관관계를 구명하였다. 구체적으로는 95% 에탄올 추출물 및 비극성 용매 등에 다량 추출되는 생리활성물질인 α-eleostearic acid는 우수한 저해효과를 나타내었다(IC50=43.4 μg/mL). 또한 효소저해제의 함량을 HPLC를 통한 정량분석을 수행함으로써 여주씨에 함유된 기능성성분의 혈당개선 식의약 소재로의 응용가능성을 연구하였다.
The seeds of MC were extracted into five different polarity solvents: 30%, 50%, 70%, 95% ethanol and distilled water. The 95% ethanol extract showed the most potent inhibition (IC50=88.7μg/mL) against α-glucosidase. To investigate the compounds responsible for this effect, activity guided fractionation of MC seeds by chromatography yielded two phytochemicals which were confirmed as vicine (1) and α-eleostearic acid (2) based on their NMR and ESI-MS spectroscopic data. Among them, α-eleostearic acid (2) possessed potent α-glucosidase inhibitory activities with IC50 values from 32.4μg/mL.
Collectively, the results from this present study strongly suggest that both extract and α-eleostearic acid (2) have potent α-glucosidase inhibitory activity. Furthermore, α-eleostearic acid (2) as the most active α-glucosidase inhibitor was proven to be present in high quantities in the MC seeds by a HPLC chromatogram.
여주(
여주에서 다양한 생리활성을 나타내는 성분들이 보고되고 있는데, 구성성분으로는 essential oil, flavonoid, phenolic acid, triterpene 및 alkaloid 등이 알려져 있다(Liu
최근 경제성장과 생활수준의 향상으로 한국인의 식생활이 서구화로 변모됨에 따라 비만인구의 증가로 인한 당뇨환자가 급격히 증가하면서 사회적 문제로 대두되고 있다. α-glucosidase는 소장에 존재하는 당분해효소로서 그 저해제는 탄수화물의 포도당으로의 소화를 지연시킴으로써, 결국 식후의 혈당치를 감소시키는 역할을 한다(Maki
따라서 본 연구는 국내에서 재배된 여주에 들어있는 여주씨 추출물의 α-glucosidase 저해효과를 측정하고 함유된 기능성물질과의 상관관계를 알아보고자 하였다. 또한 효소저해제의 함량을 HPLC를 통한 정량분석을 수행함으로써 여주씨에 함유된 기능성성분의 혈당개선 식의약 소재로의 응용가능성을 연구하였다.
실험에 사용한 α-glucosidase (EC 3.2.1.20, from Baker’s Yeast)와 기질(
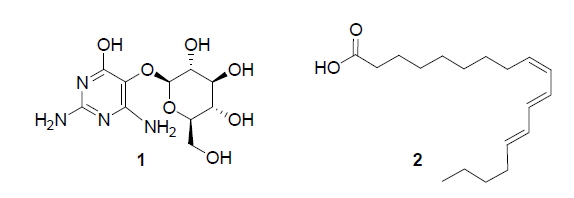
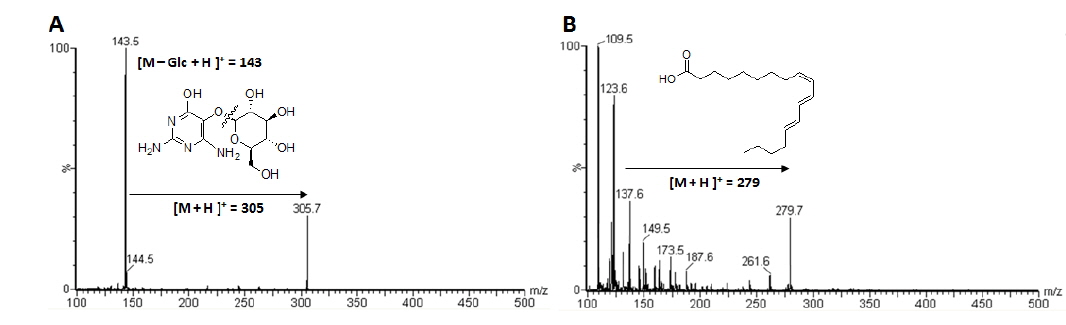
본 실험에 사용한 여주씨는 함양영농조합법인에서 2014년 9월에 제공받은 여주과실을 수세하여 과육과 완숙된 씨를 분리한 다음 여주씨를 동결건조 한 후 최종 분쇄하여 사용하였다. 본 추출에 앞서 증류수, 30%, 50%, 70% 에탄올 및 95% 에탄올 등으로 추출을 실시하여 α-glucosidase 저해활성을 비교한 결과 가장 높은 억제효과를 가진 95% 에탄올 추출물을 생리활성물질의 분리를 위한 추출 용매로 결정하였다. 분리를 위해 여주씨 분말 200 g을 95% 에탄올에 1일간 침적시키고 추출된 여액을 감압, 농축하여 건조된 추출물 10 g을 얻었다. 얻어진 95% 에탄올 추출물을 헥산(2 L×2)/물(1 L)로 분배 추출 후 물층에 대하여 역상 크로마토그래피 및 재결정법을 이용하여 고순도의 vicine (1)을 분리 하였으며, 상기의 방법으로 분리된 화합물은 HPLC-ESI/MS, 1H and 13C NMR 등의 기기분석을 통한 정성분석으로 화학적 구조를 밝혔다. 이 후 헥산층에 대하여 silica gel CC를 실시하여(헥산-에틸아세테이트=20:1→1:1) 7개의 분획물(A-G)을 얻었다. 그 중 TLC에 전개시켜 UV흡수가 약하게 있고, 10% 황산을 분무, 건조 한 후 발색한 결과 갈색으로 발색된 분획물 C에 대해 sephadex LH-20의 CC를 통한 선택적인 정제 과정을 거쳐 지표수준의 고순도 eleostearic acid (2)를 분리하여 HPLC-ESI/MS 및 GC-EI/MS를 통해 표준물질과 비교하여 정성분석 하였다(Fig. 1).
Vicine (1): White powder; ESI-MS
α-Eleostearic acid (2): Colorless oil; ESI-MS
분석시료 조제를 위한 추출은 건조분말시료 1 g을 cornical tube에 칭량하여 30 mL의 에탄올(30%, 50% 70%, 95%) 및 증류수를 추출용매로 하여 50℃에서 1시간동안 초음파추출(sonication) 하였다. 추출된 각 시료를 원심분리(3000 rpm, 15 min)를 한 후 상층액을 취하여 0.2 μm PTFE syringe filter로 여과하여 이를 HPLC-MS 분석시료로 사용하였다. 분석 컬럼은 Phenomenex hydro-RP C18, 80A (250×4.60 mm, 4 micron, Phenomenex, Torrance, CA, USA)를 사용하였고 시료 주입량은 10 μL, 검출파장은 270 nm에서 측정하였다. 이동상으로는 A용매(0.5% formic acid in water)와 B용매(0.5% formic acid in acetonitrile)를 사용하였고, 유속은 0.8 mL/min로 하였다. 이동상의 농도구배조건은 B용매를 10분까지 4%로 일정하게 유지하였고, 32분까지 90%로 일정하게 증가시킨 후 37분까지 컬럼 세척(B, 100%)과 40분까지 B용매 0%로 급격하게 감소시켰다. 정량분석을 위한 표준용액의 제조는 0.01, 0.05, 0.1, 0.5, 1 mg/mL로 각각 조제하여 검량선을 작성한 후 계산된 함량으로 나타내었다. 여주씨의 생리활성물질의 정성분석을 위한 MS의 분석조건은 cone voltage 30 V, source temperature 120℃, desovation temperature 350℃, 고순도 N2 가스 L/h이었으며, 분자량 측정범위는
α-glucosidase 저해활성은 합성기질인 1 mM
Inhibition rate (%)=[1-(Abssample-Absblank)/Abscontrol]×100, Abssample, blank, and control: Absorbance of the sample, blank, and control
실험에서 얻어진 결과의 통계적 유의성은 SPSS (statistical package for social sciences, Version 10.0, Chicago, USA)를 이용하여 모든 값은 mean±SD 값으로 나타내었고, 각 농도의 평균치의 통계적 유의성을
여주씨 분말 500 g을 에탄올로 침지하여 얻어진 추출물에 대하여 용매의 극성에 따라 클로로포름(chloroform)과 물층으로 분획하고 각각 농축하여 2개의 분획물을 얻었다. 각각의 분획물에 대해 순상, 역상 및 sephadex LH-20 CC를 반복실시하여 2종의 화합물을 분리하였다.
화합물 1은 백색의 분말형태로서 ESI/MS에서
화합물 2는 무색의 오일(oil) 형태의 클로로포름에 잘 용해되는 지용성의 물질로 ESI/MS에서
여주씨에서 주요성분을 정량하기 위한 HPLC 분석조건을 검토한 결과에서 Fig. 2에서와 같이 Phenomenex hydro-RP C18 (250×4.60 mm, 4 μm, 80Å)의 입도(paticle size)가 작은 역상(C18)컬럼을 사용하였을 때 vicine, α-ESA 등 주요 생리활성성분의 분리능이 양호하였다. 본 연구에서는 여주씨의 에탄올 추출농도별에 대한 주요성분의 함량을 분석하기 위해 상기의 두 성분을 지표성분으로 최종 설정하여 표준정량곡선을 작성하였다. 최적의 HPLC 분석조건하에서 얻어진 표준정량곡선에서는 vicine (1), α-ESA (2) 성분이 10, 50, 100, 500, 1000 μg/mL 농도 범위에서 회귀식이 각각
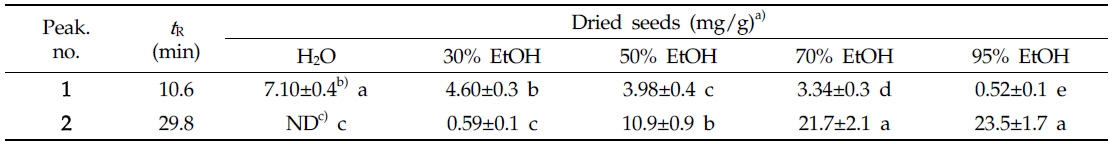
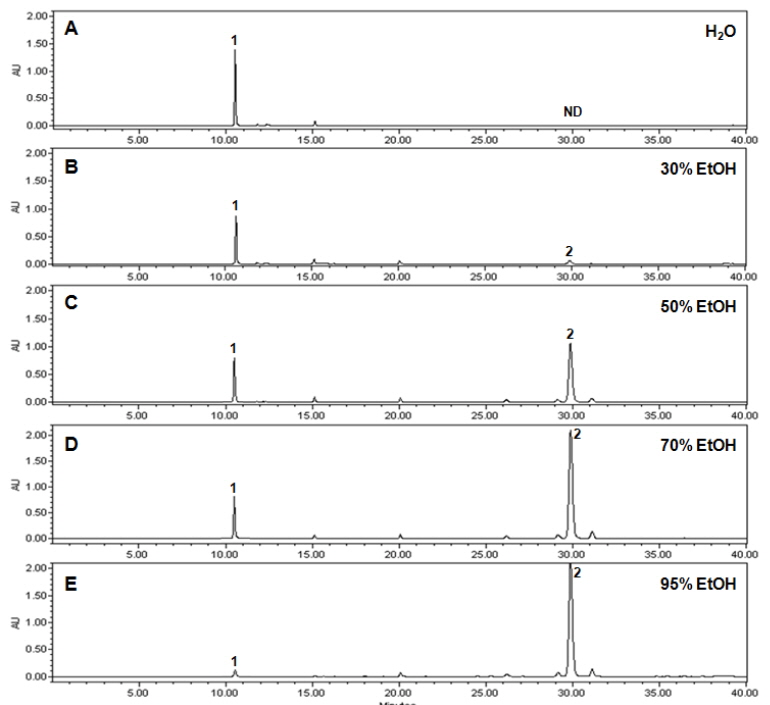
에탄올의 농도를 달리하여 여주씨의 추출물을 제조한 후 각 추출물의 지표성분 함량을 분석한 결과는 Table 1과 같았다. 추출수율이 가장 높았던 70% 에탄올 추출물 중 vicine, α-ESA 함량은 각각 3.34±0.3, 21.7±2.1 mg/g이었다. vicine (1)의 경우 물, 30%, 50%, 70%, 95% 에탄올 추출물까지 각각 7.10±0.4, 4.60±0.3, 3.98±0.4, 3.34±0.4, 0.52±0.1의 함량을 나타내었으며, 극성도가 증가할수록 다량 추출되었고 95% 에탄올 추출물에서는 그 함량이 현저히 줄어들었다. 반면 α-eleostearic acid (2)의 경우 에탄올 농도별 추출물은 각각 ND(검출안됨), 0.59±0.1, 10.9±0.9, 21.7±2.1, 23.5±1.7의 함량을 나타내었고 특히, 50% 에탄올 이상의 지용성물질의 추출조건에서 그 함량이 지속적으로 증가하였다. 이러한 경향은 vicine 성분의 추출은 95% 에탄올보다는 극성이 훨씬 높은 물 추출 혹은 70% 에탄올 이하의 폴라(polar)한 조건에서 추출하는 것이 성분 용출에 더 용이함을 시사하고 있으며, 동일한 추출 조건에서 α-eleostearic acid는 95% 에탄올 추출물의 함량이 23.5±1.7으로 가장 높은 것으로 보아 50% 에탄올 이상의 non-polar한 조건에서 추출하는 것이 성분 용출에 더 용이함을 확인할 수 있었다(Fig. 3). 이상의 결과를 토대로 추출수율과 지표성분의 함량을 고려할 때, α-glucosidase에 저해활성을 나타내는 여주씨 분말 시료에 대한 최적의 추출조건은 α-eleostearic acid 성분이 다량 추출되는 조건인 95% 에탄올의 조건인 것으로 판단된다.
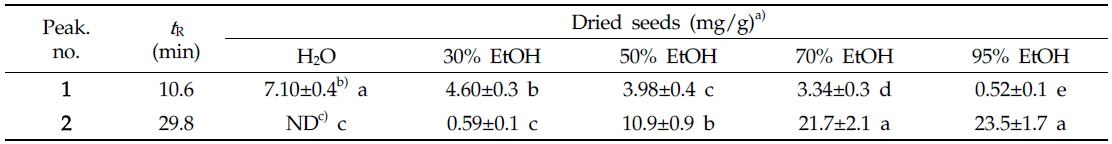
The contents of vicine (1) and α-eleostearic acid (2) in various extracts from the seeds of Momordica charantia
에탄올 농도별에 따른 다양한 여주씨 추출물 및 주요성분의 α-glucosidase 저해활성은 Table 2에 나타내었다.
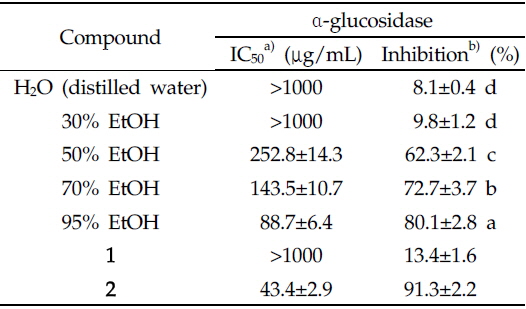
Inhibitory effects of the seed extract of Momordica charantia using different solvents and vicine (1) and α-eleostearic acid (2) on α-glucosidase inhibitory activities
Vicine(1)은 극성도가 매우 높은 물질로서 α-glucosidase에 대해 1000 μg/mL의 측정농도에서 저해율이 13% 이하로 목표효소에 대한 저해효과를 나타내지 못했다. 반면 α-eleostearic acid (2)는 활성이 기대되는 non-polar한 물질로서 동일한 측정농도에서 저해율 90% 이상의 강력한 저해 효과를 나타내었다. 또한 농도 의존적으로 α-glucosidase를 저해하였으며, IC50값은 43.4 μg/mL으로 α-glucosidase의 치료제 및 대조약물로 사용되는 DNJ (IC50=124 μg/mL)보다 약 3배 가까이 우수한 저해효과를 확인하였다. 따라서 여주씨 추출물에서 저해효과가 가장 우수한 95% 에탄올 추출물 및 그 속에 다량 함유된 생리활성물질인 α-eleostearic acid는 α-glucosidase 저해 효과에 중요하게 기여하고 있음을 나타내며, 식후의 혈당 상승을 억제시켜 줄 수 있는 잠재력이 있음을 확인하였다.