The current study purposed to analyse the dissipation levels of a neonicotinoid insecticide and clothianidin in paddy and upland soils and clarify the effects of soil moisture on degradation and persistence of the insecticide.
In order to achieve the research purposes, clothianidin 8% SG was applied to the paddy and upland fields at the rate of 0.024 kg a.i./10a, while the analytical standard was treated at 0.25 mg/kg soil under laboratory conditions.
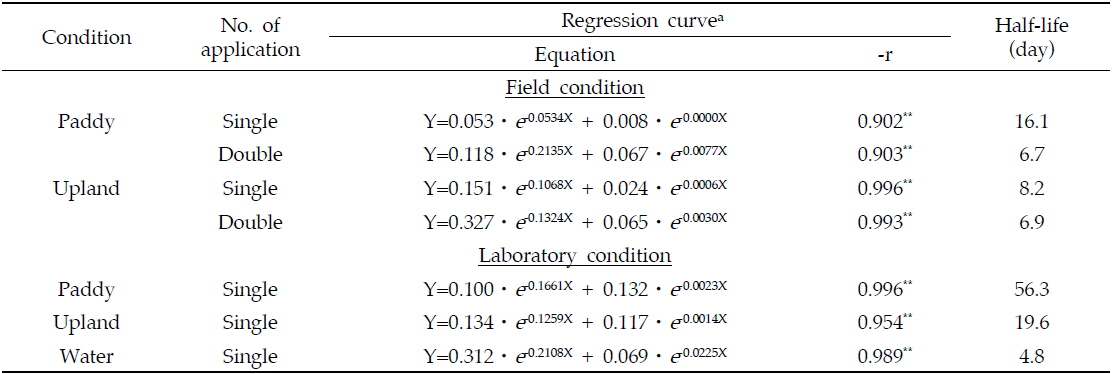
Based on the multiple first-order kinetics, total clothianidin in soils was dissipated with DT50 of 6.7-16.1 and 6.9-8.2 days in the paddy and upland fields, respectively, whereas the figures under the laboratory condition became larger showing 56.3 and 19.6 days.
As affected by soil moisture, some differences in degradative pathways were observed. Flooding of soil caused evidently demethylation and delayed cyclization of a major metabolite, thiazolylmethylguanidine (TMG) and methylaminoimidazole(MAI), compared to the aerobic upland condition. More than 80% and 50% of the parent compound was dissipated by the 24th day after the final application in both soils and, transformation products had constituted most of soil residues after that.
환경 중 농약 잔류성에 영향을 미치는 것으로는 농약 자체의 극성, 해리성, 휘발성 등 농약 화합물 고유의 물리 화학적 특성과 작물체 표면에서의 부착성 및 고착성 등 제형에 관련된 물리적 특성, 그리고 농약의 사용방법 등이 있으며 이들 요소들의 관여 정도에 따라 잔류성에 상당한 차이를 보인다(Barbero and Gaia, 1979; Sukhendu
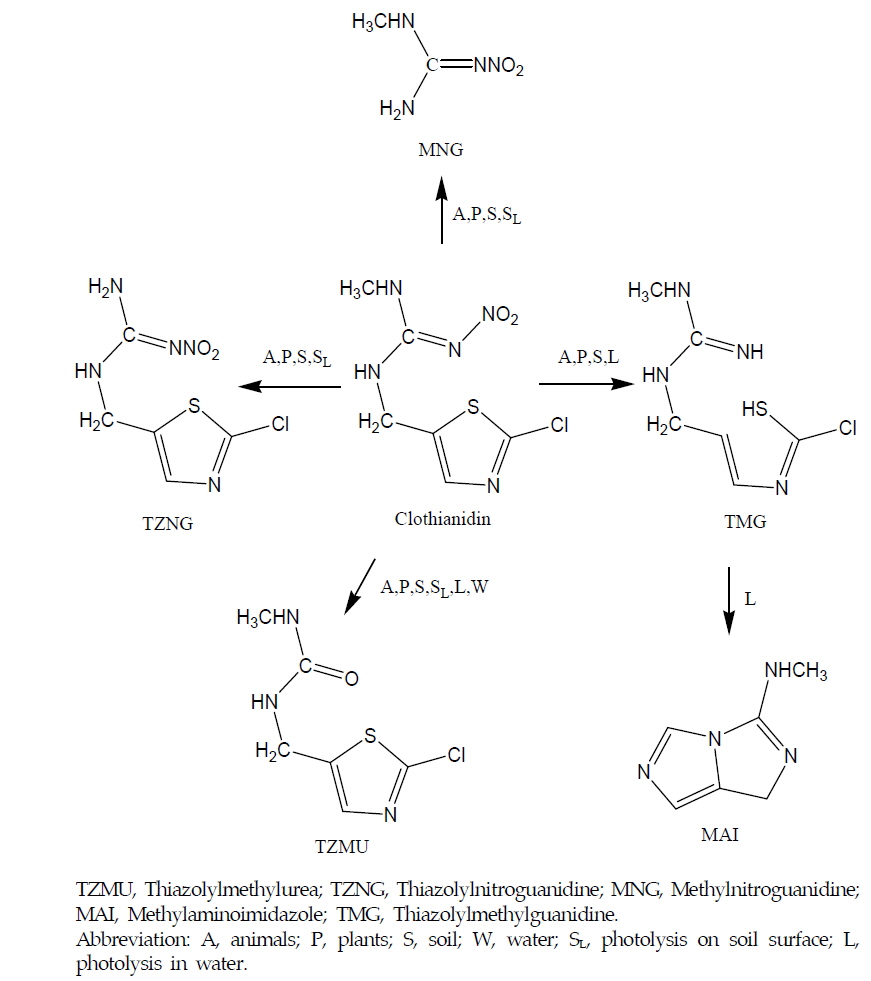
Clothianidin은 Neonicotinoid 계통의 살충제로서 넓은 살충범위와 다양한 적용작물 그리고 제형으로 만들기 쉬운 실용적인 물리 화학적 특성을 나타낸다(Tomlin, 2009). 국내에서는 현재 액상수화제(Suspension Concentrate, SC), 입제(Granule, GR), 수용성입제(Soluble Granule, SG), 수화제(Wettable Powder, WP) 등이 상용화되어 있다 (KCPA, 2012). 국내 작물별 최대잔류허용량(Maximum Residue Limit, MRL)은 감 등 41개 농산물 또는 농산물 그룹에 기준이 설정되어 있다 (MFDS, 2013). Clothianidin의 우수한 살충력과 다양한 실용성으로 인하여 매년 국내에서 지속적인 사용량을 나타내고 있으며 (KCPA, 2012), 이에 따라 Clothianidin에 대한 국내 재배환경에서의 행동과 행적에 대한 연구가 절실하다. 현재까지 Clothianidin의 동식물 및 환경 중 주요 대사과정에 대하여 단편적으로 연구된 바를 요약하면 동식물 및 토양 중에서는 대사산물 Thiazolylmethylurea(TZMU), Thiazolylnitroguanidine(TZNG), Thiazolylmethylguanidine(TMG), Methylnitroguanidine(MNG)가 생성되며, 물 중 광분해에서는 TZMU, TMG가 생성되며 TMG는 다시 Methylaminoimidazole(MAI)가 생성된다 (Hideki et al., 2006; FAO report, 2010) (Fig. 1). 이렇게 생성된 대사산물들은 다시 동, 식물체 및 환경중에 존재하는 동안 다양한 대사과정을 거쳐 분해 소실되어지지만, 국내 농업환경 중 Clothianidin의 행동 및 잔류성에 관한 연구는 현재까지 없는 실정이어서 환경에 대한 안전성을 평가하기는 매우 어려운 실정이다. 따라서 본 연구에서는 환경 중 Clothianidin과 5가지 주요 대사산물을 분석하여, 논토양과 밭토양, 수중 및 실험실 조건에서 Clothianidin의 잔류 및 분해특성을 구명하고자 하였다.
본 연구에서 사용한 clothianidin과 주요 대사산물로 알려진 MAI, MNG, TMG, TZNG, TZMU의 표준품은 Sumitomo Chemical Takeda Agro (Japan)로부터 분양 받았으며 그 순도는 각각 99.7%, 99.0%, 99.3%, 98.9%, 100.0% 및 99.3%이었다. 이들 표준품을 각각 Acetonitrile(clothianidin, TZNG, TZMU), Methanol(MNG, MAI) 및 Deionized water(TMG)에 용해시켜 1,000 mg/L의 표준용액을 조제, 4℃에서 냉장보관 하였으며 필요시마다 일정량을 취하여 deionized water에 희석, 사용하였다. 한편 시험에 사용한 약제인 clothianidin 8% 수용성 입제는 (주)동방아그로로부터 분양받아 사용하였다.
본 연구에서 사용한 농약의 추출 및 정제용 유기용매는 잔류 분석용 또는 High-performance Liquid Chromatography(HPLC)용을, 무기 시약은 분석용 특급을 사용하였다. Solidphase extraction(SPE) Cartridge로는 SupelcleanTM LC-18 (500 mg, 3 mL, Supelco, USA)및 LC-Strong cation-exchanger(SCX) (500 mg, 3 mL, Supelco, USA)와 Hydromatrix media (ChemElutTM 20 mL, Varian, USA)는 구입 후 전용의 Vacuum manifold 장치에 장착하여 사용하였다. 또한, 본 연구에서 사용한 주요 기구 및 기기는 HPLC(Hewlett Packard 1100 series, USA), Ultraviolet-visible(UV-VIS) Scanning spectrophotometer(Shimadzu UV-2101 PC, Japan), High-speed refrigerated centrifuge(Hitachi Himac CR21, Japan) 등이었다.
논토양 잔류성 시험을 위하여 전북 익산시 망성면 장선리 488번지의 일반 벼 재배 지역의 논 1개소를 선정하여 각 20 m2 (4 m×× 5 m) 크기의 반복구를 처리별로 각각 3반복으로 시험구를 설치하였다.
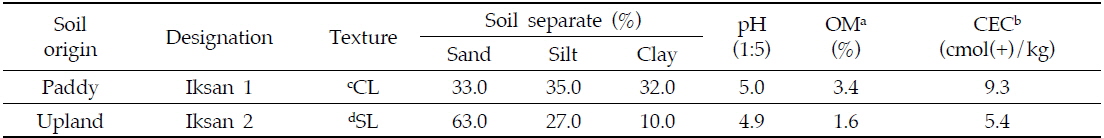
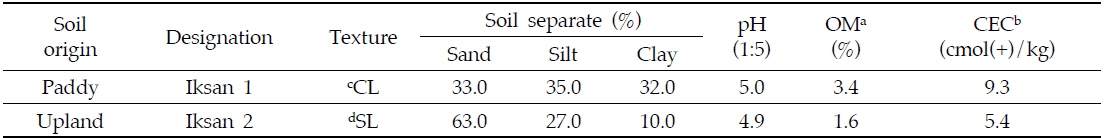
약제 처리는 관개수를 미리 유출시켜 수심 1∼2 cm로 조절한 논에, clothianidin 8% 수용성 입제를 2,000배 희석하고 배부식 분무기를 이용하여 600 L/10a (0.024 kg a.i./10a) 수준으로 수면 전면에 균일하게 살포하였다. 약제처리 후 시기별로 표층에서 10 cm 깊이로 토양시료를 5 cm 지름의 토양시료 채취기를 이용하여 반복구당 10곳에서 균일하게 채취하였으며 이때 중력수는 제거하였다. 채취한 토양은 즉시 실험실로 운반하여 잔류량 분석시료로 이용하였다. 시험에 사용된 토양의 이화학적 특성은 Table 1과 같다.
[Table 1.] Physicochemical characteristics of soils used
Physicochemical characteristics of soils used
밭토양 잔류성 시험을 위하여 논토양과 인접한 전북 익산시 망성면 장선리 489번지의 밭토양에 각 20 m2(4 m×× 5 m)의 반복구를 처리별로 각각 3반복으로 설치하였다. 약제처리는 Clothianidin 8% 수용성 입제를 2000배 희석하고 600 L/10a (0.024 kg a.i./10a) 수준으로 배부식 분무기를 사용하여 토양 전면에 균일하게 살포하였다. 약제처리 후 시기별로 표층에서 10 cm 깊이로 토양시료를 5 cm 지름의 토양시료 채취기를 이용하여 반복구당 10곳에서 균일하게 채취하였으며, 1회 채취한 토양의 양은 시험구당 약 1500 g이었다. 채취한 토양은 즉시 실험실로 운반하여 2 mm 체를 통과시킨 후 혼화하여 균질시료를 얻고 잔류량을 분석하였다. 시험에 사용된 토양의 이화학적 특성은 Table 1과 같다.
토양 중 Clothianidin의 분해양상을 구명하기 위해 실험실 조건에서 논토양 및 밭토양 시료를 다음과 같이 조제하여 시험하였다. 논토양 및 밭토양 잔류시험에 사용된 동일한 토양의 표토(표층에서 10 cm 깊이)를 채취하여 음건한 후 2 mm 체를 통과시켜 사용하였다. 공시 무처리 논토양 및 밭토양 1 kg 을 스텐제 해부용 판에 각각 균일하게 깔은 후 Clothianidin 표준용액을 0.25 mg/kg 수준이 되도록 점적처리하였다. 처리 후 균일하게 혼합하고 시험관 (40 mm i.d.×11 cm)에 30 g 씩을 달아 넣은 후 밭토양은 포장용수량의 60%에 해당하는 증류수 5.46 mL를 첨가, 혼합하여 25±2℃에서 항온 처리하였고, 논토양은 약 2 cm 높이의 담수상태가 되도록 증류수를 첨가한 다음 밭토양과 동일한 조건에서 항온 처리하였다. 약제 처리 후 시기별로 시료를 채취하고 확립된 잔류분석법에 따라 Clothianidin 및 대사산물의 잔류량을 산출하였다.
온실에서 수행되어진 수중 잔류성 시험에는 논토양 잔류시험에 사용되어진 토양의 표토를 채취하여 음건한 후 2 mm체를 통과시켜 사용하였다. 시험용 수조 (30 cm × 20 cm × 20 cm)에 시험토양을 3 cm 높이로 채우고 지하수를 가한 다음 토양을 저어 써레질한 후 물 표면의 부유물을 제거하고 지면을 고른 다음 수심이 5 cm가 되도록 지하수를 주가(注加)한 후 실내에서 3일간 안정화시켰다. 안정화 기간 중 물표면에 부유하는 유기물은 수시로 제거하였다. 시험약제는 Clothianidin 8% 수용성 입제(SG)를 2000배 희석하고 600 L/10a (0.024 kg a.i./10a) 수준으로 시험포트에 처리하였다. 약제 처리 후 원래의 물높이로 증류수를 보충하고 시기별로 수질시료 및 토양시료를 채취, 확립된 잔류분석법에 따라 Clothianidin 및 대사산물의 잔류량을 측정하였다.
Clothianidin, MAI, MNG, TZNG 및 TZMU의 경우 토양시료 50 g에 증류수 50 mL를 가하여 10분간 습윤화하였다. 토양시료에 0.1M NH4OH 메탄올 용액 100 mL를 가하고 250 rpm에서 1시간 동안 진탕한 후 rpm에서 30분간 원심분리하였다. Büchner funnel을 사용하여 상등액을 감압 여과한 다음 여분의 50 mL 추출용매로 용기 및 잔사를 다시 씻어 내려 앞서의 여액과 합하였다. 추출액을 50℃에서 5 mL 정도 남을 때까지 농축한 후 10 mL volumetric flask에 옮기고 잔사를 증류수로 씻어 눈금을 맞추었다. Clothianidin, MNG, TZNG 및 TZMU 정제를 위하여 vacuum manifold 위에 ChemElutTM를 올려놓고 시료 10 mL 중 5 mL를 취하여 가한 다음 30분간 방치한 후
토양수 시료의 경우 토양 용탈수 50 mL를 300 mL round-bottomed flask에 취한 다음 methanol 50 mL를 가하여 50℃에서 5 mL정도 남을 때까지 농축한 후, 10 mL volumetric flask에 옮기고 증류수로 눈금을 맞추었다. 분배 및 정제방법은 토양시료 조제시와 동일한 방법 수행하였다.
Clothianidin 및 대사산물의 잔류량 분석은 photodiodearray detector(PDA) 검출기가 장착된 HPLC를 사용하였다. Clothianidin, TZNG, TZMU의 분석용 컬럼은 Symmetry C18(3.9 mm × 150 mm, 4 μm spherical, Waters, USA)을, MNG의 분석용 컬럼은 Inertsil ODS3 (4.6 mm × 250 mm, 5 μm spherical, GL Science, Japan)을, MAI와 TNG의 분석용 컬럼은 Capcell Pak C18 (4.6 mm × 150 mm, 5 μm spherical, Shiseido Fine Chemicals, Japan)을 사용하였으며, 컬럼 온도는 40 ℃로 설정하였다. Clothianidin, TZNG 및 TZMU의 이동상 조건은 10% acetonitrile을 1.5 mL의 유속으로 사용하였으며, MNG의 경우에는 deionized water만을, TMG와 MAI는 20% 및 15% acetonitrile을 함유한 혼합용매 (0.005 M sodium acetate, 0.005 M soduin octyl sulfonic acid 및 0.15 M acetic acid)를 각각 1.0 mL의 유속으로 사용하였다. 269 nm에서 clothianidin, MNG, TZMU을, 250 nm에서 MAI, TMG, TZNG를 측정하였으며, 이 기기분석 조건하에서 모화합물인 clothianidin의 머무름시간은 9.8분이었으며, 대사산물 MAI, MNG, TMG, TZMU 및 TZNG의 머무름 시간은 각각 4.0분, 7.9분, 7.2분, 4.4분 및 6.9분이었다.
각각의 대상 토양 및 토양수 무처리 시료에 clothianidin과 대사산물 5종의 표준용액을 0.05-0.25 mg/kg 및 0.01-0.05 mg/L 범위에서 각각 2수준 3반복으로 처리하고 앞서 기술한 분석과정을 수행, 회수율 및 분석오차를 산출하였다.
무처리 토양시료에는 0.05와 0.25 mg/kg, 무처리 수질시료에는 0.01과 0.05 mg/L의 농도로 clothianidin과 그 대사 산물들을 각각 2수준 3반복으로 처리하여 분석법의 회수율 및 분석오차를 조사한 결과 clothian0idin 및 5종 대사산물의 회수율은 87.4-104.3% 범위로 잔류분석 기준인 회수율 70-120% 이상을 모두 만족하였으며 분석법의 오차도 토양 및 수질시료에서 5% 미만으로 나타나 높은 재현성을 보였다(농진청고시 제2012-13호. 농약의 등록기준 (별표 14) 잔류성 시험의 기준 및 방법).
재배환경 중에 살포된 약제의 가장 많은 잔류분이 분포하게 되는 토양에서 Clothianidin의 소실 및 분해경로를 약제 살포대상에 따라 논과 밭토양 조건에서 각각 조사하였다.
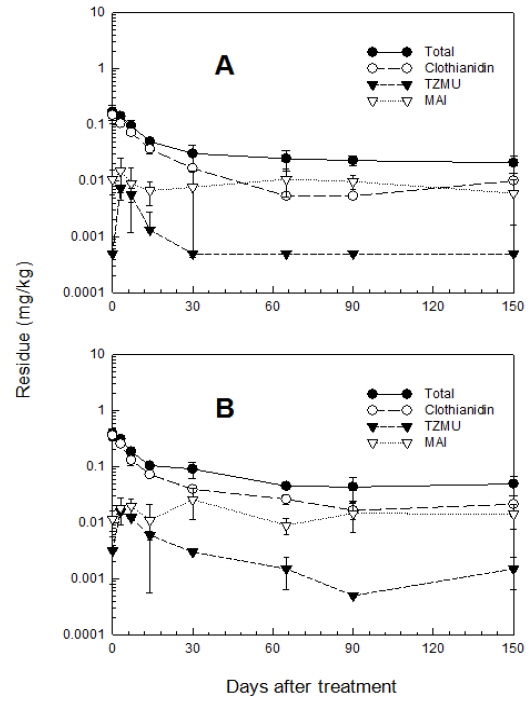
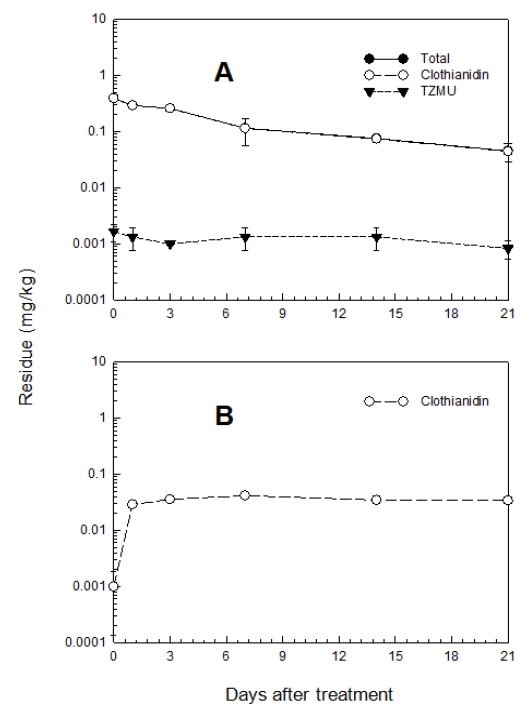
실제 포장조건에서 토양 중 Clothianidin의 잔류특성을 평가하고자 인접지역의 논토양과 밭토양에 Clothianidin 수용성 입제를 살포하고 토양 중 모화합물 및 분해 대사산물의 잔류량 변화를 경시적으로 조사한 결과는 Fig. 2 및 Fig. 3과 같다. 논토양에서 생성된 주요 분해 대사산물은 MAI, TMG 및 TZNG였다. 이중 MAI와 TMG는 지속적으로 검출되었으나 TZNG는 14일 후에는 검출되지 않았다. Clothianidin 모화합물의 분해 경향을 살펴보면 약제처리 후 30일이 경과 되면 완전히 분해, 소실되었다. 대사산물들의 잔류분을 합산하여 총 Clothianidin을 기준으로 소실경향을 살펴보면 약제 처리 후 7일까지는 급격한 감소양상을 보이다가 7일 이후부터는 그 속도가 급격히 완만해지는 경향을 보여 토양 중 소실에 적어도 2가지 이상의 독립적 인자가 관여함을 알 수 있었다. 즉, 많은 농약에서 토양 중 소실경로에는 흡착 및 가수분해, 광분해 등과 같은 물리 화학적 소실과 미생물에 의한 분해와 같은 생화학적 소실인자가 별개로 관여한다. 전자의 경우 주로 초기의 빠른 소실에 관여하며 후자의 경우는 농약의 생화학적 분해에 대한 용이성 정도에 따라 그 속도가 결정된다. 이들 두 인자가 서로 비슷한 속도를 나타낼 경우 단순 1차 감쇄반응과 유사한 경향을 보이게 되나 서로 상이한 경우에는 다중 1차 감쇄반응(multiple first-order kinetics)의 양상을 보이게 된다고 알려져 있다 (Hamaker and Thompson, 1972; Hamaker and Goring, 1976; Lim and Lee, 1998). Clothianidin의 겨우 후자인 다중1차 감쇄반응의 양상으로 잔류소실 양상이 나타났으며, clothianidin을 기준으로 논토양 중 반감기는 6.7-16.1일 이었다.
밭토양에서의 주요 분해 대사산물로는 MAI와 TZMU가 생성되었으며, 논토양과 마찬가지로 MAI의 경우에는 지속적으로 검출되었으나 TZMU의 경우에는 처리 30일 후에는 검출되지 않았다. 모화합물인 Clothianidin의 분해경향을 살펴보면 약제처리 후 30일이 경과하면 90%이상 분해되었으며, 총 Clothianidin의 분해 경향은 논토양과 마찬가지로 7일까지는 급격한 분해양상을 보이다가 7일 이후부터는 완만한 분해곡선을 그려 다중 1차 감쇄반응의 양상을 나타내었다. 밭토양에서의 다중 1차 감쇄반응식에 의한 반감기는 6.9-8.2일 이었다. 또한 논토양과 밭토양에서 생성된 대사산물 중 TZMU와 TZNG는 각각 denitration과 demethylation에 의해 처리 초기에 생성되었다가 급격히 감소하는 경향을 나타내었다. 포장조건의 논 및 밭토양에서 관찰되는 대사산물 TZNG, TZMU 및 TMG는 clothianidin 분자내 서로 상이한 부위에서 일어난 대사과정의 산물이다. 약제처리 초기에 이들 대사산물이 동시에 관찰되는 점으로 미루어 서로 상이한 이들 대사반응이 토양 중 Clothianidin 잔류분에 대하여 동시에 진행됨을 알 수 있었다. 논토양에서 관찰된 TZNG가 밭토양에서는 검출되지 않았는데 이는 논토양에 비하여 밭토양 조건에서 demethylation 반응조건이 형성되지 않음을 의미하였다. 또한 논토양에서는 TMG와 MAI가 비슷한 수준으로 검출되었으나 밭토양에서는 TMG에 비하여 MAI의 수준이 매우 높았다. MAI가 TMG를 경유하여 생성되는 대사산물임을 감안할 때 (Hideki
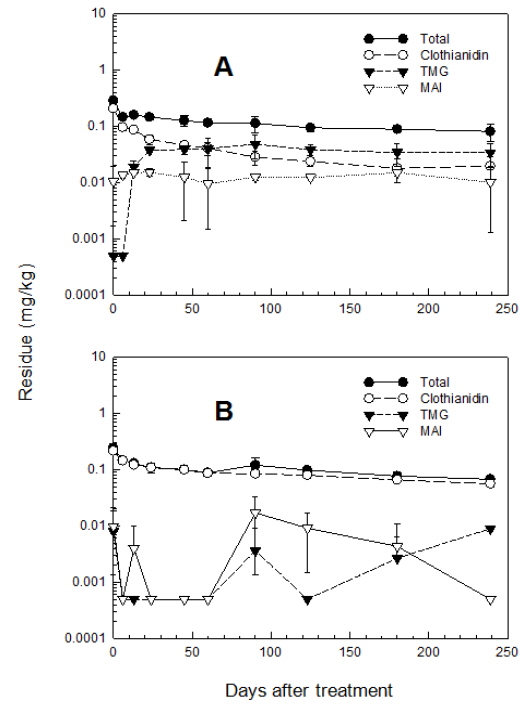
포장실험에서의 환경요인의 관여에 따라 Clothianidin 및 대사산물 잔류량이 심한 변이차를 나타내는 것을 고려, 보다 재현성이 높은 결과를 얻기 위하여 실험실조건에서 토양 중 Clothianidin의 소실 및 분해특성을 조사하였다. 전라북도 익산지역의 2종 토양을 공시, 논과 밭조건에서 토양 중 잔류 특성을 조사하였다. 공시한 2개 토양의 총 Clothianidin 및 대사산물의 잔류분의 소실양상은 Fig. 4와 같다. 논토양과 밭토양에서 Clothianidin은 약제처리 24일 후 모화합물인 clothianidin은 50% 이상이 분해되었다. 총 Clothianidin의 분해 경향을 살펴보면 약제처리 24일 이후부터는 초기 분해 속도에 비해 매우 완만함을 나타내어 포장 조건에서와 마찬가지로 2가지 이상의 독립적 인자가 관여하는 다중 1차 감쇄 반응의 양상을 나타내었다. 토양 조건별로 양상간의 차이는 관찰되지 않았으나 그 소실속도에서 차이를 보여 다중 1차 감쇄반응식의 결과, 논조건에서는 56.3일, 밭조건에서는 19.6일 이었다.
논조건인 담수토양에서 주요 분해산물은 MAI와 TMG로 30일 이후 총 잔류량의 7.1-14.5%를 차지하였으며, 밭조건에서의 주요 분해산물도 역시 MAI와 TMG로 30일 이후 총 잔류량의 6.1-10.0%를 차지하였으나, 밭조건에 비해 논조건에서의 생성비율이 높은 것으로 나타났다. 또한 밭조건에 비하여 논조건에서 MAI에 대한 TMG의 비율이 높은 것으로 보아 포장조건에서와 마찬가지로 TMG에서 MAI로의 전환반응이 밭에서 더 빠르게 일어나는 것으로 판단된다. 한편 멸균 토양에서는 분해대사산물이 생성되지 않는다고 보고되어져 있는 바 (FAO, 2010; U.S.EPA, 2003) 이들 대사과정에서는 토양 미생물이 크게 관여하는 것으로 생각된다.
포장 및 실험실 조건 간에 총 Clothianidin의 반감기는 포장에서 더 길게 나타났다. 그 이유는 실험실 조건에서는 암조건으로 인하여 광분해과정이 배제되었고 또한 약제 이동 및 토양 유실 등과 같은 물리적 소실과정 또한 계산되지 않았기 때문이라 생각된다.
Clothianidin의 수중 잔류특성을 Fig. 5에 나타내었는데, 약제처리 후 7일 경과 시 수중에서 Clothianidin의 잔류량은 초기 농도의 71.1%가 분해되었으며, 회귀곡선식에 의하여 산출된 반감기는 4.8일(pH 5.6)이었다. 수중 약제 처리 후부터 수중 토양에서의 Clothianidin의 잔류량은 0.03-0.42 mg/kg으로 총 Clothianidin의 약 15% 수준으로 나타났는데 이는 물에 대한 용해도가 327 mg/L이며 logPow가 1.05 인 극성특성으로 인하여 토양으로의 분배나 흡착정도가 크지 않고 수중에서 분해되기 때문인 것으로 판단된다. 수중에서의 분해산물로는 TZMU가 0.001-0.002 mg/L 검출되었으며, 그 외 대사산물은 검출되지 않았다. 이는 clothianidin의 분해 및 소실에 영향을 미치는 주요 요인 중 미생물 등과 같은 생화학적 요인보다 가수분해 등과 같은 화학적 요인이 분해에 더 큰 영향을 미쳐 본 연구에서 분석대상으로 한 대사산물과는 다른 화합물 형태로 분해되었기 때문이라 생각된다. 논토양과 밭토양 및 수중에서의 Clothianidin의 감쇄경향을 다중 1차 감쇄반응으로 해석한 결과를 Table 2에 나타내었다.
Comparative persistence of total clothianidin residues in soil and water under different conditions