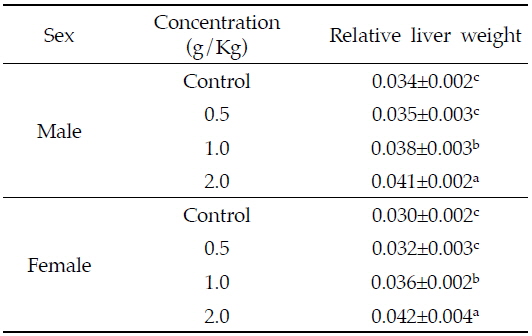
In this study, the four week repeated oral dose toxicity test of aqueous AIE in Sprague-Dawley rats was carried out to investigate the toxic effect of liver, main toxicity target organ of AIE. The male and female rats were divided into 4 groups, respectively; control(0 g/Kg bw), low-dose group(0.5 g/Kg bw), middle-dose(1.0 g/Kg bw) and high-dose group(2.0 g/Kg bw). As a results, relative liver weight increased with dose-dependent of AIE(
In conclusion, 4 weeks of the repeated oral administration of AIE 2.0 g/Kg to rats has resulted no toxic response in liver. Therefore, AIE was no indicated to have any toxic effect in the SD rats, when it was orally administrated below the dosage 2.0 g/Kg/day for 4weeks.
최근 토양이나 작물체내에 잔류하거나 화학적 변화를 일으키는 잔류농약에 대한 관심과 우려가 더욱 커짐에 따라(Woo
천연 식물추출물 유기농업자재에 대한 연구는 고추씨나 겨자씨 추출물의 복숭아혹진딧물 방제효과, 황련 추출물과 고추씨 추출물이 배추좀나방 방제에 효과 등 주로 약효 위주의 연구가 진행되어 왔다(Madhumathy
님을 원료로 한 님추출물의 종류는 매우 다양하고 추출부위 및 추출용매에 따라 그 효능 및 안전성이 달리 보고되고 있다. 님 종자에서 추출한 유지는 근육통, 말라리아, 결핵, 당뇨에 효과가 있으며(Dixit
님추출물은 유효성분인 azadirachtin으로 우리나라에서 농약으로 등록되어 있기도 한 물질로서, 유럽식품안전청에서는 시판하고 있는 님 제품에 대한 시험결과를 근거로 단기독성시험에서 주요 독성기관(target organ)을 간으로 보고, NOAEL(No Observable Adverse Effect Level)을 32 mg/Kg bw/day로 설정한 바 있으며(EFSA, 2011), 미국환경보호청에서도 암수 랫드에 대한 90일 시험에서 간 중량 및 GGT(Gamma-glutamyl transpeptidase)의 증가가 관찰되어 NOAEL을 수컷에서 2.3 mg/Kg bw/day, 암컷에서 2.7 mg/Kg bw/day로 설정한 바 있다(EPA, 1991).
이상과 같이 님추출물이 간 손상에 미치는 영향에 관한 연구들이 활발하게 진행되고 있으나, 대부분 vepacide 등 시판되는 상업제품 위주로 이루어지고 있으며, 실제 우리나라 유기농업자재 제품의 조제에 사용되는 님추출물 원제에 대한 안전성 시험은 미비한 상황이다. 따라서, 본 연구에서는 우리나라에서 유기농업자재 제품의 조제에 사용되는 수용성 님추출물 시료를 이용하여 간에 미치는 독성 영향을 확인하고자, 랫드에 4주 반복경구독성시험을 수행하여, 혈액생화학적 지표 및 간 조직 병리학적 변화를 관찰함으로써 수용성 님추출물의 안전성을 확인하였다.
시료는 시중에 유통되는 미얀마산 수용성 님추출물 시료를 구입하여 사용하였다. 총 18.42 g/Kg의 azadirachtin을 함유(azadirachtin A 8.2 g/Kg, azadirachtin B 3.45 g/Kg, deacetylsalannin 1.65 g/Kg, salannin 5.12 g/Kg 등)하는 시료를 실험기간 동안 빛이 통하지 않는 불투명한 용기에 담아 실온에서 보관하였으며, 사용직전 0.22 μL filter를 이용하여 여과 후 멸균수에 희석하여 사용하였다.
본 동물시험은 국립농업과학원의 동물윤리위원회 승인(NAAS 1305)을 받아 진행하였으며, 시험동물은 SPF Sprague-Dawley(SD)계 랫드를 ㈜Koatech(Kyunggi-Do, Korea)으로 부터 분양 받아 1주일간 순화 후 사용하였다. 시험동물은 평균체중의 ±20% 범위 내에 있는 4주령의 암컷 및 수컷으로 군당 10마리의 동물을 사용하였고, 실험실 조건은 온도 23±2℃, 상대습도 55±5 %, 조명시간 12시간으로 하였다. 4주의 시험기간 동안 폴리카보네이트 사육상자에 2∼3마리씩 넣어 시험하였으며, 물과 사료는 자유섭취 시켰다.
아급성경구시험은 농진청 고시 제 2012-37호의 반복투여 경구독성 시험에 준하여 시행하였다. 시험용량 선정은 선행시험(Yoon
임상 증상은 모든 시험동물에 대해 매일 1회 이상씩 일정시간에 일반상태의 변화, 중독증상발현, 사망동물의 유무를 관찰하였다. 또한, 시험에 사용된 모든 시험동물에 대하여 체중을 시험기간 중 매주 2회, 사료 섭취량과 물 섭취량은 주 1회 측정하였다.
모든 시험동물에 대하여 시험물질 투여 개시일로부터 4주 후에 부검을 실시하였으며, 부검을 위해 CO2로 마취하여 혈액 채취 한 후 해부하여 육안으로 간을 검사하여 이상소견을 관찰하고 중량을 측정하였다.
채취한 혈액은 4℃ 냉장 보관 한 후 10,000 rpm에서 15분간 원심분리(Hanil, supra 22K, Incheon, Korea)하였으며, 뇨 채취를 위해 부검 전일 대사케이지에 넣어 뇨 시료를 수집하였다. 혈액 및 뇨의 생화학적 분석을 위해 자동생화학분석기(Beckman coulter, AU480, Miami, USA)를 이용하여 ALB(Albumin) 및, ALP(Alkaline phosphatase), GOT(Glutamic oxaloacetic transaminase), GPT(Glutamic pyruvic transaminase), GGT(Gamma glutamyltransferase), D-Bil(Direct bilirubin), TP(Total protein), LDH(Lactate dehydrogenase), GLU(Glucose)와 U-GLU(Unine-Glucose)를 측정하였다. 또한, 혈액학적 변화를 살펴보기 위하여 혈구계수기(Scil, Vet ABC, Colorado, United States)를 이용하여 WBC(White Blood Cells) 및 RBC(Red Blood Cells), HGB(Hemoglobin), HCT, MCV(Mean Corpuscular Volume), MCH(Mean Corpuscular Hemoglobin), MCHC (Mean Corpuscular Hemoglobin Concentration), PLT (Platelet)를 측정하였다.
모든 시험동물에서 적출한 간은 10% 중성 포르말린으로 고정시켜 Hematoxylin Eosin(H&E) 염색 후 광학현미경으로 400배에서 관찰하였다.
자료에 대한 통계분석은 SAS(version 9.2, SAS Institute Inc., Cary, NC, USA) 프로그램을 이용하였다. 시험물질 투여군과 대조군의 차이를 비교하기 위하여 general linear procedure로 분석하였으며 pairwise t-test를 이용하여 유의차 0.05 수준에서 평가하였다.
님추출물 시료 0.5, 1.0, 2.0 g/Kg을 랫드에 4주간 경구투여 하였을 때 체중은 암수 모든 군에서 정상적으로 증가하였고, 투여용량간의 유의적인 차이는 보이지 않았으며, 사료 및 물 섭취량도 대조군과 비교하여 유의적 차이도 보이지 않았다. 또한, 실험 종료 후 모든 실험동물을 부검하여 간을 육안으로 관찰한 결과 님추출물 시료를 투여한 암수 모두에서 간에 대한 외관상의 어떠한 이상 병변도 나타나지 않았다.
간의 상대중량은 암수 모두 저농도인 0.5 g/Kg 투여군은 대조군에 비해 차이가 없었으나 중농도(1.0 g/Kg 투여군)와 고농도(2.0 g/Kg 투여군)에서 농도의존적으로 증가하였다(
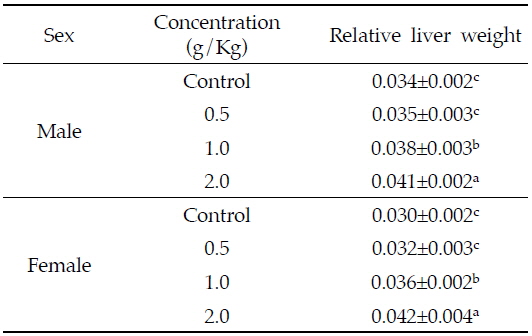
Effects of Azadirachta indica extract on relative liver weights in Sprague-Dawley rats for 4 weeks
Ashafa 등(2012)은 수컷 랫드에 님 나무줄기의 에탄올 추출물을 21일간 0.05 및, 0.1, 0.2, 0.3 g/Kg으로 경구투여 하였을 때 투여용량이 증가함에 따라 간의 상대무게가 유의적으로 증가한다고 보고하여, 본 시험에서 투여 용량이 증가함에 따라 간의 중량이 증가한 결과와 유사하였다. 반면, Deng 등(2013)은 마우스에 님 종실류에서 추출한 님 오일 0.18, 0.53, 1.60 g/Kg을 28일간 경구투여 했을 때 간의 상대중량 차이가 나타나지 않았다고 보고하였으며, 랫드에 0.2, 0.3 g/Kg의 님 잎 추출물을 7일동안 경구투여 하였을 때 대조군에 비해 0.2 g/Kg 투여군은 간 중량이 증가하였으나, 0.3 g/Kg 투여군은 간 중량이 감소하였다(El Hawary
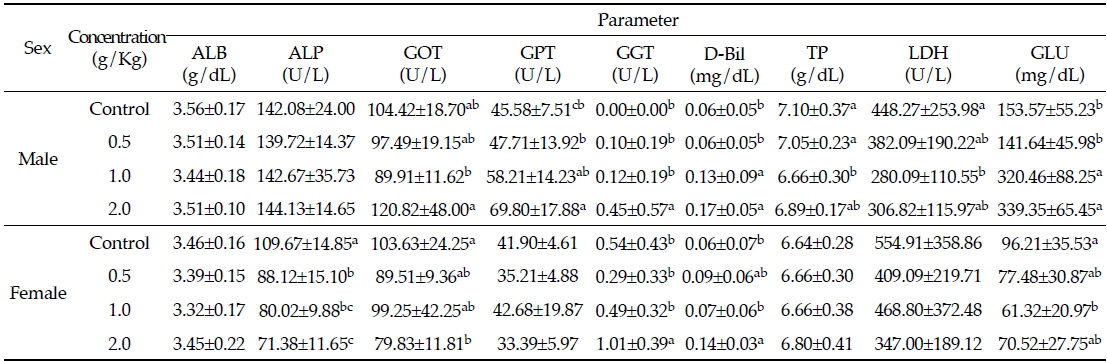
님추출물을 투여한 랫드에서 채취한 혈액을 혈액생화학분석 통하여 간 기능과 관련된 성분인 ALB, ALP, GOT, GPT, GGT, D-Bil, TP, LDH와 혈중 GLU의 함량 변화를 살펴본 결과는 Table 2와 같다. GOT, GPT, LDH활성은 세포손상과 세포 사멸 후 순환계로 분비되어 혈중 활성이 증가하는 등 간 손상과 밀접한 연관성을 가지고 있다(Ozaki
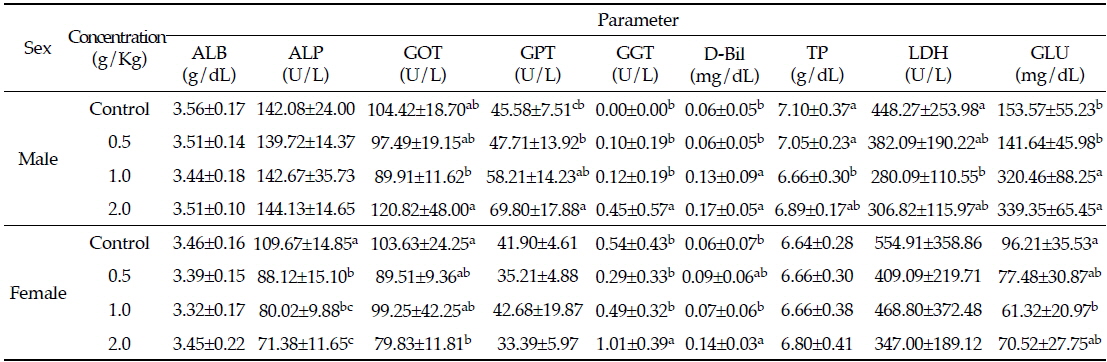
Effects of Azadirachta indica extract on serum biochemical parameters in Sprague-Dawley rats for 4 weeks
본 시험에서 수컷의 경우, GOT는 대조군과 비교하였을 때 고농도 투여군에서 유의적으로 증가하였다. 또한, GPT는 시험물질의 투여용량이 증가함에 따라 유의적으로 증가하였지만, LDH는 투여 농도에 따라 유의적으로 감소하였다(
이는 선행연구에서 랫드에게 azadirachtin을 0.5, 1.5, 4.5 mg/Kg 60일 동안 경구투여 하였을 때 GOT는 유의적으로 증가하였으나, GPT는 변화가 없었으며(Gupta
D-Bil은 본 시험의 연구결과 수컷과 암컷 모두에서 대조군에 비해 유의적으로 증가하였다(
간 효소인 ALP는 담관 손상의 지표로서 종양, 간염, 간경화 등에 의한 담관 폐쇄 등에서 증가한다(Song
혈중GLU는 수컷에서 대조군과 비교했을 때 시험물질의 투여농도에 따라 유의적으로 증가하였고, 반대로 암컷에서는 시험물질을 중농도 처리한 군의 혈중 GLU가 대조군에 비해 유의적으로 감소하였으나, 다른 시험군에서 차이가 없었다(
TP 는 님추출물을 투여한 수컷의 경우, 대조군에 비해 시험물질 투여농도가 증가할수록 유의적으로 감소하지만, 암컷의 경우에는 농도에 따른 유의적인 변화는 관찰되지 않았다(
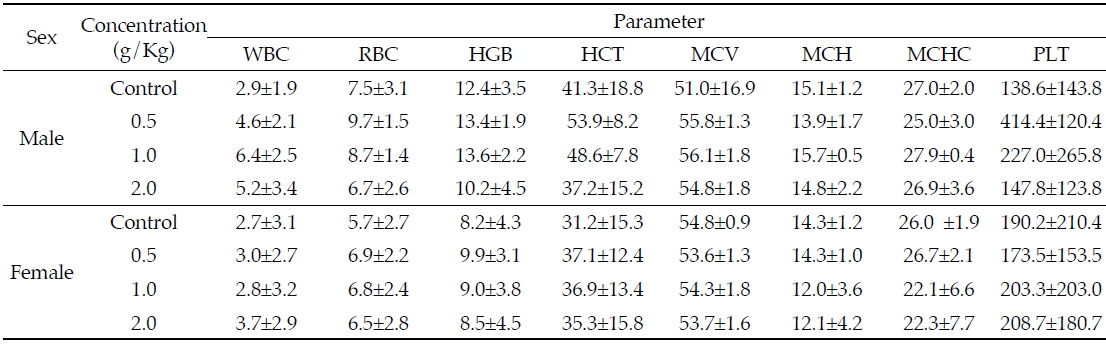
본 연구의 혈액학적 검사 결과 범위는 Table 3과 같다. 간염, 악성종양, 골수 이상 등과 같은 원인 질환에서 증가하는 PLT의 경우(Buss
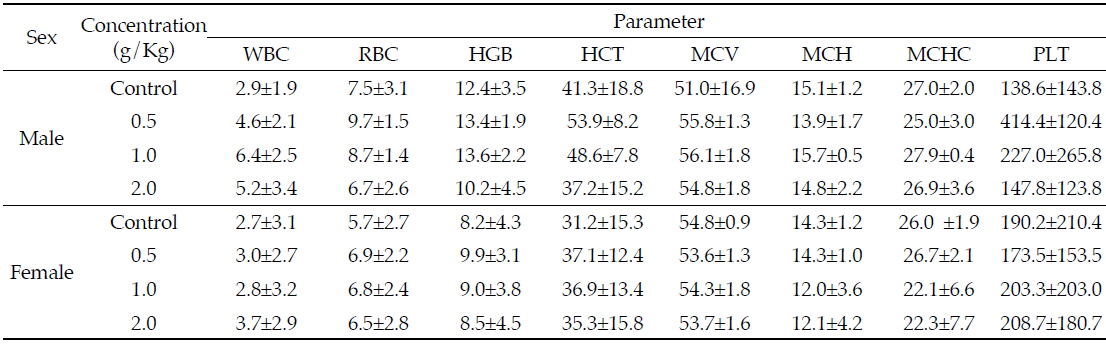
Effects of Azadirachta indica extract on hematological parameters in Sprague-Dawley rats for 4 weeks
또한, WBC 및 RBC, HGB, MCV, MCH, MCHC도 수컷과 암컷 랫드 모두에서 투여 농도에 따른 유의적인 변화가 없는 것으로 나타나, 님추출물 시험물질에 따른 감염이나 혹은 종양, 염증반응의 가능성은 낮은 것으로 판단된다. Eyong 등(2013)은 마우스에 28일간 님 잎 에탄올 추출물을 200 mg/Kg bw 투여하였을 때 대조군과 비교하여 WBC와 PLT 수치가 감소하였지만 유의적인 차이는 보이지 않았다고 보고하였으며, Gangar 등(2010)의 연구에서도 님 추출물 100 mg/Kg을 24주간 경구 투여하였을 때 대조군과 비교하여 WBC, RBC, HGB수치의 유의적인 변화는 나타나지 않았다고 보고하여 본 연구 결과와 유사하였다.
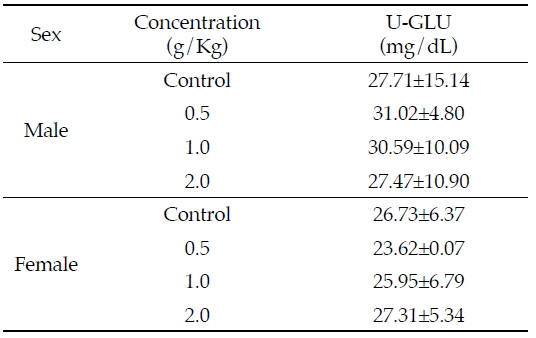
님추출물 시료투여에 따른 뇨 중 GLU의 변화는 Table 4과 같이, 암수 모든 동물에서 대조군에 비하여 모든 님추출물 투여군에서 유의적인 변화가 관찰되지 않고 정상 수준을 유지하였다. Table 2에 의하면 수컷의 혈중 GLU이 님추출물 중농도 및 고농도 처리군에서 급격히 증가함에 따라 당뇨의 가능성을 예측하였으나 실제 뇨를 통한 GLU의 배설은 정상 수준으로 유지됨에 따라 님추출물 물질 투여로 인한 당뇨의 가능성은 낮다고 보여진다.
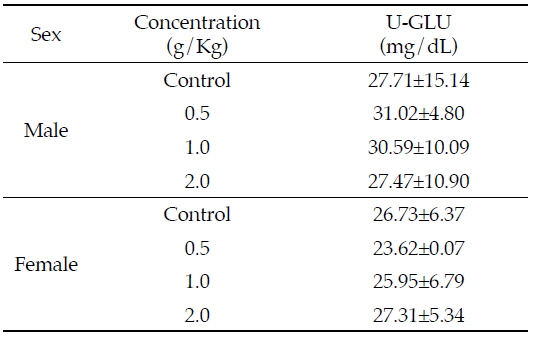
Effects of Azadirachta indica extract on urinary parameters in Sprague-Dawley rats for 4 weeks
Modak 등(2007)은 님을 당뇨병 치료에 효과가 있다고 보고하였으며, Gonzalez등(2010)도 님 잎의 열수추출물을 암컷 마우스에 15일, 30일 동안 40 mg/Kg 경구 투여하였을 때 뇨 중 당 뿐만 아니라 케톤체가 감소하였다고 보고한 바 있다. 본 연구에서는 님추출물의 농도증가에 따른 뇨 중 GLU가 변화하지 않음에 따라 당뇨 치료에 대한 효과를 확인할 수 없었다.
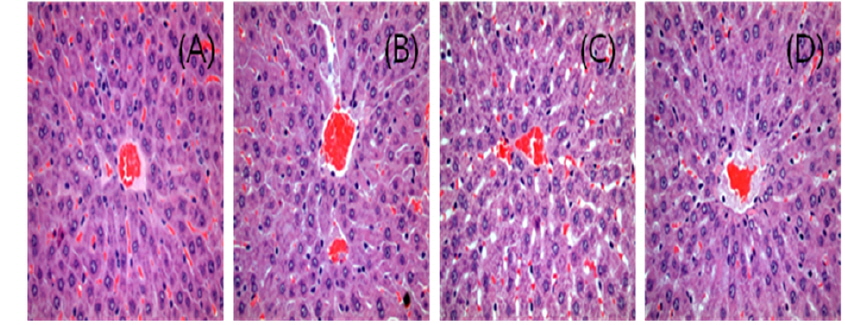
간의 손상 정도를H&E 염색해 400배로 관찰한 결과는 Fig. 1과 같다. 시험결과, 4주간 0.5, 1.0, 2.0 g/Kg을 수컷 랫드에 반복경구 투여한 결과 울혈(congestion), 과립상 변성(granular degeneration), 괴사(necrosis), 림프구 침윤(lymphocytic infiltration) 등 간 조직에서의 어떠한 이상병변도 관찰되지 않았다. Deng 등(2013)은 본 연구에서 사용한 랫드가 아닌 마우스에서 님 종실류에서 추출한 님오일을 최고 1.6 g/Kg bw로 28일간 아급성 경구투여 하였을 때 간 조직에서 간 소엽(liver lobule)의 중심정맥 울혈(central venous congestion), 간세포의 지방 과립상 변성(fatty and granular degeneration)이 관찰되었다고 보고하였다. 또한, Rahman 등(2001)도 님의 상업용 제품인 vepacide를 0.08, 0.16, 0.32 g/Kg의 용량으로 90일 동안 투여했을 때 간의 괴사가 있었다고 보고하였는데, 사용된 시료가 님 종실류의 껍질에서 분리되어 azadirachtin 함량이 12%에 이르는 분말형태였으며 실험동물에 투여되는 농도는 본 연구와 비슷한 수준이었다. 순수한 azadirachtin 성분을 이용하여 LD50의 1/10수준인 57 ppm으로 랫드에 1∼3일 처리한 연구 결과에서도 간에 울혈(congestion), 수종변성(hydropic degeneration), 괴사(necrosis)와 림프구 침윤(lymphocytic infiltration)과 같은 조직병리적 변화가 관찰되었다(Abdel Megeed
이상과 같이 본 시험에 사용된 수용성 님추출물은 수컷에서 혈중 GOT 및 GPT가 증가하였으며 특히 GPT가 시료에 농도 의존적으로 증가하여 수컷의 간 손상 가능성이 있다고 생각되었으나 조직병리학적 관찰 결과 이상 병변이 확인되지 않음에 따라 간 독성에 영향을 미치지 않고 안전한 것으로 판단하였다. 본 연구에서 사용된 시료는 수용성으로 많은 선행연구에서 유기용매 등의 추출용매를 사용한 님추출물의 간독성 연구 결과가 차이가 나며, 님 추출 부위의 차이에 따른 azadirachtin의 함량 차 등이 독성영향에 영향을 미치는 것으로 생각된다.