패화석에 의한 카드뮴의 용출특성과 부동화 기작을 구명하기 위해 우리나라의 대표적인 석회비료인 소석회를 비교구로 선정하여 실내에서 비교시험을 실시하였다. 두 칼슘제재의 처리량을 증가시킴에 따라 토양의 pH와 음하전도는 증가하는 결과를 나타내었으나 소석회가 패화석에 비해 토양의 pH와 음하전도를 증대시키는 효과가 더욱 우수하였다. 소석회는 패화석에 비해 1 N NH4OAc extractable Cd의 함량을 감소시키는 효과가 더욱 우수한 것으로 조사된 반면 패화석은 소석회에 비해 0.1 N HCl extracble Cd의 함량을 감소시키는 효과가 더욱 우수한 것으로 조사되었다. 본 연구에서 소석회에 의한 카드뮴의 부동화기작은 주로 토양의 음하전도의 증대에 기인된 카드뮴의 흡착에 의한 것으로 판단된다. 그러나 패화석에 의한 카드뮴의 부동화기작은 음하전도의 증대에 기인된 카드뮴의 흡착 이외에 부가적으로 다공성의 패화석 내부에 카드뮴이 물리적으로 흡착되어지는 것에 기인되는 것으로 판단된다. 결과적으로 패화석은 토양 내 식물이 이용하기 쉬운 형태의 카드뮴의 함량(F2)을 저감시키고 식물이 거의 이용하기 힘든 형태의 카드뮴의 함량(F5)을 증가시켜 카드뮴으로 오염되어진 농경지에서 식물의 카드뮴 흡수를 저감시키기 위한 토양개량제로써의 활용가능성이 높은 것으로 평가되었다.
Oyster shell(OS) is alkaline with pH 9.8, porous, and has high concentration of CaCO3. It could be used as an alternative of lime fertilizer to immobilize cadmium(Cd) in heavy metal contaminated arable soil. Therefore, this study has been conducted to compare effects of calcium(Ca) materials [OS and Ca(OH)2] on Cd extractability in contaminated soil and determined mechanisms of Cd immobilization with OS.
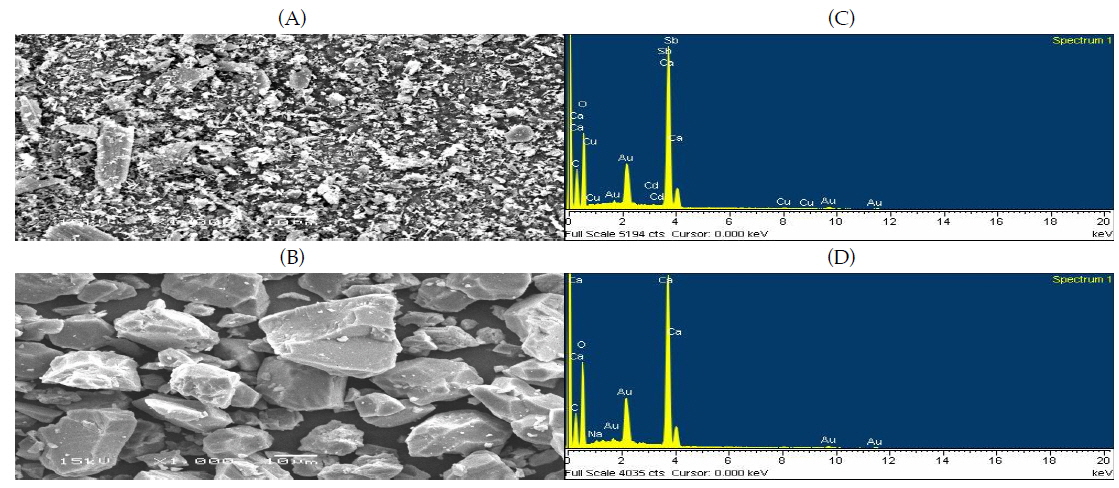
Both Ca materials were added at the rates of 0, 0.1, 0.2, 0.4, and 0.8% (wt Ca wt-1) in Cd contaminated soil and the mixtures were incubated at 25℃ for 4 weeks. Both Ca materials increased pH and negative charge of soil with increasing Ca addition and decreased 1N NH4OAc extractable Cd concentration. 0.1 N HCl extractable Cd concentration markedly decreased with addition of OS. 1 N NH4OAc extractable Cd concentration was related with pH and net negative charge of soil, but not with 0.1 N HCl extractable Cd concentration. We assumed that Cd immobilization with Ca(OH)2 was mainly attributed to Cd adsorption resulted from increase in pH-induced negative charge of soil. Scanning electron microscope (SEM) images and energy dispersive spectroscopy(EDS) analyses were conducted to determine mechanism of Cd immobilization with OS. There was no visible precipitation on surface of both Ca materials. However, Cd was detected in innerlayer of OS by EDS analyses but not in that of Ca(OH)2.
We concluded that Cd immobilization with OS was different from that with Ca(OH)2. OS might adsorbed interlayer of oyster shell or have other chemical reactions.
카드뮴은 저농도에서도 인간과 동물에 독성이 강하며 토양 내에서 이동성이 높아 식물에 쉽게 흡수되어 먹이연쇄를 통해 환경적으로 많은 문제를 유발하고 있는 중금속이다. 또한 고농도의 카드뮴은 식물의 생육저해 현상을 유발하여 농경지의 작물생산에도 영향을 미친다(John
석회를 시용하여 토양 내 카드뮴을 부동화하는 기술은 널리 이용되어지고 있는 기술이다(Lehoczky
패화석비료는 대부분 석회물질로 구성된 굴 껍질을 낮은 온도에서 소성하고 분쇄하여 제조한 비료로서 산성토양을 개량하고 토양의 미생물상을 개선하는 토양개량제로 활용할 수 있는 유용한 대체 자원이라고 보고되었다(Kim
패화석은 상당량의 CaCO3를 포함하고 있어 토양의 pH를 증대시킬 수 있으므로 중금속 오염 농경지 내 카드뮴을 화학적으로 안정화시키는 토양개량제로 활용될 수 있을 것으로 예측된다. 따라서, 본 연구는 경남해안지역에서 환경문제가 되고 있는 패화석의 농업적 활용성을 높여보고자 실시되었다. 이를 위해 패화석과 우리나라의 대표적 석회비료인 소석회가 카드뮴의 용출성에 미치는 효과를 비교하고 패화석의 카드뮴 부동화 기작을 구명하여 중금속 오염 농경지의 카드뮴 부동화를 위한 개량제로 패화석의 활용 가능성을 모색하여 보았다.
본 연구를 수행하기 위해 경남 합천군 술곡리의 봉산광산(128°01'N 34°37'E) 인근 밭토양을 공시토양으로 선정하였다. 대상지역의 토양은 칠곡통에 속하는 토양이었으며 점토6.1%, 미사 35.0%, 모래 58.9%를 포함하는 사질양토(sandy loam)이었다. 공시토양의 이화학적 특성은 Table 1에 나타 냈다. 공시토양 내 조사된 중금속 중 카드뮴(Cd)의 함량은 토양오염우려기준(4.0 mg kg-1)을 초과하였다.
[Table 1.] Selected properties of the studied soil
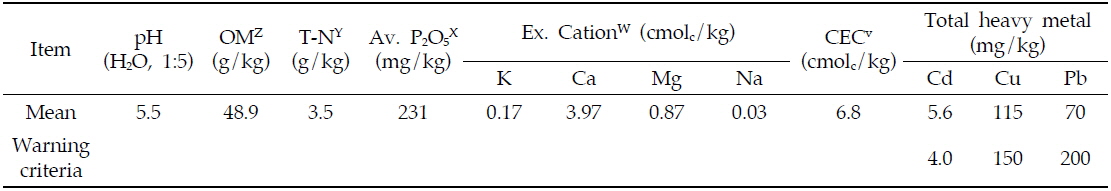
Selected properties of the studied soil
밭토양 내 카드뮴의 부동화에 대한 패화석과 소석회의 효과를 비교하기 위하여 시중에서 판매되고 있는 패화석비료(분말도 2~5 mm 이하, 칼슘함량 34.0%)와 소석회비료(분말도 1.7mm 이하, 칼슘함량 38.6%)를 공시칼슘제재로 선발하였다. 밭토양의 석회비료 추천량인 2 Mg/ha를 토양의 용적밀도가 1.2 g/cm3 이고 표토의 깊이가 15 cm인 토양에서 무게비로 환산하면 약 0.1% (wt/wt)가 된다. 따라서 석회비료 추천량의 0, 1, 2, 4, 8 배를 처리하기 위해 플라스틱 용기내 건토 500 g에 소석회와 패화석을 칼슘의 무게비로 0, 0.1, 0.2, 0.4, 0.8% (wt/wt)로 처리를 하였다. 플라스틱 용기에 칼슘제재들과 혼합된 토양을 용적밀도가 1.2 g/cm3이 되도록 충진하고 입자밀도(2.65 g/cm3)을 이용하여 공극의 부피 227.6 cm3을 얻었다. 밭토양 조건을 유지하기 위해 토양 공극 부피의 70% 수분인 증류수 160 ㎖를 첨가한 후 2일에 한번씩 무게를 측정하여 유실된 수분을 보충하였다. 처리되어진 토양은 암조건의 인큐베이터에 25℃에서 4주간 놓아졌다. 처리구는 3반복으로 설치되었으며 각 처리구는 인큐베이터 안에 완전임의배치법에 따라 놓아졌다. 4주간의 인큐베이션 후 토양 내 1 N NH4OAc extractable Cd 함량(유효태 카드뮴 함량, Gommy
공시토양 및 시험 후 토양의 이화학적 분석방법은 다음과 같은 방법을 따랐다: pH(1:5 토양:물), 유기물 함량(Wakley and Black method; Allison 1965), 총질소 함량(Kjeldahl method; Bremner, 1965), 치환성 양이온 K+, Ca2+, Mg2+, Na+ (1 M NH4-acetate pH 7.0, ICP-OES, inductively coupling plasma optical emission spectroscopy, Perkin elmer model DV 4300, Shelton, CT, USA). 유효인산의 함량은 Lancaster method(RDA, 1988)를 이용하여 분석하였다. 총중금속(Cd, Cu, Pb) 함량을 분석, 측정하기 위해서 왕수(Aqua regia)를 이용하여 습식분해 시킨 후 Whatman No.42 (pore size 2.5 ㎛) 여과지로 여과한 후 각 중금속의 농도를 ICP-OES로 측정하였다.
본 연구에서는 카드뮴의 용출성을 조사하기 위해 식물이 이용 가능한 형태의 카드뮴을 침출하는 방법인 1 N NH4OAc extraction 방법(Symeonides and McRae 1977)과 국내에서 중금속의 용출성을 파악하기 위해 주로 사용되었던 0.1 N HCl extraction 방법을 이용하였다. 카드뮴의 함량 중 1 N NH4OAc extractable Cd 함량은 토양:용액 비 1:5의 비로 1 M NH4OAc로 1시간 침출한 후 여과하여 ICP-OES로 Cd의 함량을 분석하였다. 0.1 N HCl extractable Cd 함량은 토양과 용액을 1 : 3 의 비율로 혼합하여 1시간동안 침출한 후 0.45 ㎛ membrane filter에 여과하고 ICP-OES로 분석 하였다.
토양의 음하전도를 측정하기 위하여 토양 5 g을 centrifuge tube에 담고 1 M NaCl 30ml을 가하여 1 시간 동안 교반한 후 원심분리하여 상등액을 따라내고 남아 있는 토양에 ethyl alcohol 20 ml을 가하여 남아있는 침출액을 3회 반복하여 씻어냈다. ethyl alcohol을 분리시킨 후 상등액은 따라내고 남은 토양에 1 M NH4OAc 30 ㎖을 가하여 1 시간 동안 침출하였다. 침출 후 여과시켜 여과액 내의 나트륨(Na)의 함량을 ICP-OES로 분석하여 음하전도를 구하였다.
카드뮴의 형태별 함량은 연속추출법에 의해 실시하였다(Ure
패화석과 소석회에 의한 카드뮴의 부동화 기작을 구명하기 위해 패화석의 원료가 되는 굴 껍데기와 소석회의 원료가 되는 석회석(calcite)을 분쇄하여 0.84 mm 체로 통과시킨 후 각각의 5 g을 50 ml centrifuge에 넣고 Cd 1,000 mg/L CdCl2 용액 25 ml를 가하여 6 주간 25℃에서 교반시켰다. 반응 후 centrifuge를 15 분간 6,000 rpm으로 원심분리하여 상등액은 따라내고 남아 있는 각각의 칼슘제재에 ethyl alcohol 20 ml을 가하여 남아있는 상등액을 3회 반복하여 씻어냈다. 카드뮴 용액과 반응한 패화석과 석회석을 막자사발에서 분쇄하여 200 mesh 체로 걸러 표면 이미지 분석을 위한 시료로 준비하였다. SEM(scanning electron microscope, Hitachi FE-SEM S-4700, Japan)과 EDS(energy dispersive spectroscopy, Hitachi FE-SEM S-4700, Japan)를 이용하여 패화석과 석회석 표면의 이미지 분석을 실시하였다.
통계분석은 SAS 통계프로그램(버전 9.2)을 이용하여 실시하였다(SAS institute, 2006). 처리간의 차이를 비교하기 위하여 조사된 자료는 ANOVA 검증을 통하여 분석되어졌다. F-test 결과값이
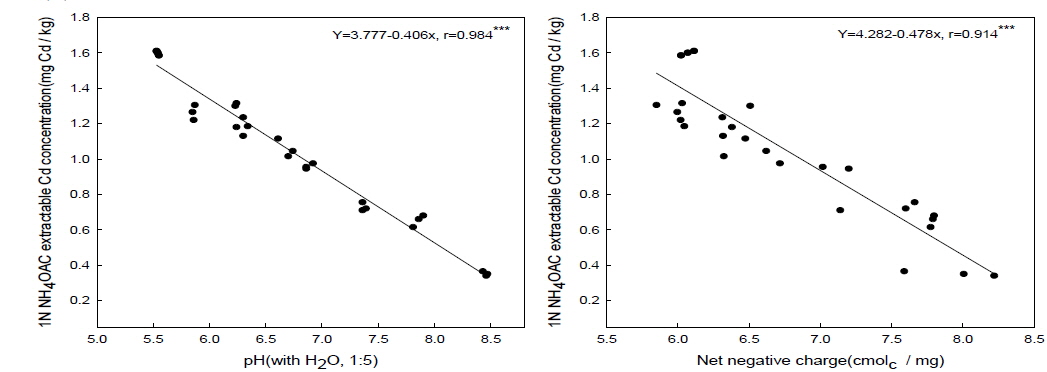
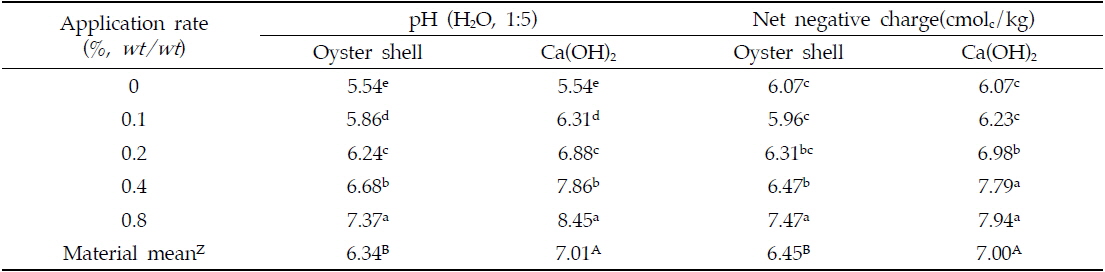
실내에서 4주간 인큐베이션 시험을 실시한 결과, 패화석과 소석회의 처리량을 증가시킴에 따라 토양의 pH는 유의하게 증가하는 것으로 나타났다(Table 2). 토양의 pH을 증대시키는 효과는 소석회의 시용이 패화석의 시용보다 우수한 것으로 나타났으며 모든 처리량의 평균값은 패화석 시용 시 6.3소석회 시용 시 7.0로 나타났다. 이러한 결과는 두 칼슘제재의 용해도 차이에 의해 기인된 것으로 판단되어진다. 소석회 [Ca(OH)2]의 용해도(1.85 g/L)는 패화석의 주요성분인 CaCO3의 용해도(0.014 g/L) 보다 훨씬 높다(Weast and Astle 1978-1979). 토양의 pH는 토양교질의 가변전하를 변화시키는 중요한 요인 중의 하나이며(Barrow, 1985), 토양의 pH가 증대하게 되면 토양교질과 유기물의 작용기로부터 수소이온(H+)이 토양 용액으로 해리되어 나와서 토양의 음하전도는 증대하게 된다(Thoma and Hargrove, 1984; Curtin
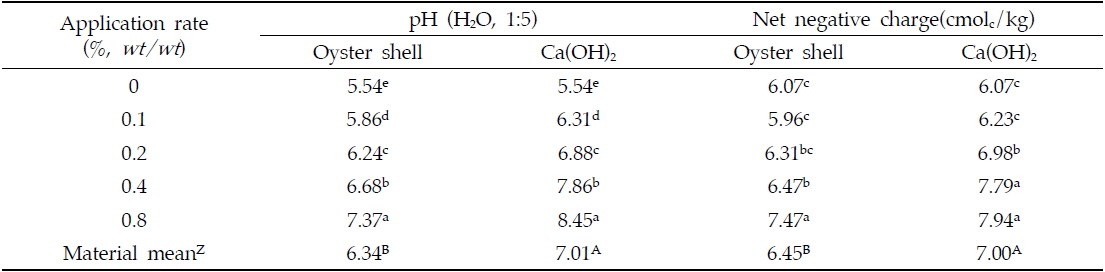
Changes of pH and net negative charge in soil amended with different rates of oyster shell and Ca(OH)2
토양의 음하전도가 증대하게 되면 2가 양이온인 카드뮴 이온(Cd2+)의 흡착은 증대하게 된다(Naidu
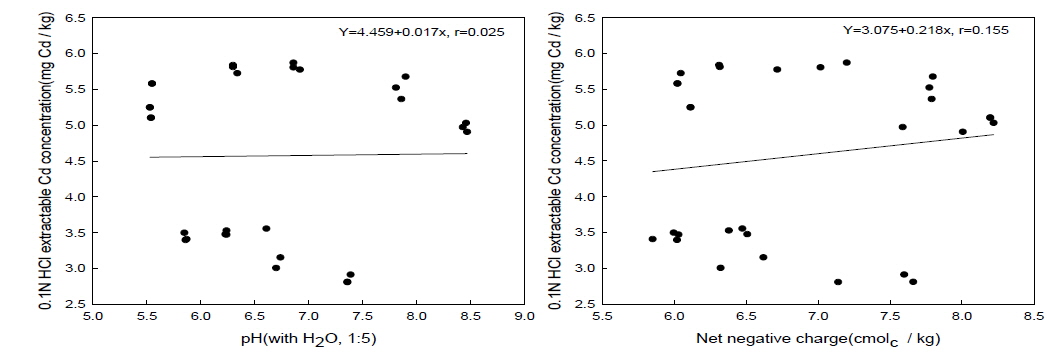
소석회의 시용에 따른 1 N NH4OAc extractable Cd의 함량의 변화와 달리 패화석은 소석회보다 0.1 N HCl extractable Cd의 함량을 감소시키는 효과가 우수한 것으로 나타났다[Fig. 1(B)]. 칼슘제재를 처리하지 않은 무처리에서 1 N NH4OAc extractable Cd 함량과 0.1 N HCl extractable Cd의 함량은 각각 1.6 mg Cd/kg 과 5.2 mg Cd/kg으로 나타났다[Fig. 1 (A)와 (B)]. 0.1 N HCl extractable Cd의 함량이 1 N NH4OAc extractable Cd의 함량보다 높은 이유는 1 N NH4OAc 용액은 수용성과 치환성 형태의 Cd만을 용출해내는 반면에 0.1 N HCl 용액은 보다 많은 Cd의 형태들을 용출하기 때문인 것으로 판단된다. 패화석과 소석회의 처리에 따른 토양의 pH 및 음하전도와 1 NH4OAc extractable Cd 함량과의 관계를 분석한 결과 유의한 부의 상관관계를 확인할 수 있었다[Fig. 2 (A)와 (B)]. 그러나 토양의 pH 및 음하전도와 0.1 N HCl extractable Cd함량과의 관계를 분석한 결과 유의한 상관관계를 찾을 수 없었다[Fig. 3 (A)와 (B)]. 이상의 결과를 바탕으로 볼 때 패화석과 소석회의 시용에 따른 1 N NH4OAc extractable Cd 함량의 감소는 주로 pH에 유도된 토양의 음하전도의 증대에 기인된 카드뮴의 흡착에 의한 것으로 판단되어진다. 이러한 결과는 다른 연구결과들에서도 보고되어진바 있다(Bolan
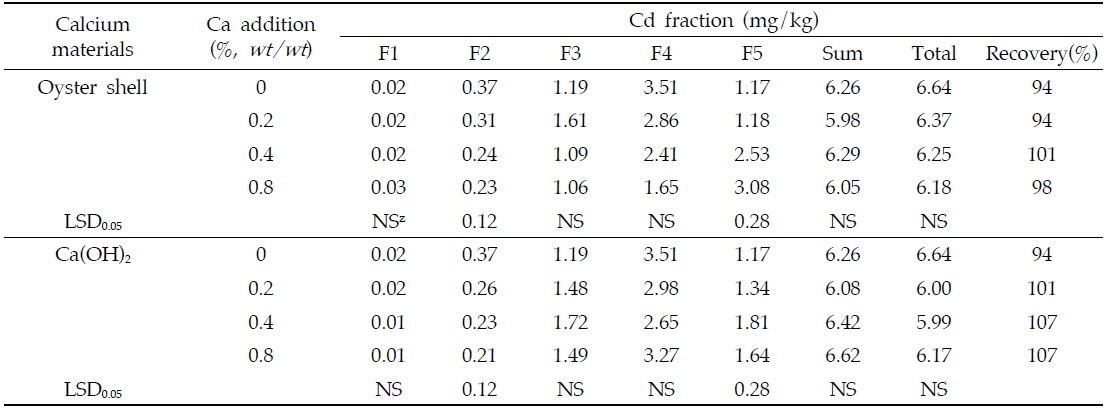
연속 침출법을 이용한 중금속의 분획특성조사는 중금속으로 오염되어진 토양 내 중금속의 이동특성을 평가하는데 이용되어져 왔다(Sposito
[Table 3.] Cd fractions in soils amended with the different rates of Ca materials
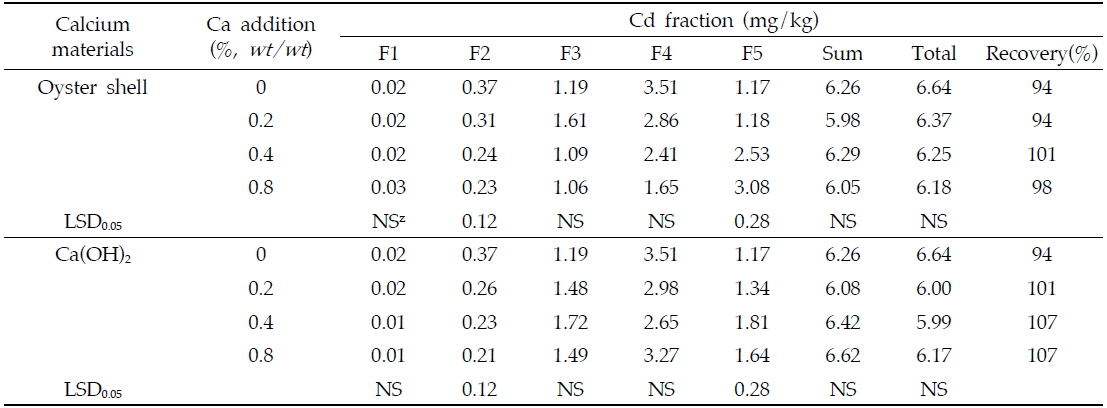
Cd fractions in soils amended with the different rates of Ca materials
패화석과 소석회의 시용에 의해 카드뮴은 토양 내 침전반응을 통해 CdCO3나 Cd(OH)2를 형성하여 부동화되어질 수 있다. 앞에서 언급되어진 바와 같이 카드뮴은 토양의 pH가 10.0 이상인 조건에서 Cd(OH)2의 형태로 침전되어질 수 있으며 토양의 pH가 8.0 이상인 조건에서는 CdCO3의 형태로 침전되어 질 수 있다(Naidu


![Changes of extractable cadmium concentration in soils added with different rates of oyster shell and Ca(OH)2 [(A) 1N NH4OAc extractable cadmium concentration, (B) 0.1 N HCl extractable Cd concentration].](http://oak.go.kr/repository/journal/16438/HGNHB8_2014_v33n4_245_f001.jpg)