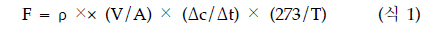Intergovernmental Panel on Climate Change (IPCC)에 따르면 지구의 대기평균온도의 선형 경향은 0.65∼1.06℃로 꾸준한 상승세를 보이고 있다 (IPCC, 2014). 이러한 지구 온난화의 원인으로 CO2, CH4, N2O, O3, CFCs 등의 온실가스 대기농도증가가 지목되고 있다. 특히 메탄 (CH4)은 대기중 잔존시간이 10년 정도로 짧음에도 불구하고 장파장의 흡수능이 이산화탄소 대비 20∼30배 높아, 지구온난화 기여도가 약 20%인 대표적인 온실가스로 회자되고 있다 (Blake D.R. and Rowland F.S., 1988). 메탄의 발생량은 연간 550Mt으로 이 중 470Mt이 대기 중 라디칼 반응에 의해 산화되며, 약 50Mt은 토양 내 메탄산화균인 Methanotrophs에 의해 제거되는 것으로 알려져 있다 (IPCC, 2007). 대기 메탄농도 조절에 있어서, 대기권에서의 메탄 제거는 인위적 조절의 어려움이 있는 반면에, 상대적으로 토양에서는 메탄산화균의 활성을 증대시키는 조건형성을 통해 대기 메탄농도 조절이 가능하다 (Anne Saari
메탄산화균은 대기 중 메탄의 농도와 토양 내 수분함량, 온도, pH, 유기물함량 등의 영향을 받으며(Hanson and Hanson, 1996), 크게 두 부류로 나뉜다 (Conrad R. 2007). Type I 메탄산화균은 낮은 메탄농도 (< 12ppm 대기 중 메탄농도와 유사한 조건) 조건과 높은 산소농도 조건에서 메탄을 산화하는 것으로 알려져 있으며, Type II 메탄산화균은 높은 메탄농도 조건과 낮은 산소농도 조건에서 메탄을 산화하는 것으로 알려져 있다. 메탄 산화균은 공통적으로 pMMO(particulate methane mono oxygenase)를 가지고 있는 것으로 알려져 있으며 (Conrad, 2007), pMMO 의 Alpha subunit인
산림토양에서의 메탄산화에 대한 연구는 대부분 유럽(Dobbie
조사지역인 가좌산 (35° 9'26.27"N, 128° 5'9.59"E)은 경상남도 진주시 가좌동에 위치하고 있으며, 진주시 중심부에서 남북으로 완경사의 구릉지형을 이루고 있다. 본 연구를 위하여 침엽수 대표 수종인 소나무와 활엽수 대표 수종인 참나무와 밤나무가 우점하고 있는 지역을 각각 선정하여 실험을 수행하였다.
조사시설설치
연간 산림토양에서의 메탄산화를 측정하기 위해 Closed chamber method를 이용하였다. 선정된 지역별로 각각 반복구로 3개의 원통형 PVC static chamber를 설치하고 간섭을 피하기 위해 설치 후 일주일이 경과한 이후에 가스채취를 실시하였다. 챔버 내부 용적은 약 9 L 이고, 원통형 PVC 챔버 내부에 공기를 혼합하기 위해 64 cm2(8 cm×8 cm)사이즈의 소형 팬을 설치하여 시료의 균질성을 확보하였다. 가스 채취 시 토양의 온도를 온도계를 이용하여 측정하였으며, 가스 채취는 2011년 3월 23일부터 1주일에 1회, 1년간에 걸쳐 평균적인 메탄발생량을 가지는 오전 10∼11시 사이에 실시하였다. 메탄의 포집시간은 30분 동안 실시하였으며, 50 ml 주사기를 이용하여 채취하였다. 채취한 가스 중 메탄 농도는 Gas chromatograph를 이용하여 정량하였다. 이때 Porapak NQ column (Q 80-100 mesh)과 Flame ionization detector (FID)가 이용되었으며, column-injector-detector 온도는 80-100-110℃로 각각 조절하였다. Carrier gas로 He가스를 사용하였으며, burning gas로 H2가스를 이용하였다.
메탄배출량 산정
메탄 배출량(CH4 emission rate)은 Closed chamber의 뚜껑을 닫기 전과 닫은 지 30분 경과 후 농도차를 이용 아래식 1과 같이 계산하였다(Rolston 1986).
여기서, F는 메탄 배출율 (CH4 flux, mg CH4/m/h), ρ는 메탄의 밀도(0.714 g/L, 1atm, 0℃), V는 챔버부피 (chamber volume, m3), A는 챔버넓이 (chamber area, m2), Δc/Δt는 챔버 내 메탄가스 축적량 (CH4 gas accumulation rate in the chamber, mg CH4/m/h), T는 챔버 내 절대온도(273+mean temperature in the chamber, ℃).
1년간 산화된 총 메탄 산화량을 Singh등 (1999)이 도입한 식 2를 이용하여 도출 하였다.
여기서, Seasonal flux는 조사기간 중 발생된 총 메탄 발생량 (CH4 g/m2), Ri는 i 번째 시료채취 시기에 메탄 배출율 (CH4 flux, mg CH4/m2/day), Di는 i 번째 시료채취 시기에 시료채취 간격 (day).
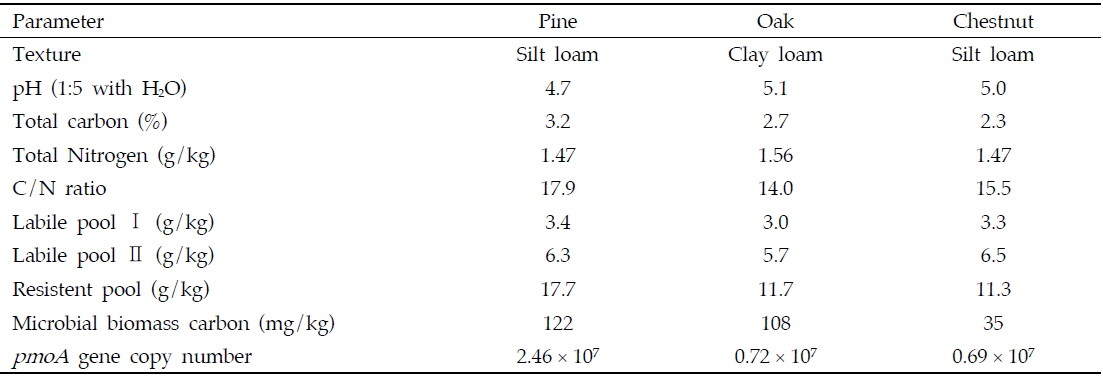
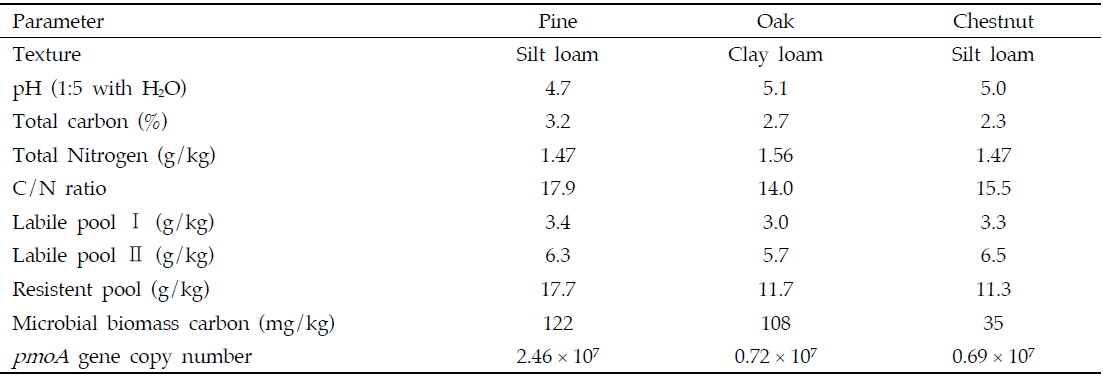
각 산림토양의 특성과 메탄산화력간의 관계를 조사하기 위하여 토양의 특성을 분석하였으며, 3반복의 토양 채취와 반복시험을 통해 오차를 최소화 하고자 하였다. 토양의 물리화학적 특성을 알아보기 위하여 토양온도, 수분함량, 토성, 총탄소함량(total carbon, TC), pH, 총 질소함량(Toatl nitrogen, TN), 미생물이 쉽게 이용할 수 있는 형태의 Labile carbon 함량을 분석하였으며, 미생물적 특성을 확인하기 위해 microbial biomass carbon (MBC),
[Table 1.] Properties of alpine soils having different forestation structure
Properties of alpine soils having different forestation structure
통계 분석은 SAS package version 9.2 (SAS Institute Inc., 2001)를 이용하여 실시하였으며 최소유의차 (LSD, Least significant difference) 방식으로 각 처리구간의 각 산림토양 별 전체 메탄산화량 차이를 비교하였다. 또한 산림토양의 특성과 메탄산화량 간의 관계를 확인하기 위하여, 상관관계 분석은 PASW statistics 18.0 (SPSS Inc., 2009)을 이용하여 실시하였으며 단순 상관분석 (Simple correlation analysis)으로 Pearson 상관계수 (Pearson correlation coefficient)를 이용하여 각 변수간의 상관관계를 비교하였다.
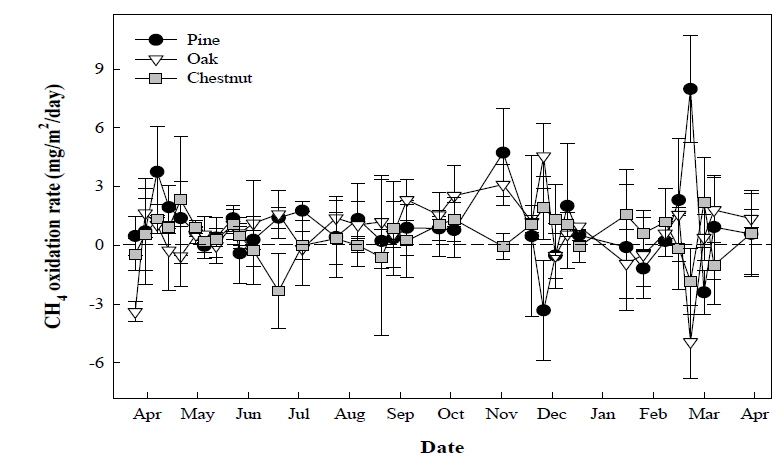
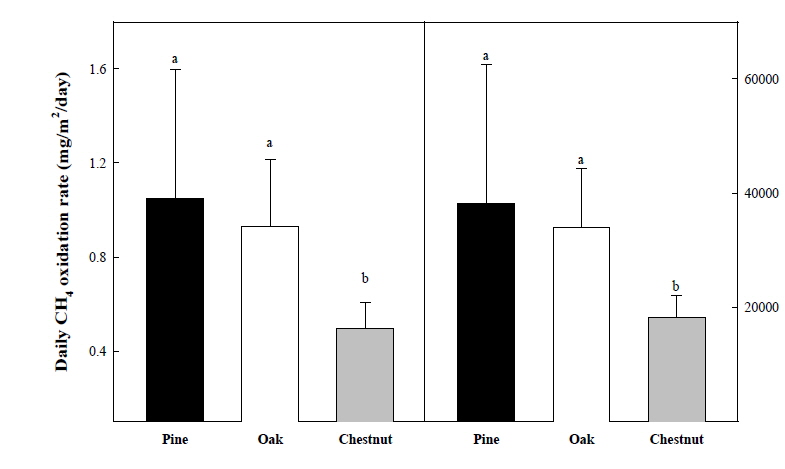
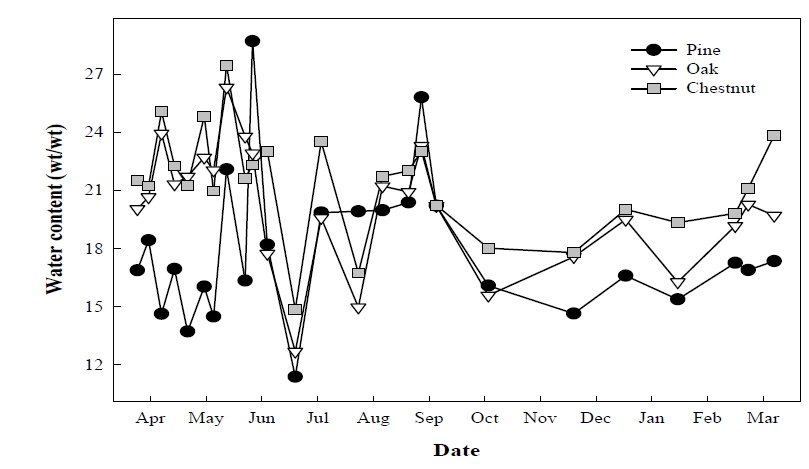
1년에 걸쳐 다른 산림조성을 지닌 산림토양에서 메탄산화력을 모니터링한 결과, 산림 수종에 따른 메탄 산화량은 11월과 3월 경 소나무 우점 토양에서 크게 높았던 것이 확인되었다. 참나무 우점토양의 경우 8, 9, 10월에 비교적 높은 산화량이 관찰되었으며, 밤나무 우점토양의 경우 겨절별로 큰 변화없는 메탄 산화량을 보였다. 그러나 각각의 산림토양에서 계절에 따른 메탄산화의 공통적인 경향성은 뚜렷하게 나타나지 않았다 (Fig. 1). 측정기간 전체에서 수종이 다른 산림토양의 일일 평균 메탄 산화력을 조사한 결과 소나무가 우점한 토양의 메탄 산화력은 하루 평균 1.046 mg/m2/day 이었으며, 참나무 우점 토양은 0.930 mg/m2/day, 밤나무 우점 토양은 0.497 mg/m2/day 의 메탄 산화력을 나타내었다 (Fig. 2). 따라서 연간 산림토양에서 산화될 수 있는 메탄의 양은 1 ha 면적 당 소나무 우점 토양에서 3.820 kg, 참나무 3.396 kg, 밤나무 1.814 kg으로 조사되었다. 현재 보고되어진 산림토양의 평균 메탄 산화력은 1.54 mg/m2/day 으로 본 연구에서의 메탄산화력이 보통 산림토양의 메탄산화력 보다는 다소 낮은 편이었다. 이러한 메탄 산화력의 차이는 식생의 잔재로부터 유래된 유기물 조성 및 토양의 특성에 의해 발생된 것으로 판단되었다.
각 수종에 따른 메탄산화력과 토양의 특성을 비교해본 결과 토성이 통기성에 영향을 주어 간접적으로 메탄산화에 영향을 줄 것으로 판단하였으나 (Dörr
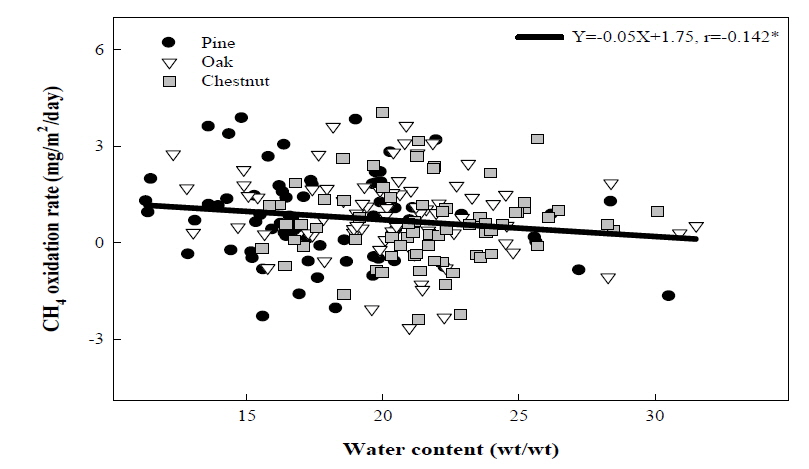
메탄 산화에 영향을 줄 것으로 판단되는 환경 인자로, 식생조성이 다른 각각의 산림토양에서 1년에 걸쳐 수분함량변화를 조사하였다. 조사기간 중 전반적으로 소나무 우점 산림토양에서의 수분함량이 다른 토양에 비해 다소 낮게 관찰이 되었다 (Fig. 3). 토양 수분과 메탄 산화력 간의 관계를 해석 하고자 상관관계 분석을 실시한 결과, 토양의 수분함량이 증가됨에 따라 메탄 산화력은 약한 음의 상관관계 (상관계수-0.142*)를 갖는 것을 확인하였다 (Fig. 4). Semrau 등(2010)에 의하면 토양 내 수분함량은 메탄산화균의 조성과 활성에 영향을 미칠 수 있는 인자로, 특히 높은 수분함량은 메탄 또는 공기의 확산을 제한해 메탄산화균의 활성을 저해하는 것으로 알려져 있으며 또한 산소농도를 저감시켜 메탄산화균의 성장을 저해할 수 있다고 하였다. 정확하게 어느 인자가 메탄산화균의 활성을 저해하는지 정확하게 알 수는 없으나 산소와의 접촉이 저해되고 메탄생성균과 메탄산화균 활성간의 경쟁에 의해 메탄산화가 저해될 것으로 생각되고 있다. 본 연구에서는 토양 내 수분함량의 증가는 토양 내 산소의 결핍과 메탄의 발생량 증가로 인해 메탄의 산화를 저해하는 요인으로 작용한 것으로 사료되었다.
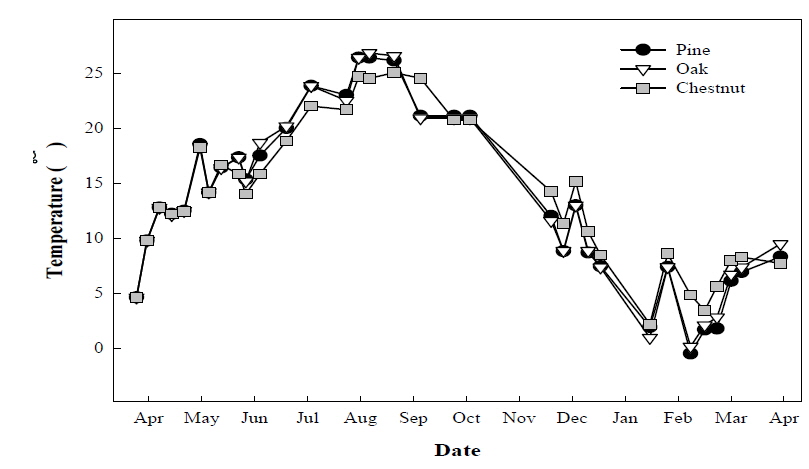
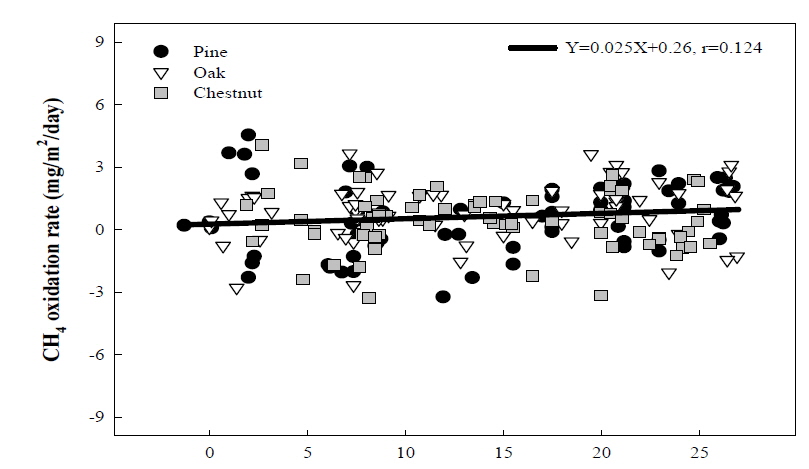
토양 환경인자 중 미생물 활성에 영향을 끼칠 것으로 판단되는 토양온도를 조사한 결과 는 Fig. 5와 같았다. 계절에 따라 토양의 온도가 증감하는 것이 관찰되었으며, 각각의 다른 산림토양 모두 비슷한 경향과 값을 나타냈다. 실제 조사된 토양 온도와 메탄 산화량 간의 관계 확인을 위해 상관관계를 분석한 결과 토양 온도와 메탄 산화력 간에 유의성이 확인되지 않았다 (Fig. 6). 이는 메탄산화균이 메탄생성균에 비해 온도의 변화에 덜 민감하기 때문인 것으로 판단되며 (Hanson and Hanson, 1996: Chu
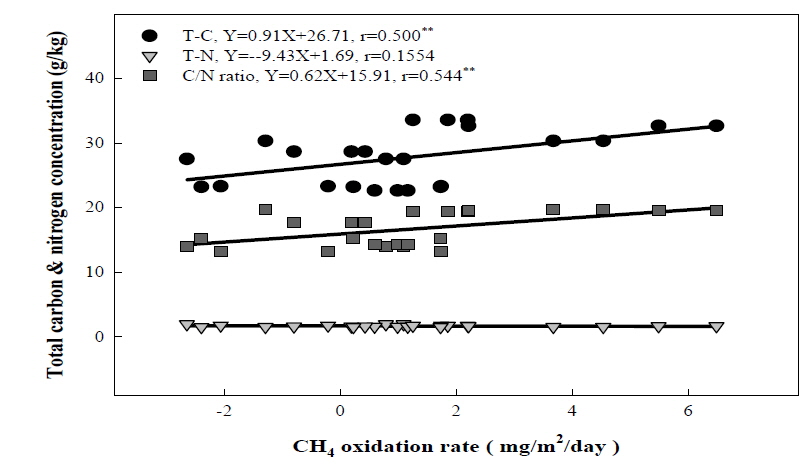
전반적으로 토양의 물리적인 환경 요인은 메탄산화에 크게 영향을 미치지 못하는 것으로 판단되었으며 메탄 산화력의 차이는 토양의 화학적 생물학적 특성에 의해 결정되어 질 것으로 판단되었다. 토양의 화학적 특성으로서 각각의 산림토양이 지닌 TC, TN, C/N 비와 메탄 산화량 간의 상관관계를 분석하였으며, 메탄 산화량과 TC (상관계수 0.500**), 메탄 산화량과 C/N 비 (상관계수 0.544**)가 정의 상관관계가 있음을 확인할 수 있었다 (Fig. 7). 특히 탄소성분 중에서 미생물이 이용하기 쉬운 형태의 Labile pool 보다는 Resistant pool 탄소의 함량이 높은 소나무 우점토양에서 가장 높은 메탄 산화량을 확인할 수 있었다 (Table 1, Fig. 2). 이는 resistant pool의 방향족 물질 및 methoxylated sugars에 의해 유래한 비 메탄 기질 (예, methanol)에 의한 메탄산화균의 촉진효과로 판단되었다 (King, 1993).
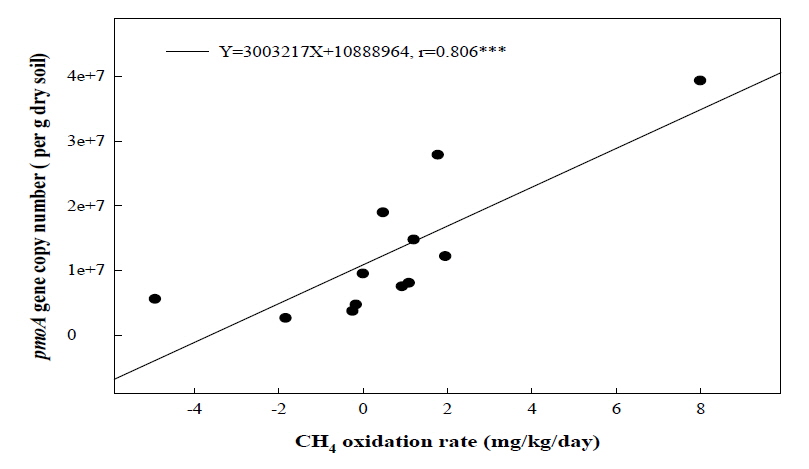
메탄산화능이 높았던 토양에서 실제 미생물들의 활성을 평가하기 위해 Microbial biomass carbon을 측정한 결과 소나무 우점 토양에서 129 mg/kg으로 가장 높았고 참나무와 밤나무 우점 토양에서는 109 mg/kg, 35 mg/kg의 순으로 나타났다 (Table 1). 산림토양의 미생물 활성에 의해 메탄산화가 영향을 받는 것으로 판단되었으며 실제 메탄산화량과 메탄산화균 량 간의 관계를 살펴보기 위하여 토양 내 메탄산 화균의
온실가스 메탄 (CH4)의 주요 소화원 (Sink)으로 평가받고 있는 주요 산림토양의 메탄 산화력을 평가하기 위해 소나무 참나무 밤나무 우점 토양을 선발하여 현장에서 메탄 산화력을 평가하여 다음과 같은 결과를 얻었다. 식생별 토양의 메탄산화력은 토양의 유기물 축적이 가장 많았던 소나무 (평균 1.05 mg/m2/day)가 가장 높았으며, 참나무 (0.930 mg/m2/day), 밤나무 (0.497 mg/m2/day) 우점 토양의 순으로 감소하는 경향을 보였다. 이를 통해 연간 산림토양에서 산화될 수 있는 메탄의 양은 1 ha 면적 당 소나무 우점 토양에서 3.820 kg, 참나무 3.396 kg, 밤나무 1.814 kg으로 조사되었다. 그러나 주요 수종 별 국내 산림 면적 통계정보의 부정확성으로 전체 메탄 산화량의 평가 수행이 불가하였다. 차후 통계자료 확보 후 산정이 가능할 것으로 판단되었다. 결론적으로 토양의 메탄 산화능은 토양의 유기물 함량 및 전체 미생물과 메탄산화균(Methanotrophs)의 활성과 고도의 정의 상관관계가 있었으며, 식재 수종에 따라 메탄 산화능의 차이를 보였다. 현재 산림분야의 온실가스 배출량 산정에 있어서 이산화탄소 흡수량이 큰 부분으로 평가되고 있으나, 본 연구에서 조사한 산림 수종 별 메탄 산화량의 조사를 기반으로 보다 더 넓은 지역의 조사자료를 추가하여 온실가스 산정에 반영한다면 보다 더 정확한 국내 온실가스 배출량 산정이 가능 할 것으로 판단된다.