이 연구는 농산물 중 아클로니펜의 안전관리를 위한 공정분석법을 확립하기 위하여 수행하였으며 분석법의 선택성, 검출한계 및 정량한계, 회수율에 대한 검증을 통하여 아클로니펜의 공정시험법으로의 유효성을 확인하였다. 아클로니펜의 이화학적 특징에 따라 분석기기는 GC-ECD를 사용하였고, 아세톤 추출 후 실리카 카트리지를 이용하여 정제하였다. 개발된 분석법의 회수율은 고추에서 92.3-95.0%, 감귤에서 74.3-90.4%, 아몬드에서 76.7-89.8%였으며, 분석오차는 8% 이하로 코덱스 가이드라인 (CAC/GL 40)에 적합하였다. 또한 GC-MS를 이용한 재확인 과정을 통해 분석법의 신뢰성을 확보하였다. 따라서 본 분석법의 정확성 및 재현성이 입증되어 농산물 중 아클로니펜의 잔류분석에 적용할 수 있을 것으로 판단된다.
Aclonifen is used as a systemic and selective herbicide to control a wide spectrum broad-leaf weeds by inhibition carotenoid biosynthesis, and then its MRLs(Maximum Residue Limits) will be determined in onion and garlic. In this study, a new official method was developed for aclonifen determination in agricultural products to routinely inspect the violation of MRL as well as to evaluate the terminal residue level.
Aclonifen was extracted from crop samples with acetone and the extract was partitioned with dichloromethane and then purified by silica solid phase extraction(SPE) cartridge. The purified samples were detected GC using an ECD detector. Limits of detection(LOD) was 0.001 mg/kg and quantification(LOQ) was 0.005 mg/kg, respectively. For validation purposes, recovery studies were carried out at three different concentration levels (LOQ, 10×LOQ, 50×LOQ, n=5). The recoveries were ranged from 74.3 to 95.0% with relative standard deviations(RSDs) of less than 8%. All values were consistent with the criteria ranges requested in the Codex guidelines(CAC/GL 40).
The proposed analytical method was accurate, effective and sensitive for aclonifen determination and it will be used to as an official method in Korea.
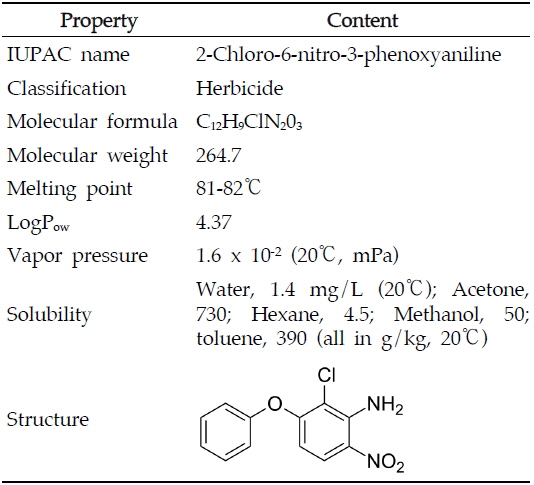
아클로니펜(Aclonifen, 2-chloro-6-nitro-3-phenoxyaniline)은 1983년 Celamerck GmbH & Co. 에서 개발한 디페닐에테르계(diphenyl ether family) 제초제로서 식물체 중 카로테노이드의 생합성을 억제하고 엽록소의 합성에 관여하는 protoporphyrinogen oxidase를 저해하여 살초작용을 나타내는 농약이다(Kilinc
현재 아클로니펜은 국제식품규격위원회(CODEX), 미국, 일본에서는 잔류허용기준이 설정되지 않은 반면 유럽(EU)에서는 채소류, 과일류, 견과종실류 등의 농산물을 대상으로 0.1 mg/kg 이하의 잔류허용기준이 설정되어 있다(EU, 2005). 국내에서는 2014년 근채류인 마늘, 양파를 대상으로 사용등록을 추진함에 따라, 각 작물의 섭취량 및 아클로니펜의 인체 위해도를 고려하여 잔류허용기준 설정을 추진하고 있다. 따라서 본 연구에서는 국내에 유통되는 농산물에 잔류할 수 있는 아클로니펜에 대한 안전관리를 위하여 잔류허용기준 초과유무를 확인할 수 있는 분석법을 확립하고자 하였다.
아클로니펜의 분석과 관련하여 그간 토양, 물, 소변 등에서 GC-ECD, LC-MS/MS를 이용한 분석법(Sicbalbi
아클로니펜(Table 1) 표준품(99.6%)은 Dr. Ehrenstofer GmbH(Augsburg, Germany)사 에서 구입하여 분석물질로 사용하였고, 전처리용 시약으로 사용된 아세톤(acetone), 디클로로메탄(dichloromethane), 아세토니트릴(acetonitrile), 헥산(
[Table 1.] Chemical structure and physicochemical characteristics of aclonifen
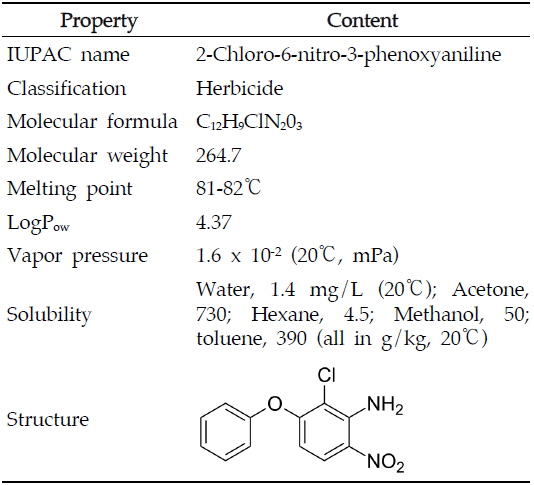
Chemical structure and physicochemical characteristics of aclonifen
아클로니펜 표준품 20.8 mg을 아세톤 20 mL에 용해하여 1,000 μg/mL의 표준원액을 제조하고, 이를 아세톤으로 희석하여 0.05, 0.1, 0.2, 0.5, 1.0, 2.0 및 5.0 μg/mL의 표준용액을 제조하였다. 제조된 표준원액과 표준용액은 모두 갈색병에 담아 4℃에 보관하여 실험에 사용하였다.
균질화된 검체 20 g (과일류와 채소류는 약 1 kg을 혼합하여 분쇄한 20 g, 견과종실류는 약 1 kg을 혼합하여 표준체 420 μm를 통과하도록 분쇄한 후 20 g)에 아세톤 100 mL를 가하여 5분간 고속으로 균질화한 후 이를 여과지가 깔려있는 부흐너깔때기에 흡인여과하고, 아세톤 20 mL로 잔사 및 용기를 씻어내어 상기 여액에 더하였다. 수분함량이 낮은 시료인 아몬드의 경우 물 20 mL를 넣어 30분간 습윤화 후 추출하였다. 잔류물은 500 mL 용량의 분액여두로 옮겨 증류수 100 mL, 포화식염수 30 mL, 디클로로메탄 100 mL를 가한 후 2분간 진탕하고 디클로로메탄층을 무수 황산나트륨에 통과시켜 탈수하였고, 다시 디클로로메탄 50 mL를 가하여 위의 과정을 반복한 후 플라스크에 취하여 40℃ 이하의 수욕상에서 감압 농축하였다. 지방성 검체(아몬드)의 경우 추가적으로 유지성분의 제거를 위해 미리 아세토니트릴로 포화시킨 헥산 30 mL를 건고물에 가하여 재용해 후 250 mL 용량의 분액 여두에 옮기고 미리 헥산으로 포화시킨 아세토니트릴 30 mL씩으로 2회 분배 추출하고 감압 농축하였다. 건고된 잔류물은 5 mL의 헥산으로 재용해하여 정제하였다.
헥산 10 mL로 활성화시킨 실리카 카트리지의 상단에 위의 추출과정을 통해 얻은 잔류물을 넣은 후 이를 헥산/디클로로메탄 혼합액 (80/20, v/v) 10 mL로 씻어내고, 헥산/디클로로메탄 혼합액 (55/45, v/v) 10 mL로 유출시켜 받은 시험액을 40℃ 이하 수욕 상에서 감압농축하고 아세톤 2 mL로 재용해하여 시험용액으로 사용하였다.
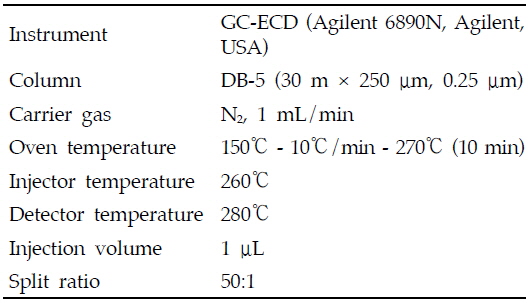
아클로니펜의 분석은 기체크로마토그래프-전자포획검출기(GC-ECD, Agilent GC model 6890A, Agilent, CA, USA)를 사용하였고, 분석용 칼럼은 DB-5(0.25 mm i.d. × 30 m, 0.25 μm; Agilent Technologies CA, USA), 이동상가스(N2) 유량은 1 mL/min, 주입량은 1 μL로 split mode(50:1)를 이용하여 분석하였다. 주입구 온도는 260℃, 검출기 온도는 280℃이었으며, 오븐온도는 150℃에서 검체를 주입하고 분당 10℃씩 270℃까지 승온한 후 10분간 유지하였다(Table 2).
[Table 2.] Analytical conditions for the determination of aclonifen residues
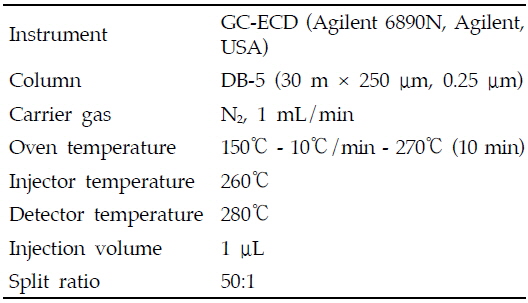
Analytical conditions for the determination of aclonifen residues
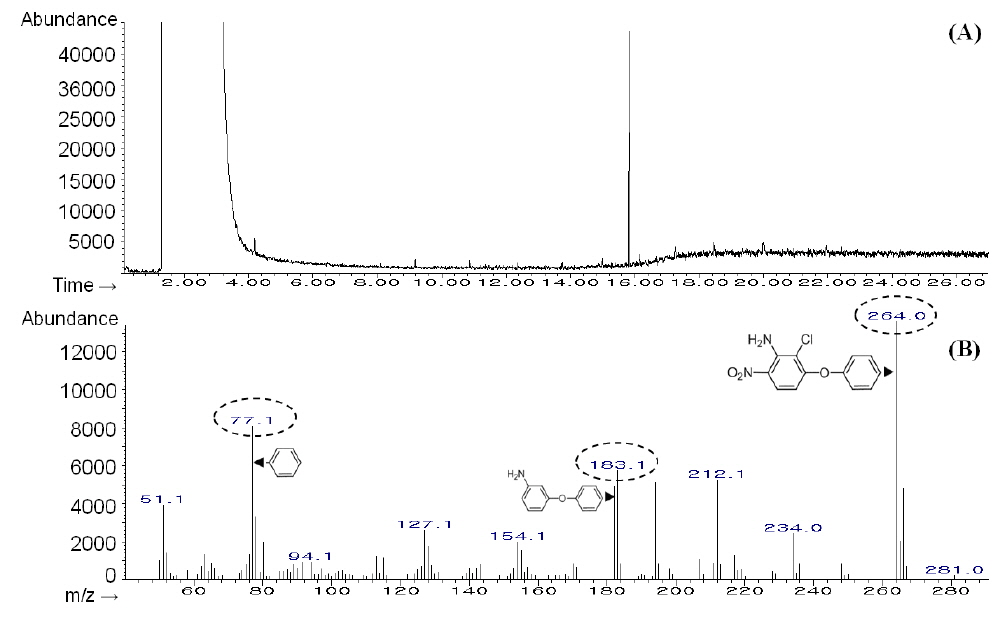
분석법의 신뢰성 확보를 위해 기체크로마토그래프-질량분석기(GC-MS, Agilent Technologies 5793MSD, Agilent, CA, USA)를 이용하여 재확인 과정을 수행하였다. 분석용 칼럼은 DB-5MS capillary column (0.25 mm i.d. × 30 m, 0.25 μm; Agilent Technologies CA, USA), 이동상가스(He) 유량은 1 mL/min, 주입량은 1 μL로 splitless mode를 이용하여 분석하였다. 주입구 온도는 260℃, interface 온도는 260℃이었으며, 오븐온도는 100℃에서 검체를 주입하고 10℃씩 270℃까지 승온한 후 10분간 유지하였다. 질량분석기 조건은 EI(electron impact ionization, 70 eV)를 이용하여 분자량 범위 50-500 m/z의 스캔 모드에서 총이온크로마토그램과 질량 스펙트럼을 확인하고 최적의 특성이온을 선정하였고, 선정된 이온만을 분석하는 SIM(selected ion monitoring) 모드로 재확인하였다.
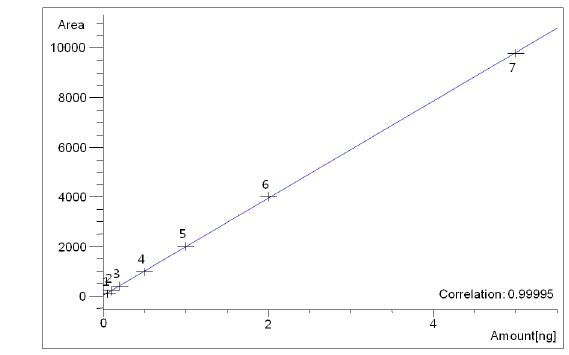
개발한 아클로니펜 분석법의 직선성(linearity), 검출한계(limit of detection, LOD) 및 정량한계(limit of quantification, LOQ), 회수율(recovery), 재현성(reproducibility)에 대해 유효성을 검증하였다. 직선성의 확인을 위하여 아클로니펜 표준용액 0.05-5 μg/mL의 농도 범위에 대한 각각의 피크 면적을 이용하여 검량선을 작성하였고, 검량선의 상관계수(coefficient of correlation,
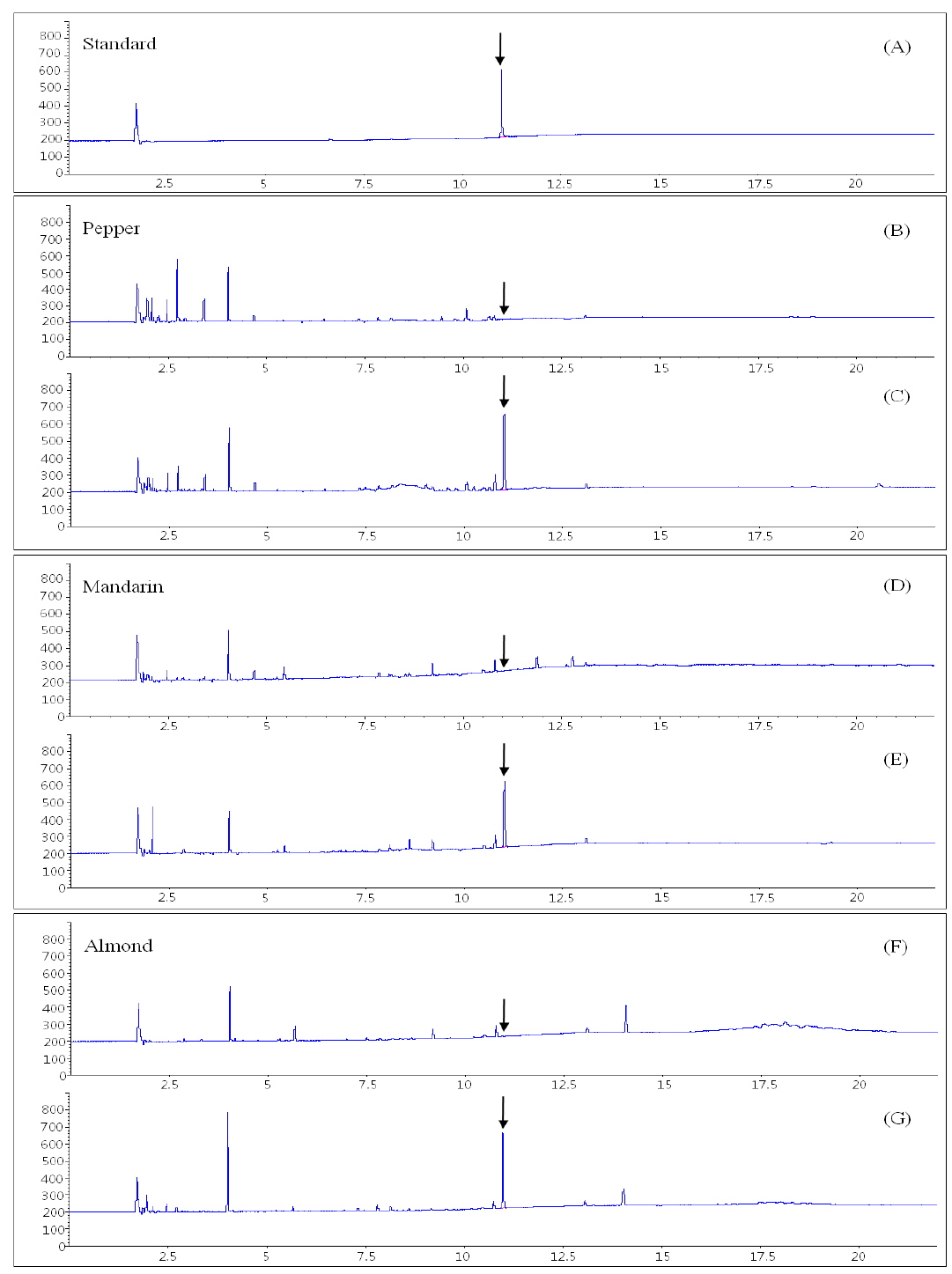
아클로니펜은 분자량이 264.7이고 증기압이 1.6 x 10-2 mPa (20℃)이며 옥탄올/물 분배계수(Log Pow)가 4.37인 비극성 화합물로 분자 구조상 ECD에 선택적으로 감응하는 할로겐 원소와(염소,chlorine) 질산기(nitrate)를 포함하고 있어 GC-ECD를 분석기기로 선정하였다(Table 2). 분석용 칼럼은 여러 종류의 물질에 광범위하게 사용 가능한 비극성 칼럼인 DB-5를 사용하였으며, 아클로니펜의 기기상 감도를 높이고 시료에 존재하는 간섭물질로부터 선택적으로 분리하기 위하여 칼럼의 승온 온도를 조절하여 최적의 기기분석 조건을 확립하였다. 이때 아클로니펜의 머무름 시간은 11분대로 확인하였다(Fig. 2).
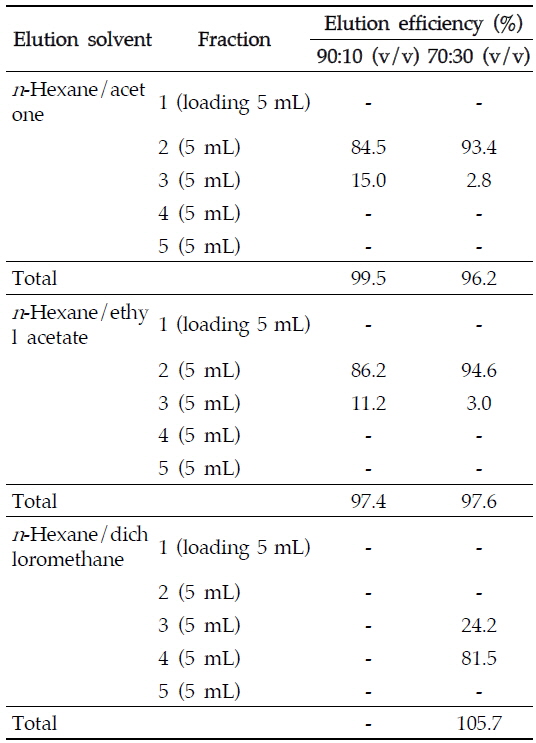
본 연구에서는 고추, 감귤, 아몬드 중 아클로니펜의 최적추출용매를 선정하기 위해서 식품 및 농산물 검체의 잔류농약 추출에 주로 사용되는 수용성 유기용매인 아세톤, 아세토니트릴, 메탄올의 추출 효율을 비교하였다. 세 용매 모두 90% 이상의 우수한 추출효율을 보였으나, 아세톤으로 추출시 효율이 가장 높았고 아클로니펜의 머무름 시간대에 간섭물질이 존재하지 않아 이를 추출용매로 선정하였다. 추출 후 검체추출액은 1차적으로 불순물 제거를 위해 디클로로메탄을 이용한 액-액 분배법을 적용하였으며, 포화식염수를 첨가하여 염석효과를 통해 분배효율을 향상시켰다. 또한 50% 이상의 유지성분을 함유하고 있는 지방성 식품인 아몬드의 경우 아세톤으로 추출 시 다량의 유지성분이 동시에 추출되어 농축 후에서 잔여물이 남게 되는데 이와 같은 유지 및 비극성 성분의 정제를 위해 추가적으로 헥산/아세토니트릴 분배법을 적용하였다. 그러나 1차 정제과정을 거친 후의 추출액은 여전히 검체의 일부 불순물을 포함하고 있으며, 기기분석 시 많은 간섭물질이 존재하므로 SPE 카트리지를 이용한 2차 정제과정이 요구되었다. 정제과정 확립을 위해 플로리실과 실리카 카트리지의 회수율을 비교 실험하였는데 실리카 카트리지에서 더 높은 회수율을 보였고 플로리실 카트리지의 아클로니펜에 대한 흡착성이 상대적으로 약한 것으로 보여 실리카 카트리지를 2차 정제에 사용하였다. 효과적인 정제를 위해 헥산/아세톤, 헥산/에틸 아세테이트, 헥산/디클로로메탄 90/10 (v/v), 70/30 (v/v) 각각의 용매 조성으로 정제효율을 비교하였다. 헥산/아세톤, 헥산/에틸 아세테이트의 경우 90/10 (v/v), 70/30 (v/v)의 각 조성으로 정제 실험을 한 결과 카트리지에 아클로니펜이 흡착된 후 바로 용출되어 정제 용매로 사용하기 어려웠지만, 헥산/디클로로메탄의 경우 70/30 (v/v)의 용매조성에서 시료 로딩 후 15 mL를 가했을 때 초기 5 mL에서는 아클로니펜이 용출되지 않고, 10∼15 mL에서 아클로니펜 105.7%가 회수되어 헥산/디클로로메탄을 용매로 사용하는 것이 보다 효과적임을 확인할 수 있었다(Table 3). 따라서 실리카 카트리지를 본 실험의 정제 카트리지로 헥산/디클로로메탄을 정제용매로 선택하였으며, 정제조건의 최적화를 위해 용매의 극성도를 순차적으로 조절하여 정제 실험을 추가로 실시하였다. 헥산/디클로로메탄 (80/20, v/v), 헥산/디클로로메탄 (75/25, v/v), 헥산/디클로로메탄 (65/35, v/v), 헥산/디클로로메탄 (60/40, v/v), 헥산/디클로로메탄 (55/45, v/v)으로 세분화하여 각 용매 조성에 대해 5 mL 씩 4개의 분획을 받아 정제 테스트를 진행한 결과 헥산/디클로로메탄 (55/45 v/v) 10 mL에서 가장 높은 회수율을 보였고, 헥산/디클로로메탄 (80/20, v/v) 10 mL로 용출해 주었을 때 다양한 간섭물질로부터 아클로니펜을 효과적으로 정제할 수 있었다.
[Table 3.] Comparisons of elution solvents for aclonifen analysis using silica cartridge
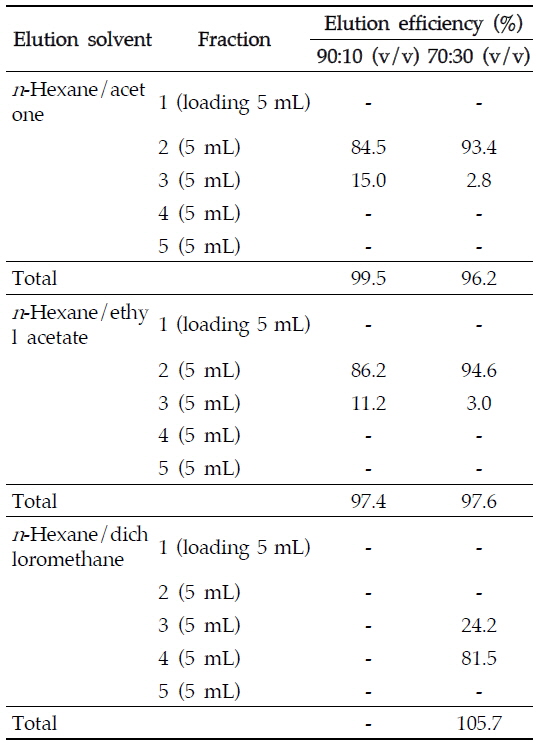
Comparisons of elution solvents for aclonifen analysis using silica cartridge
아클로니펜의 선택성(Selectivity)은 표준용액, 무처리 시료, 표준용액을 첨가한 회수율 시료의 크로마토그램을 서로 비교하여 평가하였다. 무처리 시료와 표준용액을 첨가한 시료를 확립된 시험방법에 따라 분석한 결과, 무처리 시료 중 아클로니펜과 같은 머무름 시간을 갖는 어떠한 간섭물질도 검출되지 않아 검체 중 아클로니펜 분석을 위해 확립된 본 분석법의 높은 분리능과 선택성을 확인할 수 있었다. 아클로니펜의 직선성(linearity)을 확인하기 위하여 0.05, 0.1, 0.2, 0.5, 1.0, 2.0 그리고 5 μg/mL 1 μL를 주입하여 분석한 결과 상관계수(
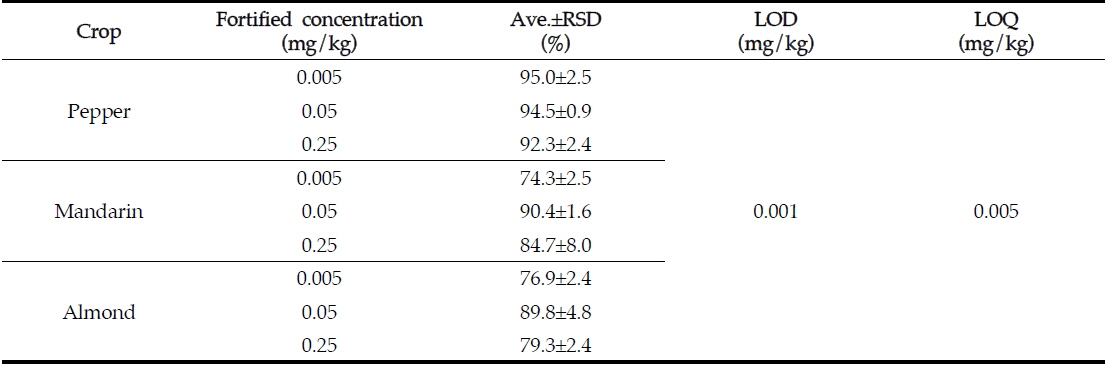
[Table 4.] LODs, LOQs, and recoveries of aclonifen in pepper, mandarin and almond
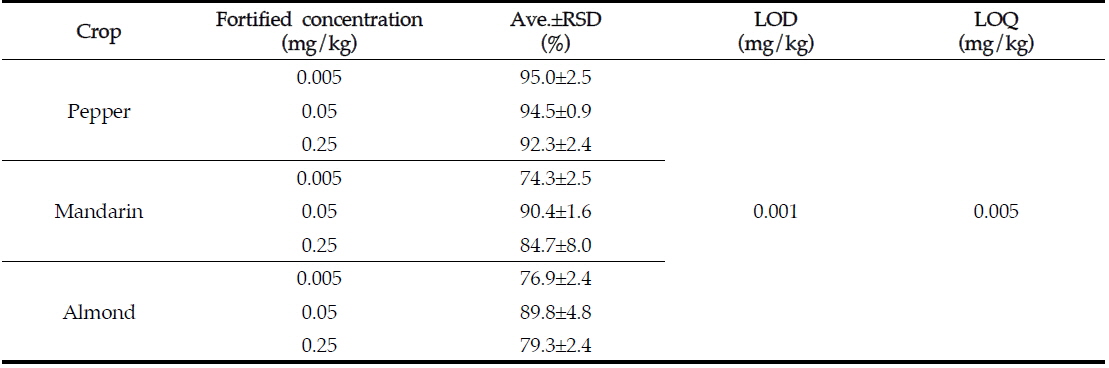
LODs, LOQs, and recoveries of aclonifen in pepper, mandarin and almond
아클로니펜의 검출한계는 기기 크로마토그램 상에서 신호 대 잡음비(S/N ratio) 3이상으로 결정하여 분석기기의 최소 검출량이 0.01 ng에 따른 검출한계는 0.001 mg/kg이었고, 정량한계는 신호 대 잡음비(S/N ratio) 10 이상으로 결정하여 0.005 mg/kg이다. 본 분석법의 정량한계는 EU에 설정되어있는 최저 잔류허용기준인 0.05 mg/kg의 절반 미만으로 본 분석법의 정량한계로 적합한 수준이었다(Table 4).
분석법의 정확성과 재현성 및 효율성을 평가하기 위하여 정량한계, 정량한계의 10배, 정량한계의 50배 수준인 0.005, 0.05와 0.25 mg/kg의 처리농도로 회수율 실험을 5반복 수행하였다. 평균 회수율은 고추에서 92.3-95.0%, 감귤에서 74.3-90.4%, 아몬드에서 76.9-89.8%이었고, 분석오차는 8% 미만으로 잔류물 분석에 관한 CODEX 가이드라인(Codex Alimentarius Commission, CAC/GL 40)의 잔류농약 분석 기준에 적합함을 확인할 수 있었다(Table 4). GC-ECD를 이용하여 분석한 고추, 감귤, 아몬드 중 아클로니펜 회수율 크로마토그램을 Fig. 2에 제시하였다.
검체 중 아클로니펜의 재확인을 위해 분자량 범위 50-500 m/z의 스캔모드에서 표준용액을 주입하여 총이온크로마토그램과 질량 스펙트럼을 확인하였다(Fig. 3). 아클로니펜의 분자량은 264.7이나 이는 분자 내의 염소원자의 두 개의 안정한 동위원소(35Cl, 37Cl)가 존재하는 비율을 고려하여 계산한 평균 분자량이며, 실제로는 분자량이 264와 266인 아클로니펜이 각각 76%, 24%의 비율로 존재한다. 이 중 자연계에 많이 존재하는 35Cl을 포함한 264 m/z을 선택하여 검출하였으며 동시에 37Cl로 인하여 발생하는 266 m/z 이온의 존재와 264 m/z와의 비율도 확인하였다. Fig. 3의 질량스펙트럼에 의하면 분자이온(M+)이 가장 큰 이온으로 나타나며 방향족 화합물에서 주로 나타나는 벤젠에 의한 77 m/z과 아클로니펜에서 염화이온 및 질산이온이 깨져서 나타난 183 m/z이 나타나 이를 특성이온으로 선정하였으며 머무름 시간은 15.8분이었다.