In this study aiming at the cultured olive flounders in Jeju island of Korea, has performed a total of 216 cases of pathogen tests for the olive flounders which seemingly had the symptom of emaciation in 24 farms on the suspicion of its occurrence from June 2010 to December 2013 and intended to get the basic information about the pathogen. According to the survey results of the emaciation infection status of 24 farms in Jeju over the period of this survey, it was confirmed that 18 (75%) of 24 farms in Jeju are positive in the emaciation infection. Among them, as for the rate of infection per year, it was observed that they are 38% in 2010, 48% in 2011, 50% in 2012 and 60% in 2013, and over the period of this survey the infection rate in accordance with the temperature of water has observed a variety of incidence rates from the summer to the winter season. In addition, according to the results of emaciation infection status for each size, the equivalent showed a detection rate, 54% in 11-20 cm, 43.9% in 21-30 cm and 25.4% in over 31 cm. This result accounts for an important portion among the diseases of farmed olive flounders in Jeju, is considered to be one of the diseases which cause troubles in the farms for olive flounders on land and it is thought that it can be utilized as basic data in order to estimate emaciation which may occur in the similar size of the cultured olive flounders in Jeju island.
1990년대부터 각종 해수어의 양식이 활발하게 이루어져 각국에서 종묘 수입이 성해지자 방역체계가 미비한 상태에서 수입종묘와 같이 질병도 함께 도입되어 우리나라에 없었던 질병들이 유행하기 시작하였으며(Chun, 2006), 질병의 발병 양상 또한, 양식 초창기에는 고수온기에 기생충 및 세균에 의한 단독 감염이 주를 이루었으나 최근에는 수온과 상관없이 연중 다양한 병원체가 혼합감염의 형태로 질병을 일으키고 있어 수산 생물의 대량 폐사를 유발시키기도 한다(Kim et al., 2006). 최근 들어 외래 질병의 유입 가능성이 증가하고 양식 어류의 질병 연관성에 대한 관심이 증가하면서 질병을 전반적으로 모니터링하거나 질병과의 상관관계를 구명하고자 하는 연구가 점차 증가하고 있는 추세이다(Cho et al., 2009; Jung et al., 2012; Song et al., 2013). 그러나 현재까지 국내 양식 어류에 대한 질병 조사는 대부분 특정 질병을 중심으로 조사되어 왔으며(Kim et al., 2006; Cho et al., 2008; Kim et al., 2010), 원인불명의 질병에 대해서는 연구가 미미한 실정이다.
국내 양식 산업의 대표적 품종인 넙치(
본 연구에서는 2010년부터 2013년까지 국내 양식 산업의 대표적 품종인 넙치에서 발생하는 여윔증 원인체의 감염 현황을 파악하기 위하여 Kim et al. (2015)의 방법에 따라 PCR법과 조직학적 검사를 통해 여윔증 원인체의 감염률을 조사하고자 한다.
제주도 양식 넙치를 대상으로 여윔증 원인체의 감염 현황을 조사하기 위해, 2010년부터 2013년까지 4년 동안 양식 넙치를 대상으로 2010년에 21회(6, 7, 8, 11, 12월), 2011년 25회(3, 7, 8, 10, 11월), 2012년 4회(7, 10, 11월), 2013년 16회(1, 3, 7, 8, 11, 12월)에 걸쳐 동.하절기 및 중복된 양식장을 포함하여 24개 소 양식장에서 66회의 샘플링을 실시하여 총 216마리를 대상으로 실험을 수행하였고, 확보된 샘플은 육안상 여윔증상을 보이며 폐사가 발생하여 의뢰를 맡긴 양식장과 일반적인 질병증상을 보이는 양식장을 대상으로 감염조사를 실시하였다. 실험 전수질측정기 YSI Model 650XL (YSI,USA)을 사용하여 수온측정을 실시하였고, 실험실로 운반된 어류의 외부 및 내부증상을 확인하고, 어체의 전장 및 무게를 측정하였다.
DNA를 분리하기 위하여 Kim et al. (2015)에 보고된 방법을 참고하여 실험어의 신장을 해부용 칼로 절개한 후 DNeasyⓇ Blood & Tissue Kit (Qiagen Hilden, Germany)을 사용하여 DNA를 분리하였다. 먼저 ATL buffer 180 μL와 proteinase K 20 μL를 첨가하여 56℃에서 조직이 녹을 때까지 반응시켰다. 반응 후, AL buffer 200 μL를 섞은 다음 ethanol 200 uL를 더하여 spin column에 옮겨 6,000 g (gravity)로 1 분간 원심분리하였다. Column을 새로운 tube로 옮긴 후 AW1 buffer와 AW2 buffer 500 μL를 이용하여 세척과정을 거친 후, AE buffer 50 μL를 첨가하여 DNA를 분리하였다. 분리된 DNA는 실험 전까지 -20℃에 보관하여 사용하였다.
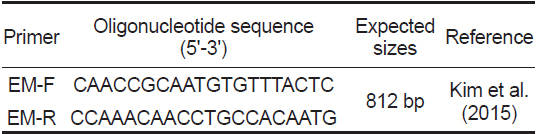
PCR분석을 위하여 Kim et al. (2015)이 여윔증 진단을 위하여 제시한 primer set를 사용하였으며(Table 1), PCR은 microtube에 1 μM의 각 primer, 2.5 mM의 각 dNTP, 10 x G-Taq Buffer, 2.5 U G-Taq DNA polymerase (Gene Pro Themal Cycler Cosmo, Korea) 및 template DNA로서 추출된 핵산을 첨가한후 distilled water로 PCR 혼합물의 최종 volume이 20 μL 가 되게 하였다. PCR 조건은 95℃에서 3분간 pre-denaturation 시킨 후, 95℃에서 30초 denaturation, 55℃에서 30초 annealing, 72℃에서 30초 extension의 반응을 1회로 하여, 35회 반복하여 반응시켰다. 그리고, 72℃에서 7분간 post-extension시켰다. PCR 후 증폭 산물은 1×TAE buffer를 전기영동을 위한 완충액으로 하여, 0.5 μg/μL EtBr이 첨가된 1% agarose gel 상에서 전기영동한 후, UV 검출기를 이용하여, ultraviolet상에서 검출되는 산물의 크기를 관찰하였다.
[Table 1.] PCR primers used in this study
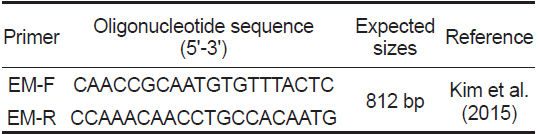
PCR primers used in this study
조직병리학적 분석을 위해 넙치의 신장 조직을 적출하여 Bouin’s solution에 24시간 동안 고정한 후 70% EtOH 탈수 하였다. 이후 파라핀 침투를 시키고(Leica EG 1150HC, Germany) 포매기(Leica Jung 820, Germany)를 사용하여 포매를 실시하였다. 이후 마이크로톰으로 4-5 μm 두께의 절편을 잘라 유리 슬라이드에 부착시켜 건조시켰다. 제작된 조직표본은 haematoxylin과 eosin (H&E)으로 염색을 실시한 후 광학현미경(Zeiss LT60, Germany)으로 검경하였다.
그 밖에 질병은 세균성 및 바이러스성 질병에 대해 일반적인 검사방법에 따라 진단하였다. 세균성 질병인 경우는 간, 신장, 비장을 Tryptic Soy Agar (Difco Co., USA), Thiosulfate Citrate Bile Salts Sucrose Agar (Difco), Salmonella-Shigella (Difco) 배지에 접종하여 25℃에서 배양하였고, 필요 시 API kit (BioMerieux, France)를 사용하여 동정하였다.
바이러스 질병인 경우 Cho et al. (2007)의 방법에 따라 primer sets를 동일하게 제작한 후 viral hemorrhagic septicemia virus (VHSV), viral nervous necrosis virus (VNNV), hirame rhabdovirus (HRV) 및 red seabream iridovirus (RSIV) 등 4종의 바이러스를 대상으로 감염여부를 확인하였다.
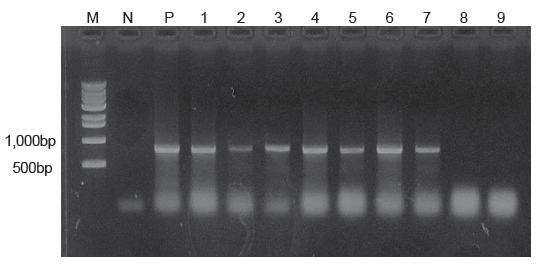
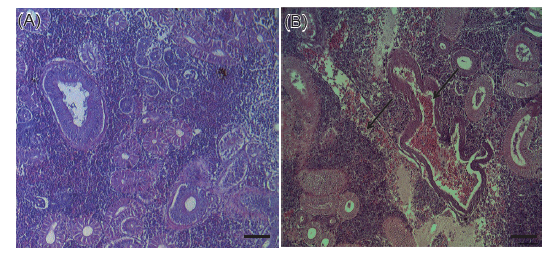
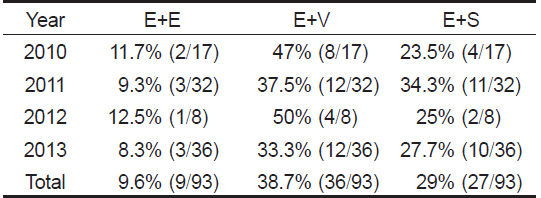
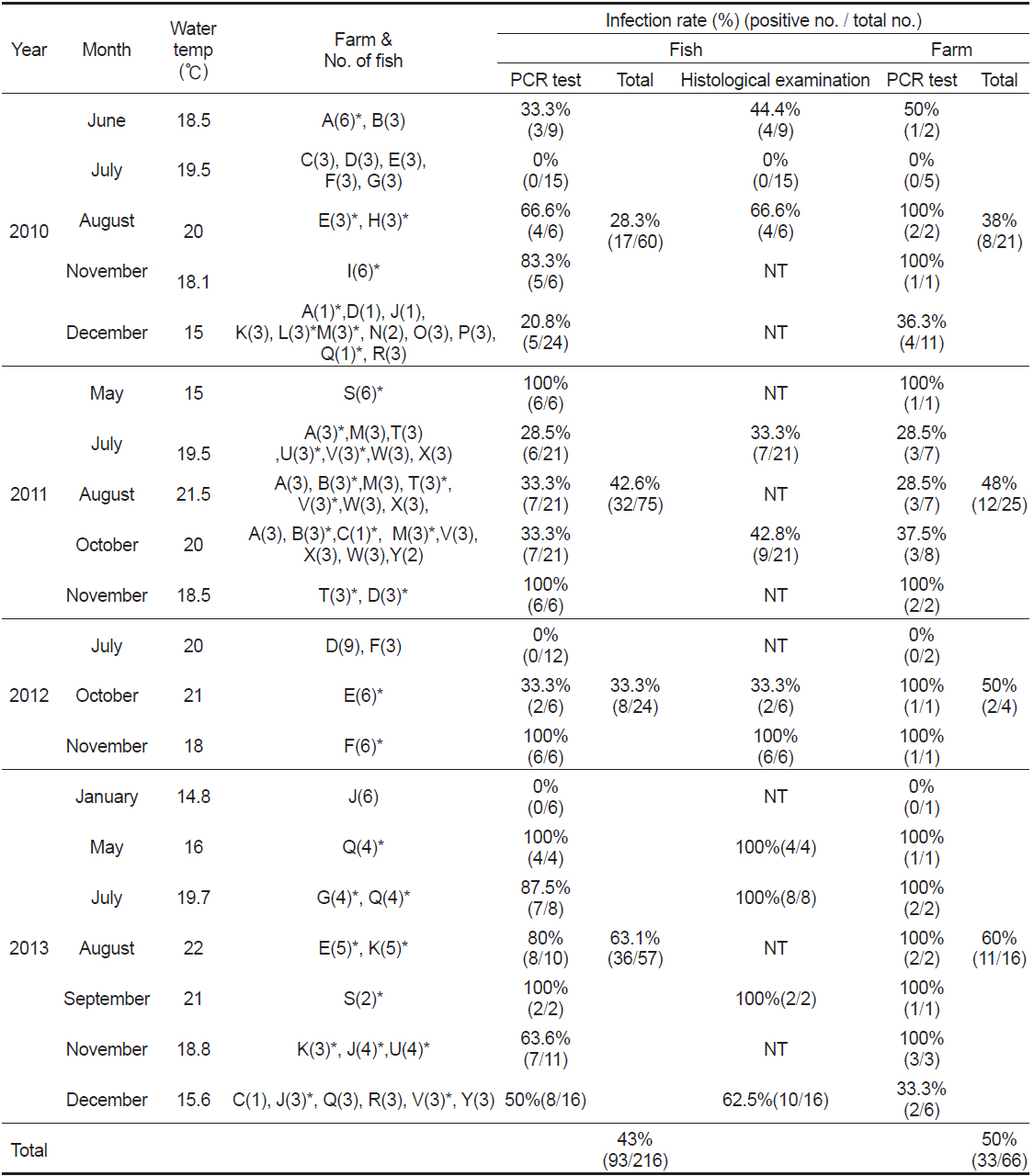
본 연구에서는 우리나라 제주도에서 양식되는 넙치를 대상으로 2010년 6월부터 2013년 12월까지 총 66회에 걸쳐 216마리의 넙치를 대상으로 여윔증 원인체의 감염 현황을 조사하여 향후 여윔증 연구에 대한 기초 자료로 사용하고자 하였다. 그 결과, 66회에 걸친 조사기간 동안의 대상 양식장 중에서 50% (33회)에서 여윔증 양성 반응이 나타났고, 총 216마리의 넙치중 93마리(43%)에서 양성반응을 나타내었다(Fig. 1, Table 2). PCR양성반응을 보인 넙치의 경우, 신장에서 4-9 μm 크기의 원형 또는 난원형의 포자가 다수 관찰되었고, 기부골절, 사구체, 핵 등의 파괴와 변형된 변형체(plasmodium)가 일부 관찰되었으며(Fig. 2B), PCR 음성반응을 보인 넙치에서는 정상적인 신장 형태가 관찰되었다(Fig. 2A). 이러한 결과는 Kim et al. (2015)의 보고와 일치하였으나, 기생충성 질병으로 잘 알려진
Prevalence of emaciation disease in cultured olive flounder Paralichthys olivaceus of Jeju from 2010 to 2013
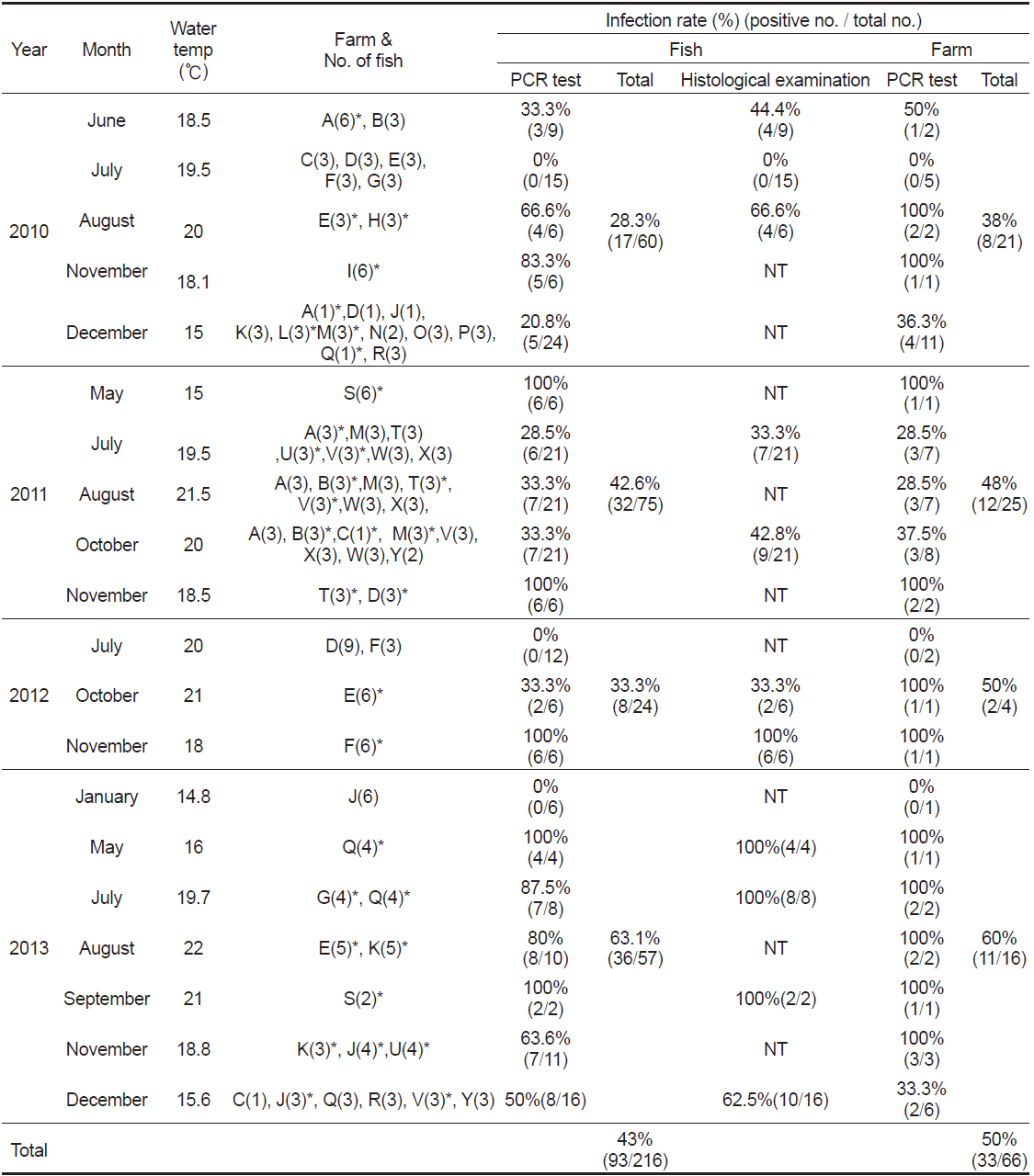
양식장 연도별 감염률은 2010년도 21개소 중 8개소(38%), 2011년도 25개소 중 12 개소(48%), 2012년도 4개소 중2개소(50%), 2013년도 16개소 중11개소(60%)에서 양성임을 확인하였다(Table 2). 그 중 양식장에서 여윔증 발생이 의심되어 분석을 의뢰해온 경우에는 분석 결과, 59.5% (75마리/126마리)의 높은 검출율을 보였고, 무작위로 여윔증 모니터링을 실시한 경우에는 20% (18마리/90마리)의 낮은 검출율을 나타내었다(data not shown). 또한, 검출된 양식장은 이후의 감염 발생율이 높은 것으로 확인되었고, 향후에는 발병경로, 기회감염성, 숙주의 감수성 등 질병에 대한 전반적인 연구가 뒤따라야 할 것이다.
여윔증 원인체에 의한 연도별 감염률은 2010년도 60마리 중 17마리(28.3%), 2011년도 75마리 중 32마리(42.6%), 2012년도 24마리 중8마리(33.3%), 2013년도 57마리 중36마리(63.1%) 등으로 나타났고, 조사 기간 중 수온에 따른 감염률은 여름철부터 겨울철까지 다양하게 나타나는 것으로 조사되었다(Table 2). 제주도의 양식장은 대부분 연중 17℃ 내외의 지하해수를 혼합 사용하여 여름철에도 사육수온을 23℃ 내외, 겨울철에는 14℃ 이상을 유지하고 있어(Oh et al., 1998), 여윔증이 연중 발생하는 원인으로서 제주도의 시기적인 수온변동이 크지 않은 것도 연관성이 있을 것으로 추정된다.
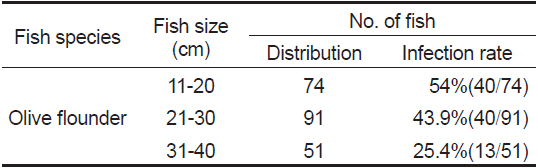
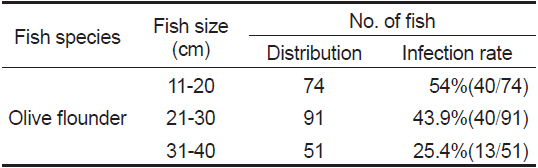
현재까지 어류에서 보고되는 여윔증 원인체에 대한 생활사가 밝혀진 종은 없으며, 감염되는 어류의 크기 및 감염경로 등에 대해서도 조사가 부족한 실정이다. 본 연구에서 넙치의 크기별로 감염 현황을 조사한 결과, 11-20 cm 74마리 중 40마리(54%), 21-30 cm 91마리 중 40마리(43.9%), 31-40 cm 51마리 중 13마리(25.4%)의 검출률을 나타내었다(Table 3).
[Table 3.] Size distribution of fish isolated with emaciation disease
Size distribution of fish isolated with emaciation disease
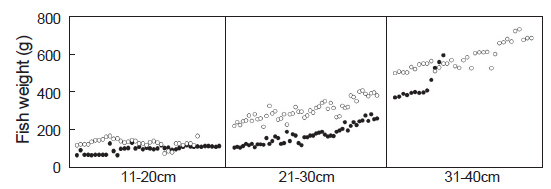
본 연구조사에서 여윔증 감염으로 판정된 양식넙치의 외부 임상증상을 관찰해 본 결과, 전체적으로는 체색흑화 및 복부여윔증상이 주로 관찰되었고, 내부 임상증상 관찰에서는 간 출혈 및 신장부위가 하얗게 변색되는 증상을 보였으며, 그 외에 특별한 증상은 관찰되지 않았다(data not shown). 하지만, 여윔증에 감염된 넙치가 여윔증이 발병하지 않는 넙치보다 30-40% 낮은 체중을 나타내었고(Fig. 3), 이러한 결과는 Kim et al. (2015)이 보고한 결과와 일치하였다. 이는 병원성에 따른 병리학적 특성을 평가하는 데에 있어 유용한 기초 자료로 활용될 것으로 기대되며, 여윔증에 의한 어체중 감소와 여윔증 병원체의 병원성과의 상관관계에 대해서는 앞으로 좀 더 체계적인 연구가 이루어져야 될 것이다.
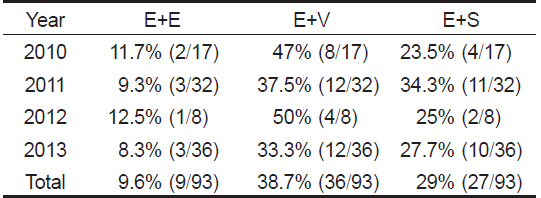
기생충은 넙치의 종묘 생산시기부터 출하 전까지 넙치의 성장과 폐사에 밀접한 영향을 미치는 것으로 알려져 있으며(Chun, 2006), 세균이나 바이러스 등에 의한 2차 감염을 유발하는 것으로 알려져 있다(Kim et al., 2010). 또한, Cho et al. (2007)은 넙치로부터 분리된 병원체의 감염상황을 비교 분석한 결과, 2종이상 병원체의 혼합 감염이 46%를 차지하였으며, 세균끼리의 혼합감염보다는 세균과 기생충의 혼합감염, 세균과 바이러스의 혼합감염 또는 세균, 바이러스 및 기생충이 모두 혼합되는 경우가 많은 것으로 나타났다.
본 연구의 병원체 감염 현황 결과, 여윔증과 주요 세균성 질병의 혼합 감염은
Occurrence of mixed infection by emaciation agent and main bacteria in cultured olive flounder Paralichthys olivaceus of Jeju from 2010 to 2013
본 연구에서는 2010년부터 2013년까지 4년간 제주도 양식넙치에서 발생하는 여윔증 원인병원체의 발병 현황을 조사하기 위하여, PCR 방법 및 병리조직학적 관찰 등의 방법을 사용하여 모니터링 하였으며, 매년 넙치양식장에서 38-60%의 매우 높은 감염률을 나타낸다는 것을 확인하였다. 제주도 넙치양식장에서 발생하는 아직 밝혀지지 않은 대량폐사의 원인을 규명하는데 있어서도 본 연구결과는 중요한 자료가 될 수 있을 것이며, 향후 국내 넙치에서 발생하는 여윔증 연구에서도 좋은 기초자료로 활용 가능할 것이다.