This study was conducted to evaluate the effect of lactic acid bacterial fermentation on the anti-oxidant and antiinflammatory activity of an edible brown alga, Eisenia bicyclis. Lactic acid bacteria were inoculated into and cultivated in E. bicyclis water extract. The antioxidant activity of the extract was assayed before and following fermentation. Antioxidant activity was determined by assaying the levels of radical scavenging activity against 2,2′-diphenyl-1-picrylhydrazyl (DPPH), hydroxyl radical and alkyl radical. The lactic acid bacterial fermentation of E. bicyclis extract resulted in enhanced antioxidant activity. The greatest enhancement of antioxidant activity was seen in the DPPH radical scavenging assay, in which E. bicyclis extract was fermented by Pediococcus pentosaceus MBP-34 strain for 12 h. This fermented extract also exhibited higher inhibitory activity (96.66%) on nitric oxide production compared with other lactic acid bacterial fermented extracts or raw extract (189.60%). In conclusion, fermentation by bacterial strain is an attractive strategy for developing value-added food ingredients.
대황(
대황과 같은 해조류의 유용성분을 추출하여 이용할 때에는 해 조류를 유기용매 추출, 열수 추출, 산·알칼리 처리 또는 효소처리 등의 방법들이 대부분이다(Do et al., 1997; Kim and Bae, 2002). 하지만 해조류에 포함되어 있는 다당류 대부분이 비소화성 복합다당류이기 때문에 산이나 알칼리에 비교적 안정하고 특수한 미생물 효소에 의하지 않고서는 분해가 어려워 여러가지 생체 활성물질의 변질 및 파괴 등을 초래하거나 효과적인 추출이 어려운 단점을 가지고 있다(Song et al., 2011). 또한 이러한 추출방법들은 고비용, 복잡한 공정 및 환경오염 등의 문제뿐만 아니라, 해조류 추출액에 알긴산 등의 점질 다당류와 해조류 특유의 향, 풍미, 조직감 등이 잔존하는 한계점이 있다(Lim et al., 1995; Kim and Bae, 2002; Song et al., 2011). 이러한 단점을 극복하기 위하여 효모, 유산균, 곰팡이 등의 발효 미생물을 이용한 다시마, 감태 및 톳 등의 해조류 발효에 대한 연구가 진행되었다(Bae and Kim, 2010; Eom et al., 2010; Song et al., 2011). 대황의 경우, Eom et al. (2011)이 발효에 의한 대황 추출액의 폴리페놀 함량 증가와 2,2′-diphenyl-1-picrylhydrazyl(DPPH) radical 및 hydroxyl radical 소거활성에 대한 단편적인 연구 결과만 보고하였다. 이에 본 연구에서는 우수한 생리활성을 가지고 있는 것으로 알려져 있음에도 불구하고 상대적으로 상업적 적용에 대한 연구가 미진한 대황의 활용도를 높이기 위하여 미생물 발효에 의한 대황 발효액의 항산화 활성 및 항염증 활성 변화를 비교하였다. 본 연구에서 얻어진 결과는 향후 발효공정을 이용한 다양한 해조류발효 제품개발에 연결될 것으로 기대된다.
본 연구에 사용된 대황(
Folin-Ciocalteu 법(Waterman and Mole, 1994)을 수정한 Kim at al. (2006)의 방법에 따라 phenolic compound를 정량하였다. 먼저 시료를 spectrophometer의 측정범위까지 희석을 하고 희석된 시료 80 μL 와 1 N Folin-Ciocalteu reagent 0.4 mL를 eppendorf tube에 넣은 후 3분간 상온에서 방치한 후, 7.5% Na2CO3를 0.32 mL 넣고 암실에서 20분간 방치하였다. 이후 시료를 96 well plate에 0.2 mL씩 옮긴 후 GENios® microplate reader (Tecan Austria GmbH, Grödig, Austria)를 사용하여 765 nm에서 흡광도 값을 측정하였다. 추출물 안의 total phenolic content의 농도는 표준물질로 galic acid를 이용한 다음 선형 방정식을 사용하여 나타내었다.
Y=0.007X+0.063, r2= 0.9997
여기서 Y는 흡광도 값, X는 total phenolic compound를 나타낸다. 추출물 1g 당 galic acid equivalents의 mg (mg GAE/g)로 나타내었다.
DPPH radical 소거능은 Qureshi et al. (2010)의 방법으로 분석하였다. 시료 100 μL에 150 μM DPPH 용액 100 μL를 혼합 후 반응액을 96 well plate에 옮겨 암실에서 30분간 방치 후 GENios® microplate reader (Tecan Austria GmbH, Grödig, Austria)를 통해 517 nm에서 흡광도를 측정하였다. DPPH radical 소거능은 아래의 식으로 계산하였다.
Hydroxyl radical 소거능은 Rosen and Rauckman (1984)의 방법으로 분석하였다. 시료 20 μL에 0.3 M DMPO 20 μL, 10 mM FeSO4 20 μL, 10 mM H2O2 20 μL를 혼합한 다음 quartz capillary tube에 옮긴 후 2.5분 후에 electron spin resonance (ESR) spectrometer로 측정하였다. 실험조건은 다음과 같다: magnetic field, 336.5±5 mT; power, 1 mW; modulation frequency, 9.41 GHz; amplitude, 2.5×100; sweep time, 30 sec; temperature 298 K. Hydroxy radical 소거능은 H 과 H0의 상대적인 높이에 의해 측정하는 다음 수식에 의해 계산되었다.
Alkyl radical (peroxyl radical)은 Hiramoto et al. (1993)의 방법에 따라 다음과 같이 측정하였다. 10 μL의 시료에 각각 10 μL의 phosphate buffered saline (PBS), 40 mM AAPH [2,2-azobis-(2-amidinopropane)-dihydrochloride], 40 mM POBN α-(4-pyridyl-1- oxide)-N-tert-butylnitrone을 첨가한다. 그리고 37℃에서 30분간 반응시킨 후 quartz capillary tube에 옮겨 ESR spectrometer를 이용하여 측정하였다. 실험조건은 다음과 같다: magnetic field, 336.5±5 mT; power, 7 mW; modulation frequency, 9.41 GHz; amplitude, 6.0×100; sweep time, 30 sec; temperature 298 K. Alkyl radical 소거능은 아래의 식으로 계산하였다.
마우스의 대식세포주인 Raw 264.7 cell은 한국세포주은행(KCLB)에서 분양 받았으며, 세포 배양을 위해 10% fetal bovine serum (FBS)과 1% penicillin-streptomycin을 포함하는 Dulbecco’s Modified Eagle Medium (DMEM) 배지를 사용하였다. 세포는 37℃, 5% CO2 조건에서 배양하였다.
96-well plate 에 Raw 264.7 cell 1×105개를 분주하고, 4시간 뒤에 새 배지로 교체 후 일정농도(0.5 mg/mL)의 대황 추출액 및 유산균 대황 발효액을 24시간 동안 처리하였다. 이후, 3-(4,5-dimethylthiazol-2-ly)-2,5-diphenyltetrazolium bromide (0.1 mg/mL)을 각 well에 처리하여 4시간 배양한 후 형성된 insoluble formazan을 DMSO에 녹이고 ELISA reader (Wallac 1420, USA)를 통해 540 nm에서 흡광도를 측정하였다.
>
Cell base nitric oxide (NO) assay
Raw 264.7 cell을 96 well plate에 1×105개를 분주하고, 24시간 뒤에 새 배지로 교체 후 일정농도(0.5 mg/mL)의 대황 추출액 및 유산균 대황 발효액을 1시간 동안 전처리 후 lipopolysaccharide(LPS)를 1 μg/mL로 24 시간 동안 처리하였다. 세포배양 상층액 50 μL를 96 well에 덜어 놓고 Griess 용액 (1% sulfanilamide/0.1% N-(1-naphthyl)-ethylenediamine dihydrochloride/2.5% H3PO4) 50 μL를 첨가하고 5분 후 ELISA reader (Wallac 1420; Perkin Elmer, Turku, Finland)를 통해 540 nm에서 흡광도를 측정하였으며, 3 반복을 원칙으로 하여 평균값을 구하였다.
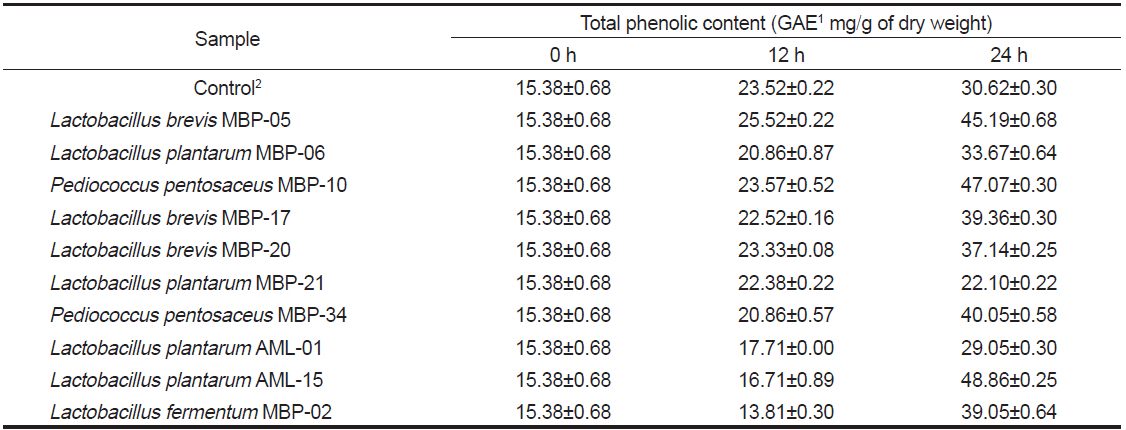
페놀 화합물은 다양한 생리활성 기능을 가지고 있다고 알려져있다(McDougall et al., 2005). 육상 식물의 페놀 화합물과 비슷한 구조를 띄는 phlorotannin은 해조류에서 유래된 phenolic compound로서 여러 생리활성들과 관련된 것으로 보고되고 있다(Lee et al., 2008). 본 실험에 사용된 10종의 균주들 중에서 대황 발효에 유용한 균주를 탐색하기 위해 대황 발효 추출액의 페놀 함량을 측정하였다. 대황 발효에 대한 이전 연구에서 Eom et al. (2011)은 대황의 페놀 함량은 발효 24시간에 최대치를 기록하였다가 그 이후에는 감소하는 경향을 보인다고 보고하였다. 이에 본 실험에서는 이전 결과를 토대로 발효 12시간과 24시간 후의 유산균 대황 발효액에서 페놀 화합물의 변화를 측정하였다(Table 1). 유산균 발효에 의해 대황 발효액의 페놀 함량이 증가하는 경향을 확인할 수 있었다. 가장 높은 페놀 함량은
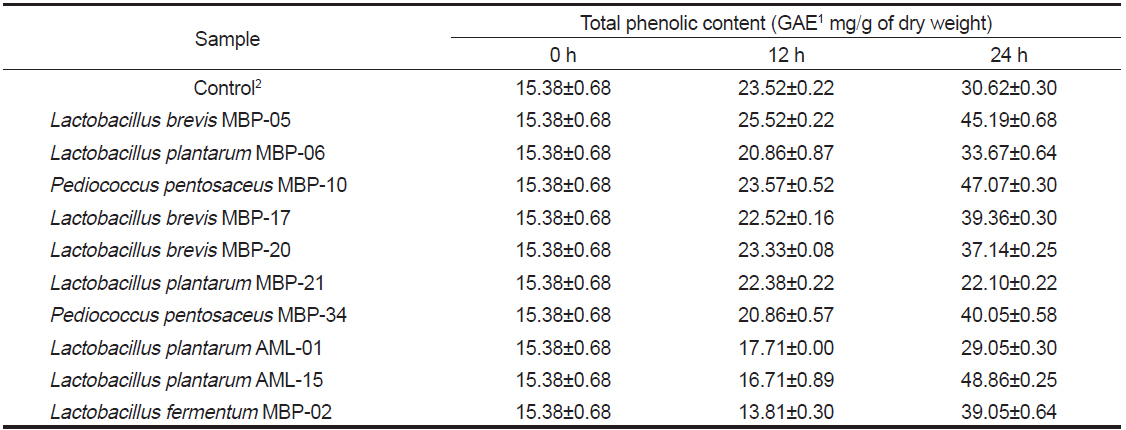
Change of total phenolic contents in Eisenia bicyclis water extract by lactic acid bacteria fermentation
이러한 결과는
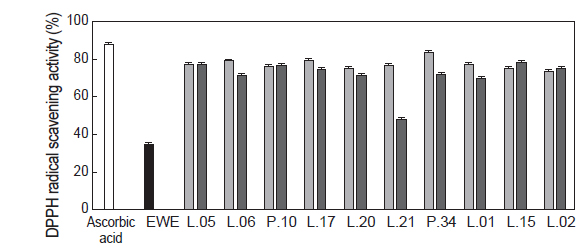
대황 추출액과 유산균 대황 발효액을 대상으로 DPPH radical 소거능 활성을 실험한 결과는 Fig. 1에 나타내었다. 발효하지 않은 대황 추출물(대조구)의 경우 DPPH radical 소거활성은 34.86%로 Eom et al. (2011)이 보고한 대황 추출액의 DPPH radical 소거활성(36.11%)과 비슷한 결과를 나타내었다. 반면 유산균 대황 발효액은 대조구에 비하여 DPPH radical 소거활성이 증가하는 경향을 나타내었다.
이러한 결과는 다시마 추출액이 곰팡이와 효모의 발효에 의해 DPPH radical 소거활성이 증가하였다는 Eom et al. (2010)과 Bae and Kim (2010)의 연구 결과와도 같은 경향을 나타내고 있다. 이는 미생물의 발효에 의해 항산화 활성을 가지는 것으로 알려진 페놀 화합물이 증가하기 때문인 것으로 판단된다. 하지만 페놀 화합물의 함량과 DPPH radical 소거능 활성 사이에 유의적인 상관관계는 관찰되지 않았다. 대황 발효에 사용된 유산균주들 중에서 상대적으로 페놀 화합물 함량이 낮은
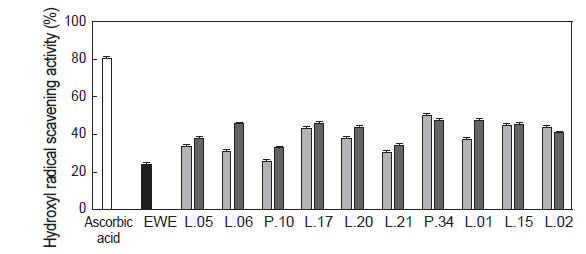
Hydroxyl radical은 노화와 관련된 원인 물질인 활성산소 중에서 반응성이 가장 강하여 생체 내 각종 조직 및 세포막 등의 산화에 중요한 역할을 하는 것으로 알려져 있다(Heo and Wang, 2008). 유산균 대황 발효액의 hydroxyl radical의 소거활성을 실험한 결과는 Fig. 2와 같다. Positive control인 ascorbic acid의 경우 80.42%의 활성을 나타내었고, 대황 추출액의 경우에는 30.51%로 Kim and Lee (2004)가 보고한 대황의 건조 조건에 따른 hydroxyl radical 소거활성(42%)과 유사하였다. 하지만, 유산균 대황 발효액은 대황 추출액(대조구) 보다 hydroxyl radical 소거 활성이 증가하는 경향을 나타내었다. 특히
이러한 결과는 유산균 대황 발효액이 정제된 화합물이 아닌점을 고려한다면 상당히 뛰어난 hydroxyl radical 소거 활성을 가지고 있는 것으로 판단된다. Eom et al. (2010)도 효모 다시마 발효액의 항산화 활성의 증가에 대해 보고하고 있으나 그 활성증가는 대황 추출액과 마찬가지로 radical의 종류에 따라 차이가 있다. 이는 해조류들 중에 존재하는 항산화 물질의 종류, 함량 및 미생물 발효에 의한 해조류 대사산물 등의 차이에 기인하는 것으로 생각되지만 현재 이에 대한 연구는 진행되어 있지 않으며 향후 연구가 필요한 것으로 판단된다.
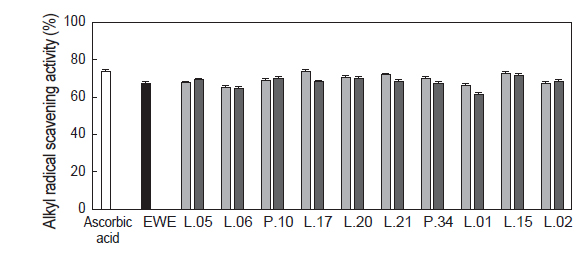
대황 추출액과 유산균 대황 발효액을 대상으로 alkyl radical 소거 활성을 실험한 결과는 Fig. 3과 같다. Positive control인 ascorbic acid는 73.81%의 활성을 나타내었고, 대황 추출액의 경우에는 67.27%, 유산균 대황 발효액은 대부분 유산균 발효에 의해 대조구인 대황 추출액의 alkyl radical 소거 활성보다 소폭 증진되는 것으로 나타났다. 또한 천연 항산화제 중 alkyl radical 소거능이 매우 우수한 것으로 알려진 ascorbic acid와 비교 시 동일농도에서 대등한 alkyl radical 소거능을 나타내었으며 alkyl radical의 소거활성이 뛰어나다고 알려진 chitooligosaccharides (25%)보다 월등한 소거활성을 나타내었다 (Ngo et al., 2010).
이상의 다양한 radical에 대한 소거활성에 대한 항산화 실험결과를 종합하여 보면 대황 추출액은 DPPH radical, hydroxyl radical 및 alkyl radical과 같은 각종 유해 radical 생성을 억제시키는 효과를 가지고 있으며 그 활성은 유산균 발효에 의해서 증가되는 것을 확인할 수 있었다. 이에 유산균 발효에 의해서 세포 독성이 생성되지 않는다면 천연 항산화제로써의 이용 가능성이 높을 것으로 판단되어 이후 MTT assay를 이용한 세포 독성에 관한 연구를 진행하였다.
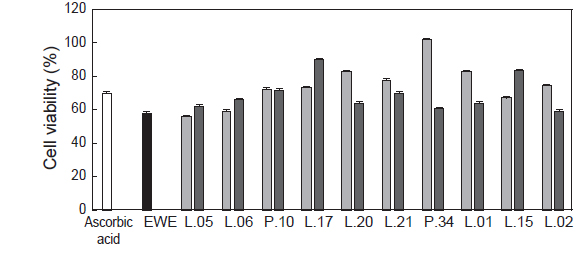
유산균 발효에 따른 대황 추출액의 세포 독성에 대해 조사하기 위하여 MTT assay를 이용하여 세포 독성에 관한 연구를 진행하였다(Fig. 4). MTT assay에 의한 세포 독성 실험 결과, Raw 264.7 cell 생존율은 positive control인 ascorbic acid는 70.02%의 세포 생존율을, 대황 추출액의 경우에는 57.70%를 나타내었다. 유산균에 의한 대황 추출물의 발효액은 대부분 발효 시간에 관계없이 대조구보다 높은 세포 생존율을 나타내었다(Fig. 4). 특히
>
유산균의 발효에 의한 대황 추출액의 항염증 활성 증가
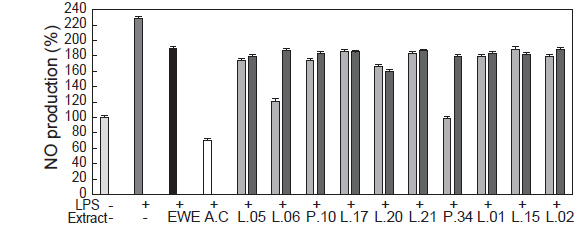
대황 추출액은 항산화 활성 외에도 항염증에 대한 활성 등이 보고되고 있으며 (Ryu and Kim, 2006), MTT assay에서 세포독성을 나타내지 않는 농도인 0.5 mg/mL에서 유산균 대황 발효액의 항염증 활성을 조사하였다. 유산균 대황 발효액의 항염증 효과를 조사하기 위하여 세포 내 염증의 지표인 NO 생성을 LPS로 유도하였고 유산균 대황 발효액의 세포보호효과(cell protective effect)를 NO 생성 억제활성으로 측정하였다.
유산균 발효액의 경우, 대부분 24시간 발효보다 12시간 발효한 대황 발효액에서 NO 생성능 억제 효과가 상대적으로 우수한 것으로 나타났다(Fig. 5). 특히
본 연구에서는 대황 추출액을 이용한 부가가치가 높은 식품 소재의 개발을 위하여 유산균을 이용한 발효공정의 적용 가능성을 검토하였다. 그 결과, 세포 독성에 영향을 미치지 않으면서 대황의 항산화 활성뿐만 아니라 항염증 활성을 증가시킬 수 있는 우수한 유산균주