넙치(
그러나, surimi 원료인 어육에 존재하는 단백질 분해력이 강한 cathepsin 및 myofibril bound serine protease (MBSP)와 같은 내인성 단백질분해효소는 근원섬유단백질의 분해에 관여하여, surimi 제조시 modori 현상을 일으키는 원인이다(Cao et al., 2006; Hu et al., 2010).
Surimi 제조 시 사용하는 시판 food-grade protease inhibitor에는 egg white powder (Hamann, et al., 1990), whey protein concentrate, beef plasma protein (Kang and Lanier, 1999), 그리고 potato extract 등이 있으며, 어육의 내인성 단백질분해효소에 의한 modori 현상을 방지하여, 연제품의 겔 강도를 개선시켜 주는 역할을(An et al., 1996) 함으로써 연제품 산업에서 없어서는 안 될 중요한 식품 첨가물 중의 하나이다(Morrissey et al., 1993). 현재 조류 독감, 광우병 등에 노출되어 있는 축산식품 소재에서 유래되는 egg white powder 및 beef plasma protein은 건강을 염려하는 소비자와 특정 종교 신도들이 소비 또는 이용을 꺼려하고 있다. 이러한 일면에서 볼 때 조류독감 및 광우병의 위험성이 없는 수산식품 소재로부터 food grade용 protease inhibitor의 개발이 절실한 실정이다.
어류의 가공 중에는 두부, fish frame, 내장, 껍질 및 알 등과 같은 다양한 부산물이 발생하며, 특히 알의 경우, 명태, 대구, 청어, 날치 및 철갑상어 알 등을 제외한 대부분의 어류 알은 폐기되고 있는 실정이다(Heu et al., 2006; Intarasirisawat et al., 2011). 이러한 폐자원인 어류 알의 protease inhibitor와 같은 유효성분의 이용에 관한 연구로는 가다랑어 알(Jung et al., 2003)및 연어 알(Shina et al., 2002)로부터 lectin의 분리, 정제 및 특성에 관한 연구, 청어(Oda et al., 1998), 잉어(Tsai et al., 1996), 연어 (Yamashita and Konagaya, 1991) 및 명태(Ustadi et al., 2005) 알로부터 protease inhibitors를 분리 정제하여 그 특성을 검토한 바 있다. 특히, 식품산업에서 protease inhibitor를 응용한 대표적인 연구로는 수산 및 축산 식품의 선도유지, 조직감 개선 및 surimi 산업에의 응용 등이 있다(An et al., 1996). 아울러 본 연구자의 선행 연구(Ji et al., 2011)를 통해 8종의 어류 알 모두에서 protease inhibitor의 분포가 확인된 바 있다. 본 연구에서는 생산량이 많아 폐기되는 가공부산물의 발생량 또한 많은 넙치를 대상으로, 가공부산물 중에서 쉽게 채취가 가능한 알로부터 단백질 유용성분으로 protease inhibitor를 이용하고자 crude extract를 추출하고, 이를 단백질의 성질(용해도, 하전, 분자량 차이)을 이용한 분획방법을 통하여 분획을 시도하고, 수율 및 총 저해활성을 통해 분획효과를 검토함으로써 protease inhibitor의 산업적 응용을 위한 기초자료를 제시하고, 버려지는 폐자원의 up-circling을 통한 고부가가치 창출과 surimi 산업에 기여하고자 한다.
넙치(Bastard halibut,
넙치 알 crude extract (CE)로부터 분획한 protease inhibitor의 저해활성 살펴보기 위한 target protease는 serine protease인 trypsin (EC 3.4.21.4), cysteine protease인 papain (EC 3.4.22.2)은 Sigma-Aldrich사(St. Louis, MO, USA) 제품을 구입하여 사용하였다. 이들 단백질분해효소의 활성을 측정하기 위해 사용한 기질은 천연기질의 경우 casein을, 합성기질의 경우 Nα-benzoyl-L-arginine-p-nitroanilide (BAPNA)을 Sigma-Aldrich사(St. Louis, MO, USA) 제품을, 기타 시약은 분석급으로 구입하여 사용하였다. 분획용 음이온 교환수지와 겔 여과용 수지는 각각 Toyopearl DEAE 650M (weak anion type, Tosoh Co., Tokyo, Japan) 및 Sephacryl S-300 (Pharmacia Biotech, Stockholm, Sweden)을 구입하여 사용하였으며, chromatography에 사용한 10 mM sodium phosphate buffer (pH 7.0)와 효소활성 측정을 위해 사용한 0.1 M sodium phosphate buffer (pH 6.0) 및 0.1 M Tris-HCl buffer (pH 9.0)는 Dawson et al. (1986)의 방법에 따라 조제하였다.
넙치 알 CE는 Kim et al. (2013a)의 방법을 다소 수정하여 조제하였다. 즉, 냉동상태의 시료를 부분해동 및 마쇄한 다음, 마쇄한 어류 알(100 g)에 대하여 3배(w/v)의 탈 이온수를 가하여 혼합한 다음, 1시간 간격으로 교반 하면서 추출하였다(20℃, 6 h). 이어서 원심분리(12,000
넙치 알 CE 및 fractions의 단백질 농도는 Lowry et al. (1951)의 비색법에 따라 bovine serum albumin을 표준 단백질로 하여 구한 검량곡선으로부터 측정하였다.
Serine protease인 trypsin에 대한 활성은 casein 및 BAPNA 기질에 대해 각각 Anson (1938) 및 Erlanger et al. (1966)의 방법을 다소 수정한 Ji et al. (2011) 방법에 따라 측정하였다. 즉, casein 기질에 대해서는 50 μL의 0.1% trypsin 용액과 0.3% casein이용해되어 있는 0.1 M Tris-HCl buffer (pH 9.0) 2 mL를 혼합 및 반응(40℃, 1 h) 시키고, 이어서 buffer와 동량(2 mL)의 5% trichloroacetic acid (TCA)용액을 가하여 실활 시킨 후, 정치(30 min), 원심분리(146 g, 20 min)한 다음, 280 nm에서 흡광도를 측정하였으며, BAPNA 기질에 대해서는 일정량(30 μL)의 0.1% trypsin 용액에 0.6 mM BAPNA기질이 용해되어 있는 0.1 M Tris-HCl buffer (pH 9.0) 3 mL를 혼합 및 반응(40℃, 1 h) 시킨 다음, 반응액에 0.3 mL의 33% acetic acid를 가하여 실활 시킨 후, 410 nm에서 흡광도(U-2900, UV-VIS spectrophotometer, Hitachi, Tokyo, Japan)를 측정하였다.
한편, cysteine protease인 papain에 대한 활성은 100 μL의 0.1% papain용액에 0.3% casein이 용해되어 있는 0.1 M sodium phosphate buffer (pH 6.0) 2 mL를 혼합 및 반응(40℃, 1 h)시키고, 이어서 실활, 원심분리(146
이들 trypsin 및 papain의 효소활성(U/mg)은 1시간 동안 1 mg의 효소(단백질)가 변화시키는 흡광도 0.1 digit을 1 U/mg으로 나타내었다.
Target protease (0.1% trypsin 및 papain을 각각 30 μL 및 100 μL씩)에 대하여 넙치 알로부터 추출한 100 μL의 CE를 각각 가하여 전 단계 반응(40℃, 30 min)을 실시한 후, 여기에 기질의 최종농도가 일정하게 되도록 첨가(BAPNA 기질의 경우 0.6 mM 및 casein 기질의 경우 0.3%)하여, 최적 효소활성조건(pH 9.0, 40℃, 1 h)에서 반응시켜, 앞서 서술한 효소활성 측정 방법에 따라 반응액의 흡광도를 측정하였다. CE 및 각 fractions의 target protease에 대한 상대 저해활성(relative inhibitory activity, RIA)은 CE 및 각 fractions을 첨가하지 않은 대조구로서 효소활성(C)에 대하여 저해제(CE 및 각 fractions)를 첨가한 저해활성(A)을 이용하여 다음과 같은 식으로 산출하였다.
RIA (%) = [(C−A) / C] × 100
CE의 target protease에 대한 저해활성(specific inhibitory activity, SIA, U/mg)은 1 mg protease inhibitor가 1시간 동안 1 U/mg의 비효소활성(enzymatic activity, U/mg)을 감소시키는 것으로 나타내었다.
>
넙치 알 CE로부터 protease inhibitor의 ammonium sulfate에 의한 분획
CE로부터 protease inhibitor의 분획은 단백질 용해성(solubility)을 이용한 ammonium sulfate 분획법으로 실시하였다. 즉, CE에 대하여 ammonium sulfate를 첨가(ammonium sulfate의 농도를 20%씩 증가시키면서 포화농도가 될 때까지 첨가)하여 순차적으로 4개(A1, 0-20%; A2, 20-40%; A3, 40-60% 및 A4, 60-80% 포화농도)의 fraction으로 분획하였다. 이어서 포화농도 별로 분획한 ammonium sulfate fractions을 원심분 리(12,000
>
넙치 알 CE로부터 protease inhibitor의 크로마토그래피법에 의한 분획
CE로부터 크로마토그래피법에 의한 protease inhibitor의 분획은 anion exchange chromatography 및 gel filtration chromatography에 따라 실시하였다. 먼저, 이온강도 차이에 의한 분획은 10 mM sodium phosphate buffer (pH 7.0)로 미리 평형화 시킨 Toyopearl DEAE 650M (weak anion type, Tosoh Co., Tokyo, Japan)로 충전한 column (i.d. 1.6×20 cm)에 7 mL의 CE 를 주입하여, 10 mM sodium phosphate buffer (pH 7.0)로 용출시키면서 단백질을 흡착시켰다. 다음으로 0-1.0 M NaCl 용액을 함유하는 10 mM sodium phosphate buffer (pH 7.0)를 사용하여 농도구배법으로 용출(30 mL/h, 3 mL/tube) 하였다.
한편, 단백질 분자량의 차이에 따른 분획은 7 mL의 CE를 0.1 M NaCl을 함유하는 10 mM sodium phosphate buffer (pH 7.0)로 평형화 시킨 Sephacryl S-300 (Pharmacia Biotech, Stockholm, Sweden)을 충진한 column (i.d. 1.6×90 cm)에 주입하고, 일정한 유속(12 mL/h)으로, 용출(3 mL/tube) 하여 분획하였다. Chromatogram 상의 단백질 농도 측정은 280 nm에서의 흡광도로 나타내었으며, casein 기질을 사용하여 trypsin 및 papain에 대한 저해활성(%)을 보인 fraction을 분획한 다음, 이를 농축 및 투석하여 총 저해활성 및 회수율을 통해 분획효율을 검정하였다.
넙치 알 CE 및 각 fractions의 분획효과 검정을 위하여 native-polyacrylamide gel electrophoresis (PAGE) 시료는 각 분획시료 0.4 mL에 0.1 mL의 sample buffer (62.5 mM Tris-HCl, pH 6.8)를 혼합하여 전기영동용 시료로 사용하였다. Walker(2002)의 방법에 따라, 10% Mini-PROTEANⓇTGXTM precast gel을 Mini-PROTEAN Tetra cell (Bio-Rad Lab. Inc., Hercules, CA, USA)에 장착한 다음, 일정량(5-10 μL)의 시료를 주입하고, gel (10 well)당 10 mA의 전류로 전기영동을 실시하였다. 전기영동이 완료된 gel은 coomassie brilliant blue R-250 용액으로 염색한 후, acetic acid, methanol 및 탈 이온수(1:2:7, v/v/v) 혼합용액으로 탈색하였다.
30 μL의 0.1% trypsin에 대하여 농도별(20-100 μL) 최적 fractions 각각 가하여 전 단계 반응(40℃, 30 min)을 실시한 후, 3 mL의 0.6 mM BAPNA 기질과 혼합한 다음, 앞서 서술한 효소활성 측정 조건에서 반응시켜 반응액의 흡광도(410 nm)를 측정하였다. 이때의 각 농도별 저해활성(RIA, %) 결과를 토대로 회귀방정식을 구하고, trypsin 활성의 50%를 감소시키는 저해제의 농도(IC50, mg/mL)를 환산하여 나타내었다.
>
Ammonium sulfate fraction의 저해활성
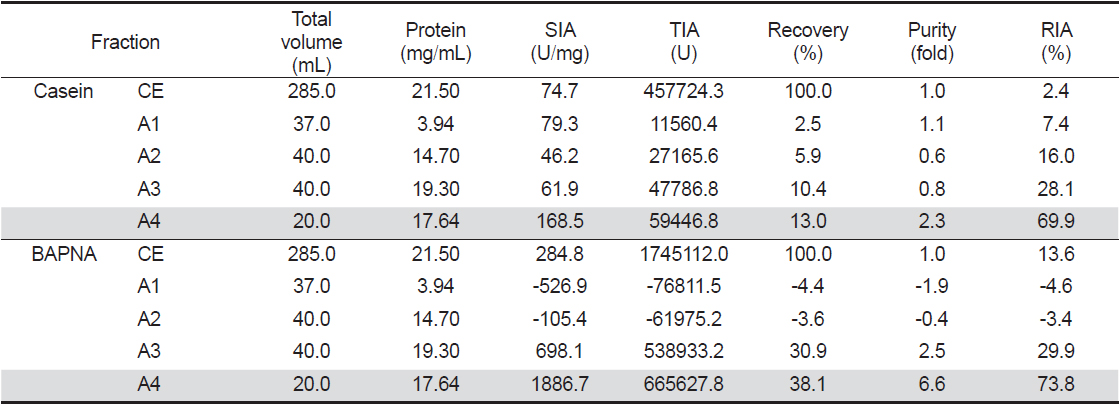
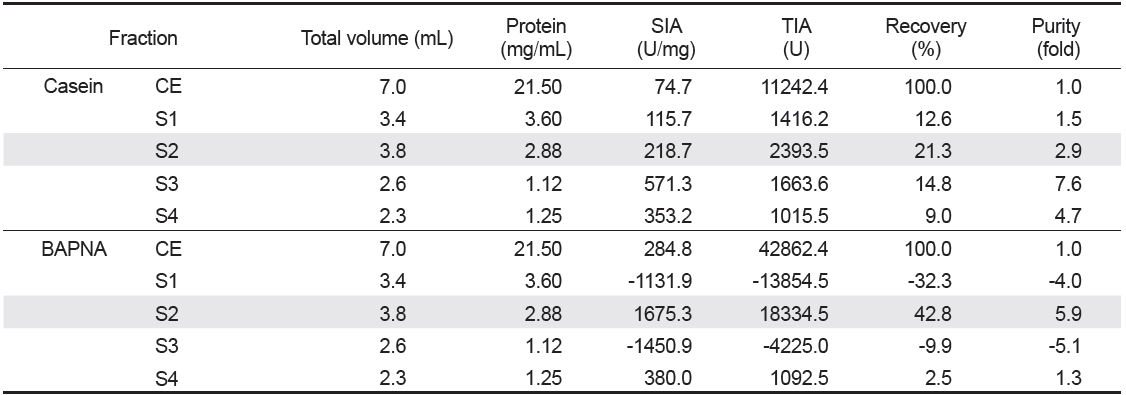
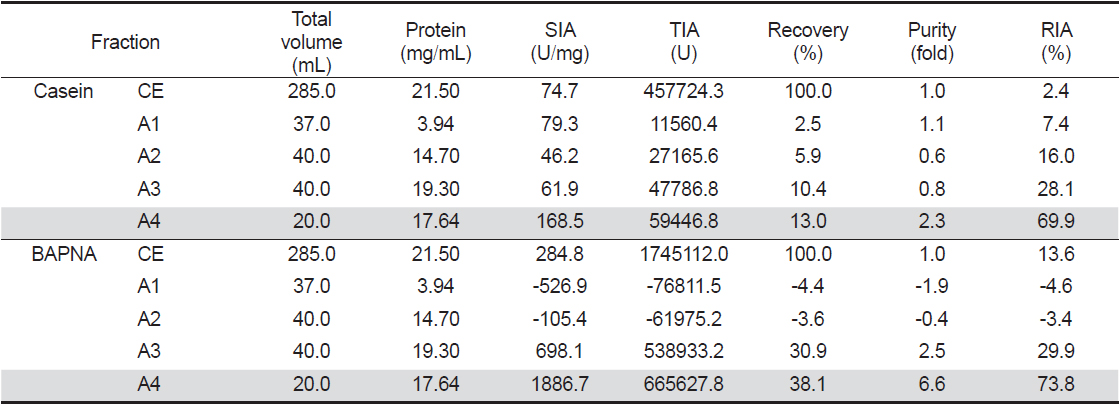
넙치 알 crude extracts (CE)로부터 ammonium sulfate (A)로 처리하여 분획한 4종 fractions (A1-4)의 casein 기질에 대한 trypsin 저해활성과 회수율을 측정한 결과는 Table 1과 같다. 먼저, A fractions의 casein에 대한 SIA (U/mg)와 purity (fold)는 A4가 각각 168.5 U/mg 및 2.3배로 가장 높았으며, 다음으로 A1이 각각 79.3 U/mg 및 1.1배 이었으나, A2와 A3의 SIA는 각각 46.2 및 61.9 U/mg으로서 CE (74.7 U/mg)에 비하여 낮은 수준을 나타내었다. 이들 A fractions의 casein에 대한 trypsin 저해활성의 총 회수율은 31.8%이었으며, A4가 13.0%로서 총 회수율의 40.9%를 차지하였다. TIA (U)는 회수율이 가장 높은 A4가 59,446.8 U이었으며, 다음으로 A3 (47,786.8 U)이었으나, CE (457,724.3 U)에 비하여 상당히 낮은 수준이었다. Kim et al. (2013a)은 어류 알의 ammonium sulfate에 의한 protease inhibitor의 분획에 있어서 40-60% 포화농도 fractions의 TIA 및 recovery가 가장 분획효율이 좋았고, 황다랑어(
Trypsin inhibitory activities of fractions obtained from roe extracts of bastard halibut Paralichthys olivaceus by ammonium sulfate precipitation base on the protein solubility toward casein and BAPNA as substrate
>
Anion exchange chromatography로 분획한 fraction의 저해활성
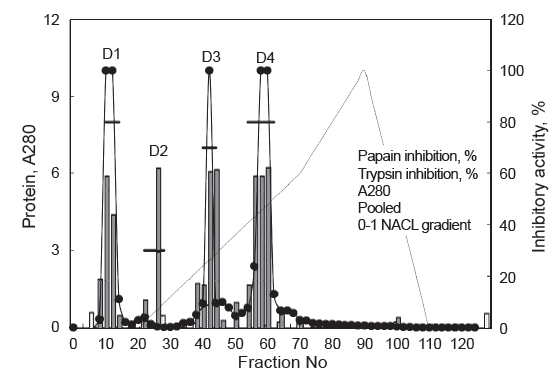
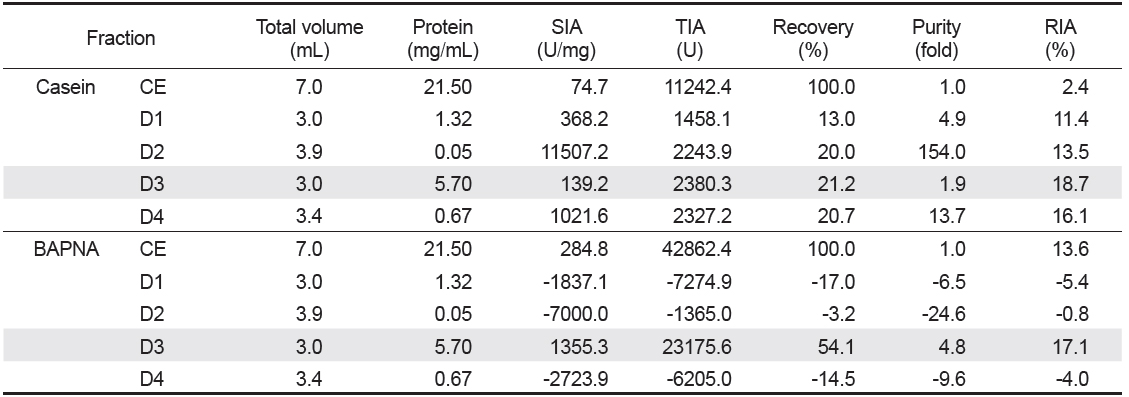
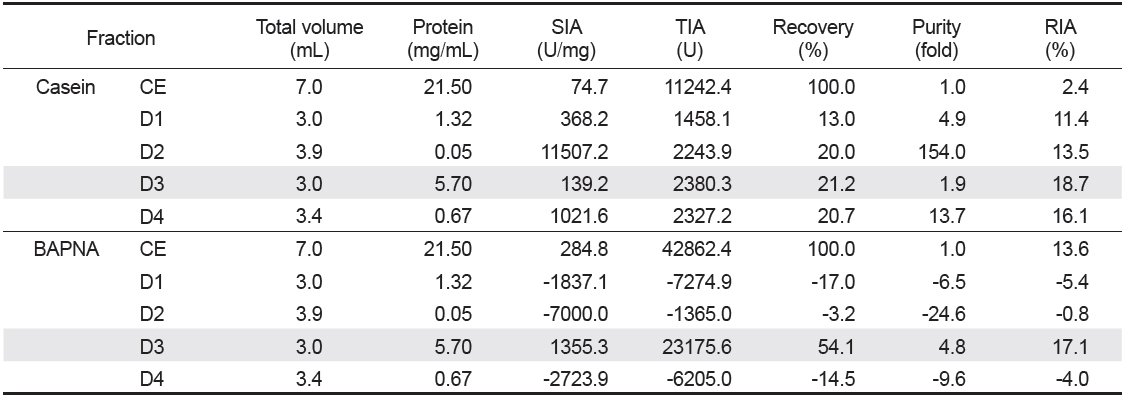
넙치 알 CE로부터 protease inhibitor의 분획을 위해 Toyopearl DEAE 650M anion exchange 수지를 충진한 column (i.d. 1.6×20 cm)에 CE (7 mL)를 흡착시킨 다음, 비흡착 fraction과 흡착 단백질을 NaCl에 의한 이온 강도별(0-1 M)로 분획한 anion exchange chromatogram은 Fig. 1과 같다. Anion exchange chromatography를 통해 총 4개의 fractions (D1-4)가 분획되었으며, D1은 fraction No. 10-14 범위에서 용출된 비흡착 단백질획분, D2는 NaCl 농도 0.02-0.10 M 범위(fraction No. 22-28)에서, D3는 NaCl 농도 0.24-0.29 M 범위(fraction No. 40-44)에서, 그리고 D4는 NaCl 농도 0.41-0.52 M 범위(fraction No. 54-63)에서 casein 기질에 대한 trypsin 저해활성을 나타내는 fractions이 용출되었다. Chromatogram 상의 trypsin 저해활성(RIA, %)은 비흡착 획분인 D1이 약 5-59%의 저해활성 분포를 보였으며, D2는 11-62%, D3는 3-61% 그리고 D4는 17-62%에 해당하는 저해활성을 나타내어, serine protease inhibitor가 분포하는 것이 확인되었다. 그러나 casein 기질에 대한 papain 저해활성은 4개의 fractions 모두에서 9% 미만의 활성을 보여 cysteine protease inhibitor의 분포는 확인되지 않았다. 단백질의 하전세기로 분획한 이들 fractions (D1-4)은 농축 및 투석과정을 거친 다음, trypsin 및 papain의 저해활성을 측정하여 분획효율에 대해 살펴보았다. Table 2는 음이온교환 수지를 통하여 분획된 4개의 fractions의 casein 및 BAPNA 기질에 대한 trypsin 저해활성(TIA, U)과 recovery (%)에 대한 결과를 나타낸것이다. 먼저 casein 기질의 경우, D3의 TIA 및 recovery는 각각 2380.3 U 및 21.2%로 가장 높았고, 다음으로 D4 (2,327.2 U 및 20.7%), D2 (2,243.9 U 및 20.0%) 그리고 D1 (1458.1 U 및 13.0%)의 순이었다. 한편, 넙치 알 CE 단백질(150.5 mg)로부터 회수된 각 fraction의 단백질량은 D3가 17.1 mg으로 11.4% 정도 단백질이 회수된 반면, 나머지 fractions의 단백질량은 0.2-4.0 mg 수준으로 0.1-2.7% 정도의 단백질 회수율을 나타내었다. 그리고 4개의 fractions의 casein 기질에 대한 papain 저해활성은 보이지 않았다(데이터 미제시). BAPNA 기질에 대하여는, CE의 TIA 및 recovery는 42,862.4 U 및 100%로서, D3는 각각 23,175.6 U 및 54.1%이었으나, 나머지 fractions에서는 저해활성을 나타내지 않았다. 또한 SIA (U/mg)에 있어서도 D3는 1,355.3 U/mg의 저해활성으로 CE (284.8 U/mg)에 비하여 4.8배의 분획효과를 나타내었다. 연어 알로부터 cation exchange chromatography에 의한 protease inhibitor의 정제효과가 우수하다고 하였으며(Kim et al., 2006), 3종의 어류 알의 anion exchange chromatography에 의한 분획효과에는 회수율과 정제도는 반비례하는 경향이라고 하였다(Kim et al., 2013b). 이상의 결과와 보고를 통해, 최적 획분은 회수율과 정제도를 고려한 획분을 선정하여야 할 것으로 판단되며, trypsin 저해활성에 있어 casein 기질에 대하여는 총 저해활성에서는 각 획분간에 차이가 두드러지지 않았지만, BAPNA 기질에는 D3만이 저해활성이 인정됨으로써, 음이온 교환수지를 이용한 넙치 알의 protease inhibitor의 분획은 0.24-0.29 M NaCl 농도에서 용출되는 fraction을 얻는 것이 효율적이었다.
Trypsin inhibitory activities of fractions obtained from the roe extracts of bastard halibut Paralichthys olivaceus by chromatographic methods base on net charge toward casein and BAPNA as substrate
>
Gel filtration chromatography로 분획한 fraction의 저해활성
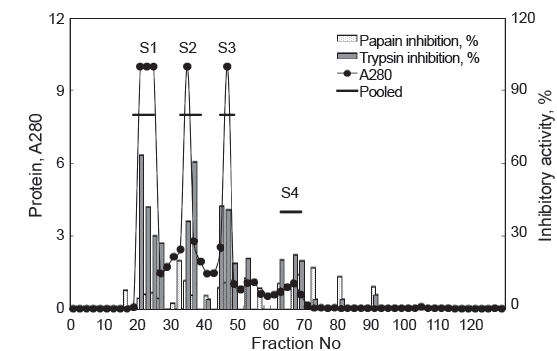
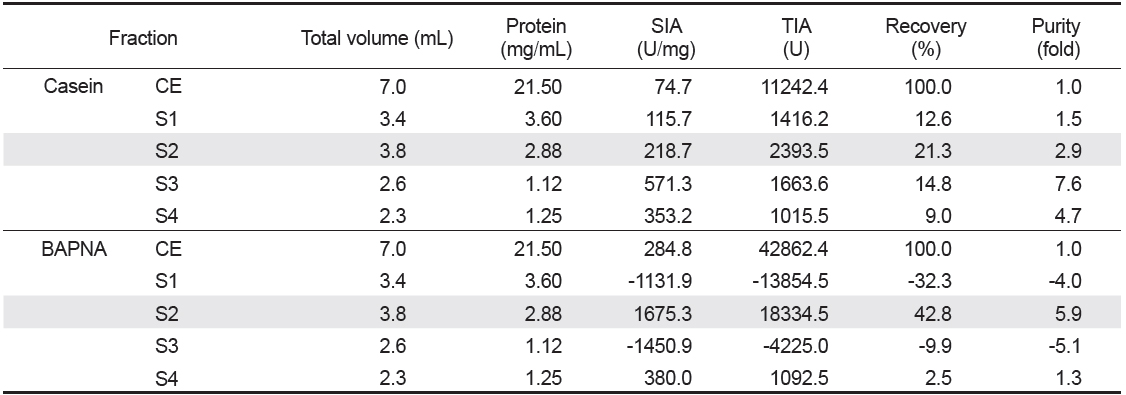
넙치 알의 protease inhibitor의 효율적인 분획을 위해, CE로부터 분자량의 크기에 따른 분획으로 Sephacryl S-300 column (i.d. 1.6×90 cm)을 사용하여 분획한 chromatogram은 Fig. 2와 같다. 파장 280 nm에서 측정한 단백질 용출 곡선과 trypsin 및 papain 저해활성 측정을 통해 4개의 fractions (S1-4)이 분획되었다. S1은 fraction No. 19-24 (분자량 160-67 K 범위)에서 trypsin 저해활성을 나타내는 fraction이 용출되었다. 이어서 S2 (fraction No. 33-38), S3 (fraction No. 44-49) 그리고 S4 (fraction No. 62-70) fractions이 순차적으로 분획되었다. 이 들 fractions (S2-S4)의 분자량 분포는 각각 55-35 K (S2), 30-12 K (S3) 그리고 <10 K (S4)를 나타내었다. Chromatogram상의 trypsin 저해활성(RIA, %)은 S1이 약 30-64%의 저해활성 분포를 보였으며, S2는 36-61%, S3는 19-43% 그리고 S4는 20-23%에 해당하는 저해활성을 나타내어, serine protease inhibitor가 분포하는 것이 확인되었다. 또한 casein 기질에 대한 papain 저해활성은 4개의 fractions 모두에서 3-20%범위의 저해활성을 보여 cysteine protease inhibitor의 분포가 일부 확인되었다. 분자량의 크기별로 얻어진 각 획분을 모아 농축 및 투석과정을 거친 다음, trypsin 및 papain의 저해활성을 측정하여 분획효율에 대해 살펴보았다. Table 3은 분자량 크기별로 분획한 4개의 fractions의 casein 및 BAPNA 기질에 대한 trypsin 저해활성(TIA, U)과 recovery (%)에 대한 결과로서, gel filtration에 의한 분획효과를 검토하기 위해 나타낸 것이다. 먼저 casein 기질의 경우, S2의 TIA 및 recovery는 각각 2,393.5 U 및 21.3%로 가장 높았으며, 다음으로 S3 (1,663.6 U 및 14.8%), S1 (1,416.2U 및 12.6%) 그리고 S4 (1,015.5 U 및 9.0%)의 순이었고, CE에 대한 저해활성의 총 회수율은 57.7%이었다. 한편, 넙치 알 CE 단백질(150.5 mg)로부터 회수된 fractions (S1-4)의 총 단백질량은 약 29.0 mg으로 19.3%정도 단백질이 회수되었다. 그러나 4개 fractions의 casein 기질에 대한 papain 저해활성은 확인되지 않았다(데이터 미제시). BAPNA 기질에 대한, CE의 TIA 및 recovery는 42,862.4 U 및 100%이었고, S2는 각각 18,334.5 U 및 42.8%, S4는 각각 1,092.5 U 및 2.5%이었으나, 나머지 fractions에서는 저해활성을 나타내지 않았다. 또한 SIA(U/mg)에 있어서도 S2는 1,675.3 U/mg의 저해활성으로 CE(284.8 U/mg)에 비하여 5.9배의 분획효과를 나타내었다. Kim et al. (2013b)은 3종의 어류 알의 겔 여과에 의한 protease inhibitor 획분은 30-50 K의 분자량 분포를 나타낸다고 하였으며, 이온교환 크로마토그래피에 비하여 분획효율이 뛰어나다고 하였다. 이상의 결과와 보고에서 trypsin 저해활성에 있어 casein기질에 대하여는 총 저해활성에서는 각 획분간에 차이가 두드러지지 않았지만, BAPNA 기질의 경우 S2만이 분획효과를 보이는 저해활성이 인정됨으로써, 겔 여과법을 이용한 넙치 알의 protease inhibitor의 분획은 55-35 K 분자량 분포를 나타내는 fraction을 얻는 것이 효율적이라 판단되었다.
Trypsin inhibitory activities of fractions obtained from the roe extracts of bastard halibut Paralichthys olivaceus by chromatographic methods base on the molecular mass toward casein and BAPNA as substrate
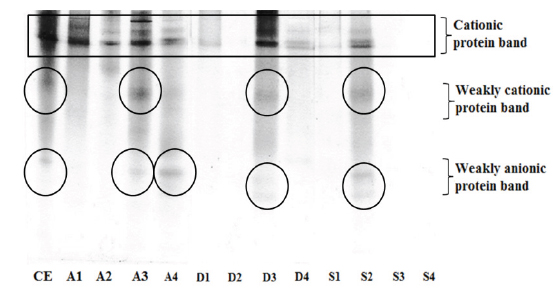
넙치 알 CE 및 분획방법 ammonium sulfate precipitation (A1-4), anion exchange (D1-4) 및 gel filtration chromatography (S1-4)를 통해 얻어진 fractions의 전기적 하전에 따른 native-PAGE 결과는 Fig. 3과 같다. 먼저, 넙치 알 CE에는 gel 상단에 2-3개의 전기적으로 cationic protein band, 이 보다 아래쪽에 전기적으로 weakly cationic protein band 및 weakly anionic protein band가 분포하는 것이 확인되었다. CE를 포함한 분획방법별 fractions는 공통적으로 cationic protein band가 관찰되었으며, trypsin 저해활성을 나타낸 fractions 중에서, A3는 weakly cationic과 anionic protein band 분포하는 반면에 A4는 weakly anionic protein band가 두드러진 것으로 나타났다. D3의 경우는 weakly cationic protein band와 옅은 weakly anionic protein band가 존재하는 것이 확인되었다. S2의 경우, weakly cationic과 anionic protein band가 각각 관찰되었다. 단백질 용해도 차이에 의한 분획효과(A1-4)는 전기영동 결과에서도 나타났듯이 각 포화농도별 protein band의 분포가 각기 다르게 나타남으로써 그 분획효과가 인지되었으며, A fractions의 저해활성 비교(Table 1)에서도 40-60% 및 60-80% 포화농도 fractions (A3 및 A4)이 trypsin 저해활성이 강한 것으로 확인됨에 따라, 목적하는 protease inhibitor를 얻기 위해서는 비교적 고포화농도의 ammonium sulfate를 사용하여야 분획 가능할 것으로 판단되었다. 단백질 하전의 차이(D1-4) 및 분자량 크기(S1-4)에 의한 분획효과는 각 fraction별 protein band의 분포가 다르게 나타났을 뿐만 아니라(Fig. 3), 저해활성(Table 2 및 3)에 있어서도 D3 (0.24-0.29 M NaCl) 및 S2 (분자량 55-35 K) fraction 만이 현저한 저해활성 강도를 나타냄으로써 그 분획효과가 인정되었다.
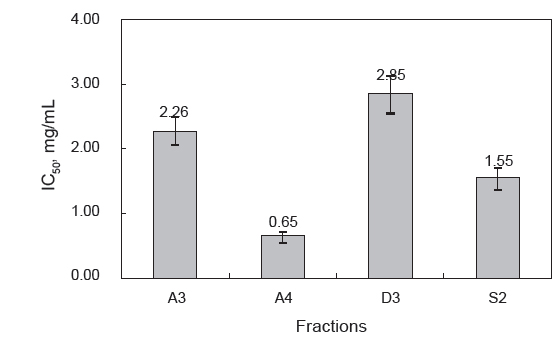
Fig. 4는 분획 방법에 대한 최적 fractions (A3, A4, D3 및 S2)의 BAPNA 기질 대한 trypsin 저해활성을 IC50 (mg/mL)으로 나타낸 것이다. 본 실험조건에서 IC50은 trypsin의 BAPNA에 대한 효소활성을 50% 수준으로 감소시키는 저해제의 농도로서, A4가 0.65 mg/mL로서 가장 저해활성이 강한 것으로 나타났으며, S2, A3 그리고 D3의 순이었다. IC50의 결과로만 국한하여 분획방법에 따른 효과를 판단한다면, ammonium sulfate를 이용한 분획이 넙치 알 CE로부터 protease inhibitor를 효율적으로 얻을 수 있는 방법이라 판단되었다. 그러나 BAPNA 기질 대한 trypsin 저해활성으로 살펴 본(Table 1-3) 분획방법간의 recovery(%)와 purity (fold)를 고려한 분획효율(recovery×purity) 측면에서는 D3 (259.7), S2 (252.5) 그리고 A4 (251.5)으로 거의 차이를 나타내지 않았다. 단백질의 용해도 차이에 따른 분획방법(ammonium sulfate precipitation)은 대량처리를 위한 분획에 이용 가능하지만, 이로 인한 폐 염류용액 처리 및 회수방법 그리고, 탈염을 위한 방안을 마련하여야 하며(Heu and Ahn, 1999; Kim et al., 2013a), 단백질의 하전세기에 따른 분획방법 (ion exchange chromatography)은 회분식(batch식)으로 분획할 경우, 상온에서 비교적 단시간에 이용 가능하며, 용해도 차이에 의한 분획방법 보다 분획효과가 좋은 점 등이 있지만, 탈염 및 농축을 위한 방안이 반드시 마련되어야 한다(Roe, 1989). 또한 단백질의 분자량 크기에 따른 분획방법(gel filtration)은 재현성과 연속처리가 가능한 점, 분획 후 별도의 처리(탈염 및 농축)가 최소화되는 점에서 단백질 유용자원의 분획에 효과적이라고 할 수 있으나, 대량처리를 위한 산업화 공정의 개발이 필요할 것으로 생각된다(Preneta, 1989; Kim et al., 2013b). 본 연구결과에서 추출물로부터 ammonium sulfate 분획법(A4 및 A3)의 1회 처리량(285 mL)이 chromatography 분획법의 처리량(7 mL)에 비해 월등히 많아 회수율 또한 높은 것으로 나타났으나, 회수율과 정제도를 고려한 분획효율에서는 연속처리가 가능한 chromatography 분획법(D3 및 S2)이 우수한 것으로 확인되어, 넙치 알 CE로부터 protease inhibitor의 산업적 이용을 고려한 효율적 분획을 위해서는 대량처리 및 연속처리가 가능한 방안을 마련해야 할 것으로 판단되었다.