The effects of temperature, photon irradiance, and photoperiod on the growth of Sargassum horneri embryos were examined for female plants collected at Chokpo in Tongyeoung, Gyeongnam Prefecture, Korea on 27 December 2011. Mature plant receptacles were detached, and fertilized eggs were cultured in the laboratory at temperatures of 5-25℃ with photon irradiances of 10-80 μmol m−2s−1 under 14L:10D and 10L:14D photoperiods. Germination and embryo growth were rapid at 20-25℃ and 40 μmol m−2s−1 under 14L:10D. The number of rhizoids in the germinated young thalli was high at high photon irradiances (40-80 μmol m−2s−1) and 15-20℃. At 20℃ and 14L:10D, vigorous growth of main and lateral branches was observed; however, at 5℃ under both photoperiods, plant growth decreased markedly. In the present study, S. horneri grew well at high temperatures (20-25℃) and high photon irradiances (40-80 μmol m−2s−1) with a 14L:10D photoperiod.
21세기 자원의 보고인 바다가 황폐화 되어가면서 연안역에 있는 해조류의 탈락, 유실로 인한 해조장의 파괴로 이를 구성하는 대형갈조류에 관심이 높아지고 있다. 특히 모자반속 식물은 어·패류의 산란장 및 치자어의 생육장 등 다양한 기능을 가지고 있고, 해양생태계내의 생산자로서 중요한 역할을 맡고 있다(Umezaki, 1984b).
갈조 모자반속 식물의 괭생이모자반(
괭생이모자반은 대개 초봄부터 성장하고 4월부터 성숙하기 시작하여 7월까지 수정을 완료하여 엽체의 상부로부터 유실되는 해조이고, 파도가 약한 곳에서 큰 군락을 만들고 있다(Terawaki, 1986). 보통 자웅이주의 개체군만 있었지만, 드물게 자웅동주의 개체도 나타나고 있다(Okuda, 1987). 대부분의 모자반은 무성포자를 형성하지 않고, 암수 배우자에 의한 유성생식만을 함으로써 잘 분화된 체제와 함께 해조류 중에서 가장 진화된 무리로 보고 있다(Chang, 1977).
이 종의 생활사에 관하여는 Uchida (1993)가 실내배양을 통하여 밝힌 바 있고, Okuda (1987)에 의해 추계에 성숙하는 개체군에 대한 생리, 생태가 밝혀졌으며, Honda and Okuda (1989)에 의해 가을에 성숙하는 조체의 난 방출, 배발생 및 광합성속도의 계절적 변화가 밝혀졌으며, Okuda et al. (1984)에 의해서 모자반류의 발아와 부착에 관한 기질 경사도와의 관계가 밝혀졌다. 또한 Matsui et al. (1994)은 괭생이모자반과 쌍발이모자반(
본 연구는 실내배양을 통해 동계에 성숙한 괭생이모자반으로부터 얻은 유배의 발아 및 생장에 미치는 온도, 광량 및 광주기의 영향을 구명하고 이를 통해 얻어진 기초자료를 해조장 조성을 위한 인공종묘의 대량배양 및 생산에 활용할 수 있는지를 검토하고자 수행하였다.
실험 조체는 2011년 12월 하순 통영시 산양면 척포리(Fig. 1) 해안에서 채집한 괭생이모자반의 성숙 조체로부터 얻은 방출난을 멸균해수 속에서 붓으로 세정하고 5% GeO2 용액 속에서 24시간 음건 방치한 후 배양실험에 이용하였다.
유배는 등농도가 되도록 배양해수 속에서 잘 흔들어 준 다음 각 1 mL씩(약100립)을 취하여 멸균해수를 채운 Petridish에 깔려 있는 slide glass위에 고루 분산되도록 흩뿌려 준 다음 온도 5, 10, 15, 20, 25℃, 광량 10, 20, 40, 80 μmol m−2 s−1, 광주기 14L:10D, 10L:14D의 조건 하에서 6주간 배양하여 유배의 발아를 관찰한 후 생장도를 측정하였다.
이후 7주부터는 각각의 기질에서 배양한 조체 중에서 성장이 가장 좋은 것으로 나타난 광량 40 μmol m−2s−1에서 배양된 조체를 선택하여 300 mL 원형플라스크속에 각각 50개체를 넣어 조체가 자랐던 같은 곳과 같은 온도, 광량 및 광주기하에서 통기 배양을 행하였다. 이때 배양해수는 매 1주일마다 환수하였고 배양액은 MGM (McLachlan, 1973) 배지를 사용하였다. 생장도의 측정은 50개체 중 30개체를 무작위로 선택하여 주지의 길이, 제1 측지의 길이, 발아한 유배의 가근수, 분기된 측지의 수로서 나타내었다.
성숙한 괭생이모자반으로부터 얻은 유배의 발아 및 성장과정을 Fig. 2에 나타내었다. 유배는 점액질 속에 둘러싸여 생식기탁에 붙어 있으며(Fig. 2A), 충분히 성숙한 유배는 곧 탈락하여(Fig. 2B), 배양 개시시에 유배의 보호막이었던 점액성분이 대부분 용해되면서 가근부 형성을 시작하는 부착기 초기상태로 되었다(Fig. 2C). 이들의 성장이 가장 빠르게 나타났던 장일하의 20℃하에서 배양 4일 후에 완전한 부착기를 형성하였고(Fig. 2D) 10일 후에는 측지가 분출하여 분기하여 자라기 시작하였으며(Fig. 2E) 18일 후에는 성장이 빨라지면서 3개의 측지를 형성하였다(Fig. 2F).
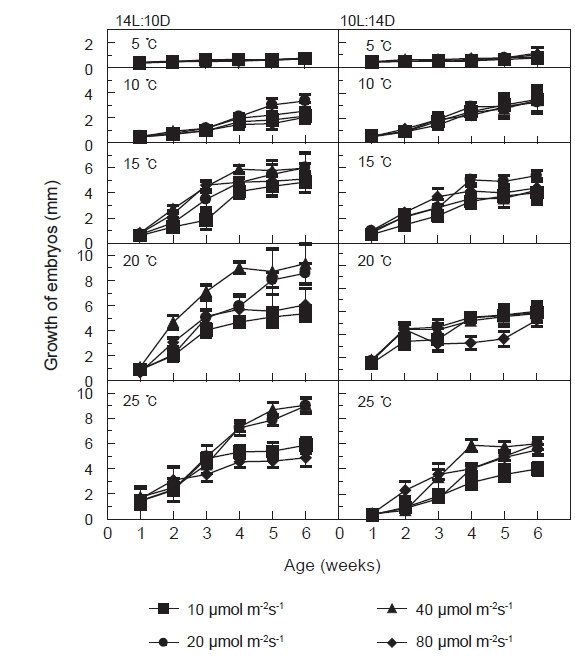
장일조건과 단일조건하의 광량과 온도에 따른 괭생이모자반의 발아 및 초기성장 결과를 Fig. 3에 나타내었다. 장일과 단일의 온도 5-25℃, 광량 10-80 μmol m−2s−1에서 성장하였다. 장일하의 온도 15℃이하에서는 성장이 느리게 나타났으나 20℃이상에서는 성장이 빨라 40 μmol m−2s−1하의 20-25℃에서 배양 6주후 각각 평균엽장 9.3 mm와 9.1mm로 성장하였다. 단일에서는 장일하와 마찬가지로 초기성장양식이 유사하게 나타났고, 성장은 장일에 비하여 다소 늦어져 40 μmol m−2s−1하의 20-25℃에서 배양 6주 후 각각 평균엽장 5.8 mm와 6.0 mm로 최대성장을 나타내었다. 그러나 장일과 단일의 각 온도조건에서 10 μmol m−2s−1을 제외하면 광량에 따른 성장차이는 크지 않았으며, 대체로 40 μmol m−2s−1이상의 고광량 조건에서 성장이 빠른 것으로 나타났다.
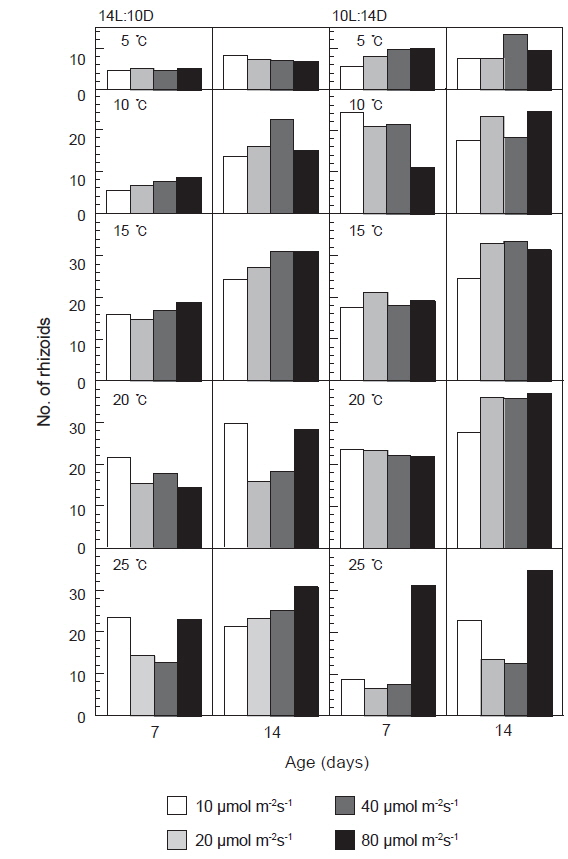
발아한 유배의 가근수는 광주기에 따른 차이는 크지 않았으나, 15-20℃, 40 μmol m−2s−1이상의 고온, 고광량하에서 많이 형성되었으며, 특히 단일하의 20℃에서 유배당 가근 수가 평균 35개 이상으로 가장 많은 가근이 형성되는 것으로 나타났다(Fig. 4).
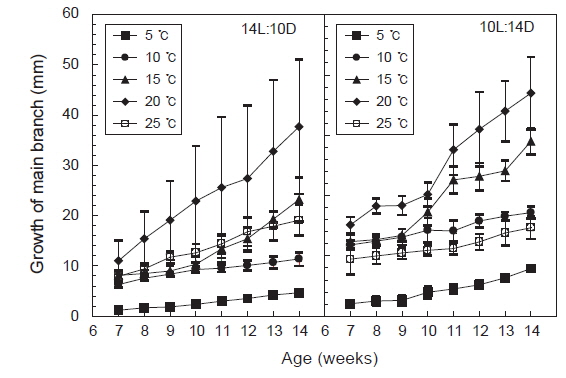
주지는 장일과 단일의 모든 조건에서 생장하였으나 단일보다는 장일하에서 생장이 빠르게 나타났고, 수온 15-20℃에서 생장이 빠른 것으로 나타났다. 최대생장은 장일하의 20℃에서 나타나 평균엽장은 37.7 mm에 달하였다. 일반적으로 배양초기인 유배의 발아시기에는 25℃가 15℃보다 성장이 빨랐으나, 주지가 발아한 이후 원형 플라스크에서 통기배양을 시작한 7주째부터는 20℃에서 성장이 빠르게 나타났다. 그러나 5℃와 10℃에서는 성장이 완만하여 8주 이후 각각 4.6 mm와 11.4 mm에 지나지 않았다. 단일조건하의 생장은 온도별로 큰 차이를 나타내지 않았으나, 장일조건과 같이 20℃에서 평균엽장이 18.5 mm로 최대로 성장하였으며, 5℃와 10℃에서는 성장이 완만하였다(Fig. 5).
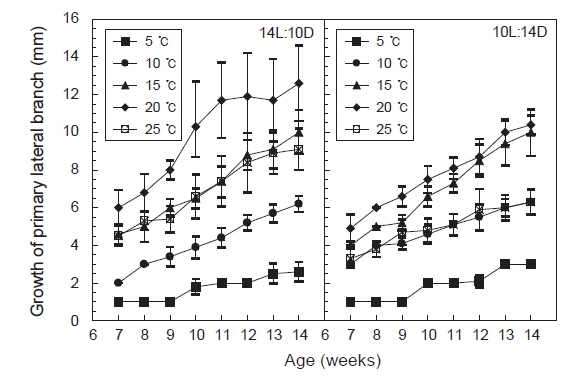
측지의 발아 및 생장도 주지와 마찬가지로 모든 실험구에서 생장 하였으나 장일조건하의 20℃에서 평균엽장이 34 mm로 최대로 성장하였고, 15℃와 25℃는 거의 비슷한 성장을 보였으며, 5℃에서는 거의 성장하지 않았다. 단일조건하에서는 20℃에서 평균엽장 15 mm로 최대로 성장하였으며, 10℃와 25℃는 성장도의 차이를 거의 나타내지 않았고, 5℃에서는 3 mm정도로 성장이 매우 늦어짐을 알 수 있었다.
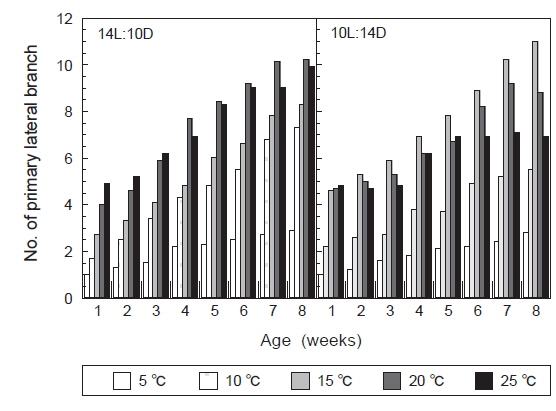
장일조건과 단일조건하에서 온도에 따른 괭생이모자반의 가지 분기수를 Fig. 7에 나타내었다. 장일하에서는 20℃에서 가장 많은 가지가 형성되었으며, 배양 8주 후의 평균가지수는 10개로 나타났다. 그러나 5℃에서는 가지의 분화를 거의 볼 수 없었으며, 10℃와 15℃에서 평균가지수는 각각 6.5개와 7.5개에 지나지 않았다. 단일조건하에서는 15℃에서 가장 많은 수의 가지가 형성되어, 배양 8주 후에는 평균가지수는 12개가 되었다. 그리고 장일과 마찬가지로 5℃에서는 가지의 분화를 거의 볼 수 없었으며, 10℃와 25℃에서는 분기수가 극히 적게 나타나 배양 8주후에는 평균가지수가 각각 5.5개와 6.5개에 지나지 않았다. 괭생이모자반의 가지분기는 장일과 단일, 어떤 배양 조건에서도 큰 차이를 나타내지는 않았으나, 장일조건하의 온도 15-20℃에서 빠르게 나타났고, 형성된 가지의 수도 많은 것으로 나타났다.
괭생이모자반의 유배발생과정과 주지 및 측지의 형성과 형태형성과정은 Terawaki et al. (1983)과 거의 일치하는 것으로 나타났다. 괭생이모자반의 성장에 영향을 미치는 조건 중 단일조건보다 장일조건에서 성장이 빠르게 나타나고, 가근 및 가지 수도 많은 경향을 나타내었는데, 일반적으로 장일과 단일 모두 20℃와 40 μmolm−2s−1에서 발아 및 성장이 빠르게 나타났다. 따라서 괭생이모자반의 발아 초기의 성장은 기질에 착생한 조건에서 장일조건하의 20℃와 고광량이 좋은 조건이 되는 것으로 확인되었다.
이상의 결과로 볼 때 동계에 성숙하는 괭생이모자반은 저수온기인 12-2월에는 발아 및 성장이 서서히 진행되다가 늦은 봄과 여름이 되는 5-8월에 접어들면서 발아, 생장이 급속히 이루어지고 9-10월이 되어 빠르게 생장하여 11월이 되면 최대로 생장한 후 12월 하순과 1월 초순경에 성숙한다. 이러한 사실은 Yoshida et al. (1998)가 춘계에 성숙하는 괭생이모자반 개체군의 성장 및 성숙시기를 추계성숙형 개체군과 비교 연구한 결과에서 추계성숙형 개체군은 12월에 모든 개체에 생식기탁을 가지고 있고, 1월까지 난 방출이 계속된다고 하였고, Terawaki (1986)는 괭생이모자반의 성장과 성숙에 관한 보고에서 1월 초순에 최대로 생장한 생식기탁을 가진 조체에서 난을 방출하며 3월에 조체가 고사 유실되면서 4월 하순에는 새롭게 발아한 유체가 생장하여 그 후 성장이 천천히 진행되다가 11월이 되면 최대가 된다고 보고하였다. 그리고 Takaba와 Mizokami (1982)는 히로시마만 쿠로시오 섬의 괭생이모자반에 대한 조사에서 추계성숙형 개체군이 10-12월까지 성숙하는 것으로 보고하고 있고, Terawaki (1986)는 오다와만산 괭생이모자반의 경우 11-2월까지 성숙하는 것으로 보고 함으로써 추계성숙형 개체군의 존재를 시사한 바 있다. 한편 Marui et al. (1981)은 홋카이도의 괭생이모자반 성숙기는 6월 중순-8월 하순 이라고 보고하였고, Umezaki (1984a)는 오바마만산 괭생이모자반에 관한 연구에서 5월에 최대로 자란다고 함으로써 괭생이모자반이 전형적으로 춘계에 성숙하는 것임을 확인해 주고 있다. 따라서 본 실험에서 사용한 조체는 Terawaki (1986)의 조사결과와 비교할 때 일본산 추계성숙형 개체군과 유사한 것으로 생각되었다. 그러나 괭생이모자반의 성장, 생태와 관련한 이들의 보고를 비교할 때 괭생이모자반 개체군의 생리, 생태는 생장과 성숙 등에 있어서 지역적으로 많은 변화가 있는 것으로 추정되었다. Okuda (1987)는 추계에 성숙하는 괭생이모자반 개체군의 분포에 관한 연구에서 넓은 범위에 걸쳐 조사할 필요성을 제기하면서 에히메켄에서 가을에 성숙하는 소량의 개체를 채집한 후, 이러한 개체군은 일본 남부 세토내해의 광범위한 곳에서 생육하고 있는 것으로 보고하였다. 다만 가을에 생식기탁을 형성하는 조체의 출현빈도는 낮은 것으로 정리하였다. 이후 Uchida and Arima (1993)는 추계와 춘계 성숙 개체군의 교배실험을 통해 이들 두 개체군이 유전적으로 다른 형이라 하였고, Yoshida et al. (1998)도 이를 지지하고 있다. 또한 Yoshida (2005)는 히로시마만의 안쪽과 입구 및 만 외부의 3개 개체군을 대상으로 한 육성실험에서 이들 개체군은 광주기 등에 대한 환경 적응성에 크게 차이가 났고, 성숙시기도 개체군별로 고정되어 있는 것으로 보고하면서 이들 개체군간 생활사의 차이는 유전적 분화의 결과에서 온 것으로 각각의 개체군을 생태형으로 부를 수 있다고 하였다. 이러한 결과로 보면, 본 연구의 대상 개체군인 추계성숙형 개체군외에 춘계성숙형 개체군에 대해 동일한 방법으로 실내 및 야외 실험을 병행하여 이들 두 형태의 성숙 개체군에 대한 생활사의 특성을 구명해 볼 필요가 있는 것으로 판단된다. Chang (1977)은 괭생이모자반의 난 방출실험에서 적수온이 15-21℃로 추정된다고 하여 난 방출과 본 연구의 유배 성장 결과가 유사함을 알 수 있었고, Uchida (1993)는 실내배양을 통한 괭생이모자반의 생활사에 대한 보고를 통해 춘계성숙형 개체군에서 얻은 유배를 사용하여 얻은 결과에서 장일조건하의 20℃, 단일조건하의 15℃에서 초기 발아가 빠르고 엽체의 형성도 빠르나 장기간의 배양을 통해 얻어진 결과는 단일조건에서 좋았다고 하였고, Ogawa (1986)는 괭생이모자반의 가근 형성이 같은 염분 농도에서 25℃의 고온에서는 낮았으나 15℃에서 가장 좋다고 하였다. Ogawa (1984)와 Nanba (1993)는 도시하수를 이용한 괭생이모자반의 초기발육과 조직절편의 재생 실험에서 최적 조건을 20℃로 설정하여 실험을 수행하였는데 이는 괭생이모자반의 초기발육 및 생장이 20℃가 최적임을 시사하는 것으로써 본 연구에서 나타난 결과들과 잘 일치하고 있다. 또한 Yoshida et al. (2000)도 저온 보존한 괭생이모자반 유배의 발아율과 성장실험에서 5℃에서 보존한 시료를 10℃와 15℃에서 순화시켜 20℃에서 발아, 생장율을 조사함으로써 20℃가 초기발아의 적정 온도였음을 입증하고 있다. 기질에 착생시킨 괭생이모자반을 통기 배양하였을 때 장일조건 온도 20℃ 광량 40 μmolm−2s−1에서 성장이 최대이고, 단일조건하에서도 장일과 같은 조건에서 성장이 최대로 나타났으며 초기생장양식도 비슷한 것으로 나타났다. Baba (2011a)는 큰잎모자반(
이상의 결과에서 괭생이모자반은 장일조건, 20℃이상의 조건에서 발아가 빠르고 가근도 많이 형성됨을 알 수 있었으며, 제 1측지의 생장과 가지의 분기는 15-20℃에서 빠르고 많은 것으로 나타났다. 이는 단일조건에서보다는 장일조건에서 괭생이모자반 가지의 분화 및 생장이 우수하다는 것을 나타내어 준 것으로 볼 수 있다. 반면 모든 실험구에서 10℃이하에서는 발아와 성장이 떨어지는 것으로 나타났다.
천연에서 추계에 성숙하여 한겨울에 이르기까지 난 방출이 이루어지는 괭생이모자반의 유배의 발아와 성장은 장, 단일하의 고온, 고광량하에서 빠르게 나타나는 것으로 볼 때 이 지역에 생육하는 괭생이모자반의 유배는 광주기보다는 온도와 광량에 의해 발아 및 성장에 영향을 받는 것으로 추정되었다. 본 연구를 통해 얻어진 유배의 생장결과는 현재 괭생이모자반 종묘의 대량생산에 활용되고 있는데, 이러한 결과를 응용하면 이들의 성숙시기를 활용한 조기종묘와 후기종묘의 생산 및 공급에 적극 활용할 수 있을 것으로 판단된다.